宰后肌肉能量代谢对肉品质的影响研究进展
2023-02-09李继强朱立贤郝剑刚张皓琪张一敏
李继强,朱立贤,仝 林,李 航,郝剑刚,张皓琪,张一敏,*
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.国家肉牛牦牛产业技术体系通辽站, 内蒙古 通辽 028000;3.国家肉牛牦牛产业技术体系恒都综合试验站,重庆 408216; 4.国家肉牛牦牛产业技术体系乌拉盖站,内蒙古 锡林郭勒 026321)
肉色、嫩度、保水性等肉的品质特性一直是影响消费者购买意愿的重要因素[1],而活体及宰后肌肉能量代谢会影响肉的生长、发育、成熟过程,并最终对肉的品质产生影响[2-3]。本文从能量代谢与肉品质的关系、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和沉默信息调节因子(silent information regulators,SIRTs) 家族对能量代谢的影响等方面概述肌肉能量代谢对肉品质的影响,以期为通过肌肉能量代谢途径调控肉的品质提供理论依据,同时也为提高我国肉类品质和肉类产业的市场竞争力提供借鉴。
1 宰后肌肉内环境变化及能量代谢
在活体动物中,要想维持机体的正常活动,必须要保持肌肉内环境的稳定。ATP是由1 个腺苷和3 个磷酸基团组成的复杂结构,3 个磷酸基团之间的高能磷酸键分解后可以释放大量的能量,进而维持机体正常代谢,因此ATP是机体新陈代谢的能量基础。肌肉产生ATP的能量途径主要有3 条:磷酸肌酸系统、糖酵解途径和氧化磷 酸化[1]。在动物屠宰放血后,机体逐渐进入缺氧状态,无法通过有氧氧化维持正常的代谢过程,为了维持ATP的平衡,磷酸肌酸系统、糖酵解等途径被激活。同时,伴随着这一系列生化反应过程,肌肉内环境也逐渐发生变化,从而使肌肉转化为“肉”。因此,了解每条途径在宰后代谢中的作用是理解肌肉转化为食用肉过程的基础。
1.1 氧化磷酸化
氧化磷酸化是指烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)和还原黄素腺嘌呤二核苷酸(flavine adenine dinucleotide,reduced,FADH2) 的电子通过电子传递链传递给O2,与H+结合生成H2O(图1),同时释放能量使代谢产物上的磷酸基团转移到二磷酸腺苷(adenosine diphosphate,ADP),通过磷酸化形成ATP的过程[4]。
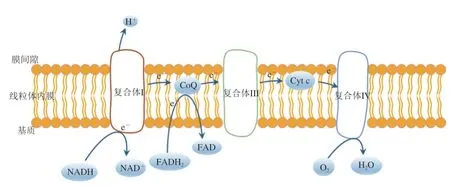
图1 线粒体电子传递链途径Fig. 1 Mitochondrial electron transport chain pathway
宰后肌肉的有氧代谢多年来一直被忽视,人们普遍认为动物宰杀放血后,氧供应中断,但氧气的消耗并不是一个瞬间的过程,宰后初始阶段机体中仍然有部分氧存在,并且线粒体在结构上保持完整,仍能通过有氧氧化产生能量。有研究表明,有氧氧化过程每分子葡萄糖的ATP产生量远高于糖酵解过程ATP的产生量(38∶3)[5], 即使是屠宰过程中氧化磷酸化的微小增加也能显著改善ATP水平[3]。因此,宰后肌肉的有氧氧化过程对ATP稳态的贡献也不可忽视。但也有学者认为,宰后肌肉中的氧气是有限的,线粒体有氧呼吸对ATP的产生贡献很小。Wang Chengcheng等[6]研究发现,在整个宰后代谢过程中,有氧呼吸产生的ATP总占比很低(小于1%)。宰后9 h左右,有氧呼吸产生的ATP停止。因此,有氧氧化对宰后ATP稳态的影响仍然存在争议,目前研究来看,有氧氧化是宰后早期ATP贡献不可忽视的因素,但从整个宰后代谢过程来看,有氧氧化对ATP的产生贡献很小。
当机体内的氧消耗殆尽后,机体无法通过氧化磷酸化生成ATP,NADH和FADH2逐渐累积,并负反馈到三羧酸循环系统,抑制三羧酸循环的进行。
1.2 磷酸肌酸体系
磷酸肌酸体系在宰后早期阶段可以有效维持ATP水平[6]。肌酸激酶(creatine kinase,CK)催化无机磷酸盐(Pi)从磷酸肌酸到ADP的可逆转移,形成ATP和肌酸(图2)。

图 2 磷酸肌酸代谢过程Fig. 2 Phosphocreatine metabolism
动物宰杀放血后的有氧氧化途径终止后,为了维持ATP水平,磷酸肌酸开始分解,产生磷酸和肌酸,并为机体提供ATP。磷酸肌酸在肌肉中的贮存有限,只能在短时间内维持宰后肌肉中的ATP水平,当70%的磷酸肌酸被消耗时,无氧糖酵解逐渐成为产生ATP的主要途径[7]。其代谢产物(AMP、ADP、Pi)在糖酵解途径中可以作为限速酶的激活剂,进而影响糖酵解途径。
1.3 糖酵解途径
糖酵解是指在无氧条件下,葡萄糖被降解为丙酮酸并产生ATP的过程[8]。动物宰杀放血后,肌肉中保留的氧气无法长时间维持氧化磷酸化过程的正常进行,磷酸肌酸体系也不能长时间维持ATP的稳态,当磷酸肌酸被消耗70%时,糖酵解途径逐渐成为产生ATP的主要途径。
机体内贮存的糖原分解成葡萄糖进入糖酵解过程,经过一系列的酶促反应过程,最终生成丙酮酸。由于肌肉长期处于缺氧状态,糖酵解产物丙酮酸无法通过乙酰辅酶A进入三羧酸循环,在乳酸脱氢酶的作用下产生乳酸。
2 能量代谢与肉品质
肌肉转化为肉的过程中所涉及的宰后肌肉能量代谢与肉品质密切相关[9]。动物宰杀放血后,肌肉组织供氧中断,细胞逐渐进入缺氧状态,为了维持机体的正常代谢,如上所述,肌肉内会发生氧化磷酸化、磷酸肌酸分解和糖酵解等一系列代谢过程,并最终影响肉的品质形成[10]。
2.1 磷酸肌酸体系与肉品质
宰后早期阶段,肌肉中的ATP主要由磷酸肌酸的分解提供:ADP+磷酸肌酸+H+↔ATP+肌酸。但仅靠磷酸肌酸分解产生的ATP无法长时间维持宰后的能量代谢,当机体内的磷酸肌酸被消耗超过70%的阈值后,肌肉糖酵解启动[7]。宰前肌肉中的磷酸肌酸含量会影响宰后早期糖酵解过程的进行。宰前肌肉中磷酸肌酸含量较高时,磷酸肌酸体系在宰后初期可以更长时间提供ATP,因此可以延迟糖酵解过程的开始。与此同时,磷酸肌酸分解产生ATP的过程会消耗H+,从而延缓宰后pH值的下降。Scheffler等[11]研究发现,具有腺苷酸蛋白激酶γ3R200Q的猪具有较高的磷酸肌酸水平,且宰后维持ATP水平的能力增强,从而延缓了糖酵解过程的进行。
肌酸是一种天然存在于肌肉中的氮化合物,在能量代谢中具有关键作用,可以被磷酸化为磷酸肌酸[12]。当肌肉ATP水平低于阈值后,作为肌肉重要的能量缓冲系统肌酸被磷酸化成磷酸肌酸,随后与ADP在肌酸激酶的催化下再生成ATP[13]。目前已经有很多研究通过在饲粮中添加物质来改变机体内的磷酸肌酸含量,调控肉品质。有研究表明,膳食中添加肌酸或一水肌酸(creatine monohydrate,CMH)可以提高机体内的肌酸和磷酸肌酸含量[14],降低宰后肌肉的糖酵解率,从而改善猪肉品质[15]。Zhang Lin等[16]研究发现,饲粮中添加CMH通过提高肌内磷酸肌酸/肌酸系统的能量缓冲能力,改善肌肉能量状态,抑制运输诱导的AMPKα通路的激活,有利于通过减少夏季运输应激的快速糖酵解来提高肉品质。也有研究发现,膳食中添加胍基乙酸(guanidineacetic acid,GAA)也增加了总肌酸和磷酸肌酸水平,并发现添加GAA提高了猪背最长肌的pH值,降低了滴水损失、蒸煮损失和剪切力,同时降低了己糖激酶的活性和乳酸含量[17]。这表明GAA可以作为一种有效的肌酸来源影 响糖酵解过程。Juhn[18]研究表明,补充肌酸增加了细胞内磷酸肌酸水平,导致细胞水合作用增强,细胞内的水合作用可能会加强肌纤维结缔组织网络并改善嫩度。
综上所述,磷酸肌酸体系对于宰后肉品质的影响也主要是通过抑制糖酵解过程来进行,当肌肉中含有较多的磷酸肌酸时,会降低宰后肌肉的糖酵解率,从而改善肉品质。此外,磷酸肌酸分解过程会消耗H+,从而减缓因H+的累积而导致的宰后pH值下降过程,改善因宰后pH值的快速下降而导致的保水性较差等问题。
2.2 糖酵解与肉品质
糖酵解过程是影响宰后肉品质形成的重要因素。肌肉中的糖原含量、糖酵解酶活性等都会通过糖酵解途径对肉的嫩度、肉色、保水性等品质产生影响,因此了解宰后肌肉糖酵解过程对肉品质的影响,对于肉品质的调控具有重要意义。
宰后肌肉内的糖原在各种糖酵解酶的催化作用下生成丙酮酸,并在乳酸脱氢酶的催化作用下最终生成乳酸。宰后pH值的下降与糖酵解过程及ATP水解产生的H+累积有关[6]。许多研究表明,宰后肌肉成熟过程中pH值的下降速率与程度是影响肉品质的关键因素[9,19-20],宰后肌肉中糖酵解速率过快会导致H+的快速积累,进而导致pH值的快速下降,肌肉中的肌球蛋白发生变性,肌丝间距变小,从而不利于肉的保水性[3]。宰后肌肉中的代谢异常会影响pH值的变化,pH值的快速下降容易导致PSE(pale, soft, and exudative)肉的产生,pH值下降程度不足,会导致DFD(dry, firm, and dark)肉的产生,进而影响肉色、嫩度、保水性等品质[21]。目前对于糖酵解过程的调控主要集中在两方面,一方面是通过改变肌肉中的糖原含量来调控糖酵解的程度,另一方面是通过调节糖酵解关键酶活性来调控糖酵解速率。
宰后肌肉的糖酵解程度受到糖原含量的影响,肌肉内糖原含量的积累与屠宰前的状态有关。畜禽屠宰前的禁食、应激反应等都会影响到体内的糖原含量,进而影响宰后肉品质的发展。畜禽在屠宰前一般都会经过禁食阶段。吴学壮等[22]研究宰前禁食时间对肉鸡糖代谢的影响,结果表明,随着禁食时间的延长,肌肉中的糖原含量降低,并最终导致宰后24 h的pH值升高,亮度值(L*)、蒸煮损失和剪切力降低。但Apaoblaza等[23]研究发现,肉牛禁食24 h,肌肉内糖原含量降低,但其极限pH(ultimate pH,pHu)值并未发生显著变化,这表明宰后pHu值不仅受到肌肉中糖原含量的影响,还受到其他因素的综合作用。也有研究发现,对于猪肉,禁食时间低于18 h会导致PSE肉的产生,禁食时间超过22 h会导致DFD肉的产生[24-25]。
除了禁食以外,宰前热应激也会导致肌肉中糖原含量的变化。研究表明,高温会对畜禽能量代谢产生不良影响,加速其糖酵解过程,H+快速积累,pH值降低[26]。李军乔等[27]研究发现,高温环境导致肉鸡L*、剪切力和滴水损失增加,并降低红度值,这与杨书慧等[28]的研究相似。Lu Zhuang等[29]证实,32 ℃热应激14 d的肉鸡乳酸含量、乳酸脱氢酶和丙酮酸激酶活性与保持在22 ℃热中性条件下的肉鸡相比表现出更高水平。这表明慢性热应激引起线粒体功能障碍,降低了动物的有氧代谢,导致糖酵解增加,表现为pHu值降低和剪切力降低,L*和滴水损失增加。对于急性热应激(32 ℃持续2 h),肉鸡血浆中CK、乳酸脱氢酶、天冬氨酸转氨酶和丙氨酸转氨酶水平升高,这些酶与肌肉糖酵解和蛋白质水解有关。因此,在屠宰后发现其具有更大的滴水损失及更快的pH值下降速率。吴小伟等[30]研究不同屠宰季节对生猪肉品质的影响,发现夏季屠宰杜长大三元杂交猪和三门峡黑猪猪肉宰后24 h的pH值均显著低于其他3 个季节,且CK、乳酸脱氢酶活性显著高于其他季节,这说明夏季屠宰导致的热应激会提高生猪体内的CK、乳酸脱氢酶活性,从而促进糖酵解过程的进行,导致H+快速积累,在宰后24 h产生较低的pH值。同时发现夏季屠宰的生猪肉具有更高的L*和汁液损失,这可能是较低的pHu值所致。除热应激以外,运输也会导致动物宰前的应激反应,大量研究表明,宰前的长期运输会加速肌肉中ATP的消耗,诱导糖酵解的进行,最后导致乳酸积累,pH值降低,肉品质变差[31-32]。
综上所述,糖酵解对肉品质的影响主要通过影响宰后pH值的变化影响酶活性、结构蛋白等,进而影响肉品质。宰后正常的糖酵解过程有助于改善肉品质,但糖酵解速率过快(pH值下降过快,形成PSE肉)、糖酵解程度不足(pHu值过高,形成DFD肉)及糖酵解过度(pHu值过低,形成酸肉)均会对肉品质产生不良影响。对于糖酵解的调控可以通过改变肌肉中的糖原含量及糖酵解酶活性来进行。宰前禁食、运输、热应激等均会对肌肉的糖原含量产生影响,进而调控糖酵解的进行。
3 AMPK对能量代谢的影响
AMPK是一种广泛存在于真核细胞中的异三聚体酶,由1 个催化亚基α和2 个调节亚基β和γ组成[33]。其中α亚基中的N端主要负责催化功能,C端负责结合β和γ亚基,β亚基可在肌肉中糖原含量处于较高水平时抑制AMPK的活性[34],而γ亚基中含有与AMP/ATP相结合的位点。许多研究表明,AMP/ATP比例增加会通过增加α亚基中Thr172的磷酸化从而激活AMPK[35]。但也有学者认为,大多数AMP在宰后肌肉中迅速转变为肌苷酸(inosine monophosphate,IMP),AMP和IMP的总量才能真正反映宰后AMP的形成量,因此提出使用(AMP+IMP)/ATP作为AMPK激活预测因子[36-37]。但AMP/ATP比例的增加并不是激活AMPK的唯一途径,有研究[36,38]表明,Ca2+增加也可以激活AMPK。
许多研究表明,激活后的AMPK对调控肌肉内能量平衡具有重要作用,可以通过抑制糖原合成来抑制ATP的消耗,同时可以通过调节糖酵解过程以及葡萄糖的摄取来促进ATP的生成,进而调节机体的能量平衡。杨雅媛等[39]研究不同海拔牛宰后AMPK活性与能量代谢的关系,结果发现,高海拔、低氧适应性下牛肉中AMPK的活性增加,从而加快了糖酵解代谢,有效调节能量的生成。杨致昊等[40]研究发现,在苏尼特羊的宰后不同时间点,AMPK含量和活性的变化会影响肌肉糖酵解,从而影响肉品质。
AMPK对糖酵解过程的调节主要通过调节糖酵解过程关键酶的活性进行,而起主要调节作用的是AMPKα2亚基[41]。张铭灏等[33]提出,AMPK可以通过活化糖原磷酸化酶并抑制糖原合成酶活性来降低肌肉内糖原水平,进而影响糖酵解过程。Holmes等[42]通过向小鼠体内注射5-氨基咪唑-4-羧酰胺核糖核苷来激活AMPK,结果显示,随着AMPK的激活,骨骼肌中的己糖激酶活性显著增加。己糖激酶是糖酵解过程的关键控制酶,可以将葡萄糖转化为葡萄糖-6-磷酸。AMPK也可以通过磷酸化磷酸果糖激酶2来增加糖酵解,磷酸化磷酸果糖激酶2可以催化6-磷酸果糖产生果糖-2,6-二磷酸,这是磷酸果糖激酶1的强效变构激活剂,磷酸果糖激酶1是糖酵解过程最重要的速率控制酶,可以催化6-磷酸果糖产生果糖-1,6-二磷酸,这是糖酵解过程的关键步骤[35]。丙酮酸激酶也是糖酵解过程的关键控制酶之一。Du Min等[43]通过研究AMPK对糖酵解的影响发现,将AMPK基因敲除后,宰后24 h的背最长肌中丙酮酸激酶的活性显著低于对照组,这表明AMPK可能通过激活丙酮酸激酶来调节糖酵解。也有研究发现,在同一温度处理条件下,AMPK活性较高时,丙酮酸激酶也有较高的活性[44]。张一敏等[45]研究发现,不同部位牛肉中AMPK活性存在显著差异,且AMPK活性较高的腰大肌中丙酮酸激酶达到最大活性的时间早于背最长肌,这也表明AMPK可能影响丙酮酸激酶活性,从而影响糖酵解过程。
此外,AMPK激活后也可以通过诱导葡萄糖转运子4完成转位以及其转录因子的磷酸化,启动葡萄糖转运子基因的表达,完成对葡萄糖的吸收和转运。Halse等[46]也发现,激活后的AMPK通过增加对葡萄糖的摄取,抑制了糖原合成,从而促使葡萄糖向糖酵解方向转化。
综上所述,AMPK是调节能量代谢的关键物质,主要在于对糖酵解过程的影响(AMPK对能量代谢的调控过程见图3)。AMPK激活后,一方面可以通过对糖酵解相关酶(己糖激酶、磷酸果糖激酶、丙酮酸激酶、乳酸脱氢酶等)的活性调节,来促进糖酵解过程的进行;另一方面也可以通过影响糖原合成酶及糖原磷酸化酶的活性来减少糖原合成,促进糖原代谢,间接促进糖酵解。 此外,AMPK还可以通过诱导促进葡萄糖转运子4完成转位以及通过磷酸化转录因子促进葡萄糖转运子基 因的表达调节对葡萄糖的摄取,促使葡萄糖向糖酵解方向进行。

图 3 AMPK和SIRTs对能量代谢的调控过程Fig. 3 Regulation of AMPK and SIRTs on energy metabolism
4 SIRTs对能量代谢的影响
SIRTs是一类NAD+依赖的蛋白去乙酰化酶,在调节和维持糖脂稳态中发挥重要作用[47]。SIRTs家族蛋白包括SIRT1~7,它们定位于细胞的不同位置,SIRT1、SIRT6、SIRT7主要位于细胞核中,SIRT2局限于细胞质中,SIRT3、SIRT4、SIRT5位于线粒体中[48]。SIRTs已经被证明可以作为代谢酶活性以及基因转录的调节因子参与细胞内能量代谢(SIRTs对能量代谢的调控过程见图3)。
4.1 SIRT1
当机体的能量供应受到限制时,NAD+含量增加,从而激活NAD+依赖的SIRT1。Canto等[49]研究表明,在啮齿动物中,SIRT1活性与NAD+/NADH比率的显著升高有关,这主要归因于NAD+的增加。但也有研究[50]表明,NAD+/NADH比率对SIRT1的激活起作用并不是由于 NAD+的增加所致,而是因为NADH的减少。
乙酰化肝激酶B1(liver kinase B1,LKB1)是一种AMPK的上游激酶,SIRT1通过去乙酰化LKB1增加AMPK的活性,而AMPK是影响糖酵解过程的一个重要分子。同时,活化后的AMPK也可以提升细胞内的NAD+含量,从而进一步激活SIRT1[51]。
SIRT1在代谢中发挥重要作用,影响线粒体生物发生、糖酵解等过程。过氧化物酶体增殖物激活受体γ辅助激活因子α(peroxisome proliferator-activated receptor γ co-activator 1α,PGC-1α)是一种诱导型转录共激活因子,其活性受到磷酸化、去乙酰化等蛋白修饰的调控。研究表明,SIRT1可以在NAD+的参与下将PGC-1α去乙酰化,同时激活肝细胞核因子4,从而调控糖异生相关基因的转录[52]。此外还发现,SIRT1可以通过调节PGC-1α抑制糖酵解相关基因的表达[53],从而调节糖酵解过程。也有研究发现,SIRT1可以通过激活转录因子叉头框蛋白O1(forkhead box protein O1,FoxO1)和PGC-1α增加肝脏葡萄糖的产生[54-55],从而调节体内的葡萄糖含量,进而影响糖酵解的发生。在低氧条件下,缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)优先激活糖酵解酶基因的表达,SIRT1会抑制转录因子HIF-1α以降低糖酵解程度,促进氧化代谢[47]。目前SIRT1已被证实与HIF-1α存在相互作用,但其对HIF-1α转录活性的影响仍然存在争议[56],SIRT1介导的HIF-1α去乙酰化可能在低氧条件下促进或降低糖酵解酶基因表达,但仍需要进一步研究。此外,SIRT1可以去乙酰化磷酸甘油酸突变酶-1(phosphoglyceratemutase-1,PGAM-1),降低其催化活性,从而抑制糖酵解过程[57]。
SIRT1对于能量代谢的影响研究主要集中在医学方面,其对能量代谢的影响主要体现在对于葡萄糖含量的调节及糖酵解过程的控制上[52-55]。SIRT1可以通过对PGC-1α、 FOXO1等的去乙酰化作用来调节糖异生过程,进而影响机体内的葡萄糖含量[54-55]。同时,去乙酰化PGC-1α可以通过抑制糖酵解相关基因来抑制糖酵解过程。SIRT1可以通过去乙酰化LKB1来激活AMPK活性,AMPK已被证实是影响糖酵解过程的重要因子。此外,SIRT1也可以通过去乙酰化PGAM-1、抑制HIF-1α等来抑制糖酵解过程,但其具体影响机制目前研究较少,其调控过程也存在争议,仍需要进一步研究[56-57]。
4.2 SIRT3
SIRT3是线粒体内最重要的去乙酰化酶,通过可逆的赖氨酸乙酰化控制氧化磷酸化过程,参与调节线粒体中三羧酸循环、电子传递和脂肪酸氧化等代谢活动;在SIRT3缺失的情况下,琥珀酸脱氢酶的亲水亚基(SdhA)被高度乙酰化,这是参与哺乳动物线粒体的三羧酸循环和氧化磷酸化的琥珀酸脱氢酶的亲水性亚基之一[58]。
SIRT3可以通过乙酰化作用调节异柠檬酸脱氢酶2和谷氨酸脱氢酶活性[59],这2 种酶在三羧酸循环中发挥重要作用。同样,活化后的谷氨酸脱氢酶可以促进氨基酸合成葡萄糖,从而调节机体内的葡萄糖含量[60]。SIRT3可以去乙酰化乳酸脱氢酶A,正向调节其活性[61],从而促进糖酵解进行。
5 结 语
宰后肌肉能量代谢对肉品质的影响是一个复杂的过程,其不仅受到宰后许多因素的影响,一些宰前因素也会影响宰后能量代谢的进行,如宰前运输、热应激、禁食等,影响肌肉中的糖原含量,进而影响宰后糖酵解过程的进行。动物宰后仍会保持一段时间的有氧代谢,主要与氧化磷酸化有关,随后磷酸肌酸开始分解产生ATP,磷酸肌酸体系可以延缓糖酵解过程进行,并且减缓宰后 H+的累积,导致pH值下降。磷酸肌酸消耗70%以上以后,糖酵解过程开始进行,糖酵解对能量代谢至关重要,影响宰后肌肉pH值的下降速率和程度,宰后pH值的变化会影响肌肉中的结构蛋白及酶活性变化,进而影响肉的嫩度、保水性等品质,较低的pHu值往往不利于肉品质。
AMPK与SIRTs家族都是调节糖代谢的关键靶点,是影响宰后能量代谢的重要因素。AMPK主要通过调节宰后糖酵解酶的活性及促进糖原的代谢过程来影响宰后能量代谢,但关于SIRTs家族对能量代谢的研究还主要集中在医学方面,对宰后能量代谢的影响仍存在一些争议,其具体的作用机制也不明确,因此还需要进一步的探索,这或许为通过能量代谢调节肉品品质提供了新的思路。
