利用激光在微流控芯片中实现细胞分选的研究
2023-02-09仲小祥冒卫星张华丽
仲小祥,冒卫星,张华丽
(南通大学机械工程学院,江苏南通 226019)
1 引言
激光光镊作为一种非接触式的操纵方式,可实现对单个细胞的操纵和定向控制[1−3]。因其对细胞无损伤且可实现微尺度下的单细胞操纵甚至细胞内的生物分子操纵,这项技术广泛应用在医药、生物工程、化学分析等各个领域,同时随着光镊在细胞分析领域的发展,光镊技术逐渐在疾病治疗、诊断上发挥重大作用[4−7]。文献[8−9]利用熔拉的方法制作了抛物线型光纤,在显微镜试验台下实现了对酵母菌细胞的三维操纵,并利用两根光纤实现了对细胞的转移交接,对捕获物实现空间状态的调节,后又利用微结构光纤制作表面等离子体共振传感器,可极大地缩小表面等离子体共振系统的体积,更易于光学器件在微芯片中的集成。
文献[10]使用对端面进行微处理过的光纤束构建的光纤光镊实现了对微颗粒和生物细胞的稳定非接触捕获,通过设计和开发微型化光学微处理器,使芯片操作和单细胞荧光显微镜具有可行性,该系统具有高通用性、低成本、易于制造和组装等优点,可作为分离稀有细胞或观察局部环境变化对诊断或筛查的影响的通用方法。另外,文献[11]首次使用光镊控制神经元的生长和伸展,同时利用光镊解剖神经元,研究神经元对局部损伤的后续反应,并且在高功率下完成了捕获细胞的裂解。
文献[12]利用CFD软件进行Y型芯片的流场分析,验证了Y型沟道的水力聚焦宽度与鞘流液流速/细胞液流速之间的关系,优化设计出了便于利用激光以及其他操纵方式分离细胞的芯片结构。另外,文献[13]使用波长为650NM、功率为200mW的红色半导体激光成功在短时间驱动酵母细胞,速度可达25μm/s。
随着光镊技术的不断发展,光流控技术的研究主要有两方面:(1)激光光镊操纵细胞光纤技术的研究;(2)微流控芯片的功能化设计从而利用鞘流流动实现更精确的细胞分选[14]。
将激光操纵的无损伤与微流控芯片的微尺度、微通量特点相结合,能实现更精确、定向的细胞分选。这里结合微流控芯片鞘的微流场动力学以及光镊的原理,利用COMSOL Multiphysics软件进行激光作用分选细胞的仿真模拟,研究激光功率大小以及细胞物理特征对捕获结果的影响,并采用100mW激光器进行分离(8~10)μm聚苯乙烯的对比试验,分析如何实现精确、高效的细胞分选。
2 模型与方法
2.1 微流体内细胞受力的数学模型
光的电磁理论,证明了光作为电磁波,不但具有能量,而且具有动量。根据牛顿第二定律,作用在物体上的力就等于光引起的单位时间内物体动量的变化,光与物体相互作用的过程中就伴随有动量的交换。
单位时间里物体动量发生变化意味着光对被照物体施加一个力的作用[15]。两束光以不同角度射入微粒小球,产生不同大小的力Fa、Fb,力的大小取决于激光的功率以及入射角度。微粒小球在两束激光的作用下运动推离,如图1所示。

图1 激光束推动细胞的力学示意图Fig.1 Mechanical Diagram of Cells Pushed by Laser Beam
在微流体内激光操纵细胞的仿真模型中,微流体中运动的细胞或粒子受到的力有:微流体对细胞的曳力FD,激光力F,不考虑自身重力G、液体的浮力FB和其他外部力,建立微流体中细胞的运动状态仿真模型。
根据牛顿第二运动定律可以得到:

根据斯托克斯公式,运动状态下的球形细胞所受阻力为:

式中:m—被导向细胞的质量;Fd—单位质量的被导向细胞受到的曳力;V—液体的流速;Vm—被导向细胞在微流体中的运动速度。根据细胞质量与直径的关系,可以表示为:

式中:μ—液体的动力粘度系数;dm—被导向细胞的直径;ρm—细胞的密度。
2.2 微流体内激光操纵细胞的仿真模型
在COMSOL中建立仿真模型,几何形状,如图2所示。左侧通道设置进口1,长度为500μm;上下两侧的鞘流通道长度为500μm,设置进口2和进口3;右侧通道长度为1000μm,设置出口1。各通道宽度均为100μm。图中蓝色区域设置Y正方向设置侧向力代替激光力。在层流模块,流体材料为水,进口1、进口2、进口3的法向流入速度为1e−4m/s,出口1为压力输出。
在粒子追踪模块,设定粒子为固体,指定其密度和直径为10μm,以及粒子的进口和速度。由层流状态分析可得,形成的聚焦流宽度为22μm。层流流场的整体流线分布,如图2所示。

图2 层流流场的整体流线分布Fig.2 Overall Streamline Distribution of Laminar Flow Field
2.3 实验材料与方法
本实验以单抛硅片为基片,均匀涂覆SU−8负胶,通过光刻法制备硅片模版[16]。采用模塑法制备微流控芯片,选用聚二甲基硅氧烷(PDMS)为芯片基材,将液态PDMS 倾覆于硅片模版上,烘干,得到具有微结构的PDMS基片。实验主要包括微流控芯片,进液模块,激光作用模块和观测模块。实验仪器主要为LSP02−1B 注射泵,210−CE 注射泵,Leica DMI 3000B 荧光倒置显微镜,聚四氟乙烯导管,IDEX P20X 接头,1ml 注射器,以及MIL−111−1064−100mV激光器和HCSIR光纤,原理,如图3(a)所示。

图3 芯片实验原理及鞘流宽度调节图Fig.3 Chip Experimental Principle and Scabbard Flow Width Adjustment Diagram
主通道流入浓度为(1×105)个/ml的聚苯乙烯PS 溶液,鞘流流入双蒸水。调节主通道与鞘流通道的流速比,使粒子成列通过。聚焦流的调节效果,如图3(b)、图3(c)所示。光纤用特殊切刀将端面切平整后嵌入光纤通道,调整光纤与主通道的距离,开激光器预热。在激光器稳定后,利用荧光倒置显微镜观察粒子偏转口的情况。
3 结果与分析
3.1 激光力大小对细胞运动的影响
激光功率的大小决定了激光中每个光子的能量多少,当激光传输到细胞表面时,产生的辐射压力也不同。
设定细胞直径为10μm,密度为1050kg/m3,以1e−4m/s的速度从进口1进入流场。激光力设为5pN、10pN、15pN、20pN、25pN、30pN。从图4(a)中可以看出,当激光力为5pN时,细胞在激光作用区域向上偏转,Y方向偏转距离dY为5μm。
层流状态下三个进口的流体互不干扰,形成的聚焦流宽度为22μm,即细胞在流体作用下分布为±11μm。当激光力作用后,细胞的分布为(−6~16)μm,即部分细胞仍在聚焦流中,部分细胞进入上层流体中。激光力为15pN、20 pN时的细胞运动轨迹,如图4(a)所示。

图4 仿真结果分析Fig.4 Analysis of Simulation Results
无激光力作用时,聚焦流即为细胞在流体作用下的分布区域。激光力施加后,细胞发生偏转。当激光力逐渐变大,细胞偏转越明显。激光力小于15pN时,细胞偏转位移较小时,分布在中间的聚焦流的部分细胞进入上层流体。激光力为15pN时,细胞全部偏转进入上层流体,不在聚焦流中。激光力为20pN时,少量上外侧细胞偏转粘结通道内壁;激光力为35pN时,细胞全部偏转粘结在通道内壁。分析不同激光力作用下,直径10μm细胞的偏转位移。得到的偏转位移与激光力的关系图,如图4(b)所示。从图中可看出,偏转位移与激光力大小成线性关系。
3.2 激光作用力对不同直径细胞运动的影响
设定作用区域的激光力为15pN,细胞大小为5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm。其中直径5μm、10μm、15μm的细胞运动轨迹,如图4(c)所示。
当激光力为15pN时,不同直径细胞的偏转位移结果,如图4(d)所示。从图4(d)可发现,当激光力一定时,细胞尺寸越大,其偏转位移越小。
3.3 细胞分选模型与实验结果
前面的研究表明了不同激光力、不同细胞直径条件下,细胞运动偏转的规律。本节改进第二节中的模型,以实现激光操纵微流体内细胞的分离,如图5所示。沿激光传输方向,设置出口2接收偏转后的细胞。细胞经激光作用后进入分选通道,根据目标细胞尺寸的大小可以设置不同的激光功率达到分选的目的。

图5 细胞分离模型及粒子轨迹Fig.5 Cell Separation Model and Particle Trajectory
利用PDMS制作的微流控芯片,通入聚苯乙烯粒子,在鞘流的作用下成列进入主通道。光纤嵌入与主通道垂直并与分选通道处于同一水平线的辅道,在激光器稳定输出时看到的粒子偏转情况,如图6所示。目标粒子在激光作用下偏转入捕获通道并且成列通过,缓慢的流速保证粒子有足够的作用时间,少数粒子由于尺寸大小的不同以及流道本身存在的凹凸导致的速度突变没有进入分选通道。

图6 光纤作用下的粒子轨迹Fig.6 Particle Trajectory Under the Action of Optical Fiber
在聚焦流侧边的芯片部位嵌入光纤,利用光纤传输激光,使细胞的运动轨迹发生改变,最终达到操纵细胞分选的目的。在模拟条件下,通过控制进液速度,激光力大小等条件,细胞由主通道偏转进入了分选通道,如图5所示直径10μm的细胞在35pN激光力作用下,偏转进入出口2所在通道。
这里研究建立的基于微流控芯片的激光分选细胞模型,有三个功能区域:聚焦区,检测区以及分选区,如图7所示。聚焦区用于形成单细胞聚焦流,使细胞依次排列。在激光作用区域前段设置检测区域,用于检测细胞流中细胞尺寸、荧光状态等,经图形采集及相关算法处理得到细胞信息,传输至计算机。分选区为光纤激光的作用区域,计算机根据细胞信息,以及分选条件,控制激光是否开启。最终,非目标细胞从出口1输出,目标细胞从出口2输出。
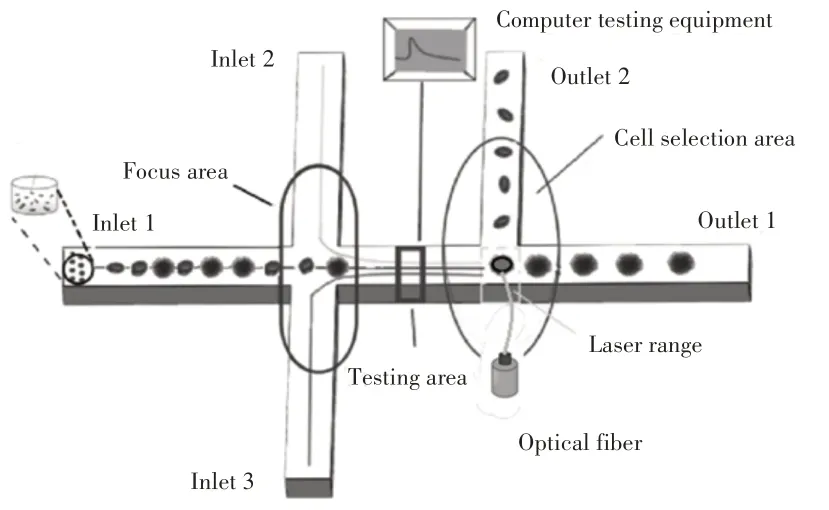
图7 基于微流控芯片的激光分选细胞模型Fig.7 Laser Cell Sorting Model Based on Microfluidic Chip
4 结论
这里结合微通道流体流动的理论基础以及利用激光进行细胞操纵的光学和力学原理,使用COMSOL Multiphysics仿真软件建立鞘流流动以及激光激光作用下捕获细胞的仿真模型,分析激光光镊实现高效捕获分离细胞的机制,利用100mW功率激光器以及聚苯乙烯微球进行分选实验,研究结果如下:
(1)随着激光力的增大,粒子或细胞的偏移角度也随之增大,偏移距离跟激光力大小成正比关系。(2)相同大小的激光力作用下,细胞直径越大,其偏转位移越小。(3)在100mW 功率的激光作用下,(8~10)μm的聚苯乙烯微球能够从主通道偏转进入分选通道。
根据上述结论,对不同直径大小的细胞或粒子进行激光操纵,选择适合的激光功率可以实现细胞粒子的捕获或分离。根据建立的物理捕获模型,计算机在混合细胞进入检测区时得到数据计算出细胞分选所需的激光功率大小,从而控制分选,实现细胞分选的自动化、集成化。
