骨质疏松症与肌-骨-脂关系研究
2023-02-09林燕平郭海威黄佳纯袁嘉尧林贤灿万雷黄宏兴
林燕平,郭海威,黄佳纯,袁嘉尧,林贤灿,万雷,黄宏兴*
骨质疏松症(osteoporosis,OP)是一种以骨量降低、骨组织微结构损坏导致骨脆性增加、易骨折为特征的全身性骨病[1]。OP作为慢性老年性疾病,其发病过程缓慢、隐匿,在学术界素有“沉默杀手”之称,而随着机体衰老,肌肉、骨骼和脂肪的生理变化在表型上较为明显。女性绝经后骨量以每年1%~2%的速度下降,骨量减少的速度比男性更快,而与肌肉量和骨组织的减少不同,脂肪组织可能在高龄时期趋于平稳或下降,以上变化均会导致个体整体力量和功能下降,增加跌倒和骨折的风险[2]。目前针对“肌-骨-脂”和OP发病关系的研究较少,目前诊断OP的“金标准”为双能X线吸收 法(dual energy X-ray absorptiometry,DXA), 该 技术操作方便、准确性及精确性高[3],同时DXA还可作为人体成分测量的标准法,可获得全身以及躯干、四肢等部位的肌肉、脂肪、骨矿含量及其比例,本文主要探讨了OP与肌-骨-脂的关系。
1 资料与方法
1.1 诊断标准 OP诊断标准参考《中国原发性骨质疏松症诊治指南(2017)》[3]:骨密度低于同性别、同种族健康成人的骨峰值1个标准差及以内属正常;降低1.0~2.5个标准差为骨量低下(或低骨量);降低≥2.5个标准差为OP;骨密度降低程度符合OP诊断标准,同时伴有1处或多处脆性骨折为严重骨质疏松。
1.2 纳入标准 (1)女性≥49岁且绝经时间在1年以上,男性≥60岁;(2)未进行过系统的OP治疗,临床症状较明显;(3)无严重的心、肺、肝、肾功能损伤和骨代谢疾病;(4)了解本研究概况并自愿参加研究。
1.3 排除标准 (1)继发性OP(甲状腺功能亢进症、糖尿病等内分泌疾病,类风湿性关节炎、强直性脊柱炎等免疫性疾病,多发性骨髓瘤等血液系统疾病,影响钙和维生素D吸收、代谢的消化系统和肾脏疾病、神经肌肉疾病,慢性阻塞性肺疾病等其他疾病导致的骨质疏松);(2)6个月内服用过影响骨代谢药物的患者;(3)合并其他疾病的患者。
1.4 一般资料 2019-07-19至2021-01-05广州中医药大学第三附属医院招募符合纳入、排除标准的骨质疏松症患者108例,均为在广州居住至少半年以上的常住人口,其中女97例,男11例;年龄49~88岁,平均年龄(62.9±7.1)岁。本研究获得广州中医药大学第三附属医院医学伦理委员会审批通过(伦理审批号:2020034)。
1.5 骨密度检测和身体成分测量 采用双能X线骨密度仪检测患者前后位腰椎(L1~4)的骨密度。骨密度通常用T值表示,T值=(实测值-同种族同性别正常青年人峰值骨密度)/同种族同性别正常青年人峰值骨密度的标准差。正常:T值≥-1.0,低骨量:-2.5<T值<-1.0,骨质疏松:T值≤-2.5。取腰椎整体T值作为正常组、骨量减少组和骨质疏松组的分组依据。使用双能X线骨密度仪对患者进行身体成分测量,同时测量患者整体的肌肉质量和脂肪质量,计算脂肪百分比,通过比较不同年龄段患者的骨密度和身体成分,分析年龄对骨密度和身体成分的影响;比较不同骨密度患者的身体成分,分析肌肉、骨骼、脂肪间的相互作用关系。
1.6 骨形成相关指标检测 于早晨9:00~10:00采集每位患者空腹10 h以上的肘静脉血4 ml,采用ELISA法检测血钙(Ca)、骨保护素(Osteoprotegerin,OPG)、骨形态发生蛋白 -2(bone morphogenetic protein 2,BMP2)和 B 淋巴细胞瘤 -2 基因(B cell lymphoma 2,BCL2)等,通过检测不同骨密度患者血液中骨形成相关指标了解骨组织新陈代谢的情况。
1.7 统计学方法 应用SPSS 25.0统计软件进行数据分析,计量资料以(±s)表示,多组间比较采用单因素方差分析(One Way ANOVA),组间多重比较采用Bonferroni检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 不同年龄患者身高、体质量和体质指数(BMI)比较,差异无统计学意义(P>0.05)。不同年龄患者T值比较,差异有统计学意义(P<0.05);与49~58岁患者相比,59~68岁、≥69岁患者T值降低,差异有统计学意义(P<0.05),见表1。
表1 不同年龄患者的身高、体质量、BMI和T值比较(±s)Table 1 Comparison of height,weight,BMI and T-score between subjects in three age groups

表1 不同年龄患者的身高、体质量、BMI和T值比较(±s)Table 1 Comparison of height,weight,BMI and T-score between subjects in three age groups
注:a表示与49~58岁相比P<0.05;BMI=体质指数
年龄(岁) 例数 身高(m) 体质量(kg) BMI(kg/m2) T值49~58 31 1.58±0.06 54.46±6.83 21.63±2.70 -1.65±1.26 59~68 57 1.57±0.05 55.21±7.59 22.33±3.08 -2.34±1.42a≥ 69 20 1.56±0.06 56.08±8.13 22.96±3.23 -2.73±1.31a F值 1.30 0.29 1.26 4.40 P值 0.28 0.75 0.29 0.02
2.2 脂肪质量、肌肉质量、脂肪百分比和骨矿含量比较 不同年龄患者脂肪质量、肌肉质量、脂肪百分比和骨矿含量比较,差异无统计学意义(P>0.05),见表2。正常组、骨量减少组和骨质疏松组脂肪百分比比较,差异无统计学意义(P>0.05);三组脂肪质量、肌肉质量、骨矿含量比较,差异有统计学意义(P<0.05)。与正常组相比,骨质疏松组脂肪质量降低,骨量减少组和骨质疏松组骨矿含量降低,差异有统计学意义(P<0.05)。与骨量减少组相比,骨质疏松组肌肉质量、骨矿含量降低,差异有统计学意义(P<0.05),见表3。
表2 不同年龄患者脂肪质量、肌肉质量、脂肪百分比和骨矿含量的比较(±s)Table 2 Comparison of fat mass,muscle mass,fat percentage and bone mineral content in subjects in three age groups
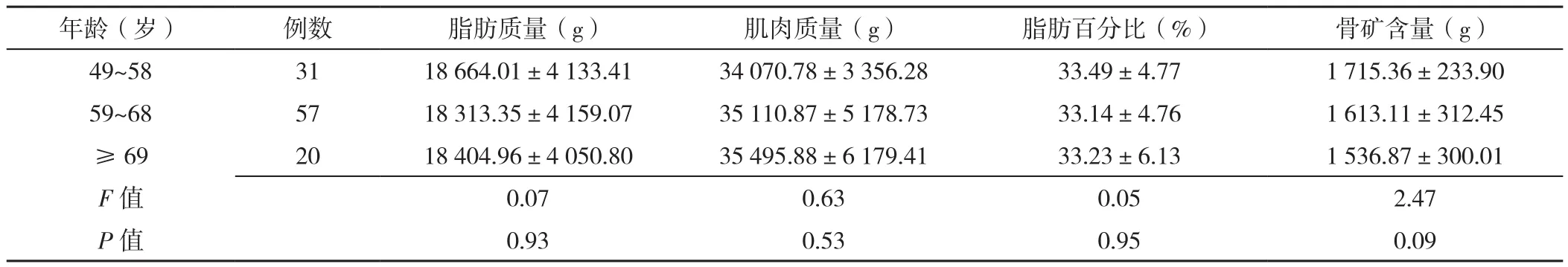
表2 不同年龄患者脂肪质量、肌肉质量、脂肪百分比和骨矿含量的比较(±s)Table 2 Comparison of fat mass,muscle mass,fat percentage and bone mineral content in subjects in three age groups
年龄(岁) 例数 脂肪质量(g) 肌肉质量(g) 脂肪百分比(%) 骨矿含量(g)49~58 31 18 664.01±4 133.41 34 070.78±3 356.28 33.49±4.77 1 715.36±233.90 59~68 57 18 313.35±4 159.07 35 110.87±5 178.73 33.14±4.76 1 613.11±312.45≥ 69 20 18 404.96±4 050.80 35 495.88±6 179.41 33.23±6.13 1 536.87±300.01 F值 0.07 0.63 0.05 2.47 P值 0.93 0.53 0.95 0.09
表3 正常组、骨量减少组、骨质疏松组的脂肪质量、肌肉质量、脂肪百分比和骨矿含量的比较(±s)Table 3 Comparison of fat mass,muscle mass,fat percentage and bone mineral content in normal group,bone loss group and osteoporosis group
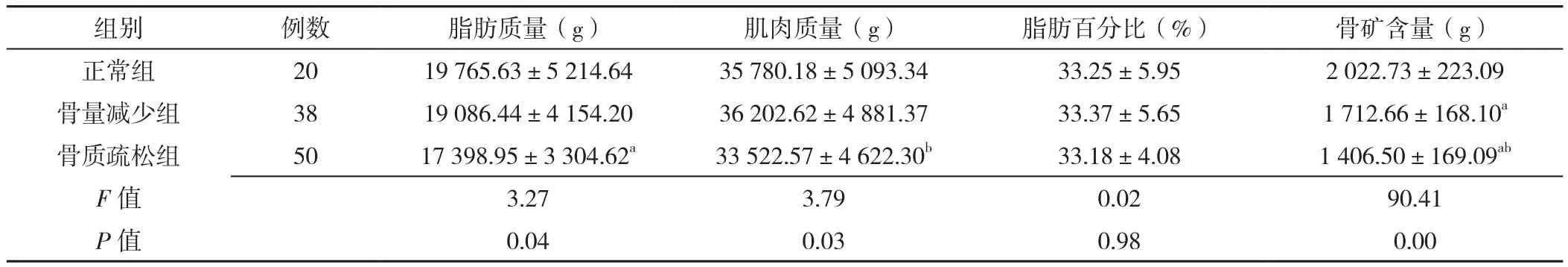
表3 正常组、骨量减少组、骨质疏松组的脂肪质量、肌肉质量、脂肪百分比和骨矿含量的比较(±s)Table 3 Comparison of fat mass,muscle mass,fat percentage and bone mineral content in normal group,bone loss group and osteoporosis group
注:a表示与正常组相比P<0.05,b表示与骨量减少组相比P<0.05
组别 例数 脂肪质量(g) 肌肉质量(g) 脂肪百分比(%) 骨矿含量(g)正常组 20 19 765.63±5 214.64 35 780.18±5 093.34 33.25±5.95 2 022.73±223.09骨量减少组 38 19 086.44±4 154.20 36 202.62±4 881.37 33.37±5.65 1 712.66±168.10a骨质疏松组 50 17 398.95±3 304.62a 33 522.57±4 622.30b 33.18±4.08 1 406.50±169.09ab F值 3.27 3.79 0.02 90.41 P值 0.04 0.03 0.98 0.00
2.3 骨形成相关指标比较 三组Ca比较,差异无统计学意义(P>0.05);三组OPG、BMP2、BCL2比较,差异有统计学意义(P<0.05)。与正常组相比,骨质疏松组OPG、BMP2降低,骨量减少组BMP2降低,差异有统计学意义(P<0.05);与骨量减少组相比,骨质疏松组OPG和BCL2降低,差异有统计学意义(P<0.05),见表4。
表4 正常组、骨量减少组、骨质疏松组骨形成相关指标比较(±s)Table 4 Comparison of bone formation indices in normal group,bone loss group and osteoporosis group

表4 正常组、骨量减少组、骨质疏松组骨形成相关指标比较(±s)Table 4 Comparison of bone formation indices in normal group,bone loss group and osteoporosis group
注:Ca=血钙,OPG=骨保护素,BMP2=骨形态发生蛋白-2,BCL2=B淋巴细胞瘤-2基因;a表示与正常组相比P<0.05,b表示与骨量减少组相比P<0.05
组别 例数 Ca(mmol/L) OPG(ng/L) BMP2(ng/L) BCL2(μg/L)正常组 20 1.24±0.19 3 665.67±3 139.33 653.47±184.44 161.88±158.01骨量减少组 38 1.28±0.19 3 352.63±3 044.51 458.87±262.95a 173.93±154.43骨质疏松组 50 1.23±0.18 2 062.60±1 474.09ab 441.45±322.46a 106.67±60.08b F值 0.80 4.43 4.35 3.73 P值 0.45 0.01 0.02 0.03
3 讨论
OP是一种进行性的、与年龄相关的代谢性骨病,其特征是骨量减少,伴随骨组织微观结构退化,可导致骨密度降低,骨折风险增加[4-5]。在机体的衰老进程中,肌肉、骨骼和脂肪含量均发生不同程度的变化。人体的肌肉量在30~40岁达到峰值,然后逐渐下降[6]。有调查显示,男性肌肉质量每年下降0.45%,女性每年下降0.37%,与年龄相关的肌肉力量下降是老年人发生功能活动障碍、跌倒、骨折和死亡的重要预测指标[7-9]。在绝经后期,骨组织的丢失导致骨骼微结构恶化和骨折风险增加,在细胞水平上,破骨细胞数量和活性增加破坏了骨小梁的连通性,增加了皮质孔隙度,骨密度和骨质量减少则降低了骨骼的机械承重性能,增加骨折的易感性[10]。脂肪组织可提供更高机械负荷和刺激的骨量积累,并且脂肪量和肌肉量的比例对骨量具有一定影响[11]。随着年龄增长,除了脂肪和肌肉含量变化外,同时也伴有骨质流失,意味着肌-骨-脂之间有可能存在紧密联系。
本研究结果显示,不同年龄患者身高、体质量和BMI无统计学差异,不同年龄患者T值有统计学差异;与49~58岁患者相比,59~68岁、≥69岁患者T值降低,表明随着年龄增长,OP患者骨密度可能呈下降趋势,这为加强老年人防治OP和预防骨折提供了临床依据,与国外研究结果一致[12-13]。一般人群骨密度随年龄增长而下降,而BMI增大则是髋关节骨折的危险因素[14]。DXA是诊断OP的首选方法,骨密度是预测骨折风险的重要指标[15]。T值代表一个标准差,表示测试者与同种族、同性别健康青年人的峰值骨密度差异,如果T值为0,则意味着受试者骨密度与健康青年人的正常骨密度相等。T值<0越多,表示骨密度越低,骨折风险越高[16]。参考世界卫生组织推荐的诊断标准,骨密度值低于同性别、同种族健康成人的骨峰值1个标准差及以内属正常;降低1.0~2.5个标准差为骨量低下(或低骨量);降低≥2.5个标准差为骨质疏松[17]。
本研究结果显示,与正常组相比,骨质疏松组脂肪质量降低,骨量减少组和骨质疏松组骨矿含量降低;与骨量减少组相比,骨质疏松组肌肉质量、骨矿含量降低,提示骨密度更有可能是影响人体脂肪质量、肌肉质量、骨矿含量的重要因素,这对临床上诊治骨量减少或OP具有重要意义,并有可能通过提高患者的骨密度改善由于肌肉质量降低而引起的功能障碍、跌倒等问题,但具体机制还有待进一步深入研究。正常体质量的成年人骨骼肌约占总体质量的40%,所以骨骼肌可以说是人体最大的器官[18]。不仅如此,骨骼肌还被认为是一个内分泌器官,可产生和释放各种因子,如成骨生长因子、白介素-6(interleukin 6,IL-6)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、成纤维细胞生长因子 2(fibroblast growth factor,FGF-2)等,通过旁分泌、自分泌、内分泌途径影响骨骼健康[19-21]。肥胖的发病率逐年上升,肥胖可引发一系列肌肉骨骼并发症和代谢紊乱[22]。而与肌肉量和骨组织的减少不同,脂肪组织可能在高龄时期趋于平稳或下降。另一方面,随着年龄增长,人体的脂肪重新分布到腹腔内以及肌肉和骨骼浸润,导致人整体力量和功能下降,增加跌倒和骨折的风险[2]。
本研究结果显示,与正常组相比,骨质疏松组OPG、BMP2降低,骨量减少组BMP2降低;与骨量减少组相比,骨质疏松组OPG和BCL2降低,提示骨量减少和OP患者骨重建失稳,骨吸收活跃加速骨量流失。骨重建受破骨细胞和成骨细胞调控,不同的细胞因子和激素调节期的激活、再吸收、逆转、形成和终止影响着骨重建[23]。核因子κ B受体活化因子配体(RANKL)和OPG是TNF超家族成员,对骨吸收的调节至关重要。RANKL通过其受体核因子κ B受体活化因子(RANK)激活破骨细胞的形成、活化和存活,而OPG是RANKL的另一个受体,主要通过与RANKL结合抑制破骨细胞形成,抑制骨丢失,从而阻止RANK-RANKL结合[24]。骨形成与成骨细胞密切相关[25],在一个正常、健康的个体中,破骨细胞活性和成骨细胞活性之间存在平衡。而在OP患者中,这两种细胞类型之间的关系不平衡,破骨细胞活性升高,成骨细胞活性降低[26],导致骨骼孔隙度增加,进而增加骨折的风险。本研究结果亦提示骨量减少和OP患者血清BMP2含量较低,这可能与成骨细胞活性降低、骨形成活动减弱有关,研究和分析BMP2对阐明成骨细胞和破骨细胞的活化机制具有重要意义,可为未来的OP治疗提供线索。BMP2能诱导成骨细胞活性和破骨细胞活性[27],可以结合两种受体,负责启动典型和非典型信号级联反应,即Ⅰ型受体(BMPRIa)和Ⅱ型受体(BMPRII)。BMP2诱导的信号传导是在该蛋白召集两个受体的结合使其二聚或与已经二聚的受体结合时启动的。一旦这三种成分结合在一起形成复合物,Ⅱ型受体将使Ⅰ型受体磷酸化[28],随后SMAD独立和依赖的信号通路均可能再次被激活[29]。
本研究结果显示,与正常组相比,骨质疏松组的Bcl2较低,推测OP患者体内Bcl2蛋白不能很好发挥抗凋亡作用和促骨形成作用。Bcl2作为一种抗凋亡蛋白,主要是通过调控线粒体的通透性来抑制细胞凋亡,包括抑制氧化剂诱导的细胞凋亡、抑制细胞内钙离子的跨膜运动和形成离子通道抑制细胞凋亡[30]。本研究团队前期研究发现,OP患者的Bcl2相关基因存在差异表达,在此基础上构建了Bcl2过表达和沉默腺病毒并转染成骨细胞和大鼠,研究发现沉默Bcl2基因表达可抑制MG63细胞增殖活力及成骨分化能力;Bcl2重组表达腺病毒载体转染MG63细胞可增强细胞活力及矿化钙化能力,促进骨形成;过表达Bcl2可以促进BMP2、OPG蛋白的表达,但在此过程中是否有其他凋亡蛋白的参与,以及是否发生了级联反应等,还有待进一步深入研究[31-33]。
OP作为一种老年慢性疾病,其发病过程缓慢、隐匿,在学术界素有“沉默杀手”之称。“肌-骨-脂”之间的联系与OP发病过程密切相关。结合本研究结果可以发现,随着年龄的增长,OP患者骨密度呈下降趋势,骨密度是影响人体脂肪质量、肌肉质量、骨矿含量的重要因素;OP患者血清BMP2、OPG和Bcl2含量降低,这可能与凋亡蛋白不能很好发挥抗凋亡作用和促骨形成作用,使得成骨细胞活性降低,骨形成活动减弱有关。本研究不足之处是尚未对OP与肌-骨-脂之间的关系做深入的相关性分析,目前针对“肌-骨-脂”之间联系的研究较少,本研究意在初步探讨三者在OP过程中的相互影响,为下一步深入开展实验研究提供参考依据。
作者贡献:林燕平进行文章的构思与设计,负责撰写论文;郭海威负责研究的实施;黄佳纯、袁嘉尧、林贤灿进行数据收集、整理;万雷负责研究的可行性分析;黄宏兴负责文章的质量控制及审校、对文章整体负责,监督管理。
本文无利益冲突。
