中药致神经毒性的物质基础与作用机制研究进展 Δ
2023-02-09何海赵沙沙邢耀莹王姿杨杜丽东邵晶甘肃中医药大学药学院兰州70000西北中藏药省部共建协同创新中心兰州70000甘肃省中药药理与毒理学重点实验室兰州70000
何海 ,赵沙沙 ,邢耀莹 ,王姿杨 ,杜丽东 , ,邵晶 , (.甘肃中医药大学药学院,兰州 70000;2.西北中藏药省部共建协同创新中心,兰州 70000;.甘肃省中药药理与毒理学重点实验室,兰州 70000)
中药是在中医药理论的指导下用以预防、治疗、诊断疾病并具有保健、康复作用的天然药物及其加工品,具有疗效好、毒性低、使用安全等多种优点,为人类的健康做出了巨大贡献。近年来,因不规范服用中药致不良反应等安全事件屡发,引起了人们对其毒性研究的重视,尤其是在肝肾毒性方面研究资料较多,但中药导致的神经毒性却鲜有报道。相关研究表明,部分中药在防治疾病的同时会产生神经系统毒性,可影响中枢神经系统和外周神经系统功能,达到一定剂量甚至可导致动物死亡[1]。值得关注的是,经过现代技术提炼之后,中药活性成分得到富集,其吸收利用度有所提高,使其安全性更应受到学界重视。基于此,本文重点综述了中药致神经系统毒性的物质基础及毒性机制,以期为揭示中药致神经毒性的危险信号,进一步完善中药安全性评估和神经毒性中药的临床合理应用提供科学依据。
1 中药致神经毒性的物质基础
神经毒性中药多具有醒脑、开窍、安神等药理活性,可用于临床治疗神昏谵语、惊风、中风、癫痫等证,是中医临证用药的一大特色[2]。此外,神经毒性中药在戒毒方面同样具有重要作用,如在阿片类药物中毒的急救、脱瘾、戒后调养等过程中,洋金花、天仙子、颠茄草等中药可有效控制戒断症状[3]。现代药理毒理学研究表明,中药所含活性成分及其量效关系是决定其药理活性和毒性作用的关键。对主要活性成分不良反应认识不足,中药使用不合理,尤其是中药滥用,很容易导致神经毒性不良反应的发生,进而对机体造成严重不良后果[4]。中药毒性成分根据其来源可分为内源性毒性成分和外源性毒性成分。
1.1 内源性毒性成分
内源性毒性成分是中药研究领域的重要话题,根据化学结构不同,可分为生物碱、糖苷类、二萜类、动植物毒蛋白和重金属等。其中,多种中药内源性毒性成分往往同时也是临床有效成分,其有效性和安全性的关键节点是临床用药剂量。
研究表明,从川乌、马钱子等药用植物中分离得到的生物碱类化合物在临床治疗中均表现出极强的药效或治疗作用,但同时也表现出一定的神经损伤作用,患者可能出现中枢兴奋、中枢抑制、瞳孔放大、意识不清、烦躁不安、头晕、惊厥、麻痹、昏迷等临床表现[5-6]。麻黄水煎液中所含的麻黄碱可缓解感冒引起的呼吸道症状,但研究表明该成分可导致小鼠运动增加,情绪焦虑,大脑记忆、认知发生错误,大脑皮层出现胶质细胞增生和锥体细胞坏死,纹状体部位出现组织间隙增宽以及胶质细胞增生,有一定的神经毒性[7]。天仙子中含有莨菪碱、东莨菪碱和阿托品等生物碱,上述成分可导致正常人活动明显减少,静卧不动、闭目,对刺激的反应性减弱,呼吸变慢[8]。
糖苷类成分主要包括强心苷、皂苷和氰苷等。研究指出,洋地黄所含的地高辛、洋地黄毒苷等强心苷类成分会引起明显的神经损伤,包括视力障碍、定位错觉、智力下降等症状[9]。苦杏仁含有氰苷,小鼠灌胃后会出现活动能力减弱、懒动、抽搐等症状,甚至出现死亡[10]。二萜类化合物主要以树脂、内酯或糖苷的形式存在,京大戟、闹羊花等中药所含的二萜类化合物对神经系统具有较强的毒性和损伤作用[11-12]。此外,部分中药所含的毒性蛋白也可导致神经损伤,如苍耳子、巴豆霜等中药所含的植物毒性蛋白均可导致小鼠活动减少、行动迟缓、抽搐、痉挛,甚至死亡[13-14];蝮蛇、全蝎、蜈蚣等动物类药材所含的动物毒性蛋白均可引发意识模糊、言语不清或障碍、抽搐、呼吸抑制等症状[15]。此外,部分中药(如雄黄、轻粉、半夏、天南星等)因含有砷、汞、铅等重金属和由草酸钙针晶及其表面糖蛋白、微量多糖组成的毒针晶,同样会导致神经毒性[16-18]。
1.2 外源性毒性成分
部分中药无内源性毒性成分,但是在使用过程中仍产生了或大或小的毒性,主要与中药外源性毒性成分有关[19]。中药外源性毒性成分是指在药材种植、加工、运输、存储过程中引入的一些非本身合成的有害元素和农药残留,是由于药材种植时施用农药、化肥不合理或由于水、土壤、空气等种植环境被污染,以及在加工、存储过程中一些错误操作所造成的。研究者发现,用硫磺进行熏制以延长保质期会造成药材中含硫量增加,温度、湿度等存储条件不合理可导致黄曲霉毒素的出现,耕种土壤富含的铜、镉、铅等重金属会导致药材重金属超标,患者长期服用或短期大量服用这些药材会出现失眠、头晕、呕吐、恶心、乏力等神经毒性症状,重者可能会出现痉挛、说话能力下降、吞咽困难,甚至死亡[20-22]。调查显示,除动物药与矿物药外,几乎所有的植物药均可检出农药残留:牛建均等[23]考察了不同产地太子参、野菊花、三七、茯苓、鱼腥草5种(共50批)药材中有机氯农药的残留情况,发现有机氯农药的检出率为50%;何清彦等[24]检测了10种(共30批)药材,均检出了禁用农药六六六(六氯环己烷)、滴滴涕(双对氯苯基三氯乙烷);顾炎等[25]从金银花中检出了水胺硫磷等有机磷农药;此外,有研究者还从部分药材中检出了克百威(2,3-二氢-2,2-二甲基-7-苯并呋喃基甲氨基甲酸酯)、三唑磷[O,O-二乙基-O-(1-苯基-1,2,4-三唑-3-基)硫代磷酸酯]等被WHO列为剧毒、高毒的农药残留[26]。上述残留物化学性质稳定,难以生物降解,脂溶性强,极易在生物体内蓄积引起神经毒性[27]。
2 中药致神经毒性的潜在作用机制
神经毒性中药对神经系统的影响是多方面的,在中枢神经系统主要表现为精神、行为障碍,智能下降,共济失调,语言障碍,听力及视力障碍;在周围神经系统则以周围神经病变多见,表现为肢体感觉障碍,出现肌肉长期、剧烈、自发性刺痛或烧灼痛[28]。中药对氧化应激、促发炎症、离子交换、能量代谢等过程的影响可能是其致神经毒性的重要机制。
2.1 诱导氧化应激
氧化应激是由于机体受外部刺激,导致体内超氧阴离子(O2·-)、羟自由基(·OH)、过氧化氢(H2O2)等氧自由基大量积累,而超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽(glutathione,GSH)等抗氧化物质不足以清除过多的氧自由基时所产生的细胞损伤现象[29]。过剩的氧自由基化学性质极度活跃,可破坏细胞DNA、蛋白和脂质分子,损伤线粒体,从而造成脑组织损害并引发多种神经退行性疾病[30]。含重金属的中药(如朱砂、雄黄、水银等)多具有神经毒性,氧化应激是其发挥毒性作用的重要途径。研究表明,雄黄在较低剂量时,能促进海马组织GSH的合成;但当剂量增加时,则可造成海马组织中GSH的合成减少,从而产生神经毒性作用[31]。Yen等[32]通过砷暴露实验发现,砷可造成小鼠大脑皮层中GSHPx、GSH和醌氧化还原酶mRNA水平的下降,脂质过氧化(lipid peroxidation,LPO)作用的增强,进而促进脂质体聚集,最终导致细胞膜流动性及通透性发生改变,产生神经毒性。Huang等[33]在小鼠连续7周的低剂量甲基汞暴露过程中发现,小鼠先后出现了活动增加、运动平衡障碍和听觉缺陷等症状,这些症状与小鼠脑组织中的汞蓄积和生化指标的改变呈相关性,包括脂质过氧化产物增加和钠钾ATP酶活性、一氧化氮水平改变等。铜同样具有抑制抗氧化酶表达、致机体氧化应激水平升高的作用,其作用可能与p38促分裂原活化的蛋白激酶(p38 mitogenactivated protein kinases,p38 MAPK)信号通路调节转录因子SKN-1/核转录因子红系2相关因子2(skinhead-1/nuclear factor-erythroid 2 related factor 2,SKN-1/Nrf2)有关[34]。神经毒性中药通过诱导氧化应激致神经毒性的潜在机制见图1。
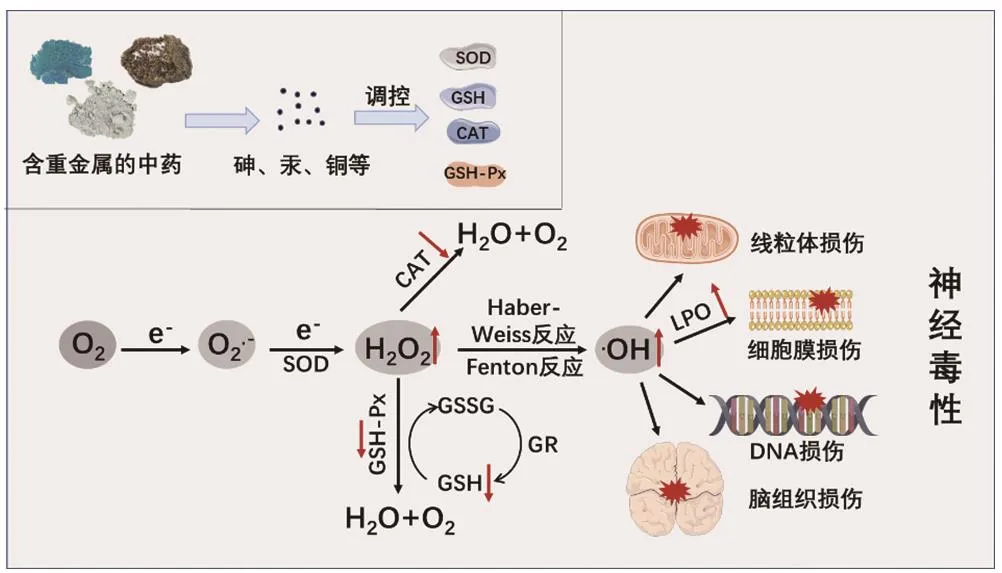
图1 神经毒性中药通过诱导氧化应激致神经毒性的潜在机制
2.2 影响离子通道
生物体内的离子通道具有参与神经与肌肉细胞调控、维持细胞正常生理活动的作用,一旦离子在通道内外的平衡被破坏,就可引发严重的细胞毒性[35]。研究发现,苦参、山豆根等中药所含的苦参碱能干扰谷氨酸(glutamic acid,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)的代谢,导致细胞膜Cl-通透性增加,持续产生抑制性突触后电位,诱导豌豆蚜持续麻痹后死亡[36]。乌头类生物碱可导致神经细胞Na+通道持续开放和激活,从而产生神经毒性[37]。Ono等[38]的研究进一步证实,乌头碱可影响神经细胞内Na+、K+、Ca2+稳态,导致神经细胞结构和功能受损,这种作用可能是通过抑制钠钾ATP酶的活性来实现的。此外,通过影响离子通道来发挥神经毒性作用的中药还包括含重金属铅的中药。铅具有模拟体内二价阳离子的能力,能替代Ca2+、Fe2+、Mg2+,影响机体生物代谢进程。有学者通过检测铅暴露后新生小鼠海马神经细胞内和细胞内质网中的Ca2+浓度发现,细胞内Ca2+浓度增加,细胞外Ca2+浓度下降,且两者成一定的线性关系,Ca2+浓度释放的变化可影响小鼠认知和学习记忆功能[39]。钙调素是能与Ca2+结合的蛋白质,能调节Ca2+浓度和离子通道,而铅能够模拟Ca2+激活钙调素,对神经细胞生理产生影响,造成神经细胞损伤[40]。神经毒性中药通过影响离子通道致神经毒性的潜在机制见图2。
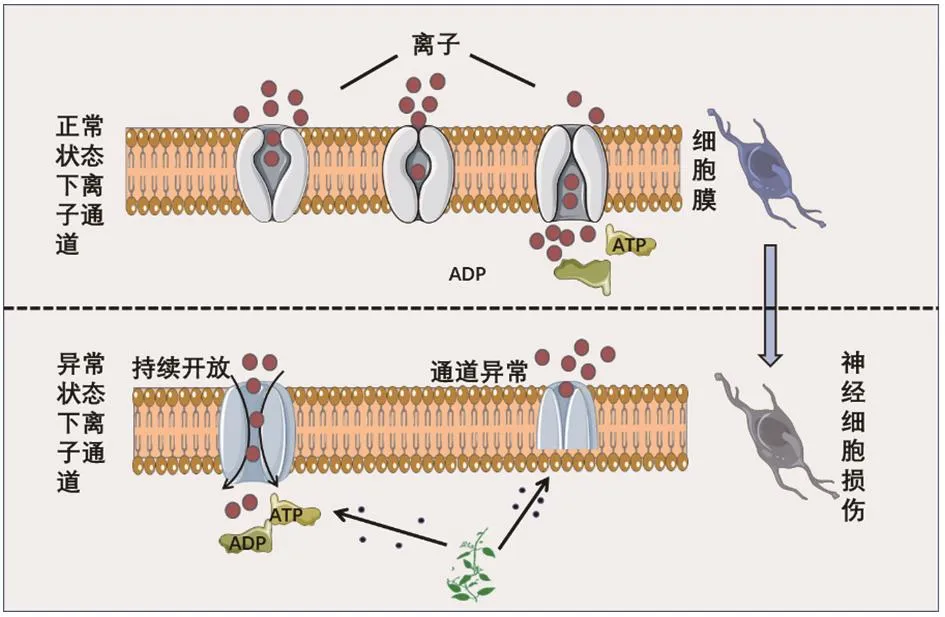
图2 神经毒性中药通过影响离子通道致神经毒性的潜在机制
2.3 影响能量代谢
神经系统对能量的需求极其敏感,能量代谢缺乏会严重影响神经调控功能,从而引起神经毒性[41]。研究发现,2%的乌头碱可使星形间质细胞的细胞膜完整性受到破坏,导致细胞内离子紊乱,从而造成细胞呼吸链中断,无氧呼吸增加,糖原大量分解,最终致使神经细胞能量代谢受阻[42]。此外,乌头碱暴露还能使线粒体受损,造成蛋白质能量供应障碍[37]。苦杏仁、核桃仁等中药所含的氰化物能阻断线粒体氧化磷酸化,使得中枢神经系统缺氧,细胞膜通透性改变,促使Ca2+内流,从而造成Ca2+稳态失调,诱发神经毒性[43]。青蒿素是我国科学家从菊科植物黄花蒿中提取的具有抗疟活性的单体化合物,后又通过半合成的方法研制出其衍生物蒿甲醚、青蒿琥酯、双氢青蒿素等。实验研究发现,青蒿素及其衍生物可损伤神经细胞及神经胶质瘤细胞的线粒体嵴和内质网膜,引起能量代谢失调并抑制蛋白质合成,导致未分化细胞的增殖和分化细胞的轴突生长或延伸被抑制,最终产生神经毒性[44-45]。神经毒性中药通过影响能量代谢致神经毒性的潜在机制见图3。
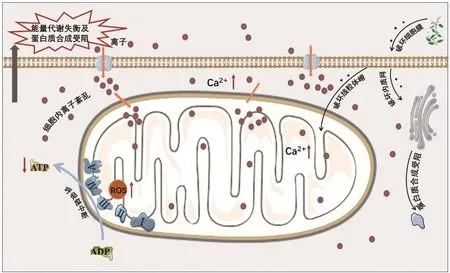
图3 神经毒性中药通过影响能量代谢致神经毒性的潜在机制
2.4 促发炎症
神经炎症是各种神经退行性疾病的共同特征,研究表明,核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体在神经炎症反应发生中发挥着关键介导作用[46]。王文倩[7]研究发现,麻黄能促进小鼠脑组织NLRP3炎症小体的表达,激活脑内吞噬细胞和其他胶质细胞通过旁分泌途径,引发神经细胞炎症反应,进而损伤神经细胞。含重金属汞的中药可诱发大脑炎症,导致神经毒性,其机制可能与汞能刺激肥大细胞释放出血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)和白细胞介素6(interleukin-6,IL-6),进而破坏血脑屏障有关[47]。神经毒性中药通过促发炎症致神经毒性的潜在机制见图4。
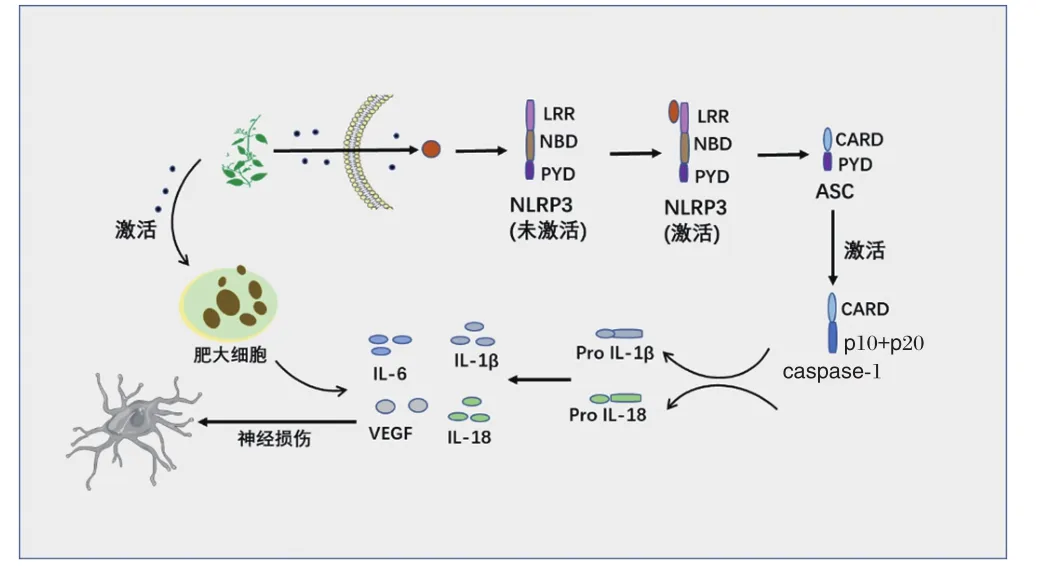
图4 神经毒性中药通过促发炎症致神经毒性的潜在机制
3 中药致神经毒性的潜在靶标
药物发挥作用的靶标不同,其神经毒性所攻击的位点亦不相同,其中神经细胞、髓鞘细胞、轴索和神经递质系统是最常见的靶标(图5)。
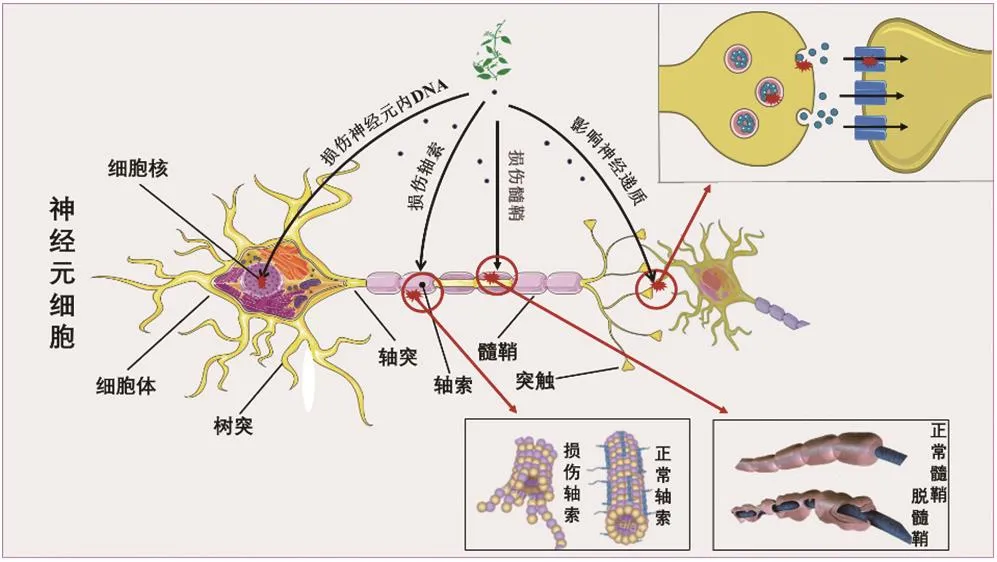
图5 神经毒性中药致神经毒性的潜在作用靶标
3.1 神经细胞
神经细胞具有感受刺激和传导兴奋的作用,是神经系统结构和功能的基本单位。神经细胞代谢旺盛,对神经毒性中药较为敏感,所以神经细胞中毒较为常见。研究发现,从中药马钱子中提取的士的宁可阻断甘氨酸受体激活,使齿状回神经细胞过度兴奋,从而诱发癫痫[6]。从金鸡纳树中提取的生物碱奎宁可作用于视网膜神经节细胞,使视网膜神经节细胞空泡变性,从而导致视野缩小[28]。DNA拓扑异构酶Ⅰ(topoisomerase-Ⅰ,TopoⅠ)是一种单体酶,可通过切断DNA的单链而使DNA超螺旋结构解旋。从中药喜树中提取得到的喜树碱类成分可抑制TopoⅠ,进而影响神经细胞的转录过程,造成神经细胞DNA损伤,最终诱导神经细胞凋亡[48]。
3.2 髓鞘
髓鞘是包被轴突表面的白色类脂质套层,既可保护轴突又可加速神经冲动的传导。髓鞘缺乏可导致神经冲动的延缓或缺失,相邻突触间的冲动传导异常还会影响轴突的运输功能,导致神经细胞功能紊乱和轴突结构改变,最终导致中毒性神经病变的发生[28]。有报道指出,山豆根可导致患者小脑白质脱髓鞘,从而引发头晕、恶心、呕吐、语言缓慢伴站立不稳等神经毒性症状[49]。乌头碱可使兔视神经髓鞘显著改变,如髓鞘疏松等[50]。此外,部分中药由于含有铅、砷等重金属,可直接作用于髓鞘产生毒性。研究指出,高水平铅暴露下,儿童脑组织可发生脱髓鞘病变、海马回结构萎缩等病理改变,最终导致大脑细胞死亡[51]。砷暴露则可导致大鼠形成髓鞘的重要原料髓鞘碱性蛋白的生成减少,从而造成髓鞘生成障碍,产生神经毒性[17]。
3.3 轴索
轴索由神经细胞轴突和感觉神经细胞长树突组成,其细胞骨架结构包括微管、神经微丝和连同轴索质膜下的带状微丝网3个部分。其中,微管具有支持轴索运输、维持轴索生存的重要作用。一些毒性中药神经毒性的产生与其作用于轴索内微管蛋白有关。例如,从中药秋水仙中提取的秋水仙碱能与轴索的微管蛋白结合,抑制微管合成,导致轴索萎缩,使其运输功能受到抑制[52];紫杉醇、长春碱类成分等与微管蛋白二聚体的亲和力较强,与之结合可阻断神经细胞有丝分裂周期,导致细胞死亡[53]。此外,有研究指出,长春碱类成分导致的轴索损伤可破坏施万细胞,进一步造成有髓神经纤维的继发性脱髓鞘和轴索变性[54]。
3.4 神经递质
神经递质是神经细胞信息传递的化学物质。一些中药可通过增加或降低突触中神经递质的浓度,放大或阻断信号传递,通过阻止神经递质的再吸收而产生神经毒性。例如,何首乌能抑制单胺氧化酶活性,抑制纹状体内单胺递质含量的降低[55];从马钱子中提取的马钱子碱能不同程度地增加神经递质5-羟色胺、去甲肾上腺素与多巴胺的含量[56]。此外,部分中药还可通过影响神经递质的合成、贮存、释放、降解等途径产生一系列的神经毒性。如洋金花能竞争性拮抗胆碱能神经递质乙酰胆碱对M胆碱能受体的激动作用,对中枢神经先兴奋后抑制,患者中毒后会处于交感神经兴奋状态[57]。
4 结语
中药成分复杂,作用靶标多样,产生神经毒性的机制尚未完全阐明,极大地限制了其药效的发挥,也在一定程度上造成了中药资源的浪费。目前,临床缓解中药致神经毒性的方法主要包括清除毒物和对症治疗。其中,清除毒物常用的措施有催吐、洗胃、导泻、灌肠等,对症治疗则是根据服毒者的临床症状给予抗兴奋、抗惊厥、抗休克或纠正水液代谢的药物。如患者马钱子中毒后,临床常使用戊巴比妥钠进行救治,川乌、草乌中毒后常根据症状给予阿托品或利多卡因进行救治[58],这些措施在一定程度上能够减轻毒性中药对于神经系统的损害。
但是,临床中毒者往往存在中毒原药不明确的情况。如何准确确定毒性物质基础,并结合患者临床症状快速判断中毒原药和解毒方案,是保障毒性中药使用安全、有效的重要前提。今后可考虑利用现代研究方法和大数据挖掘手段,建立以毒性物质基础成分群为核心的“中毒症状-中毒剂量-中毒原药-解毒方案”的安全性评价模式,形成切实可行的风险监测机制,这对神经毒性中药的开发利用以及中毒后的临床干预尤为重要。
