斗米虫抗菌肽粗提液抑菌活性及其生化特性研究
2023-02-08高诗琪周卫青徐华潮
高诗琪 周卫青 苏 兰 徐华潮*
(1.浙江农林大学林业与生物技术学院,杭州 311300;2.浙江省杭州市淳安县林业局,杭州 311700;3.浙江省湖州市安吉县灵峰街道办事处,湖州 313000)
随着经济社会高速发展和抗生素药物滥用现象激增,人类逐渐意识到细菌耐药性问题的严峻性,寻找传统抗生素替代药物已经成为当今世界尤其是发展中国家亟待解决的问题。昆虫作为地球上物种最为丰富的生物类群,防御系统独特,当受到微生物感染后,血淋巴免疫反应产生抗菌物质,其中最重要的是抗菌肽。昆虫抗菌肽通常由10~50个氨基酸残基组成,分子质量在2 000~7 000 u,具有水溶性好、热稳定高、活性强等优点[1]。研究表明,昆虫抗菌肽不仅可以有效预防细菌耐药性[2],还具有抗肿瘤[3]、抗寄生虫[4]、抗病毒[5]等功能,在先天性免疫反应中发挥着重要作用,被认为是理想的抗生素替代药物[6]。
细菌诱导昆虫可以产生活性高、稳定性强的抗菌肽。黄玉霞等[7]用球孢白僵菌感染家蚕5龄幼虫,用原核表达系统成功表达并纯化获得高纯度且具有抗菌活性的抗菌肽Enbocin1;朱小奇等[8]发现大肠杆菌(Escherichiacoli,E.coli)可以刺激黄粉虫的免疫系统,增加抗菌肽的表达量,使其产生浓度高、活性强的抗菌肽,且生化特性较稳定;王志涛等[9]发现大肠杆菌和沙门氏菌均能促进蝇蛆活体分泌抗菌肽,且诱导产生的抗菌肽浓度和抑菌圈直径均大于庆大霉素对照组。
斗米虫,是寄生于豆科药用植物云实(Caesalpiniadecapetala)中的蛀干天牛幼虫,常见种为锈色粒肩天牛种(Aprionaswainsoni),是一种优质蛋白质资源。现有研究表明,斗米虫蛋白质存在潜在的免疫调节功能[10]。为对其免疫调节功能进行探究,本试验用大肠杆菌和金黄色葡萄球菌2种细菌混合诱导锈色粒肩天牛种斗米虫,以期产生抗菌肽,为新型抗生素筛选提供研究基础。
本试验用1.5×108CFU/mL大肠杆菌和金黄色葡萄球菌(Staphylococcusaureus,S.aureus)等体积混合诱导锈色粒肩天牛种斗米虫产生抗菌肽,并测定在诱导的不同时间产生抗菌肽的量、抑菌活性,并探讨其酸碱稳定性、热稳定性以及反复冻融稳定性,旨在为将来采用分子生物学和基因工程技术,将斗米虫抗菌肽基因重组到微生物体内使其产生高活性的抗菌肽,并将其作为新型的绿色抗生素提供新的思路和科学依据。
1 材料与方法
1.1 试验材料
1.1.1 试验昆虫
斗米虫(由浙江农林大学徐华潮教授鉴定为锈色粒肩天牛种),虫龄在5~6龄,属于老熟幼虫,寄生于云实树干中,购自江西省上饶市横峰县斗米虫养殖基地,室温下人工饲养。
1.1.2 供试菌株
供试菌株主要有大肠杆菌ATCC25922、铜绿假单胞菌(Pseudomonasaeruginosa,P.aeruginosa)CMCC(B)10104、金黄色葡萄球菌CMCC(B)26003、枯草芽孢杆菌(Bacillussubtilis,B.subtilis)CMCC(B)63501,以上菌株购自中国医学细菌保藏中心,由上海鲁微公司进行转接,4 ℃斜面低温保藏。
1.1.3 主要试剂
试验所用主要试剂有胰蛋白胨、琼脂粉、氯化钠、纯度为98%的牛血清蛋白、98% N-苯基硫脲、2 mg/mL抑肽酶溶液、牛肉膏、酵母粉、1 650 U/mg青霉素G钠、0.05 mol/L乙酸铵缓冲液、100 mmol/L苯甲基磺酰氟(PMSF)溶液、≥98% β-巯基乙醇、生理盐水。
1.1.4 主要仪器
试验所用主要仪器有78-1磁力加热搅拌器、FA1204B型电子天平、ICEN-24R高速冷冻离心机、TU-100 恒温金属浴、SH10-250 生化培养箱、EQ02520-300-RD000 PRECELLYS EVOLUTION、PHU-TO全自动高压蒸汽灭菌锅、SW-CJ-IFO超净工作台。
1.2 试验方法
1.2.1 免疫诱导
大肠杆菌、金黄色葡萄球菌在培养箱中培养18~24 h,用无菌生理盐水调成0.5个麦氏比浊度(1.5×108CFU/mL),等体积混合均匀,作为诱导源。挑选体重相近的斗米虫240头,随机分为诱导组和对照组2组,每组120头。诱导组斗米虫用浓度均为1.5×108CFU/mL的大肠杆菌和金黄色葡萄球菌等体积混合开展抗菌肽诱导(诱导源1 μL,注射诱导),对照组用微量注射器针刺诱导。将以上处理的斗米虫置于温度为26 ℃、相对湿度为85%的条件下正常饲喂云实枝条粉,于饲喂12、24、36、48、60和72 h后挑取活的虫体,以备测定斗米虫抗菌肽浓度、抑菌活性及其部分生化特性。
1.2.2 抗菌肽的提取
参照朱小奇等[8]的提取方法,选用诱导不同时间的斗米虫,75%乙醇消毒,吸干虫体表面液体,称量后置于研钵中,按重量体积比1∶5转入预冷提取液(0.05 mol/L pH=5的乙酸铵缓冲液,35 μg/mL苯甲基磺酰氟,2‰巯基乙醇),冰水浴中提取30 min,充分研磨;匀浆液在4 ℃、12 000 r/min高速冷冻离心30 min取上清液,重复3次,合并上清液;随后放至100 ℃的恒温水浴箱中水浴5 min,然后以4 800 r/min(4 ℃)离心30 min,去除变性蛋白;用灭菌好的注射器抽取不含油层的上清液,装于小试管中标记后放于-20 ℃冰箱中冷冻备用。
1.2.3 蛋白质浓度测定
称取100 mg的考马斯亮蓝,在50 mL 95%的乙醇中充分溶解,加入100 mL 85%(质量体积分数)的磷酸,用蒸馏水定容到1 L;室内静止2 h左右,过滤出残渣后,分装在棕色瓶待用。称取10 mg的牛血清蛋白,并用蒸馏水定容到100 mL,得到0.1 mg/mL的牛血清蛋白标准液。
取6只带塞试管,从1~6进行编号,依次加入牛血清蛋白标准液0、0.2、0.4、0.6、0.8、1.0 mL,并将全部试管用蒸馏水或去离子水补足到1 mL(每个样品3个重复)。用移液枪吸取5 mL考马斯亮蓝溶液,依次加入试管中,盖紧试管塞,上下颠倒数次后,静置2 min(在1 h之内完成测定)。将溶液倒入1 cm石英比色皿中,在595 nm下进行比色。以蛋白质浓度为横坐标,吸光度值为纵坐标,绘制标准曲线(图1)。根据标准曲线确定斗米虫抗菌肽粗提液的蛋白质浓度。
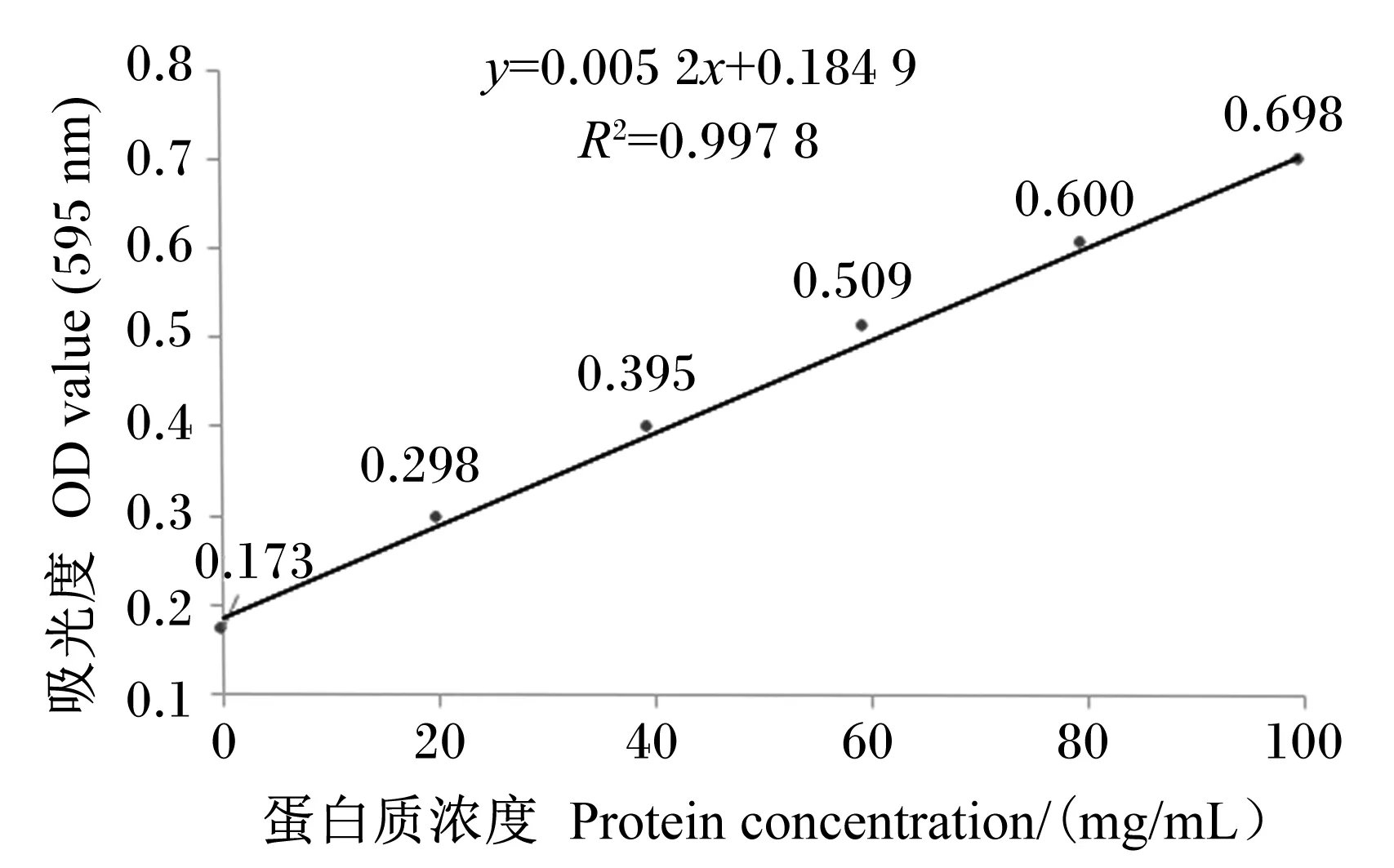
图1 蛋白质浓度标准曲线Fig.1 Standard cure of protein concentration
1.2.4 抑菌活性测定
采用滤纸片扩散法测定抑菌活性。取20 μL麦氏比浊法稀释的浓度为1×108CFU/mL的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌,分别均匀涂布于普通琼脂平板中,将直径为6 mm的滤纸片灭菌后分别放入诱导组的斗米虫抗菌肽粗提液、对照组的提取液、抗生素(青霉素浓度为64 μg/mL)中浸泡2~5 min后,常温放置5 min即成药敏纸片,分别放入涂好大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌的培养皿中,每皿设1个空白对照(相应的提取溶液),各纸片中心距离大于24 mm,纸片距培养皿内缘应大于15 mm,置36 ℃恒温箱中倒置培养24 h后,用游标卡尺测量抑菌圈直径,重复做3次并记录数据。
1.2.5 热稳定性测定
将斗米虫抗菌肽粗提液分别于50、60、70、80、90和100 ℃水浴中加热10 min,12 000 r/min(4 ℃)离心15 min,收集上清液,测定其对金黄色葡萄球菌的抑菌活性(抑菌圈直径),每个处理重复测定3次。以不经热处理的样品作为对照,将对照的抑菌率设定为100%。
1.2.6 反复冻融稳定性测定
将斗米虫抗菌肽粗提液-20 ℃分别反复冻融1、2、4、6、8和10次,12 000 r/min(4 ℃)离心15 min,收集上清液,测定其对金黄色葡萄球菌的抑菌活性(抑菌圈直径),每个处理重复测定3次。以未经处理的斗米虫抗菌肽粗提液作为对照,将其抑菌率设定为100%。
1.2.7 不同pH对抗菌肽活性的影响
配制pH分别为1、3、5、7、9的溶液,将不同pH的溶液分别与斗米虫抗菌肽粗提液等体积混合,室温放置1 h后检测其对金黄色葡萄球菌的抑菌活性(抑菌圈直径),每个处理重复测定3次。以不经不同pH溶液处理的样品作为对照,将对照的抑菌率设定为100%。
1.3 数据处理与分析
采用Excel 2019整理数据,蛋白质浓度和抑菌圈直径测定结果均表示为平均值±标准误。采用SPSS 25.0软件的独立样本t-检验和one-way ANOVA程序进行数据的差异显著性检验。
2 结果与分析
2.1 斗米虫抗菌肽粗提液蛋白质浓度的测定结果
大肠杆菌和金黄色葡萄球菌等体积混合诱导斗米虫12、24、36、48、60和72 h后,依据斗米虫抗菌肽粗提液的吸光度值及蛋白质浓度标准曲线,确定诱导不同时间的斗米虫抗菌肽粗提液的蛋白质浓度(表1)。表1的测定结果显示,未诱导(对照组)的斗米虫抗菌肽粗提液蛋白质浓度在诱导12、24、36、48、60和72 h时比较稳定,维持在0.446 mg/mL左右。而混合诱导(诱导组)的斗米虫抗菌肽粗提液蛋白质浓度在诱导不同时间时均极显著高于对照组(P<0.01),在24 h内,随着诱导时间的延长,诱导组斗米虫抗菌肽粗提液蛋白质浓度逐渐升高,且在诱导24 h时达到最大值,之后随着诱导时间的延长趋于下降。
2.2 斗米虫抗菌肽粗提液抑菌活性的测定结果
表1的测定结果显示,混合诱导24 h的斗米虫抗菌肽粗提液蛋白质浓度最高,因此,对混合诱导24 h的斗米虫抗菌肽粗提液和抗生素对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌进行抑菌活性测定,结果见表2。
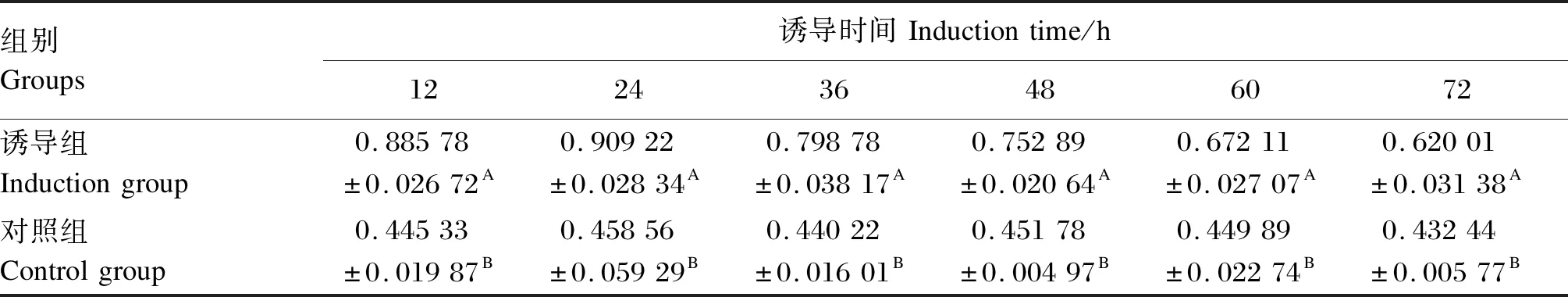
表1 斗米虫抗菌肽粗提液蛋白质浓度测定结果Table 1 Protein concentration assay results of antimicrobial peptide crude extract from Apriona swainsoni larvae mg/mL
表2的测定结果显示,对照组的提取液对4种菌株普遍没有抑制作用,诱导组的斗米虫抗菌肽粗提液对革兰氏阳性菌金黄色葡萄球菌、枯草芽孢杆菌有抑制作用,但是对革兰氏阴性菌大肠杆菌和铜绿假单胞菌无抑制作用;且诱导组的斗米虫抗菌肽粗提液对金黄色葡萄球菌、枯草芽孢杆菌产生的抑菌圈直径分别为22.05、18.64 mm,高于对照组,但低于抗生素组;此外,从抑菌圈直径看,斗米虫抗菌肽粗提液对金黄色葡萄球菌的抑菌活性要大于枯草芽孢杆菌。
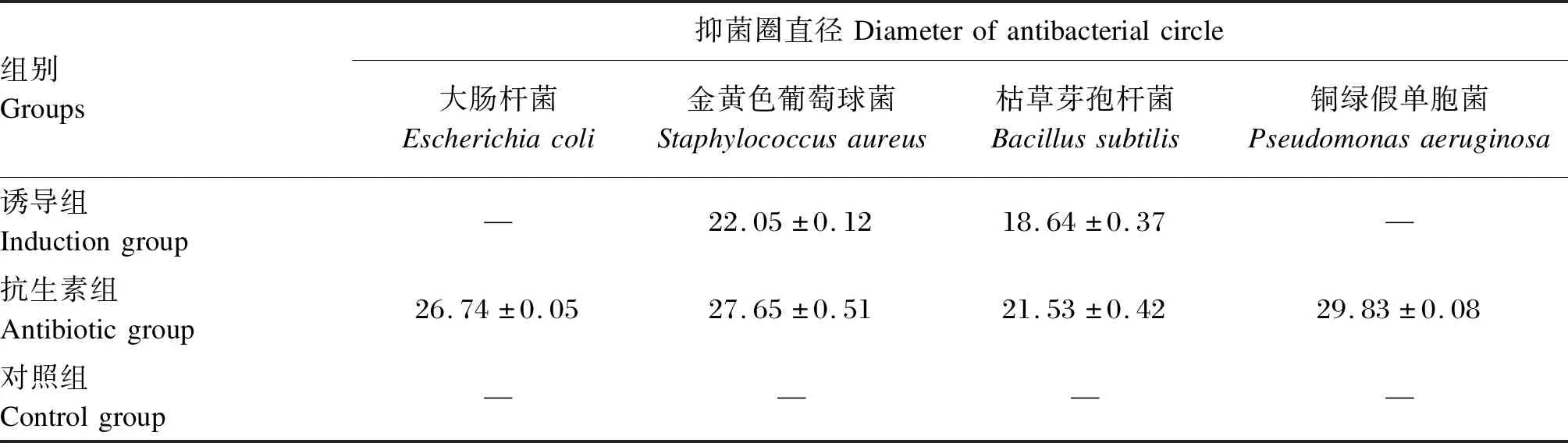
表2 斗米虫抗菌肽粗提液对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌的抑菌圈直径的测定结果Table 2 Assay results of antibacterial circle diameter produced by antimicrobial peptide crude extract from Apriona swainsoni larvae induced by Escherichia coli Staphylococcus aureus,Bacillus subtilis and Pseudomonas aeruginosa mm
2.3 斗米虫抗菌肽粗提液热稳定性的测定结果
由表2测定结果显示,大肠杆菌、金黄色葡萄球菌混合诱导的斗米虫抗菌肽粗提液对金黄色葡萄球菌的抑制作用较为明显,故选用金黄色葡萄球菌作为指示菌株,进行抑菌活性差异性分析。由表3可知,经50~60 ℃处理的斗米虫抗菌肽粗提液的抑菌圈直径与对照组(未经热处理)差异不显著(P>0.05),抑菌率在99%以上;经70 ℃处理的斗米虫抗菌肽粗提液的抑菌圈直径与对照组差异显著(P<0.05),但其抑菌率仍然可以达到98.11%,此结果提示,50~70 ℃的温度范围对斗米虫抗菌肽粗提液的抑菌效果几乎没有影响,抑菌率均在98%以上;当温度达到80~100 ℃时,斗米虫抗菌肽粗提液的抑菌圈直径较对照组显著降低(P<0.05),结果提示,80 ℃后,温度升高影响斗米虫抗菌肽粗提液的抑菌活性,但其抑菌率仍然保持在70%以上,由此推断,大肠杆菌、金黄色葡萄球菌混合诱导的斗米虫抗菌肽粗提液具有较好的热稳定性。

表3 不同温度处理后的斗米虫抗菌肽粗酶液的抑菌活性Table 3 Antibacterial activity of antimicrobial peptide crude extract from Apriona swainsoni larvae heated at different temperature
2.4 斗米虫抗菌肽粗提液反复冻融稳定性的测定结果
将大肠杆菌、金黄色葡萄球菌混合诱导的斗米虫抗菌肽粗提液在-20 ℃ 冰箱中分别反复冻融1、2、4、6、8和10次后,用离心机离心后取上清液,选用金黄色葡萄球菌作为指示菌株,对其进行抑菌活性差异性分析。由表4可知,经冻融后的斗米虫抗菌肽粗提液的抑菌圈直径有一定减小。斗米虫抗菌肽粗提液冻融4次以内抑菌率在97%以上,抑菌圈直径与对照组差异不显著(P>0.05);冻融8~10次的斗米虫抗菌肽粗提液抑菌圈直径与对照组相比存在显著差异(P<0.05),并且冻融8次和冻融10次之间也存在着显著差异(P<0.05)。随着冻融次数的增多,斗米虫抗菌肽粗提液的抑菌活性逐渐下降,但其抑菌率仍在80%左右。由此可见,少量的反复冻融不会对斗米虫抗菌肽粗提液的抑菌活性产生显著影响,但随着冻融次数的增加,可能对斗米虫抗菌肽的抑菌活性产生较大的影响。

表4 不同冻融次数对斗米虫抗菌肽粗提液抑菌活性的影响Table 4 Effects different times of freezing and thawing on antibacterial activity of antimicrobial peptide crude extract from Apriona swainsoni larvae
2.5 斗米虫抗菌肽粗提液pH稳定性的测定结果
将大肠杆菌、金黄色葡萄球菌混合诱导的斗米虫幼虫抗菌肽粗提液经不同pH溶液处理后,其抑菌活性有一定程度的下降,但均不能造成其抗菌活性的完全丧失,可见其具有一定的抗酸碱性能。在pH为3~9的条件下,斗米虫幼虫抗菌肽粗提液具有较强的抑菌活性,抑菌率在80%以上,且在pH=5时抑菌活性最大,抑菌率为99.37%,而在pH<3或 pH>9的条件下其抑菌活性会受到影响,抑菌率均低于70%。由此可知,强酸或强碱均能影响斗米虫抗菌肽粗提液的抑菌活性。
3 讨 论
昆虫免疫体系复杂,不同种类的微生物能够特异性激活特定的抗菌肽基因表达,表现为不同种诱导源可以诱导产生不同种抗菌肽,其抑菌强度也不尽相同[11],同时,2种诱导源混合诱导可以提高抗菌肽产量[12],故本试验采取大肠杆菌和金黄色葡萄球菌混合诱导的方式,根据诱导不同时间测定产生的抗菌肽的量,结果表明,诱导不同时间所产生的抗菌肽的量不同,在诱导前期产生的抗菌肽的量持续增加,至24 h时达到最大值,与已有研究报道的抗菌肽的诱导表达活性在24 h时最高相一致,如黑水虻在大肠杆菌菌液针刺诱导后饲养24 h提取的抗菌肽的抑菌活性最高[13]。随着诱导时间的继续增加,抗菌肽的产量逐渐降低,可能是菌液在斗米虫体内刺激抗菌肽的表达是一个渐进的过程,当体内的感染得到控制后,抗菌肽的表达量便维持在一个稳定的水平,具体机制有待于进一步研究。此外,昆虫免疫体系的复杂性还表现为同种抗菌肽在不同昆虫体内表达,对微生物的抑菌活性不同,如果蝇体内的抗菌肽Do-rosocin、Attacins仅对革兰氏阴性菌有抑制作用,Defensin仅对革兰氏阳性菌有抑制作用,Cecropins对2种菌均有抑制作用[14]。本试验结果表明,斗米虫抗菌肽虽然由金黄色葡萄球菌和大肠杆菌诱导产生,但是其仅对金黄色葡萄球菌和枯草芽孢杆菌2种革兰氏阳性菌有抑制作用,这说明对于斗米虫而言,金黄色葡萄球菌可能会有比大肠杆菌更强的诱导效应;此外,不排除匀浆后杂蛋白质浓度较高,使得斗米虫抗菌肽未达到发挥活性的浓度,需要进一步纯化验证。

表5 不同pH溶液对斗米虫抗菌肽粗提液抑菌活性的影响Table 5 Effects of different pH solution on antibacterial activity of antimicrobial peptide crude extract from Apriona swainsoni larvae
本试验结果表明,50~70 ℃的温度范围对斗米虫抗菌肽粗提液的抑菌活性几乎没有影响,抑菌率在98%以上,当温度达到80~100 ℃时,斗米虫抗菌肽的抑菌活性虽有降低,但抑菌率仍保持在70%以上。反复冻融的结果表明,反复冻融6次以内,斗米虫抗菌肽粗提液的抑菌率仍能保持在90%以上,提示其具有耐冻融性和耐低温保存性。另据报道,多数昆虫抗菌肽是碱性的,其等电点应该大于7,本试验的测定结果表明,pH为3.0~9.0的条件下,斗米虫抗菌肽粗提液具有较强的抑菌活性,抑菌率在80%以上,且在pH=5时抑菌活性最强,抑菌率达99.37%,表明其具有较强的耐酸碱性,以上研究结果与大多数昆虫抗菌肽的研究结果相符,例如,赵启凤等[13]发现黑水虻幼虫抗菌肽热稳定性较好,同时也具有一定的抗酸碱能力,在一定的pH范围内能维持抑菌活性;许兵红等[15]证明丝光绿蝇幼虫经诱导产生的抗菌肽100 ℃水浴1 min仍有抗菌活性,100 ℃处理3 min后活性丧失,具有一定的热稳定性;岳阳[16]发现蚕蛹抗菌肽在100 ℃处理下20 min对大肠杆菌的抑菌活性基本保持不变,是性质稳定的抗菌肽,在室温下能够保持稳定的抑菌活性。
4 结 论
综上可得,大肠杆菌、金黄色葡萄球菌混合诱导斗米虫,可产生浓度高、活性强、较稳定的抗菌肽,可为新型抗生素制剂的开发和药物筛选提供参考。
