丁酸梭菌对小尾寒羊生长性能、肉品质、血清生化指标、肌肉脂肪酸组成及脂肪代谢相关基因表达的影响
2023-02-08郭月英巴吉木色赵丽华
侯 冉 郭月英 张 敏 窦 露 巴吉木色 张 月 苏 琳 赵丽华 靳 烨*
(1.内蒙古农业大学食品科学与工程学院,呼和浩特 010018;2.内蒙古乌拉特中旗农牧和科技局,乌拉特中旗 015300)
丁酸梭菌(Clostridiumbutyricum,CB)属于革兰氏阳性菌,是一种广泛分布于动物肠道的有益菌,对环境变化有很强的适应能力[1]。丁酸梭菌主要代谢物如短链脂肪酸、氨基酸、促消化酶等可促进胃肠内益生菌的繁殖,从而加强动物的新陈代谢,提高动物的生长性能[2]。Hossain等[3]研究发现,饲粮中添加丁酸梭菌可增加猪肉pH24 h,减少蒸煮损失,提高肉品质。黄翠翠等[4]研究发现,饲粮中添加丁酸梭菌可提高肉鸡的胸肌红度(a*)值,改善肉品质。此外,何家俊等[5]发现在饲粮中添加丁酸梭菌后,犊牛的平均日增重显著增加,表明丁酸梭菌可以改善犊牛的生长性能。
肉类作为消费者的主要食物来源,其营养价值越来越受到重视[6],并且成为科技工作者新的关注点。小尾寒羊是我国优质的地方品种[7],它以良好的食用品质和高大的体型而闻名[8]。近年来,如何通过改变饲粮结构进而改善羊肉品质已成为目前研究的热点之一。脂肪代谢是一个十分复杂的过程,主要包括脂肪分解、脂肪合成和类脂的代谢。脂肪代谢紊乱会导致动物的生长性能下降、肉品质降低等[9],因此维持脂肪代谢的平衡对于机体健康至关重要。
目前,国内外对丁酸梭菌的研究主要集中在猪和家禽等单胃动物的生长性能和肉品质方面,而对反刍动物,尤其是在脂肪代谢方面的研究相对较少。因此,本试验以小尾寒羊为研究对象,通过测定其生长性能、肉品质、肌肉脂肪酸组成及脂肪代谢相关基因表达量,探究饲粮添加丁酸梭菌对小尾寒羊生长性能、脂肪代谢和肉品质的影响,为进一步研究其在小尾寒羊饲料中的应用奠定基础,同时为改善小尾寒羊肉品质提供技术支持。
1 材料与方法
1.1 试验材料
丁酸梭菌购自山东某生物工程股份有限公司,活菌数为5×108CFU/g。
1.2 试验设计与饲养管理
从内蒙古呼和浩特市和林格尔县选取体况良好3月龄小尾寒羊16只,平均体重(27.36±0.59) kg,随机分为2组,每组8只羊,公母各占1/2。对照组饲喂基础饲粮;丁酸梭菌组在基础饲粮中添加活菌数为5×108CFU/g的丁酸梭菌,添加量为每只羊5 g/d。饲喂前先将丁酸梭菌与玉米青贮(长5 cm)预混合,然后再与饲料完全混合并饲喂。基础饲粮参考《肉羊饲养标准》(NY/Y 816—2004)进行配制,基础饲粮组成及营养水平见表1。试验前将畜舍进行消毒处理,预试期7 d,确定丁酸梭菌添加量对小尾寒羊无不良影响后进行正式试验,正试期90 d。试验期间2组试验羊进行混群饲喂,自由饮水,管理模式和环境条件一致。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets (air-dry basis) %
1.3 样品采集
试验期结束后,选取16只试验羊进行屠宰取样,每组8只羊。动物屠宰前进行颈部静脉采血并收集于乙二胺四乙酸(EDTA)管中,置于干冰中暂存,运回实验室-80 ℃保存,用于血清生化指标的测定。屠宰后45 min内取背最长肌肉样进行肉品质指标的测定,同时立即取背最长肌肉样(约2 g)于无菌无酶冻存管中并迅速投入液氮罐,在-80 ℃冰箱中保存,用于脂肪代谢相关基因表达的测定;取100 g左右背最长肌样品,在-20 ℃冰箱中保存,用于肌肉脂肪酸组成测定。
1.4 指标测定
1.4.1 生长性能测定
试验正式开始和结束时分别称量2组试验羊的空腹体重,记录初始体重和终末体重,计算平均日增重,计算公式如下:
平均日增重(g/d)=(试验羊初始体重-试验羊初始体重)/试验天数。
1.4.2 肉品质测定
肉品质指标pH45 min、pH24 h、亮度(L*)值、a*值、黄度(b*)值、剪切力和蒸煮损失参照黄欢等[10]的方法进行测定。
1.4.3 血清生化指标测定
按照南京建成生物工程研究所试剂盒说明书测定血清生化指标,包括甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和葡萄糖(glucose,GLU)含量。
1.4.4 肌肉脂肪酸组成测定
总脂肪酸的提取:根据Folch等[11]的方法处理肉样。在5 g肉糜中加入氯仿-甲醇混合液(体积比2∶1),振荡2 h、浸泡8 h后用G3漏斗过滤,滤液中加入5 mL 20% NaCl溶液,静置分层,下层的氯仿层即为脂肪提取液。通过无水硫酸钠脱水后,40 ℃旋转蒸发浓缩得到脂肪。然后加入0.5 mol/L的氢氧化钠-甲醇溶液5 mL,70 ℃下回流5 min,进行脂肪皂化,随后加入5 mL的三氟化硼乙醚溶液,70 ℃下回流2 min,进行脂肪甲酯化。最后加入2 mL色谱纯正己烷,70 ℃下回流1 min后,加入5 mL饱和NaCl溶液,静置10 min,吸取出1 mL正己烷层于进样瓶中,用0.22 μm有机滤膜过滤后,利用气相色谱仪(Agilent 8600,美国)进行分析。
气相色谱条件:反式色谱柱尺寸100 m×0.25 mm,0.20 μm;载气(氦气)流速1 mL/min,进样温度240 ℃,进样量1 μL,分流比100∶1。程序设定温度:初始温度60 ℃(1 min),速率20 ℃/min;最终温度120 ℃,保持1 min;然后以5 ℃/min的速率上升到240 ℃,并保持15 min。质谱条件:离子源温度300 ℃,传输线温度240 ℃,质量扫描范围50~500 m/z,溶剂延迟时间4 min。
1.4.5 脂肪代谢相关基因mRNA相对表达量测定
总RNA的提取及完整性检测参照孙冰等[12]方法进行。根据Trizol抽提法和RNAiso Plus试剂的指导书对小尾寒羊背最长肌中的总RNA进行提取。提取后立即利用微量分光光度计对总RNA浓度和纯度(A260 nm/A280 nm)进行测定。通过琼脂糖凝胶电泳(1%)检测总RNA是否完整。反转录试验按照试剂说明书进行[13],将反转录得到的cDNA置于-20 ℃存放,用于后续基因表达量的测定。根据NCBI官网(http://www.ncbi.nlm.nih.gov/)提供的序列设计目的基因和管家基因的引物,并在生工生物工程(上海)股份有限公司合成(表2)。本试验的目的基因包括:一磷酸腺苷激活蛋白激酶α2(AMP-activated protein kinase α2,AMPKα2)、固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein-1c,SREBP-1c)、脂肪酸合成酶(fatty acid synthetase,FASN)、乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)和肉碱脂酰转移酶1-B(carnitine palmitate transferase 1-B,CPT1-B),管家基因为β-肌动蛋白(β-actin)。将反转录后得到的样品作为模板,使用实时荧光定量试剂盒(TB GreenTMPremix Ex TaqTMⅡ)进行实时荧光定量PCR扩增反应。PCR程序为:预变性95 ℃ 30 s;变性95 ℃ 5 s,退火57 ℃ 30 s,延伸72 ℃ 30 s,共计35个循环;延伸72 ℃ 10 min。采用2-△△Ct法计算相关基因的mRNA相对表达量。

表2 实时荧光定量PCR引物序列Table 2 Primer sequences of real-time PCR
1.5 数据统计分析
得到的数据首先经Excel 2019进行初步筛除处理后,利用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),结果用平均值±标准差表示,P<0.05表示差异显著。血清生化指标和脂肪代谢相关基因mRNA相对表达量数据采用Origin 2021软件作图。
2 结 果
2.1 饲粮添加丁酸梭菌对小尾寒羊生长性能的影响
由表3可知,丁酸梭菌组的平均日增重显著高于对照组(P<0.05)。2组之间初始体重和终末体重无显著差异(P>0.05)。

表3 饲粮添加丁酸梭菌对小尾寒羊生长性能的影响Table 3 Effects of dietary Clostridium butyricum on growth performance of small-tailed Han sheep
2.2 饲粮添加丁酸梭菌对小尾寒羊肉品质的影响
由表4可知,丁酸梭菌组的背最长肌pH24 h、L*值、b*值、蒸煮损失和剪切力均显著低于对照组(P<0.05)。2组之间背最长肌a*值和pH45 min无显著差异(P>0.05)。
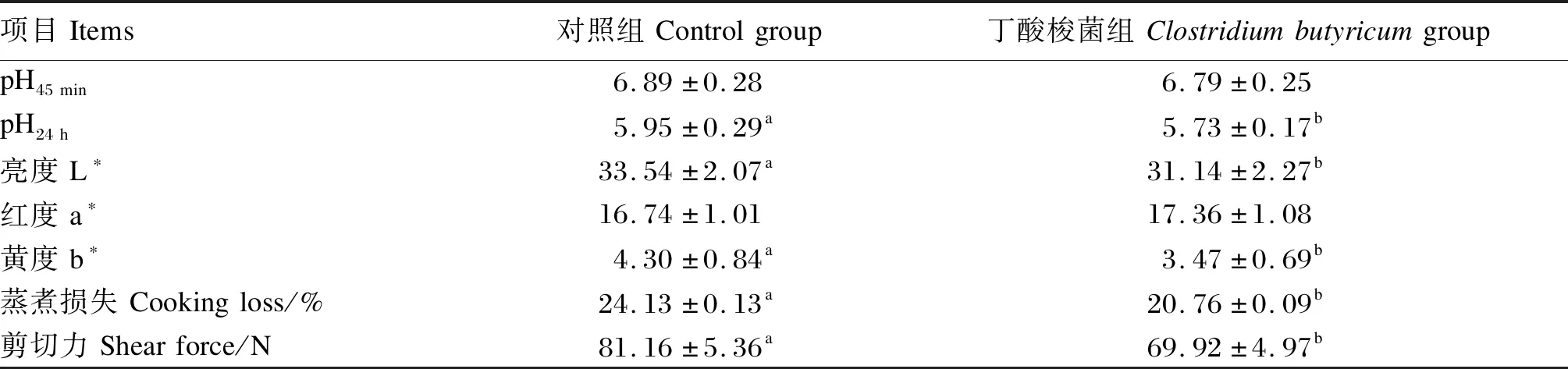
表4 饲粮添加丁酸梭菌对小尾寒羊肉品质的影响Table 4 Effects of dietary Clostridium butyricum on meat quality of small-tailed Han sheep
2.3 饲粮添加丁酸梭菌对小尾寒羊血清生化指标的影响
如图1所示,丁酸梭菌组的血清TG、TC和LDL-C含量均显著低于对照组(P<0.05),血清HDL-C含量显著高于对照组(P<0.05)。2组之间血清葡萄糖含量无显著差异(P>0.05)。
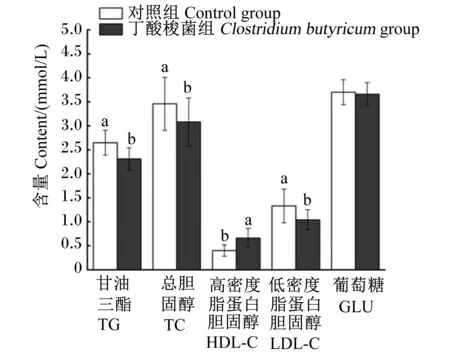
数据柱标不同小写字母表示差异显著(P<0.05)。下图同。Value columns with different small letters mean significant difference (P<0.05).The same as below.图1 饲粮添加丁酸梭菌对小尾寒羊血清生化指标的影响Fig.1 Effects of dietary Clostridium butyricum on serum biochemical indexes of small-tailed Han sheep
2.4 饲粮添加丁酸梭菌对小尾寒羊背最长肌脂肪酸组成的影响
由表5可知,丁酸梭菌组的背最长肌硬脂酸比例显著低于对照组(P<0.05),背最长肌油酸、花生四烯酸、α-亚麻酸、二十二碳六烯酸和多不饱和脂肪酸比例显著高于对照组(P<0.05)。2组之间背最长肌其他脂肪酸比例无显著差异(P>0.05)。
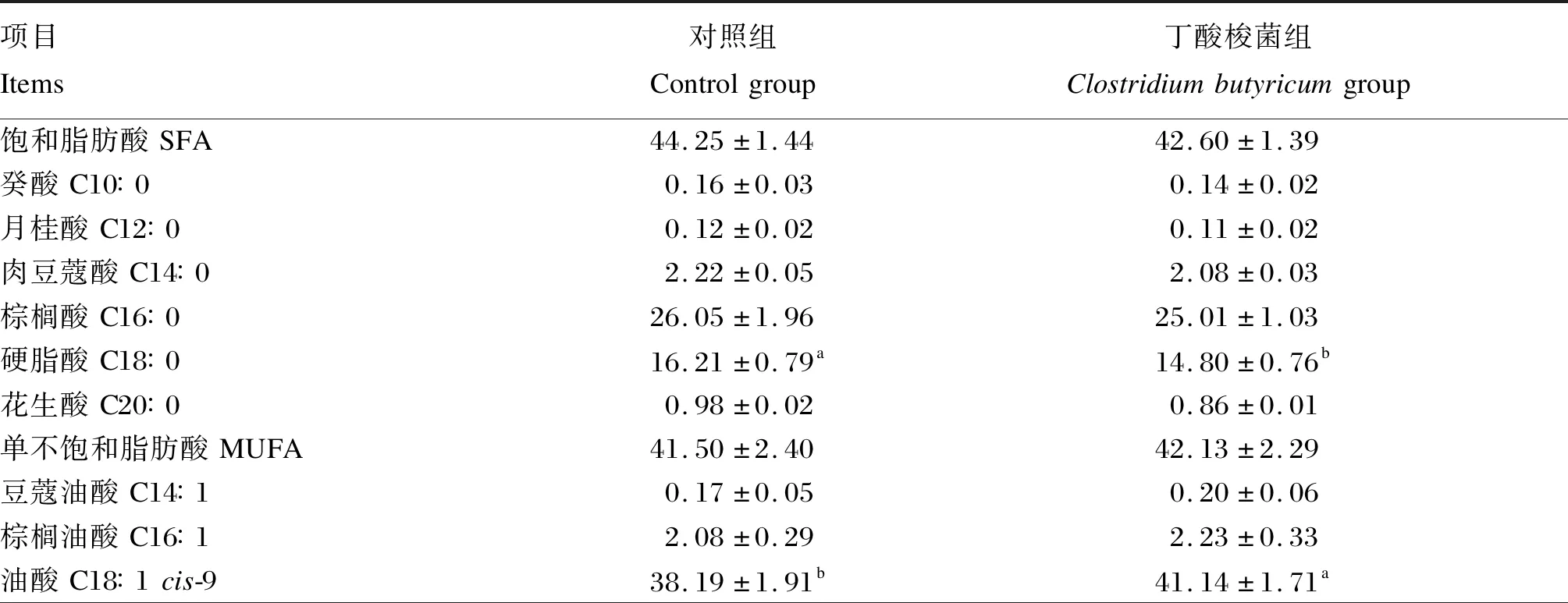
表5 饲粮添加丁酸梭菌对小尾寒羊背最长肌脂肪酸组成的影响Table 5 Effects of dietary Clostridium butyricum on fatty acid composition of Longissimus dorsi of small-tailed Han sheep %

续表5项目Items对照组Controlgroup丁酸梭菌组Clostridiumbutyricumgroup多不饱和脂肪酸PUFA13.20±1.16b16.66±1.21a亚油酸C18∶2cis-9cis-1211.35±0.9712.90±1.22反式亚油酸C18∶2tan-9tan-120.15±0.030.12±0.03γ-亚麻酸C18∶3n-60.15±0.020.17±0.04花生三烯酸C20∶3n-60.40±0.100.48±0.10花生四烯酸C20∶4n-60.30±0.09b0.47±0.12aα-亚麻酸C18∶3n-30.32±0.07b0.46±0.15a二十四碳烯酸C24∶1n-30.74±0.140.80±0.15二十碳五烯酸C20∶5n-3(EPA)0.19±0.040.22±0.07二十二碳六烯酸C22∶6n-3(DHA)0.11±0.04b0.18±0.08an-6多不饱和脂肪酸n-6PUFA13.20±1.2316.66±1.67n-3多不饱和脂肪酸n-3PUFA1.43±0.211.54±0.36n-6多不饱和脂肪酸/n-3多不饱和脂肪酸n-6PUFA/n-3PUFA8.24±0.808.31±0.91
2.5 饲粮添加丁酸梭菌对小尾寒羊背最长肌脂肪代谢相关基因表达的影响
如图2所示,丁酸梭菌组的背最长肌SREBP-1c和ACC的mRNA相对表达量显著高于对照组(P<0.05),背最长肌AMPKα2和CPT1-B的mRNA相对表达量显著低于对照组(P<0.05)。2组之间背最长肌FASN的mRNA相对表达量无显著差异(P>0.05)。
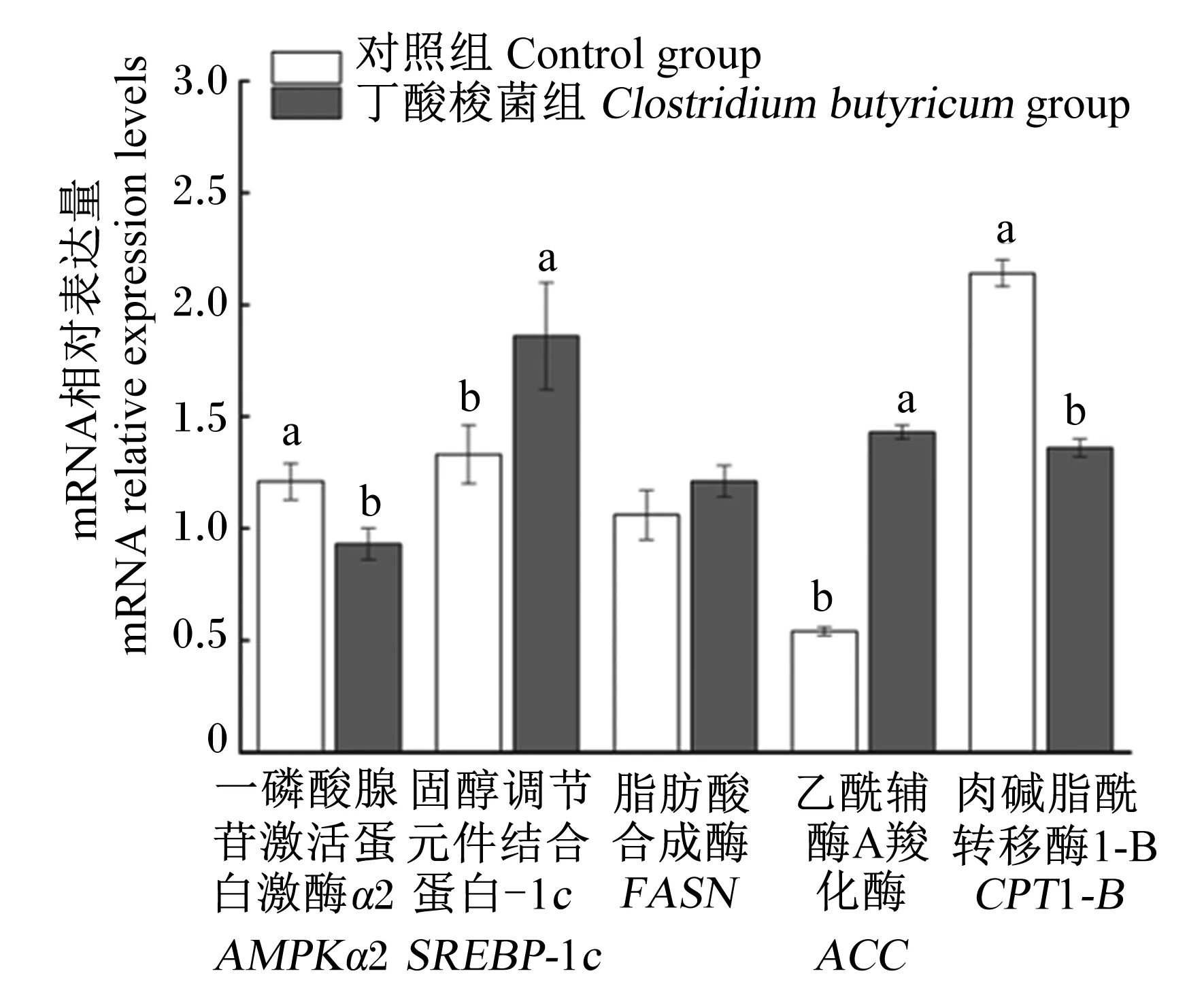
图2 饲粮添加丁酸梭菌对小尾寒羊背最长肌脂肪代谢相关基因表达的影响Fig.2 Effects of dietary Clostridium butyricum on lipid metabolism related gene expression of Longissimus dorsi of small-tailed Han sheep
3 讨 论
3.1 饲粮添加丁酸梭菌对小尾寒羊生长性能的影响
生长性能是机体代谢的综合性指标。Zhang等[14]研究发现,丁酸梭菌及其代谢产物可以改善多种消化酶如纤维素酶、脂肪酶等的活性,提高动物对饲料的转化率,进而提高动物生长性能。Liang等[15]研究发现,在断奶仔猪的饲粮中添加丁酸梭菌后,其平均日增重显著升高。胡志超等[16]研究发现,在生长期肉牛的饲粮中添加丁酸梭菌后,其平均日增重显著升高;推测其原因可能是丁酸梭菌在肉牛体内产生的多种消化酶和氨基酸等生物活性物质能够提高肉牛对饲料的消化利用率,补充肉牛生长所需要的各种养分和微量元素,进而提高其生长性能。李文茜[17]研究发现,丁酸梭菌能够有效降解饲料中的抗营养因子,促进机体对养分的消化分解,从而提高饲料利用率,进而改善犊牛的生长性能。本试验中,饲粮添加丁酸梭菌显著提高了小尾寒羊的平均日增重,进而促进了小尾寒羊的生长。
3.2 饲粮添加丁酸梭菌对小尾寒羊肉品质的影响
肉品质可以综合体现肉的状态,其中pH、色泽、嫩度和蒸煮损失等指标能直接反映肉品质[18]。pH可以表示屠宰后肌肉的pH和糖酵解速率,也可以作为判断肉质好坏的一个重要标志。本试验中排酸24 h后2组小尾寒羊的pH均呈现下降趋势,但二者均在正常范围内(5.3~6.0),其中丁酸梭菌组小尾寒羊的背最长肌pH24 h显著低于对照组。已有大量文献证实益生菌的添加有降低肌肉pH24 h的趋势,如杜瑞等[19]研究发现,益生菌组羊肉pH24 h显著低于对照组,推测益生菌的添加可能通过改变宰后羊肉机体内糖酵解速率,进而使肉中的乳酸增多,降低了肉的pH。窦露等[20]研究表明,苏尼特羊背最长肌的pH24 h呈现乳酸菌组低于对照组的趋势。Karaoglu等[21]和Abdulla等[22]的试验也均证实益生菌的添加会降低肉鸡胸肌的pH24 h。
肉类的颜色可以决定人们的购买行为。L*值主要反映肌肉的白度,其值越低,肉色越好;a*值主要反映肌红蛋白的数量,与肉色呈正相关;b*值与肉的新鲜度相关,b*值越小,肉质越新鲜[23]。家畜被屠宰后,肌肉组织中的肌红蛋白会氧化生成高铁肌红蛋白,使肉的色泽降低,窦露等[20]研究认为乳酸菌能够通过阻碍氧化进程来改善肉的颜色,使b*值降低。黄翠翠等[4]在饲粮中添加丁酸梭菌后发现,肉鸡胸肌L*值显著降低。本试验中,饲粮添加丁酸梭菌提高了小尾寒羊背最长肌的a*值,同时显著降低了L*值和b*值,说明丁酸梭菌的添加可改善肉色。蒸煮损失是表征肉保水性能的指标之一,当蒸煮损失较低时,肉的保水性较好[24]。本试验中,饲粮添加丁酸梭菌显著降低了小尾寒羊的蒸煮损失,使小尾寒羊肉质多汁可口。剪切力与嫩度成反比。索成等[25]研究发现,饲粮添加植物乳杆菌可以降低仔猪的肌肉剪切力,改善猪肉嫩度。本研究发现饲粮添加丁酸梭菌显著降低了小尾寒羊背最长肌的剪切力,结合脂肪代谢相关调控基因mRNA相对表达量的结果可知,饲粮添加丁酸梭菌可能通过调节小尾寒羊的脂肪代谢水平进而影响脂肪沉积,从而改善嫩度。
3.3 饲粮添加丁酸梭菌对小尾寒羊血清生化指标的影响
血清TG、TC、HDL-C和LDL-C含量是反映机体血脂代谢的常用指标。HDL-C和LDL-C是胆固醇的运输载体,HDL-C可将胆固醇运输至肝脏使其代谢生成其他物质,具有清除血浆多余胆固醇的作用[26],LDL-C则负责将肝脏中胆固醇运输至肝外组织,被认为是心血管疾病的制动剂,两者共同维持机体胆固醇的稳态[27]。血清中高含量的TG和胆固醇是心血管疾病的重要风险因素[28]。Salaj等[29]研究发现,饲粮添加植物乳杆菌ls/07降低了小鼠血清TC和LDL含量,饲粮添加植物乳杆菌Biocenol LP96降低了其血清TG含量。本试验中,饲粮添加丁酸梭菌组显著降低了小尾寒羊的血清TG、TC和LDL-C含量,究其原因可能是胆固醇被菌生长细胞同化后,与菌的细胞表面相结合,从而抑制胆固醇被机体吸收[30]。GLU是测定机体体内能量平衡的一种常用指标,是机体对糖的吸收、转运和代谢动态平衡状态的反映。本试验中,2组小尾寒羊血清GLU含量均在正常范围内,但2组之间无显著差异。
3.4 饲粮添加丁酸梭菌对小尾寒羊背最长肌脂肪酸组成的影响
脂肪酸是一种重要的营养物质,其营养价值在最近几年越来越引起重视[31]。本试验中,小尾寒羊背最长肌中共有18种脂肪酸,2组之间背最长肌饱和脂肪酸比例虽无显著差异,但其中丁酸梭菌组背最长肌硬脂酸比例显著低于对照组。研究表明,硬脂酸比例与羊肉的膻味成正比,说明饲粮添加丁酸梭菌可以通过降低肌肉中硬脂酸的比例来改善羊肉的风味,这与王亚男等[32]研究结果一致。丁酸梭菌组背最长肌单不饱和脂肪酸高于对照组,但2组之间无统计学差异。而油酸作为主要的单不饱和脂肪酸,丁酸梭菌组背最长肌油酸比例显著增加,这与刘婷等[33]研究结果相符,其发现在苏尼特羊的饲粮中添加乳酸菌后,背最长肌油酸比例显著增加。
多不饱和脂肪酸是一种特殊物质,对人体有重要的生理功能,尤其是α-亚麻酸、花生四烯酸和二十二碳六烯酸等,可以促进大脑的发育,预防心血管疾病[34]。Liu等[35]研究发现,丁酸梭菌可通过增强北京鸭的抗氧化防御系统,进而影响多不饱和脂肪酸的含量。本试验结果表明,饲粮添加丁酸梭菌提高了小尾寒羊背最长肌多不饱和脂肪酸比例;此外,还显著提高了背最长肌花生四烯酸、α-亚麻酸和二十二碳六烯酸等多不饱和脂肪酸比例。Tian等[36]试验结果表明,饲粮添加罗氏乳杆菌可增加猪背最长肌DHA含量。相伟等[37]在饲粮中添加乳酸菌后发现,育肥猪肌肉中α-亚麻酸含量增多。也有研究证实乳酸菌可以增强动物肝脏微粒体6-脱饱和酶的活性,并增加花生四烯酸的含量[38]。综上所述,丁酸梭菌可以改善小尾寒羊背最长肌的脂肪酸组成和比例,提升小尾寒羊肌肉的营养价值。
3.5 饲粮添加丁酸梭菌对小尾寒羊背最长肌脂肪代谢相关基因表达的影响
一磷酸腺苷激活蛋白激酶(AMP-activated protein kinase,AMPK)在调节脂肪组织代谢中起着关键作用,并能保持机体脂肪代谢处于稳定状态[39]。AMPK的一个重要的下游基因——SREBP-1c,可以调节脂肪生成基因如FASN、硬脂酰辅酶A去饱和酶1(stearyl coA desaturase 1,SCD1)等。SREBP-1c在丝氨酸位点上时会被AMPK磷酸化后失活,从而抑制脂肪生成基因的表达[40]。研究发现,当AMPKα2 mRNA表达下调时,会影响动物的脂肪酸合成和氧化能力[41]。本研究结果表明,饲粮添加丁酸梭菌显著下调了AMPKα2基因的表达,显著上调了SREBP-1c基因的表达,其原因可能是丁酸梭菌的添加使AMPKα2 mRNA的相对表达量降低,对SREBP-1c的抑制作用减弱,其mRNA的相对表达量因此增加。而饲粮添加丁酸梭菌对FASN的mRNA相对表达量无显著影响。Mousa等[42]研究发现,饲粮添加芽孢杆菌提高了羔羊体内的SREBP-1c的mRNA相对表达量,这与本试验结果一致。
ACC是脂肪酸合成的第1步关键酶,可催化乙酰辅酶A羧化成丙二酰辅酶A,进而促进脂肪酸合成,同时ACC也是脂肪酸合成过程中的限速酶[43]。ACC是AMPK的下游靶点,ACC的表达会受到AMPK磷酸化水平的调控,进一步影响脂肪代谢,而磷酸化后的ACC可以促进脂肪酸氧化的进程[44]。肉碱脂酰转移酶1(CPT1)是脂肪酸β氧化过程中的一种限速酶,在脂肪分解供能中发挥着重要的作用[45]。研究发现,饮食、运动和温度等因素都可以激活AMPK[46],活化的AMPK会抑制ACC,导致丙二酸单酰辅酶A活性减少,减弱对CPT1的抑制作用,促进脂肪酸进入线粒体进行氧化分解,从而使脂肪沉积减少[47]。且有研究证明AMPKα2亚基对AMPK-ACC-CPT1通路起主要的调控作用[48]。张月等[49]研究发现,饲粮添加乳酸菌能够抑制AMPKα2活性,减弱了对ACC的抑制作用,进一步降低CPT1-B的mRNA相对表达量。本试验在小尾寒羊的饲粮中添加丁酸梭菌后也得到了相同的结果。综上所述,饲粮添加丁酸梭菌可通过激活AMPK相关信号通路调节脂肪代谢,进而改善小尾寒羊肉品质。
4 结 论
① 饲粮添加丁酸梭菌增加了小尾寒羊的平均日增重,改善了生长性能。
② 饲粮添加丁酸梭菌对小尾寒羊背最长肌的肉色、嫩度和保水性有积极的改善作用。
③ 饲粮添加丁酸梭菌通过调控AMPK信号通路进而影响小尾寒羊背最长肌的脂肪酸组成。
