低精料舍饲育肥条件下牦牛与黄牛生长性能、养分消化、瘤胃发酵和血液生理指标的对比研究
2023-02-08甘水燕刘红山裴成芳吴刀知才让周建伟李发弟
甘水燕 刘红山 裴成芳 吴刀知才让 周建伟* 李发弟
(1.兰州大学草地农业科技学院,草地农业生态系统国家重点实验室,兰州 730020;2.天祝藏族自治县畜牧技术推广站,武威 733200)
牦牛(Bosgrunniens)是青藏高原地区的特有反刍家畜,主要分布在海拔3 000~6 000 m的天然草原上,是藏族牧民同胞最重要的生活与生产资料及经济来源[1]。目前,我国牦牛存栏量约为1 621万头,约占世界牦牛存栏量的95%[2]。从古至今,牦牛饲养一直以自然放牧模式为主,天然牧草往往是其唯一的食物来源。然而,由于受到青藏高原极端恶劣的生态环境所限制,该地区牧草具有生长期短(120 d/年)、生物量低及养分含量季节性不平衡等特征,这也导致了牦牛的体况随着牧草的枯荣交替而呈现“夏壮、秋肥、冬瘦、春乏”的恶性循环[1],生产效率低下。尽管如此,牦牛又是唯一能够完全适应青藏高原严酷环境的大型家畜,其具有耐高寒、耐粗饲、抗逆性强、肉质好等优点。基因组数据显示,牦牛与黄牛发生种间分离的时间在史前438万~532万年[3]。文献记载,青藏高原柴达木黄牛(Bostaurus)是在公元3世纪由古羌族人从平原地区引入,其前期主要作为役畜而分布在海拔2 600~3 600 m的区域,因而与牦牛存在一定的生态重叠区[4]。与牦牛相似,柴达木黄牛也能够在天然草地上常年放牧,但是在冷季需要适量精料补饲以及晚上在圈舍保温以保证其种群正常的繁衍生息。
进入21世纪以来,随着牧民思想的进一步解放以及生产技术水平的不断提高,舍饲、半舍饲、短期育肥及“牧繁农育”等多元化饲养技术体系在牦牛产业中正逐渐被推广和应用[5],极大地提高了牦牛的生产效率,增加了牧民收入和促进区域经济发展。前期大量的研究已经证明,通过给肉牛饲喂高精料饲粮可以显著提高其生产性能[6-8]。因此,在实际生产中,规模化养殖场也常采用高精料营养策略和高强度育肥模式来实现牛羊快速育肥的目的。然而,反刍动物如果长期饲喂高精料饲粮,容易引发其瘤胃代谢紊乱、机体炎症反应等营养代谢性疾病问题[6-10]。另外,近年来玉米、豆粕等精料原料价格也在持续攀升。由此可见,高精料育肥模式不但加重了企业和牧民的养殖成本,降低了生产效率,同时也增加了疫病风险。通过综合考量经济效益和动物福利,利用低、中精料饲粮可能是将来肉牛舍饲育肥的最优选择[6-8,10]。从传统意义上讲,牦牛是一种粗饲型牛科动物。前人的研究也表明,与黄牛相比,牦牛具有更低的能量和氮素维持需要量、更高的转化利用效率以及特殊的瘤胃微生物区系[11-15]。此外,青藏高原深处内陆,运输成本的增加也进一步推高了精料的价格。据此推断,低精料育肥可能是牦牛舍饲养殖中的一种优良策略,其不但能够发挥牦牛耐粗饲的特点,降低饲养成本,提高生产效率,并且较黄牛能够收到更好的生产效果。
综上所述,本试验拟通过对比研究牦牛与黄牛在低精料舍饲育肥模式下的生长性能、养分消化、瘤胃发酵以及血液生理指标,明析其机体的营养代谢与利用特征,以期为青藏高原地区育肥牛种及饲养技术选择提供一定的数据参考与技术支撑。
1 材料与方法
1.1 试验时间与地点
本试验于2021年3—6月在甘肃省武威市天祝藏族自治县乌鞘岭的兰州大学牦牛试验站(37°14′20.54″N,102°48′34.32″E,海拔3 154 m)进行,该试验站位于青藏高原东北部。
1.2 试验动物、饲粮与设计
选取4周岁、体况相近的健康去势牦牛[(211±6) kg]和柴达木黄牛[(210±7) kg]各6头,用于短期舍饲育肥试验。试验开始前对所有试验牛逐只注射伊维菌素以进行驱虫处理。试验饲粮由精料和粗料2部分构成,其中精料为牦牛育肥配合饲料(由甘肃某公司提供),每天的供应量为2.0 kg/头;粗料自由采食,其为单一的商业燕麦青干草颗粒(由甘肃某公司提供)。试验饲粮中的精料组成及其与燕麦青干草营养水平见表1。整个试验期总共105 d,其中预试期10 d,正试期95 d。试验牛单栏饲养,每天于07:00和18:00定时饲喂,自由饮水。记录每头牛每天的投料量,在晨饲前清空食槽并记录剩料量,以计算每头牛的采食量。采用先精后粗的饲喂方法对试验牛进行投料,根据试验牛近3 d的燕麦青干草采食量来调整其供给量,以保证试验牛吃饱并略有剩料为准。
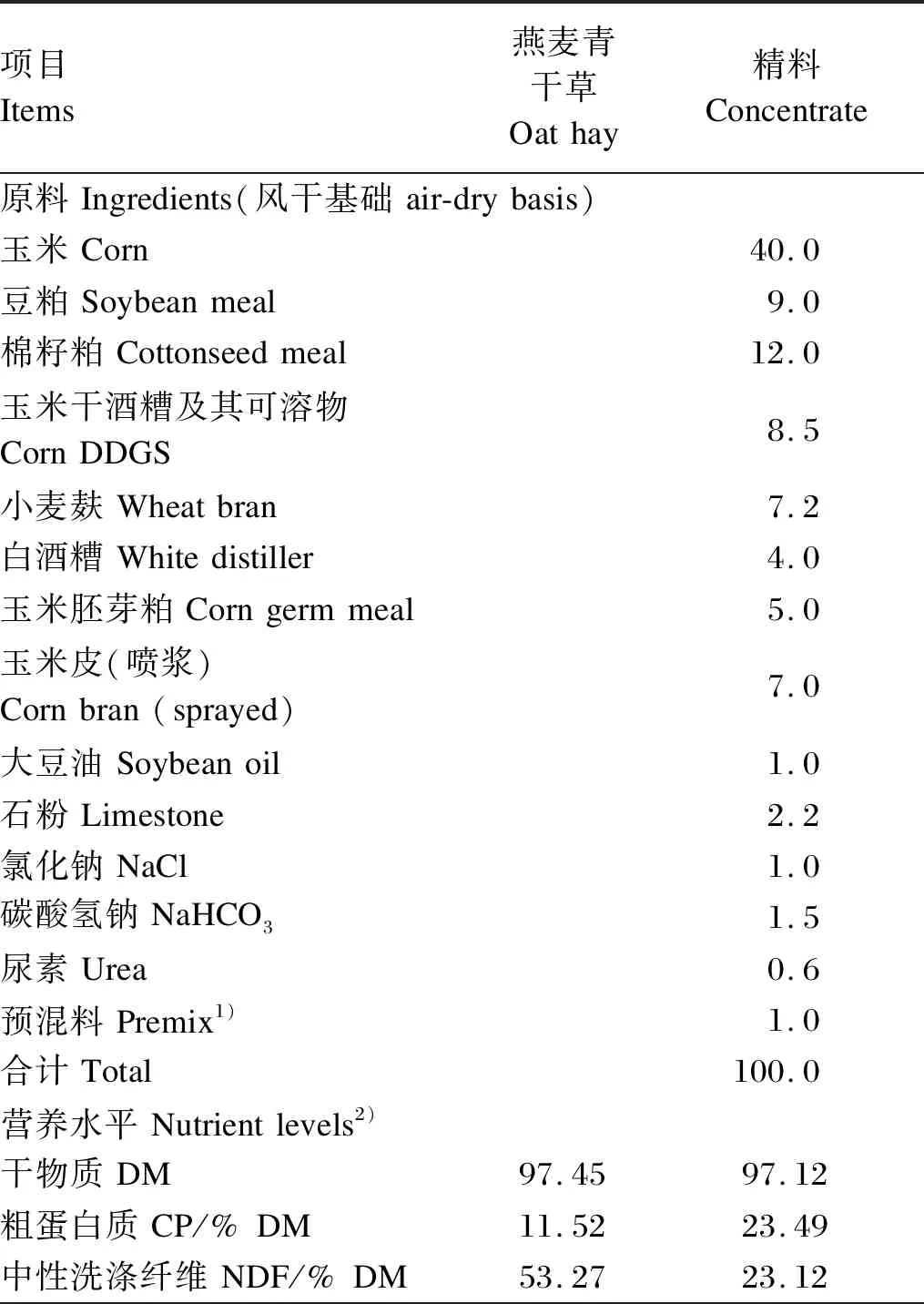
表1 精料组成及其与燕麦青干草的营养水平Table 1 Composition of concentrate and nutrient levels of concentrate and oat hay %
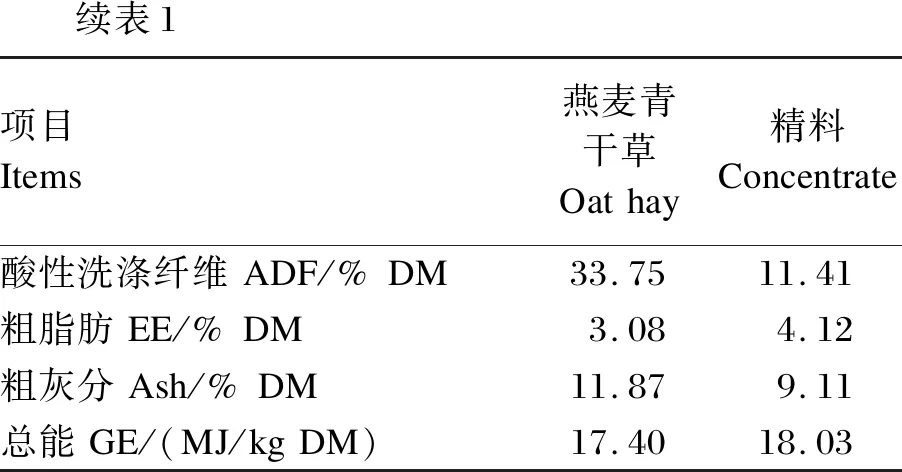
续表1项目Items燕麦青干草Oathay精料Concentrate酸性洗涤纤维ADF/%DM33.7511.41粗脂肪EE/%DM3.084.12粗灰分Ash/%DM11.879.11总能GE/(MJ/kgDM)17.4018.03
1.3 样品采集与数据记录
在试验期的第1、30、60、90和105天晨饲前对试验牛进行空腹称重,以计算平均日增重。根据试验牛的平均日采食量和平均日增重,采用料重比来衡量动物的饲料转化效率。在整个试验期,每间隔15 d采集燕麦青干草颗粒和配合饲料各300 g,分别作为试验饲粮粗料和精料样品。在试验期最后1周,利用全收粪法进行消化试验。在晨饲前,记录每头牛每天的粪便排出量,并将收集的粪便充分混匀,按四分法以5%比例对粪便进行取样,于-20 ℃冰柜保存。在试验最后1 d晨饲前,利用穿刺法通过颈静脉采集血液2 mL,保存在抗凝真空采血管中。分别在试验最后1 d晨饲前及晨饲后的3、6和9 h,利用口腔式瘤胃导管并辅以真空泵采集每头牛瘤胃液100 mL,具体方法参考Shen等[16]。利用4层纱布对瘤胃液进行过滤,然后立即使用便携式pH计(PB-10,北京)测定滤液pH。将过滤后的瘤胃液用10 mL离心管进行分装,立即投于液氮速冻,带回实验室后转-80 ℃超低温冰箱保存。
1.4 样品处理与分析
饲粮和粪便样品在65 ℃烘箱中烘干96 h,过夜回潮后称重,以计算其初水分含量。处理后的样品利用粉碎机(FZ102,中国)研磨,过1 mm筛子制样,装入自封袋中于室温保存。饲粮和粪便中的干物质(DM,GB/T 6435—2014)、粗灰分(Ash,GB/T 6438—2007)含量利用全自动水分灰分分析仪(prepASH-229,Precisa,瑞士)测定;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量利用半自动纤维分析仪(A200i,ANKOM,美国)测定,方法参照Van Soest等[17];粗蛋白质(CP,GB/T 6432—2018)含量利用半自动凯氏定氮分析仪(Kjeltec-8200,Foss,丹麦)测定;粗脂肪(EE,GB/T 6433—2006)含量利用全自动脂肪分析仪(XT15i,ANKOM,美国)测定;总能(GE)利用全自动氧弹量热仪(IKA-C3000,德国)测定。养分表观消化率计算公式如下:
某养分表观消化率(%)=100×(该养分食入量-粪中该养分量)/该养分食入量;总能表观消化率(%)=100×消化能/总能;消化能(MJ/d)=总能-粪能。
瘤胃液挥发性脂肪酸(VFA)浓度利用气相色谱仪(Trace-1300,Thermo Scientific,德国)测定,主要参考Erwin等[18]的方法,其中色谱柱为毛细管柱(DB-FFAP,30 m×0.32 mm×0.25 μm,Agilent,美国)。柱温箱程序:初始温度为90 ℃,并以10 ℃/min的速度升温至120 ℃,保留3 min,再以15 ℃/min的速度升温至180 ℃,保留5 min。瘤胃液可溶性蛋白氮浓度利用Lowry法[19]进行测定,氨态氮和游离氨基酸氮浓度测定参考Hristov等[20]的方法。
血液生理指标利用全自动血液细胞分析仪(BC-5000,深圳)测定,包括白细胞(white blood cell,WBC)数、红细胞(red blood cell,RBC)数、血红蛋白(hemoglobin,HGB)含量、红细胞压积(hematocrit,HCT)、红细胞平均体积(mean corpuscular volume,MCV)、平均血红蛋白(mean corpuscular hemoglobin,MCH)含量、平均血红蛋白浓度(mean corpuscular hemoglobin concentrations,MCHC)、红细胞体积分布宽度(red cell distribution width,RDW)、血小板 (platelets,PLT)数、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)和血小板压积(plateletcrit,PCT)。
1.5 数据统计与分析
在Excel 2016软件中对试验数据进行初步整理,利用SPSS 23.0比较平均值中的独立样本t检验进行差异显著性检验,并利用Levene检验程序进行方差等同性检验。连续采集的不同时间点瘤胃液样品当作技术重复来处理。P<0.05表示差异显著,0.05≤P<0.10表示差异有显著趋势。试验数据采用平均值±标准误(SE)表示。
2 结 果
2.1 牦牛与黄牛的采食量、生长性能和料重比
由表2可知,由于给牦牛补充的精料有少许剩余,且燕麦青干草平均日采食量也是黄牛更高(P<0.05),因此,饲粮总干物质摄入量、CP摄入量以及GE摄入量均是黄牛显著高于牦牛(P<0.05)。终末体重以及平均日增重在2物种间无显著差异(P>0.05),但是牦牛的料重比显著低于黄牛(P<0.05)。
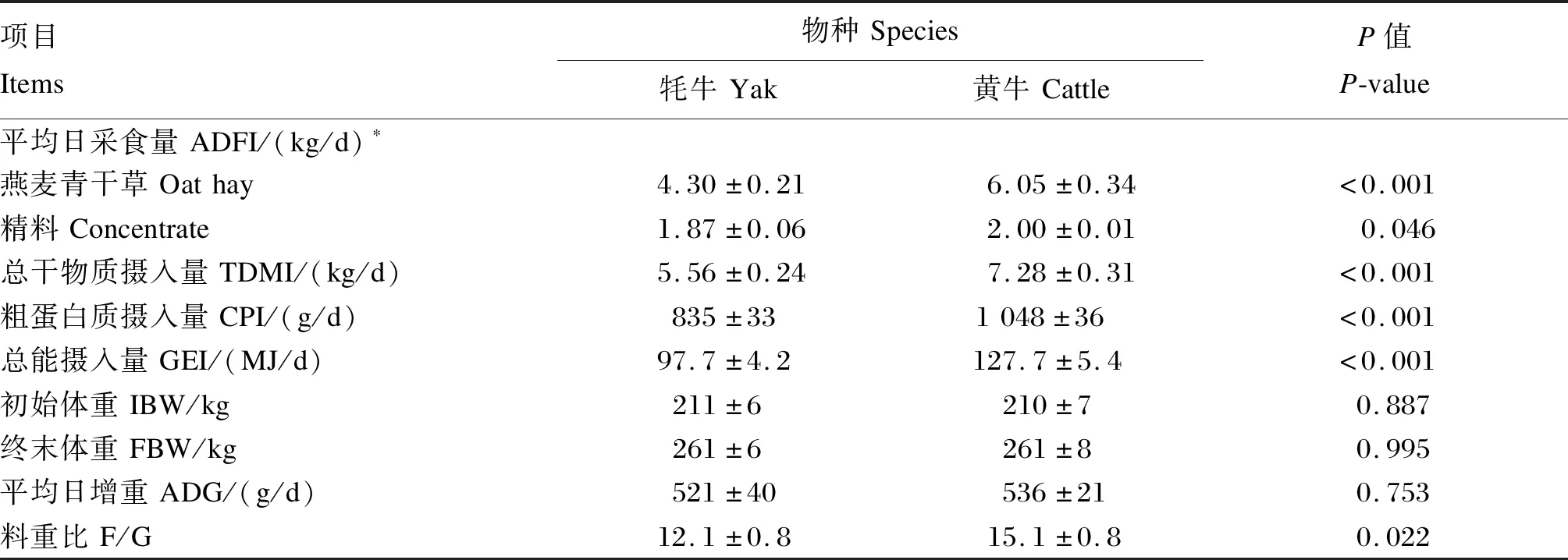
表2 牦牛与黄牛的采食量、生长性能和料重比Table 2 Feed intake,growth performance and feed/gain in yaks and cattle
2.2 牦牛与黄牛的养分表观消化率
由表3可知,饲粮DM、OM、CP、NDF、ADF、EE、Ash和GE的表观消化率在牦牛与黄牛间均无显著差异(P>0.05)。

表3 牦牛与黄牛的养分表观消化率Table 3 Apparent digestibilities of nutrients in yaks and cattle %
2.3 牦牛与黄牛的瘤胃发酵参数
由表4可知,牦牛瘤胃液的pH有高于黄牛的趋势(P=0.083),TVFA、乙酸、丙酸、丁酸浓度以及乙酸/丙酸在2物种间均无显著差异(P>0.05),但是牦牛支链脂肪酸浓度却显著高于黄牛(P<0.05)。牦牛瘤胃液中的氨态氮、游离氨基酸氮和可溶性蛋白氮浓度均显著高于黄牛(P<0.05)。

表4 牦牛与黄牛的瘤胃发酵参数Table 4 Rumen fermentation parameters in yaks and cattle
2.4 牦牛与黄牛的血液生理指标
由表5可知,牦牛血液中的RBC数、HGB含量、HCT和RDW-CV均显著低于黄牛(P<0.05),但是其MCV、MCH含量、PLT数却都显著高于黄牛(P<0.05)。牦牛血液中的MCHC有高于黄牛的趋势(P=0.057),而WBC数、RDW-SD、MPV、PDW和PCT在2物种间均无显著差异(P>0.05)。

表5 牦牛与黄牛的血液生理指标Table 5 Blood physiological indexes in yaks and cattle
3 讨 论
3.1 牦牛与黄牛采食量、生长性能以及料重比的对比研究
在本研究中,饲粮精料限量供给而粗料自由采食,黄牛的燕麦青干草平均日采食量显著高于牦牛,且后者仍有少量精料剩余,因此黄牛的总干物质采食量及各养分摄入量都显著高于牦牛。然而,在初始体重相同的基础上,平均日增重在2物种间也无显著差异,这就直接导致了牦牛较黄牛具有更小的料重比,即更高的饲料转化效率。该结果说明在低精料舍饲育肥条件下,牦牛较黄牛的饲料成本投入更少,因而前者具有更高的经济效益。与本试验研究结果相似,韩兴泰等[22]也发现生长期牦牛对不同类型饲粮的采食量显著低于其他牛种,这可能与牦牛相对较小的瘤胃容积有关[23]。另外,食欲肽A是一种具有促进机体摄食的小分子神经肽,其表达量高低可显著影响动物的进食欲,进而调控采食量[24]。研究发现,牦牛胃肠道食欲肽A的表达量显著低于黄牛[25],这可能也是牦牛采食量较黄牛低的原因之一。本试验中,养分表观消化率在2物种间无显著差异,但是牦牛的饲料转化效率较黄牛更优,这可能与其机体特殊的氮素和能量代谢机制有关。研究表明,牦牛的氮素每天维持需要量仅为0.40~0.53 g/kg BW0.75[12,26-27],低于肉牛的每天维持需要量0.88 g/kg BW0.75[28];Zhou等[13]发现在采食相同饲粮时,牦牛较黄牛具有更小的肾小球滤过率、更低的氮排泄量以及更多的内源循环尿素,这些结果表明了牦牛对氮素营养高效利用的特点。相似地,资料显示牦牛的每天能量维持需要量低于黄牛(458 kJ/kg BW0.75[29]vs.545 kJ/kg BW0.75[30]),饲料甲烷能损失量也是前者更低[31]。以上结果表明,在相同饲粮养分摄入的情况下,牦牛较黄牛具有更多的氮素和能量物质用于机体维持或合成代谢,这也从侧面反映了牦牛在应对青藏高原长期饲料营养缺乏过程中所进化形成的抗逆性营养代谢机制。
3.2 牦牛与黄牛养分表观消化率的对比研究
反刍动物饲粮养分的消化作用主要发生在瘤胃内,并且瘤胃微生物能够有效降解植物纤维物质,所以全肠道的表观消化率也可以间接反映瘤胃的消化能力和饲粮利用率[32]。根据李金辉等[33]的预测模型,影响绵羊养分表观消化率的主要因素是动物品种、饲粮组成及营养水平等。前人的研究发现,在相同的自然放牧条件下,牦牛瘤胃微生物丰富度和多样性,尤其是纤维分解菌的相对丰度均高于黄牛[15],进而导致了牦牛较黄牛具有更高的纤维消化能力[34]。然而本试验的研究结果却显示,饲粮的NDF和ADF表观消化率在2物种间无显著差异,这可能是因为不同的饲养管理模式(放牧vs.舍饲)改变了其瘤胃微生物区系,进而影响了饲粮纤维消化。即便如此,本研究中牦牛和黄牛的纤维表观消化率均在50%以上,显著高于低海拔肉牛[35]、奶牛[36]和绵羊[37]上所报道的数值。与本试验的研究结果相同,Zhou等[14]也发现,饲粮供给相同的舍饲条件下牦牛和柴达木黄牛的饲粮养分全肠道表观消化率无显著差异,但牦牛瘤胃液的TVFA浓度显著高于黄牛。在本研究中也存在类似现象,饲粮供给相同,虽然牦牛与黄牛的养分表观消化率无显著差异且牦牛采食量显著低于黄牛,但是瘤胃液TVFA浓度在2物种间无显著差异,牦牛瘤胃液氨态氮、氨基酸氮和可溶性蛋白氮浓度均较黄牛更高,这说明牦牛瘤胃微生物降解碳水化合物和CP的效率较黄牛更高。以上结果表明,牦牛由于自身特殊的营养代谢机制,其养分表观消化率可能无法很好地诠释瘤胃消化能力。
3.3 牦牛与黄牛瘤胃发酵参数的对比研究
瘤胃pH是直观反映瘤胃内环境的重要指标之一,其与反刍动物的健康状况和生产性能密切相关。瘤胃pH主要受饲粮组成及营养水平、VFA浓度、氨态氮浓度和缓冲物质含量等因素的共同影响[6,14-15,38]。据报道,当瘤胃pH处于6.2~7.2时,瘤胃微生物降解饲粮纤维和蛋白质的效率最高[39];而当瘤胃pH<6.2时,瘤胃纤维分解菌的生长及其活性均会受到抑制,从而导致饲粮中纤维物质降解效率的降低[40]。在本试验中,牦牛和黄牛瘤胃pH均在最佳范围之内,说明在该营养水平下试验牛能够维持健康的瘤胃环境,从而保证了其高效的纤维降解能力。
瘤胃VFA是反刍动物最重要的能量来源,其占机体能量需求的70%~80%[41]。VFA主要由饲粮中的碳水化合物经瘤胃微生物发酵产生,因此瘤胃液VFA与采食量、饲粮营养与组成以及微生物区系等因素密切相关[42-43]。在本研究中,试验牛的饲粮供给相同,且黄牛的采食量显著高于牦牛,然而TVFA、乙酸、丙酸、丁酸浓度在2物种间无显著差异。这说明牦牛瘤胃微生物将碳水化合物转化成VFA的效率较黄牛更高,而前期的研究也证实牦牛瘤胃微生物较黄牛更加富集VFA生成通路的基因[44]。与该推论相符,在采食量或底物相同以及饲养条件一致的情况下,牦牛比本土黄牛能产生更多VFA[14-15,44-45]。支链脂肪酸包括戊酸、异丁酸和异戊酸,其主要通过饲粮中的支链氨基酸降解产生[46]。在本试验中,牦牛瘤胃液可溶性蛋白浓度显著高于黄牛,从而导致前者瘤胃液中具有更高的支链脂肪酸浓度。
氨态氮是瘤胃细菌合成菌体蛋白的重要氮源之一,其占细菌氮素营养需求总量的40%~68%[47]。瘤胃液氨态氮一方面来自饲粮中蛋白质、肽、氨基酸及其他含氮化合物的降解,另一方面源于宿主动物通过尿素循环转运至瘤胃的尿素[48]。在本试验中,牦牛瘤胃液氨态氮浓度高于黄牛,而黄牛的饲粮CP摄入量却更高,这说明牦牛通过尿素循环机制而将内源尿素转运进入瘤胃的效率更高。前期的研究也发现,当采食相同的蛋白质水平饲粮时,牦牛的肝脏尿素合成量、循环进入消化道的尿素量以及被瘤胃微生物捕获的内源尿素效率均高于黄牛[13]。研究表明,瘤胃微生物生长最佳的氨态氮浓度在5~25 mg/100 mL[49],本研究中,牦牛和黄牛的瘤胃液氨态氮浓度都在该范围之内。瘤胃液游离氨基酸和可溶性蛋白也能够为微生物蛋白合成提供20%~50%的氮源[50],本试验中,牦牛瘤胃液氨态氮、游离氨基酸氮和可溶性蛋白氮浓度均较黄牛高,说明牦牛瘤胃微生物降解饲粮CP的效率更高,这也表明了牦牛具有更充足的氮源用于瘤胃微生物蛋白合成。
3.4 牦牛与黄牛血液生理指标的对比研究
血液生理指标可以直接反映动物机体新陈代谢、生理功能、环境适应性以及健康状况。WBC是机体免疫系统的重要组成成员,其数值可以直接反映机体健康状况。在本研究中,试验牛的WBC数在物种间无显著差异,且都在正常生理参考范围内,说明试验牛的身体状况健康良好。RBC是脊椎动物体内通过血液运输氧气的主要媒介,其主要成分是HGB,而HGB是携氧的直接载体。因此,根据RBC数和HGB含量的相关参数能够准确评估动物机体内氧的供应与利用功能及其效率。前期的研究表明,藏羊[51]、牦牛[52]、藏马[53]和藏猪[54]血液中的RBC数、HGB含量以及HCT均显著高于低海拔的同类动物,并且上述指标均随着海拔梯度的升高而显著增加。与此相反,本试验的结果显示,牦牛的RBC数、HGB含量和HCT均低于黄牛,且都在参考范围以下,这可能与本试验所在地的海拔和氧气含量相关。试验地的海拔为3 154 m,接近牦牛饲养的下限,且血液采集在6月下旬,此时草原已处于青草期,这也就造成了该地区当时的氧气含量较为充沛。为应对“醉氧”胁迫,牦牛可能通过机体稳态调控以适当降低了血液中的RBC数和HGB含量。与该研究结果相似,饲养在该区域的小尾寒羊血液中的RBC数、HGB含量和HCT也显著高于藏羊[37]。此外,齐晓园等[55]的研究发现,随着海拔梯度升高,黄牛血液中的RBC数和HGB含量下降,MCV和MCH含量升高;然而,牦牛的RBC数升高,HGB含量、HCT、MCH含量和MCHC均下降。以上研究结果表明,黄牛与牦牛可能存在各自不同的低氧适应机制,并且会随着环境条件启动相应的反应机制。一般而言,RBC数与MCV呈现负相关关系,一者的升高会引起另一者的降低。该负反馈机制是为了有效调控血液黏稠度和血液流速,以保障动物机体对氧的需求[55]。在本试验中也发现该现象,即黄牛的RBC数显著高于牦牛,但其MCV却显著低于牦牛。牦牛的MCH含量和MCHC均高于黄牛,RDW-CV低于黄牛,与邓茗月等[52]的试验结果一致,这也说明了牦牛单位红细胞体积内HGB含量更高。PLT是哺乳动物血液中最小的血细胞,其不仅具有凝血与止血功能,还参与机体的免疫与抗炎过程,并且与抗寒抗感染能力也密切相关[56]。在本试验中,牦牛血液中的PLT数显著高于黄牛,提示了牦牛较黄牛可能具有更强的免疫、抗寒以及环境适应能力[56]。
4 结 论
在本试验条件下,养分表观消化率和平均日增重在2物种间无显著差异,而牦牛的总干物质采食量显著低于黄牛,这导致前者具有更加高效的饲料转化效率。因此,在青藏高原东北部,低精料舍饲养殖模式下,牦牛的育肥效果要优于柴达木黄牛。
