β-胡萝卜素对母犏牛营养物质表观消化率、瘤胃发酵特征及微生物区系的影响
2023-02-08岳双明李梦雅王之盛王立志彭全辉
李 宁 岳双明 李梦雅 王之盛 薛 白 王立志 彭全辉*
(1.四川农业大学动物营养研究所,成都 611130;2.四川水利职业技术学院,成都 611230)
反刍动物自身不能合成β-胡萝卜素,主要依赖饲粮提供。我国肉牛养殖大多以舍饲为主,与放牧条件相比,舍饲肉牛青绿饲料缺乏,粗饲料大多以青贮干草为主。据报道,β-胡萝卜素是最容易破坏的养分,田间晒干干草的β-胡萝卜素损失高达90%~95%,牧草在制成青贮后其损失量在40%~60%[1]。新鲜羊茅牧草含有的β-胡萝卜素大约是干草的10倍[2]。β-胡萝卜素容易被氧化,随着收割时间的延长,苜蓿中β-胡萝卜素量随着时间的延长而减少[3]。β-胡萝卜素缺乏容易导致肉牛生产性能下降[4]、卵巢功能受损和流产发生率增加[5],以及犊牛生出生后6日龄出现腹泻的几率提高[6]。适当补充β-胡萝卜素有助于反刍动物生产潜力的发挥。
前人研究表明,微生物可以利用β-胡萝卜素,β-胡萝卜素含量和柠檬酸杆菌、小球菌属和乳球菌呈负相关[7]。丝状酵母属和许旺酵母菌能分解胡萝卜素产生2,2,6-三甲基环己酮、β-环柠檬醛和β-紫罗兰酮等物质[8]。Hino等[9]在体外培养的添加红花油抑制剂的瘤胃细菌中加入β-胡萝卜素,能显著增加细菌数量,提高脂肪酸的利用,还能通过促进纤维素分解菌的生长增强对纤维素的消化。这说明β-胡萝卜素可以调控菌群。目前,还没有关于β-胡萝卜素对体内瘤胃微生物影响的研究,而犏牛是高原地区独有牛种,既能很好地适应高原环境,又能改善牦牛生长缓慢的劣势,探究β-胡萝卜素对母犏牛瘤胃微生物组成的影响具有理论和现实意义。因此,本试验拟通过饲养和消化试验考察β-胡萝卜素对母犏牛营养物质表观消化率、瘤胃发酵特征及微生物区系的影响,为β-胡萝卜素改善瘤胃功能提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用β-胡萝卜素购自成都某生物科技有限公司,纯度为10%。
1.2 试验动物和试验设计
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
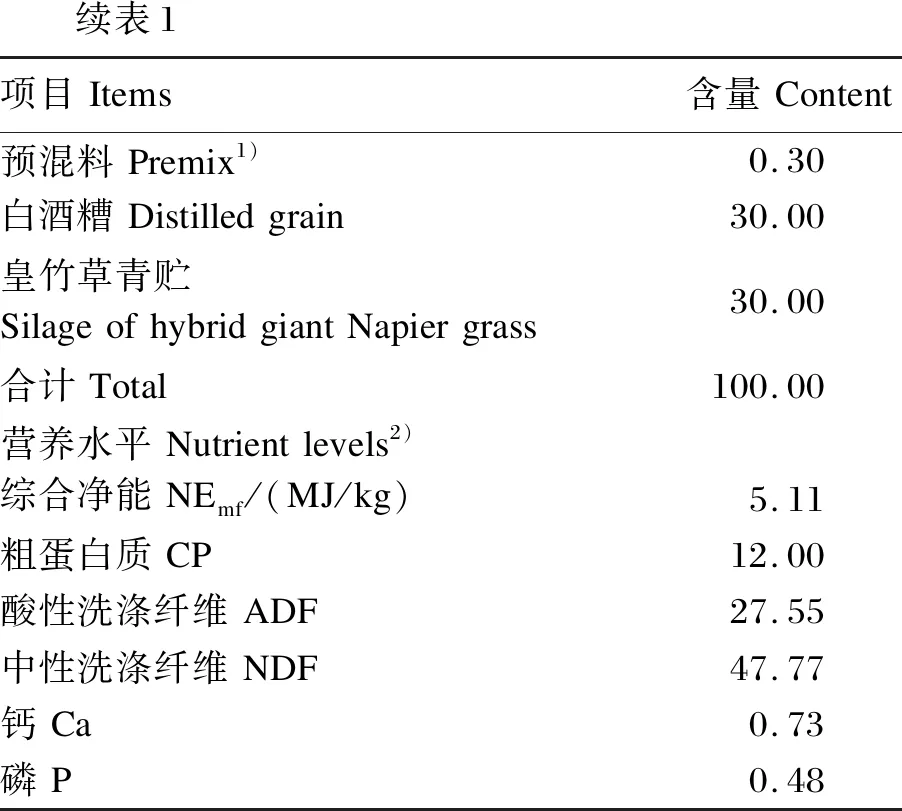
续表1项目Items含量Content预混料Premix1)0.30白酒糟Distilledgrain30.00皇竹草青贮SilageofhybridgiantNapiergrass30.00合计Total100.00营养水平Nutrientlevels2)综合净能NEmf/(MJ/kg)5.11粗蛋白质CP12.00酸性洗涤纤维ADF27.55中性洗涤纤维NDF47.77钙Ca0.73磷P0.48
1.3 饲养管理
试验牛采用单栏饲养。预试期内,让牛只熟悉饲养人员和操作流程。牛粪早晚各清1次,每2周牛舍消毒1次。试验期间,牛舍温度保持在10~25 ℃,每天饲喂2次(07:30和18:00),自由饮水,保证每天试验牛料槽中存在剩料。
1.4 样品采集和指标测定
1.4.1 营养物质表观消化率
正试期第82~84天连续3 d收集饲粮和粪便样品,将饲粮样品混合均匀后采用四分法收集饲粮;每隔4 h采集1次粪便,将3 d收集的粪便混匀后,每头牛取300 g粪便样品加入10%的硫酸30 mL,-20 ℃保存待测。
参照张丽英[11]的方法测定饲粮和粪便样品中干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)和磷(P)含量。各营养物质表观消化率的计算公式如下:
某营养物质表观消化率(%)=100×[(食入该营养物质的含量-粪便排出该营养物质的含量)/食入该营养物质的含量]。
1.4.2 瘤胃液采集
正试期第85天,用胃管法采集瘤胃液,立即测定pH。然后先取10 mL瘤胃液装于10 mL离心管中并编号,用于微生物测定;后取15 mL瘤胃液用于瘤胃发酵指标测定。
1.4.3 瘤胃发酵指标测定
氨态氮(NH3-N)含量采用碱性次氯酸钠-苯酚比色法测定,微生物蛋白(MCP)含量采用Brandford法测定[12],挥发性脂肪酸(VFA)含量采用气相色谱仪(CP-3800,Varian,美国)测定[13]。
1.4.4 瘤胃微生物区系测定
采用微生物DNA提取试剂盒[天根生化科技(北京)有限公司]提取DNA后,用0.8%琼脂糖电泳检测DNA完整性,然后用带有Barcode的细菌特异性引物515F(5′-GTGYCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对样本的16S rDNA V4区域进行扩增。PCR反应体系及条件参照前人研究[14]。PCR结束后的产物与6倍上样缓冲液混合,随后使用2%琼脂糖凝胶进行目的片段电泳检测。回收使用Zymoclean Gel DNA Recovery Kit(D4008),用Illumina HiSeq 2500测序平台进行双末端测序。
采用Flash软件对高通量测序的片段进行拼接,并用QIIME进行质控。使用UCHIME算法和Gold数据库去除嵌合体,得到有效片段(Effective Reads)。基于USEARCH(http://drive.com/uparse/)软件,使用UPARSE算法在97%的一致性水平上进行操作分类单元(OTU)聚类,选出OTU中出现频数最高的序列作为OTU的代表性序列。使用UCLUST分类法与SILVA数据库进行注释分析。使用R软件(3.6.0)Picante包计算系统发育多样性(PD)指数,其他α多样性指数指数使用Vegan包计算。主坐标分析(PCoA)使用R软件的ape包。
1.5 数据统计分析
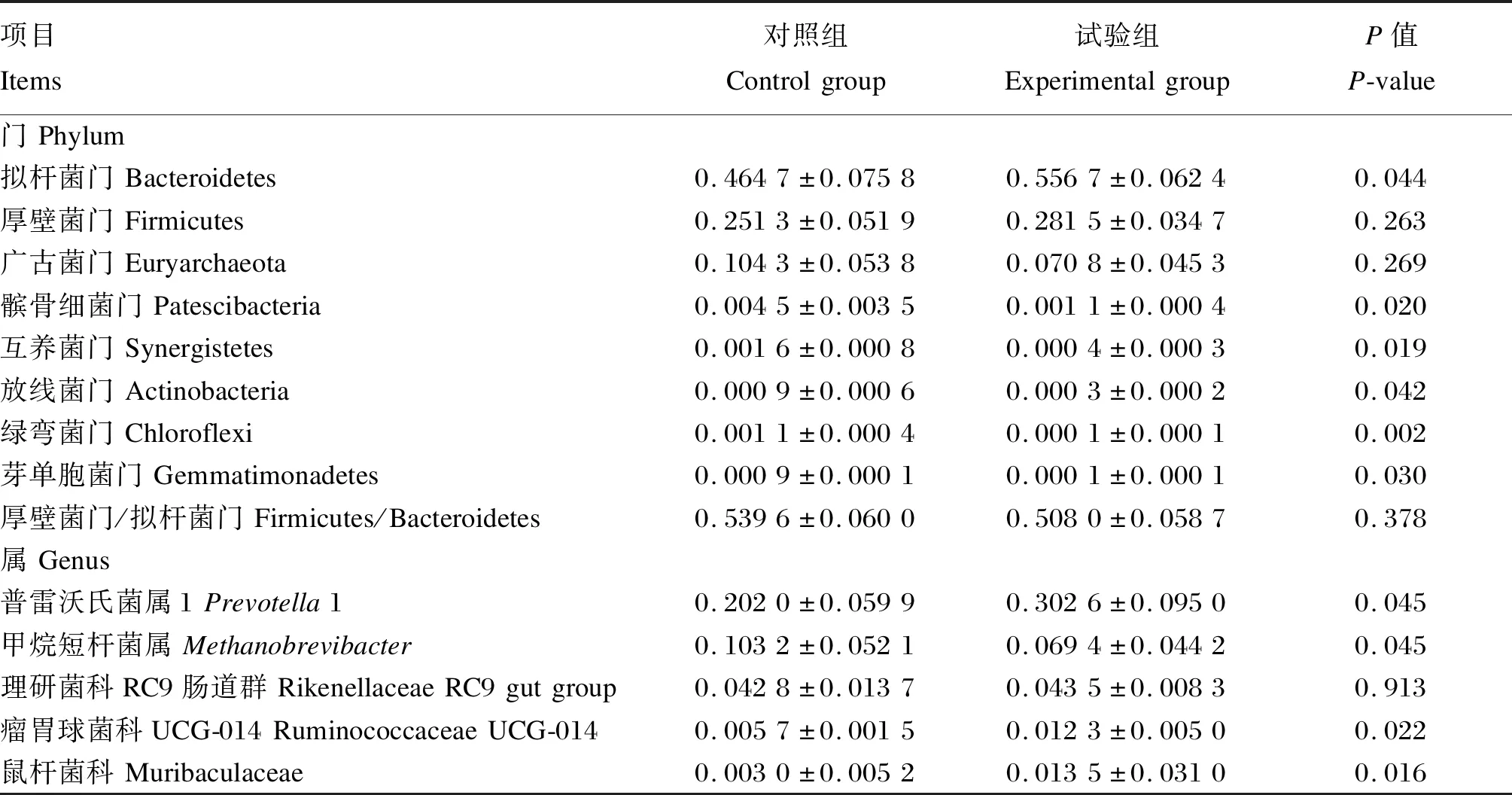
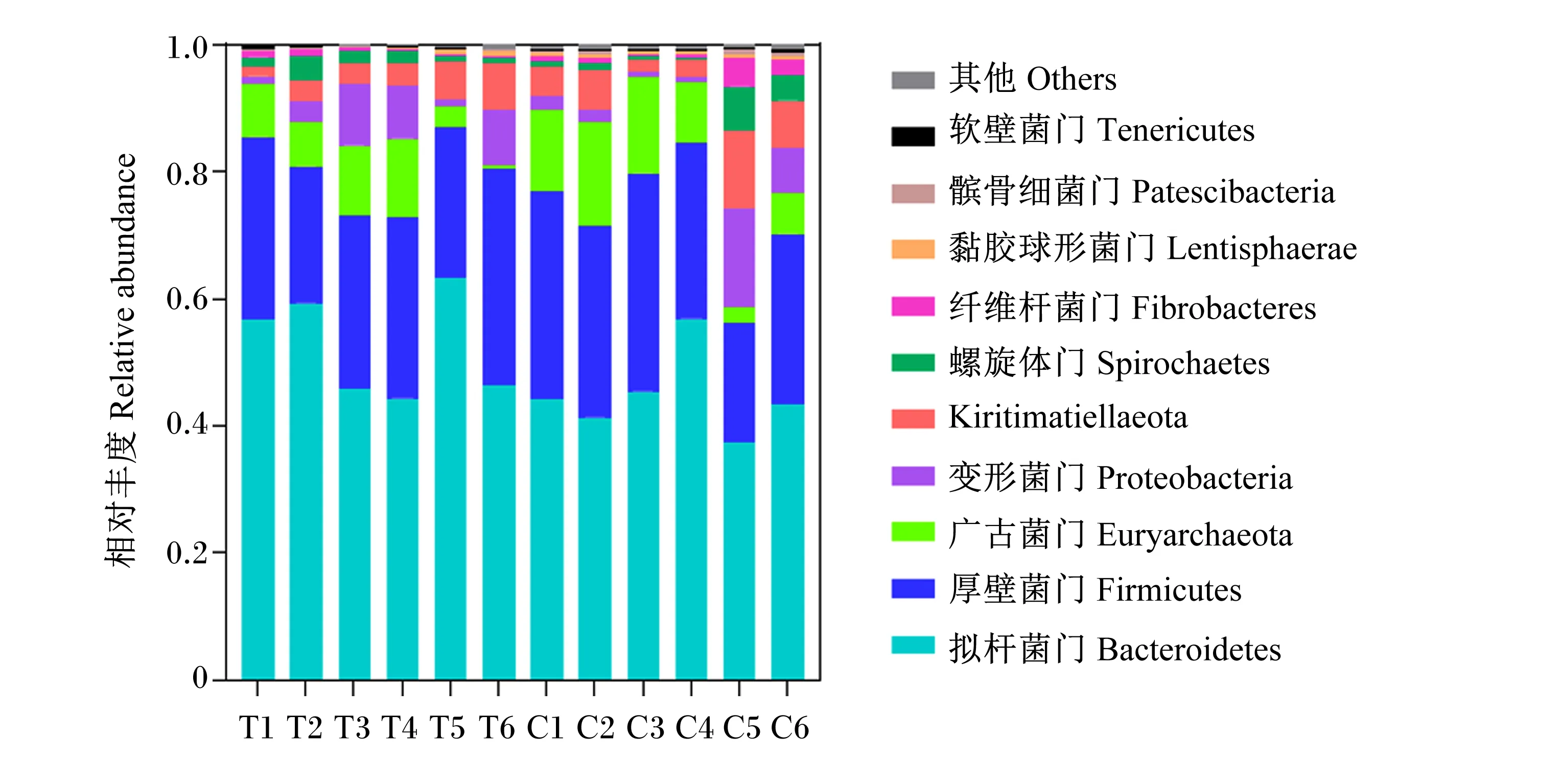
试验数据采用Excel 2019进行初步整理,然后采用SPSS 19.0软件中的t检验进行分析,P≤0.05视为差异显著,0.05 由表2可知,试验组母犏牛ADF和NDF表观消化率显著高于对照组(P<0.05),但2组之间DM、CP和EE表观消化率均无显著差异(P>0.05)。 表2 β-胡萝卜素对母犏牛营养物质表观消化率的影响Table 2 Effects of β-carotene on nutrient apparent digestibility of female yak-cattle hybrid % 由表3可知,试验组母犏牛瘤胃NH3-N含量和乙酸/丙酸值显著低于对照组(P≤0.05),瘤胃MCP和丙酸含量显著高于对照组(P<0.05),瘤胃总挥发性脂肪酸(TVFA)含量有高于对照组的趋势(P=0.096);2组之间瘤胃pH、乙酸和丁酸含量均无显著差异(P>0.05)。 表3 β-胡萝卜素对母犏牛瘤胃发酵特征的影响Table 3 Effects of β-carotene on rumen fermentation characteristics of female yak-cattle hybrid 2.3.1 α多样性分析 由表4可知,试验组母犏牛瘤胃微生物的OTU数目、Chao1指数、Shannon指数和PD指数均显著低于对照组(P<0.05),但2组之间的Simpson指数无显著差异(P>0.05)。 表4 β-胡萝卜素对母犏牛瘤胃微生物区系α多样性的影响Table 4 Effects of β-carotene on α diversity in rumen microflora of female yak-cattle hybrid 2.3.2 β多样性分析 PCoA便于观察样本间的变化程度和变化规律。如图1所示,基于未加权UniFrac距离PCoA的主坐标1和主坐标2分别说明存在22.7%和17.0%的菌群结构变异量;此外,试验组6个样品能很好地聚在一起,对照组样品分布较为分散,但2组之间能明显区分,这说明2组之间瘤胃微生物区系存在差异,试验组微生物区系结构相似性高,而对照组微生物区系结构差异较大。 图1 瘤胃微生物区系主坐标分析Fig.1 PCoA of rumen microflora 2.3.3 瘤胃微生物区系 在门水平上,对照组共检测到22种菌门,试验组共检测到19种菌门。对2组相对丰度较高的10个菌门进行统计,如图2所示,试验组和对照组的优势菌门均为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和广古菌门(Euryarchaeota),相对丰度平均值分别是48.74%、27.88%和8.75%。由表5可知,试验组拟杆菌门相对丰度显著高于对照组(P<0.05),厚壁菌门/拟杆菌门(F/B)值与对照组相比无显著差异(P>0.05),互养菌门(Synergistetes)、放线菌门(Actinobacteria)、髌骨细菌门(Patescibacteria)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes)相对丰度显著低于对照组(P<0.05),其他菌门相对丰度与对照组相比均无显著差异(P>0.05)。 在属水平上,共检测到332个属,其中试验组共检测到217个属,对照组共检测到330个属,共享菌属215个。以相对丰度>1%进行筛选共筛选出22个属,如图3所示,其中普雷沃氏菌属1(Prevotella1)的相对丰度最高,其次是甲烷短杆菌属(Methanobrevibacter)和理研菌科RC9肠道群(Rikenellaceae RC9 gut group)。由表5可知,试验组普雷沃氏菌属1、鼠杆菌科(Muribaculaceae)和瘤胃球菌科UCG-014(Ruminococcaceae UCG-014)相对丰度显著高于对照组(P<0.05),甲烷短杆菌属相对丰度显著低于对照组(P<0.05),其他菌属相对丰度与对照组相比无显著差异(P>0.05)。 表5 门水平和属水平相对丰度较高或差异显著的瘤胃微生物Table 5 Rumen microflora with higher relative abundance or significant difference at phylum level and genus level T1~T6表示试验组样本,C1~C6表示对照组样本。图3同。T1 to T6 represented samples of the experimental group,and C1 to C6 represented samples of the control group.The same as Fig.3.图2 瘤胃微生物区系门水平相对丰度Fig.2 Relative abundance of rumen microflora at phylum level 图3 瘤胃微生物区系属水平相对丰度Fig.3 Relative abundance of rumen microflora at genus level β-胡萝卜素作为饲料添加剂在反刍动物上运用已有较长历史,但目前关于β-胡萝卜素对营养物质表观消化率的影响还未见报道。本研究结果表明,试验组ADF和NDF表观消化率显著高于对照组,2组的DM、CP和EE表观消化率无显著差异。研究表明,阿尔泰马鹿饲粮中添加12 800 IU/kg维生素A可显著提高磷的表观消化率,对其他营养物质的表观消化率无显著影响[15]。结果不一致的原因可能是由于饲粮种类和动物品种差异导致的,虽然都是反刍动物,但生产目的不同,饲粮结构和瘤胃菌群存在差异,因而会出现不同结果。此前关于β-胡萝卜素影响纤维消化率的解释则是其能促进纤维素分解菌的生长从而促进纤维素的消化[9]。近日,Honarbakhsh等[16]进一步表明与维生素A缺乏的小鼠相比,补充维生素A使得肠道厚壁菌门相对丰度显著提高。这说明β-胡萝卜素对ADF和NDF表观消化率的影响可能是通过影响厚壁菌门等纤维分解菌的相对丰度来发挥作用的。 瘤胃pH是反映瘤胃发酵状态的综合指标,本试验中瘤胃pH在6.3左右,属于正常范围(5.5~7.5)。但也有研究表明,体外发酵瘤胃液中加入β-胡萝卜素,1~3 h内瘤胃pH在6.7~7.3,但在5 h以后,添加200 g/L β-胡萝卜素组的pH下降到了5.87,显著低于对照组。这说明胡萝卜素对pH的影响受采样时间的影响。NH3-N和MCP一定程度上反映了瘤胃微生物对含氮物质的利用情况。本试验中,试验组NH3-N含量降低,MCP合成增加,造成该结果的原因可能是由于β-胡萝卜素能够刺激瘤胃与蛋白质合成相关微生物的增长,从而增加了对NH3-N的利用。Ulziisaikhan[17]研究在奶牛饲粮中添加300 mg/(头·d)β-胡萝卜素,结果与本研究结果一致。VFA是碳水化合物发酵产物,而其中的丙酸是糖异生底物,可为反刍动物提供70%~80%的能量[18]。本试验中,试验组瘤胃丙酸含量显著提高,瘤胃乙酸/丙酸值显著降低,说明试验组瘤胃发酵模式主要以丙酸型发酵为主,可以为机体代谢提供更多能量。这一点也在刘利林等[19]的研究中得到证实,饲粮添加0.005%和0.008% β-胡萝卜素均能促进瘤胃中TVFA含量的升高,且有降低瘤胃乙酸/丙酸值的趋势。瘤胃丙酸含量升高主要与饲粮类型有关,可能是由于β-胡萝卜素能提高精饲料的利用率所致。 反刍动物瘤胃菌群与其生长和健康密切相关[20]。本试验中,试验组母犏牛瘤胃菌群的OTU数目、Chao1指数、Shannon指数和PD指数均显著低于对照组,这说明添加β-胡萝卜素会减少菌群物种总数和微生物的丰富度以及多样性,该物种多样性的降低可能与营养物质表观消化率的提高有关;而2组的Simpson指数无显著差异,这说明二者群落多样性相似。 在瘤胃中,厚壁菌门和拟杆菌门是瘤胃内丰度最高的2个菌门,二者与纤维素的降解有关[21]。研究表明,在肥胖病人和小鼠模型中,肥胖与拟杆菌门和厚壁菌门的相对丰度有关,拟杆菌门和厚壁菌门相对丰度高,则表明机体对食物的消化吸收能力强[22]。还有研究表明,饲料利用率低的牦牛瘤胃拟杆菌门相对丰度较低[23]。本研究中,试验组瘤胃拟杆菌门相对丰度显著高于对照组,这可能就是ADF和NDF表观消化率提高的原因。互养菌门具有蛋白质降解功能[24-25]。研究发现,互养菌门与牙周炎的发生密切相关[26];此外,目前17个互养菌门分离株中有12株在不同过程感染样本中被分离到,这表明它们可能在微生物区系中发挥着功能作用,但也可能作为条件致病菌导致炎症反应的发生[27]。本研究结果发现,试验组瘤胃互养菌门相对丰度显著低于对照组,这表明β-胡萝卜素可能在减少瘤胃炎性反应中发挥作用。据报道,放线菌门、髌骨细菌门、绿弯菌门和芽单胞菌门是在土壤堆肥中的优势菌门[28],主要作用于纤维素、半纤维素、木质素以及腐殖质的分解[29],但是其在瘤胃中的潜在功能还有待进一步阐明。 本研究中,在属水平上,试验组瘤胃普雷沃氏菌属1和鼠杆菌科的相对丰度显著高于对照组;此外,试验组瘤胃球菌科UCG-014相对丰度显著高于对照组,这进一步说明β-胡萝卜组可提高母犏牛对蛋白质和纤维的降解能力。甲烷短杆菌属与甲烷的产生有关[30],本研究中甲烷短杆菌属为第2大菌属。祝伊枭等[31]研究表明,相比于荷斯坦奶牛和麦洼牦牛,犏牛的产甲烷菌属更多,这与本研究结果一致。研究表明,放牧70 d后奶牛乳中β-胡萝卜素含量显著高于初始放牧[32],这说明放牧牛摄取了更多的β-胡萝卜素并能在体内沉积;还有研究表明,放牧牛最长肌和半腱肌中β-胡萝卜素含量高于圈养牛[33];此外,有研究表明圈养牛瘤胃产甲烷菌数量显著高于放牧牛和放牧加补饲牛[34];圈舍牦牛瘤胃产甲烷菌属高于放牧牛[35],这说明β-胡萝卜素可能对产甲烷菌属具有抑制作用。有趣的是,本研究中,试验组瘤胃甲烷短杆菌属相对丰度显著低于对照组,这表明β-胡萝卜素可能可以降低瘤胃甲烷的产生,但该结果有待进一步验证。 ① 饲粮添加β-胡萝卜素可以提高母犏牛对ADF和NDF的表观消化率。 ② 饲粮添加β-胡萝卜素可以提高母犏牛瘤胃丙酸和MCP含量,降低瘤胃乙酸/丙酸值,改变瘤胃发酵模式。 ③ 饲粮添加β-胡萝卜素可以降低母犏牛瘤胃甲烷短杆菌属相对丰度,提高瘤胃拟杆菌门、普雷沃氏菌属1和瘤胃球菌科UCG-014相对丰度,增强对纤维的降解能力。2 结果与分析
2.1 β-胡萝卜素对母犏牛营养物质表观消化率的影响

2.2 β-胡萝卜素对母犏牛瘤胃发酵特征的影响

2.3 β-胡萝卜素对母犏牛瘤胃微生物区系的影响



3 讨 论
3.1 β-胡萝卜素对母犏牛营养物质表观消化率的影响
3.2 β-胡萝卜素对母犏牛瘤胃发酵特征的影响
3.3 β-胡萝卜素对母犏牛瘤胃微生物区系的影响
4 结 论
