硒源对泌乳牛瘤胃发酵参数及微生物区系的影响
2023-02-08齐志国金银姬程柏丛郭江鹏
付 瑶 齐志国 王 俊 李 岩 金银姬 程柏丛 郭江鹏*
(1.北京市畜牧总站,北京 100107;2.农业农村部人力资源开发中心/中国农学会,北京 100125)
近年来,富硒畜禽产品的巨大市场开发潜力使得有关硒的研究成为当前学者关注的热点之一。饲粮中常见的补硒形式有无机硒和有机硒2种,研究表明无机硒生物利用率低,同时具有潜在毒性[1-2],所以在实际生产中推荐使用有机硒源补硒。多数学者在硒源的选择和硒的最佳用量方面进行了相关研究,并证明了硒在反刍动物营养、生产和免疫方面的关键作用[3-7],但仍存在一定的局限性。瘤胃是反刍动物的第一胃,反刍动物采食富硒饲粮到达瘤胃,瘤胃内丰富的微生物对不同硒源饲粮进行消化,导致瘤胃内环境发生改变[8]。研究表明,瘤胃微生物可以直接将硒源合成含硒氨基酸[9]。同时,瘤胃微生物对有机硒的吸收率更高,能显著降低无机硒的利用率[10-11]。反之,硒也会影响反刍兽新月单胞菌等瘤胃微生物的生长繁殖[12-13]。
羟基硒代蛋氨酸(HMSeBA)是一种新型的有机硒源,属于硒硫氨酸的羟基类似物,被吸收后代谢为硒甲硫氨酸,2013年欧盟委员会宣布它可以作为硒源补充剂添加到动物饲粮中[14],其作用已经在猪[15]和鸡[16]上得到了证实,但在奶牛上的研究甚少。本项目组已有的研究表明,硒源可以显著增加奶牛血硒、乳硒含量及乳硒/血硒,且添加HMSeBA上述指标显著高于添加亚硒酸钠(SS),分别比后者高239.09%、31.02%和43.75%,但平均日采食量、产奶量及乳成分无显著差异。为了更好地综合评估不同硒源在奶牛生产中的应用,鉴于其对奶牛瘤胃影响的研究鲜见报道,作用效果尚需实证,本试验旨在研究HMSeBA作为一种新型有机硒源与SS对奶牛瘤胃发酵参数及微生物区系的影响。
1 材料与方法
1.1 试验设计
选取48头泌乳中期的健康荷斯坦奶牛[泌乳日龄为(179±22)日龄,日产奶量为(34.00±3.87) kg/d,胎次为(3.38±1.28)胎],随机分为3组,即对照组、SS组及HMSeBA组,每组16头。预试期2周,正试期9周。
1.2 试验饲粮
试验过程中,每天投料2次,保证奶牛自由采食、饮水,早、中、晚挤奶。参照《奶牛饲养标准》(NY/T 34—2004)配制饲粮,所用预混料为无外源添加硒预混料。对照组饲粮不额外添加硒源,另外2组在对照组饲粮基础上额外添加SS(分析纯化学试剂,纯度≥99.5%)或HMSeBA(含硒量为2%),添加量均为15 mg/(d·头),实际测得的3组饲粮硒含量分别为0.096、0.500和0.500 mg/kg DM。对照组饲粮组成及营养水平见表1。

表1 对照组饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the diet for control group (DM basis) %
1.3 样品采集与测定
1.3.1 样品采集
在试验结束前最后1 d晨饲后4 h,每组选取6头体况良好的奶牛,使用口腔插管采集瘤胃液,并经4层纱布过滤。采集好瘤胃液后,测定pH,一部分置于2 mL冻存管中,保存在液氮中,测定瘤胃微生物区系;一部分置于50 mL离心管中,保存在-20 ℃冰箱中,测定氨态氮和挥发性脂肪酸(VFA)浓度。
1.3.2 样品测定
1.3.2.1 瘤胃发酵参数测定
瘤胃液pH采用UB-7 pH计测定;瘤胃液VFA浓度采用TP-2060型气相色谱仪测定,方法为Erwin等[17]的气相色谱分析法;瘤胃液氨态氮浓度采用UV-1601型紫外可见分光光度计测定,方法为Broderick等[18]的靛酚蓝-分光光度法。
1.3.2.2 瘤胃微生物多样性测定
DNA提取和检测:按照天根(北京)DNA提取试剂盒的步骤说明进行提取,使用NanoDrop2000(Thermo Scientific,美国)对DNA的浓度和纯度进行检测。
扩增及测序:使用含barcode的特异引物扩增16S rDNA的V3~V4可变区。PCR扩增产物切胶回收,用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)检测定量。将纯化的扩增产物进行等量混合,连接测序接头,构建Miseq测序文库。通过Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
用FLASH软件对reads进行拼接,通过Uparse软件将相似性≥97%的序列聚类到同一操作分类单元(OTU)并进行注释,使用QIME软件计算微生物群落α多样性,使用R软件(vision 3.2.2)计算样品间UniFrac距离,分析微生物群落β多样性。
1.4 统计分析
试验数据通过SAS 9.2软件进行单因素方差分析(one-way ANOVA),并进行Duncan氏多重比较,计算均值标准误(SEM)和P值。P<0.05为差异显著。
2 结 果
2.1 瘤胃发酵参数
由表2可知,瘤胃液pH、氨态氮浓度、各VFA的比例、乙酸/丙酸、总VFA浓度均不受硒源的影响(P>0.05),且3组奶牛瘤胃发酵参数均在正常范围内。

表2 硒源对奶牛瘤胃发酵参数的影响Table 2 Effects of selenium sources on rumen fermentation parameters of dairy cows
2.2 瘤胃微生物区系
2.2.1 瘤胃微生物多样性
由表3可知,3组样品文库覆盖率均在0.99以上,可见每个样品测序量合理,能够很好地反映瘤胃微生物群落种类和结构多样性;反映丰富度实际观测值的Sobs指数和反映谱系多样性的PD whole tree指数在HMSeBA组显著高于对照组和SS组(P<0.05),但另外2组间无显著差异(P>0.05);3组间反映群落均匀度的Pielou指数无显著差异(P>0.05),各组间存在相似的群落均匀度。HMSeBA组丰富度Chao1指数显著高于对照组和SS组(P<0.05),但另外2组间无显著差异(P>0.05);硒源对Shannon指数无显著影响(P>0.05),各组间存在相似的均一性。
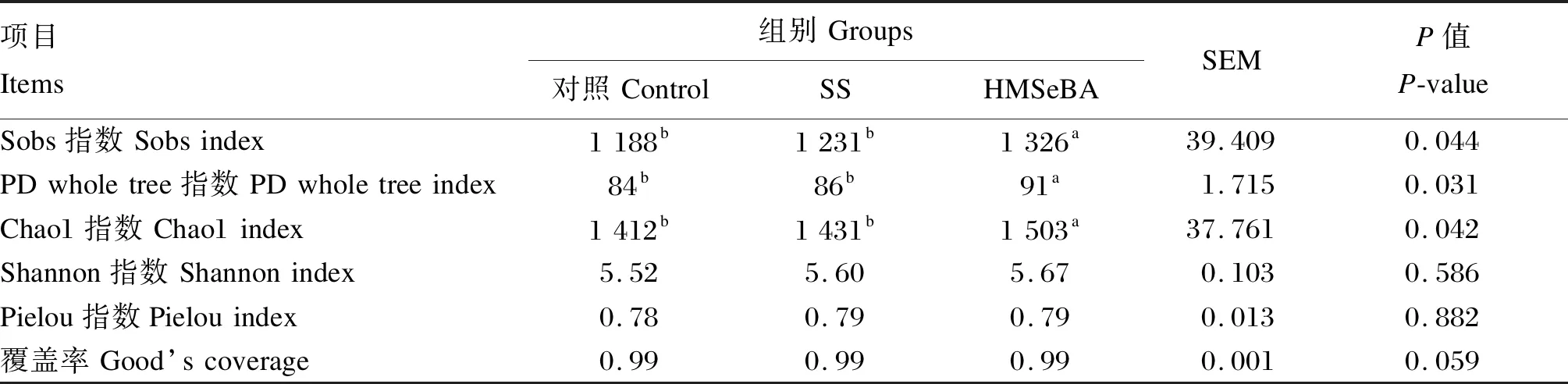
表3 硒源对奶牛瘤胃微生物多样性指数的影响Table 3 Effects of selenium sources on diversity indexes of rumen microorganisms of dairy cows
2.2.2 瘤胃中细菌群落相似性
采用基于Unweighted UniFrac距离的偏最小二乘法判别分析(PLS-DA)对对照组、SS组和HMSeBA组奶牛瘤胃中细菌群落差异进行研究。由图1可知,第1主成分贡献率是10.00%,第2主成分贡献率是12.26%,对照组、SS组和HMSeBA组奶牛的瘤胃液样品可以明显区分并聚成3个类群,说明瘤胃液样品中细菌群落结构差异明显。

图1 各组瘤胃液样品偏最小二乘法判别分析Fig.1 PLS-DA of rumen fluid samples in each group
2.2.3 瘤胃中细菌群落结构在门和属水平上的变化
在3组奶牛的瘤胃微生物中鉴定出了18个门,其中13个门为全部样本所共有。在门水平上,相对丰度占比大于1%的菌门为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、糖化菌门(Saccharibacteria)和变形菌门(Proteobacteria),平均相对丰度分别为(55.46±9.15)%、(38.79±9.08)%、(1.41±0.42)%和(1.12±1.05)%。由表4可知,硒源对各组优势菌门相对丰度均无显著影响(P>0.05)。
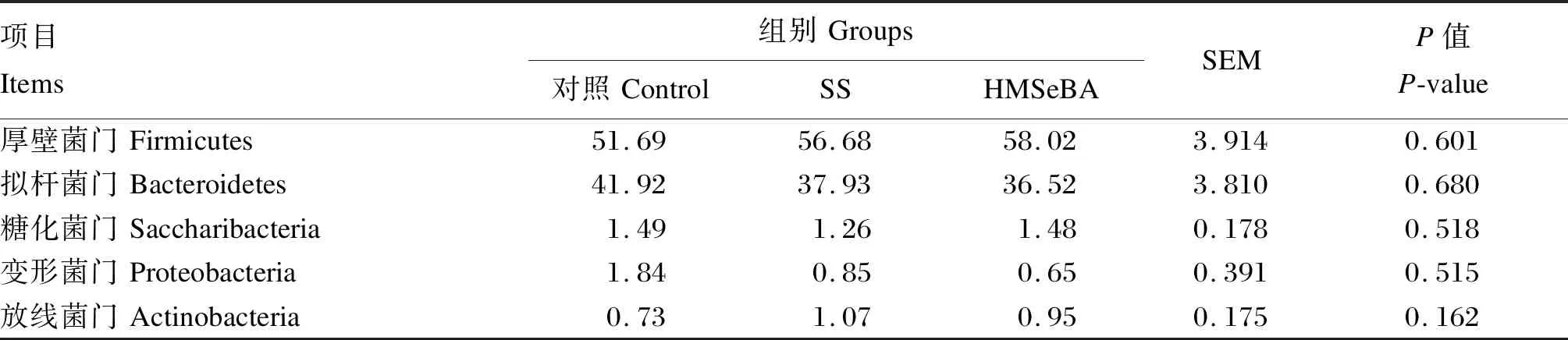
表4 硒源对奶牛瘤胃门水平微生物相对丰度的影响Table 4 Effects of selenium sources on relative abundance of rumen microorganisms at phylum level of dairy cows %
在3组奶牛的瘤胃微生物中鉴定出了227个属,其中117个属在所有样品中存在。高相对丰度的菌属有普雷沃氏菌属_1(Prevotella_1)(19.24±7.95)%、解琥珀酸菌属(Succiniclasticum)(12.55±5.43)%、未分类拟杆菌门_S24-7菌群(norank_ f_Bacteroidales_S24-7_group)(5.76±3.67)%、瘤胃球菌科NK4A214群(Ruminococcaceae_NK4A214_group)(5.62±2.15)%、克里斯滕森菌科R-7群(Christensenellaceae_R-7_group)(3.09±1.14)%、毛螺菌科NK3A20群(Lachnospiraceae_NK3A20_group)(3.06±1.22)%、瘤胃球菌科UCG-014(Ruminococcaceae_UCG-014)(2.89±1.42)%、未分类拟杆菌门S11肠道群(norank_f_Bacteroidales_BS11_ gut_group)(2.70±1.88)%、普雷沃氏菌属_7(Prevotella_7)(2.62±4.57)%、瘤胃球菌属_2(Ruminococcus_2)(2.39±1.67)%、理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)(2.17±1.29)%、瘤胃球菌属_1(Ruminococcus_1)(1.83±0.87)%、丁酸弧菌属_2(Butyrivibrio_2)(1.62±1.14)%、普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)(1.47±0.62)%、候选糖化假丝酵母菌属(Candidatus_Saccharimonas)(1.41±0.42)%、瘤胃球菌科UCG-005(Ruminococcaceae_UCG-005)(1.36±0.68)%、产粪甾醇真细菌群([Eubacterium]_coprostanoligenes_group)(1.14±0.39%)、反刍动物真杆菌群([Eubacterium]_ruminantium_group)(1.13±0.59)%和普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003)(1.05±0.62)%。由表5可知,3组的优势菌属均为Prevotella_1和Succiniclasticum,但其相对丰度3组间差异不显著(P>0.05)。

表5 硒源对奶牛瘤胃优势菌属相对丰度的影响Table 5 Effects of selenium sources on relative abundance of rumen dominant bacteria of dairy cows %
表6比较了不同硒源之间的瘤胃属水平差异细菌。3组的显著差异性细菌有6种(至少存在于1个样品中的占总序列0.05%相对丰度的微生物)。其中,HMSeBA组Ruminococcaceae_NK4A214_group、Ruminococcaceae_UCG-004和Blautia相对丰度显著高于另外2组(P<0.05),HMSeBA组毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group)相对丰度显著低于另外2组(P<0.05),但对照组和SS组无显著差异(P>0.05);SS组和HMSeBA组毛形杆菌属(Lachnobacterium)相对丰度显著高于对照组(P<0.05),但2组间无显著差异(P>0.05);对照组和HMSeBA组月形单胞菌属(Selenomonas)相对丰度显著低于SS组(P<0.05),但2组间无显著差异(P>0.05)。

表6 硒源对奶牛瘤胃属水平微生物相对丰度的影响Table 6 Effects of selenium sources on relative abundance of rumen microorganisms at genera level of dairy cows %
3 讨 论
3.1 硒源对瘤胃发酵参数的影响
瘤胃液pH、氨态氮、VFA等能够反映瘤胃发酵的情况。瘤胃液pH的正常值范围是5.5~7.5,当数值小于6.2时,会抑制纤维分解菌的活动[19]。本研究中,对照组、SS组和HMSeBA组瘤胃液pH分别为6.49、6.38和6.30,说明本试验条件下3组奶牛瘤胃液pH均适宜于瘤胃微生物的活动。VFA是饲粮中碳水化合物发酵产生的终物质[20],对于有机硒源对VFA的影响,学者得到了不同的结论。Wang等[21]、Shi等[22]认为饲粮中添加酵母硒或纳米硒可显著增加丙酸浓度,且显著降低乙酸/丙酸。同时,Wei等[23]的研究表明,饲粮中添加HMSeBA可以显著增加丙酸、丁酸及总VFA浓度,显著降低乙酸/丙酸,且随着添加量的增加,丙酸、丁酸及总VFA浓度线性增加,乙酸/丙酸线性降低。Serra等[24]研究表明,乙酸、丙酸、总VFA浓度及乙酸/丙酸都略有降低。但Erasmus等[25]、倪丽丽[26]并未发现硒源对VFA浓度有显著影响,这与本试验的结果相似。本试验中,3组饲粮奶牛的VFA比例及乙酸/丙酸无显著差异,说明在本试验条件下,硒源没有显著影响瘤胃的发酵模式,试验结果的不同可能与硒的添加量、奶牛泌乳期等的不同有关。氨态氮可为瘤胃微生物蛋白质合成提供氮源,瘤胃微生物对饲粮蛋白质的利用率随微生物活性的增加而增加[27]。本试验中,3组饲粮奶牛瘤胃液中氨态氮的浓度没有显著差异,且均在正常值范围内,间接证明了3个处理未对瘤胃微生物菌群活跃度产生不良影响。
3.2 硒源对瘤胃微生物群落的影响
本试验中,3组饲粮对奶牛瘤胃发酵参数影响不显著,但是在瘤胃细菌群落组成上观察到了差异。Chao1指数、Sobs指数及PD whole tree指数变化趋势相近,其中,Chao1指数代表微生物群落的相对丰度,数值越大代表相对丰度越高;Sobs指数代表观测的OTU数目;PD whole tree指数代表谱系多样性[28]。本试验中,HMSeBA组3个指数均显著高于对照组和SS组,说明HMSeBA组奶牛的瘤胃具有较高的物种丰富度。Pielou指数代表群落的均匀度,本试验未观察到显著差异。Shannon指数综合反映了群落的丰富度和均匀度,数值越大样本均一性越好[29]。该指数在本试验中未观察到显著差异,说明3组存在相似的均一性。
在门水平上的分析结果显示,3组奶牛瘤胃液中的主要细菌菌门为Firmicutes和Bacteroidetes,两者占比超过93%,与前人研究结果[30-31]一致。本试验中,3个处理对奶牛瘤胃液中2种主要菌门相对丰度无显著影响。在属水平上,占比排名前2位的细菌菌属为Prevotella_1和Succiniclasticum,两者占比超过29%,与前人研究结果[32-33]一致。本试验中,3个处理对奶牛瘤胃液中2种主要菌属相对丰度无显著影响。
差异分析显示,在属水平上,HMSeBA组Ruminococcaceae_UCG-004、Ruminococcaceae_NK4A214_group和Blautia相对丰度显著高于对照组和SS组,Lachnospiraceae_NK4A136_group相对丰度显著低于对照组和SS组。SS组和HMSeBA组Lachnobacterium相对丰度显著高于对照组,对照组和HMSeBA组Selenomonas相对丰度显著低于SS组。Ruminococcaceae_NK4A214_group、Ruminococcaceae_UCG-004都是瘤胃球菌科的潜在有益菌,属于纤维降解菌,在瘤胃内参与纤维降解,产物为纤维酶降解纤维二糖等纤维类物质[34-35],其相对丰度的增加可以显著提高饲粮中性洗涤纤维(NDF)的消化率[36-37]。有学者证明,HMSeBA有助于增加NDF的表观消化率[38]。同时,也有研究证实Ruminococcaceae具有免疫调节和平衡内环境的作用[39-40]。本试验中,HMSeBA组Ruminococcaceae_NK4A214_group、Ruminococcaceae_UCG-004相对丰度均显著高于其他2组,这可以作为HMSeBA提高NDF消化率的原因之一,也推测HMSeBA具有更好地提高奶牛免疫力和平衡瘤胃内环境的作用。Blautia属于纤维降解菌,是一种以生产短链脂肪酸为目标的微生物[41],研究表明其具有抗炎和免疫调节功能[42-43],Lachnospiraceae_NK4A136_group在临床上作为免疫[44]、结肠炎[45]鉴定的标志微生物,其丰度越高表示免疫力或抗病性越低。本试验中,HMSeBA组Blautia相对丰度显著高于对照组和SS组,而Lachnospiraceae_NK4A136_group相对丰度显著低于对照组和SS组,因而可以推测HMSeBA对提高奶牛免疫力或抗病性的作用更明显。Lachnobacterium是厚壁菌门的有益菌,主要发酵葡萄糖,发酵产物为乳酸,还有极少量的乙酸和丁酸[46]。本试验中,虽然表现出了明显差异,但因其含量低,可能没有对奶牛机体产生较大影响。瘤胃微生物具有浓缩饲粮硒的能力,至少15个属的微生物参与了硒的转化和有机硒的形成[47-48]。Hudman等[12]、Koening等[49]的研究发现,Selenomonas能够将硒合成含硒氨基酸,含硒氨基酸被合成到菌体蛋白中,同时它能将少部分的氧化型硒还原成元素硒,且SS能显著促进Selenomonas的生长。这与本试验结果相似,即对照组和HMSeBA组Selenomonas相对丰度显著低于SS组,这似乎可以为SS降低硒的生物学利用率提供一定程度的依据。
4 结 论
在本试验条件下,与无外源添加硒相比,添加SS或HMSeBA未对泌乳中期荷斯坦奶牛瘤胃发酵类型产生显著影响,且对瘤胃主要优势菌门和优势菌属相对丰度无显著影响。但添加HMSeBA可以显著提高物种丰富度,且在属水平上检测到4种具有显著差异的功能性细菌Ruminococcaceae_NK4A214_group、Ruminococcaceae_UCG-004、Blautia、Lachnospiraceae_NK4A136_group。
