基于斜率比法评定断奶仔猪对不同铜源的相对生物学利用率
2023-02-08晏家友罗宗刚李书伟汤文杰邝声耀
晏家友 罗宗刚 李书伟 汤文杰 邝声耀
(1.四川省畜牧科学研究院,成都 610066;2.动物遗传育种四川省重点实验室,成都 610066;3.西南大学动物科学技术学院,荣昌 402460;4.四川省畜科饲料有限公司,成都 610066;5.畜禽生物制品四川省重点实验室,双流 616200)
铜是动物机体必需的微量元素之一,它在动物的生长发育及免疫调节等方面都发挥着重要的营养生理作用,可以作为酶的组成成分或激活剂,参与体内物质代谢;可以维持铁的代谢,促进血红蛋白合成和红细胞成熟;可以参与骨细胞、胶原和弹性蛋白的形成,促进骨骼发育[1-2]。目前,无机铜(如硫酸铜和碱式氯化铜)是饲粮中铜源的主要添加形式,但是其存在吸收率低、排放量高,吸湿性、易结块等负面问题,还会对饲粮中的维生素和油脂产生破坏作用[3-4]。因而,研发和应用更加安全、有效和环保的新铜源来满足动物对铜的营养需要,已成为当今饲料行业的必然趋势。2019年4月,我国农业农村部发布第162号公告,批准柠檬酸铜作为新型有机铜源在断奶仔猪饲粮中使用。研究表明,断奶仔猪饲粮中添加低剂量(20或30 mg/kg)柠檬酸铜形式的铜,不但可以促进仔猪生长,而且可以提高免疫力,进而降低腹泻率和死亡率[5-6]。进一步研究发现,在仔猪饲粮中,与硫酸铜或碱式氯化铜相比,柠檬酸铜更能发挥营养性和功能性的作用,这可能与其生物学利用率有关[7]。然而,关于断奶仔猪对柠檬酸铜的生物学利用率研究尚未见相关报道。生物学利用率又称之为生物学效价,评定微量元素生物学利用率的方法主要有平衡试验法、放射性同位素法和斜率比法,其中前2种方法因成本高、设备贵等原因没有得到广泛应用,而斜率比法操作比较简单,对试验器材要求不高,是目前评定微量元素生物学利用率的常用方法[8-9]。因此,本试验通过研究不同铜源和铜添加水平对断奶仔猪生长性能、血清铜含量与含铜酶活性以及组织铜含量的影响,探讨碱式氯化铜和柠檬酸铜的相对生物学利用率,为新型铜源在仔猪生产中的科学选择和合理应用提供试验依据。
1 材料与方法
1.1 试验铜源
试验采用的3种铜源——硫酸铜(五水硫酸铜,饲料级,Cu2+含量实测值为25.0%)、碱式氯化铜(饲料级,Cu2+含量实测值为58.0%)和柠檬酸铜(饲料级,Cu2+含量实测值为35.0%),均由四川省某饲料有限公司提供。
1.2 试验设计
采用3×2双因子随机区组试验设计(铜源分别为硫酸铜、碱式氯化铜和柠檬酸铜;铜添加水平分别为20和30 mg/kg),另设1个不额外添加铜源的对照组。
1.3 试验动物与管理
试验在西南大学科教实训基地进行。选取平均体重(8.98±0.48) kg的杜×长×大三元杂交断奶仔猪112头,随机分为7组,每组4个重复,每个重复4头猪,以重复为单位分栏。试验前,对猪舍进行彻底清扫和消毒。试验期间,人工喂料和清粪,每天06:00、11:00和17:00各饲喂1次,仔猪自由采食、饮水。试验猪舍执行常规免疫程序,严格控制温湿度,保持舍内通风换气。试验预试期3 d,正试期28 d。
1.4 试验饲粮
参照NRC(2012)和《中国饲料成分及营养价值表(2021年第32版)》配制玉米-豆粕型基础饲粮。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.5 样品采集与处理
1.5.1 血样采集与处理
试验第28天,从每个组随机选取8头猪,前腔静脉采血10 mL,在室温下静置0.5 h,2 000 r/min离心10 min,制备血清,于-20 ℃冷冻保存,待测。
1.5.2 组织采集与处理
试验结束当天,从每个重复随机选取2头健康仔猪,放血屠宰后立即分离出心脏、肝脏、胰脏、肾脏和跖骨。取心脏、肝脏、胰脏和肾脏样品各2~3 g,在65 ℃烘至恒重,经室温回潮24 h后用研钵碾碎,备测。先用去离子水加热煮沸跖骨,然后剔除跖骨外层附着的肌肉和结缔组织,再用去离子水冲洗干净,于550 ℃灰化至恒重,最后取样约1 g,备测。
1.6 测定指标与方法
1.6.1 生长性能
试验开始和结束时,分别对每头仔猪进行空腹称重,计算每头仔猪的平均日增重(ADG)。试验期内,以重复为单位,记录总投料量和总余料量,计算每头仔猪的平均日采食量(ADFI)。根据每头仔猪的ADG和ADFI计算料重比(F/G)。
1.6.2 血清含铜酶活性
利用紫外-可见光分光光度计(Uvikon XS,Secomen,法国),采用比色法测定血清中铜蓝蛋白(CP)和铜锌超氧化物歧化酶(Cu/Zn-SOD)活性。测定所用试剂盒均购自南京建成生物工程研究所,严格按照试剂盒说明书操作。
1.6.3 血清和组织铜含量
利用原子吸收光谱仪(240FS,安捷伦,美国),按照《食品安全国家标准 食品中铜的测定》(GB 5009.13—2017)中第二法火焰原子吸收光谱法,测定血清、心脏、肝脏、胰脏、肾脏和跖骨中铜含量。
1.7 数据统计与分析
试验数据经Excel 2010处理后,利用SAS 9.4软件中的GLM程序进行双因素方差分析,差异显著时采用Duncan氏法进行多重比较,试验结果均用“平均值±标准差”表示,且以P<0.05为差异显著性判断标准。建立多元线性回归方程:Y=a0+a1X1+a2X2+a3X3(Y为所测指标,a0为截距,X1、X2和X3分别为硫酸铜、碱式氯化铜和柠檬酸铜形式的铜添加水平),以硫酸铜的生物学利用率为100%,根据斜率比法计算碱式氯化铜和柠檬酸铜相对于硫酸铜的生物学利用率,计算方法分别为(a2/a1)×100和(a3/a1)×100[10]。
2 结 果
2.1 不同铜源和铜添加水平对断奶仔猪生长性能的影响
由表2可知,饲粮铜源、铜添加水平及其交互作用对断奶仔猪ADG、ADFI和F/G均无显著影响(P>0.05)。柠檬酸铜组断奶仔猪末重、ADG和ADFI最高,料重比最低;30 mg/kg铜添加水平组断奶仔猪末重、ADG和ADFI最高,料重比最低,但与其他组差异均不显著(P>0.05)。
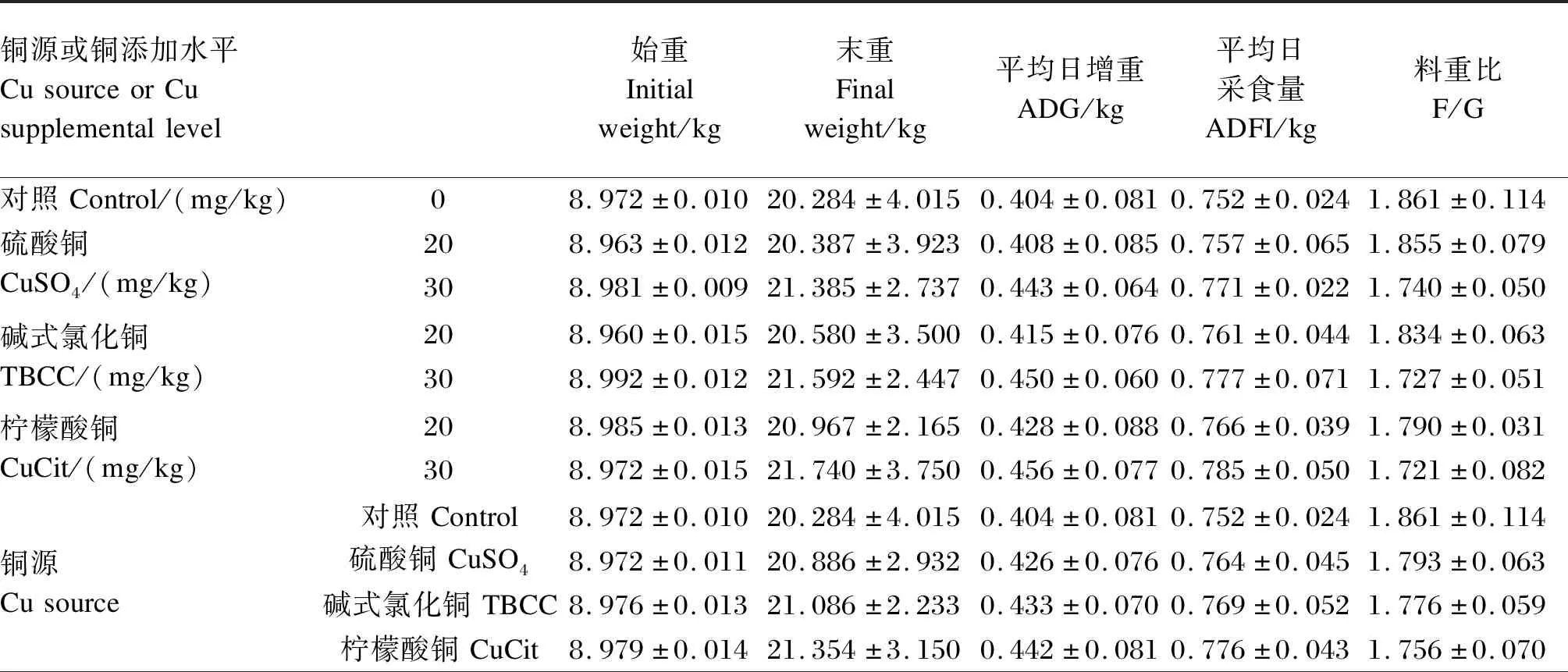
表2 不同铜源和铜添加水平对断奶仔猪生长性能的影响Table 2 Effects of different Cu sources and Cu supplemental levels on growth performance of weanling piglets
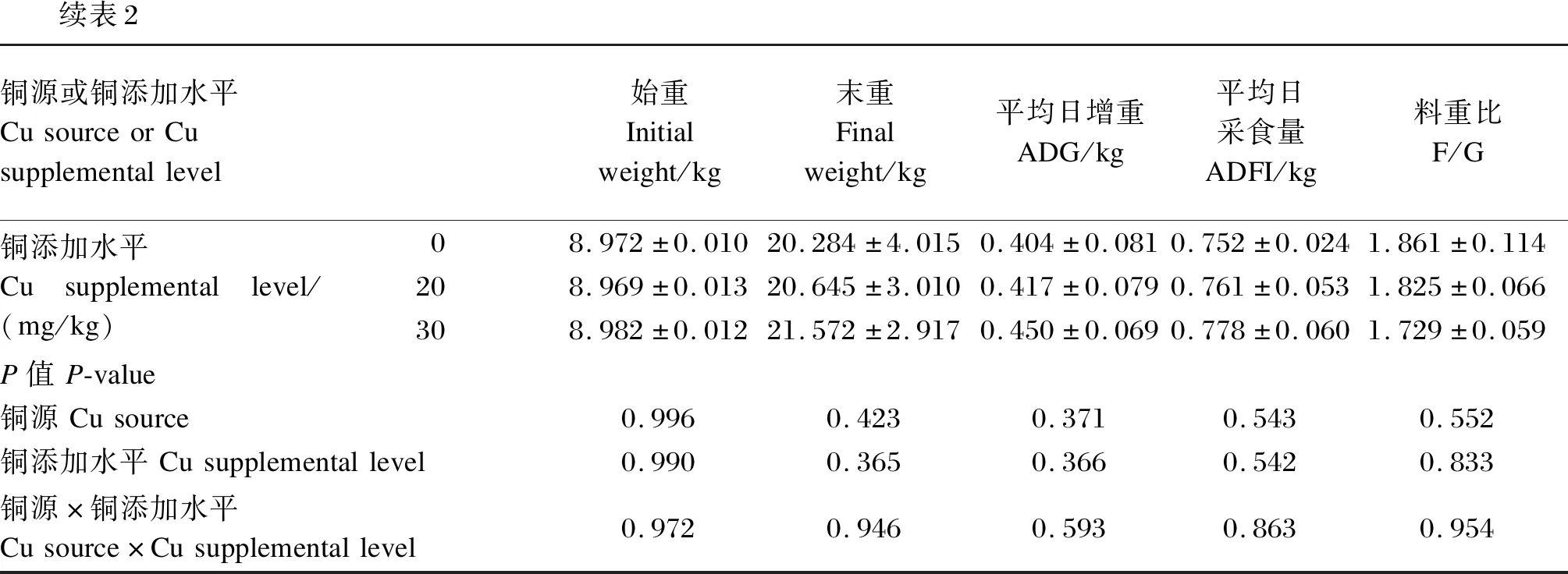
续表2铜源或铜添加水平CusourceorCusupplementallevel始重Initialweight/kg末重Finalweight/kg平均日增重ADG/kg平均日采食量ADFI/kg料重比F/G铜添加水平Cusupplementallevel/(mg/kg)08.972±0.01020.284±4.0150.404±0.0810.752±0.0241.861±0.114208.969±0.01320.645±3.0100.417±0.0790.761±0.0531.825±0.066308.982±0.01221.572±2.9170.450±0.0690.778±0.0601.729±0.059P值P-value铜源Cusource0.9960.4230.3710.5430.552铜添加水平Cusupplementallevel0.9900.3650.3660.5420.833铜源×铜添加水平Cusource×Cusupplementallevel0.9720.9460.5930.8630.954
2.2 不同铜源和铜添加水平对断奶仔猪血清铜含量与含铜酶活性的影响
由表3可知,饲粮铜源和铜添加水平对断奶仔猪血清铜含量具有显著影响(P<0.05),而对血清CP和Cu/Zn-SOD活性均无显著影响(P>0.05);饲粮铜源和铜添加水平的交互作用对断奶仔猪血清铜含量与含铜酶活性均无显著影响(P>0.05)。根据血清铜含量与饲粮铜添加水平建立的多元线性回归方程为:Y=0.215+0.077X1+0.085X2+0.093X3(R2=0.326,P=0.016)。式中,Y为血清铜含量;X1、X2和X3分别为饲粮中硫酸铜、碱式氯化铜和柠檬酸铜形式的铜添加水平。以断奶仔猪对硫酸铜的生物学利用率为100%,则断奶仔猪对碱式氯化铜和柠檬酸铜的相对生物学利用率分别为110.39%和120.78%。

表3 不同铜源和铜添加水平对断奶仔猪血清铜含量与含铜酶活性的影响Table 3 Effects of different Cu sources and Cu supplemental levels on serum Cu content and Cu-containing enzyme activities of weanling piglets
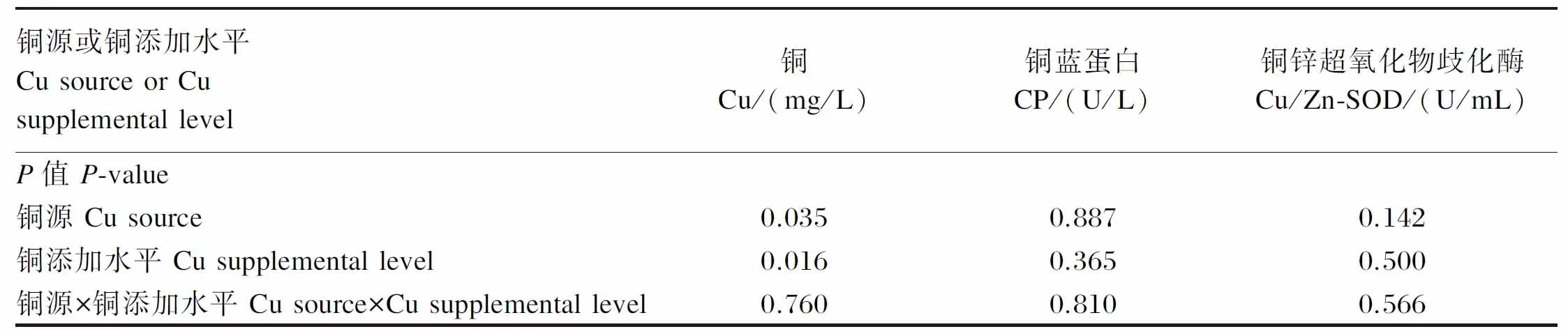
续表3铜源或铜添加水平CusourceorCusupplementallevel铜Cu/(mg/L)铜蓝蛋白CP/(U/L)铜锌超氧化物歧化酶Cu/Zn-SOD/(U/mL)P值P-value铜源Cusource0.0350.8870.142铜添加水平Cusupplementallevel0.0160.3650.500铜源×铜添加水平Cusource×Cusupplementallevel0.7600.8100.566
2.3 不同铜源和铜添加水平对断奶仔猪组织铜含量的影响
由表4可知,饲粮铜源和铜添加水平对断奶仔猪肝脏铜含量具有显著影响(P<0.05),而对心脏、肾脏、胰脏和跖骨铜含量均无显著影响(P>0.05);饲粮铜源和铜添加水平的交互作用对断奶仔猪组织铜含量无显著影响(P>0.05)。根据肝脏铜含量与饲粮铜添加水平建立的多元线性回归方程为:Y=5.415+0.593X1+0.708X2+0.807X3(R2=0.465,P=0.013)。式中,Y为肝脏铜含量;X1、X2和X3分别为饲粮中硫酸铜、碱式氯化铜和柠檬酸铜形式的铜添加水平。以断奶仔猪对硫酸铜的生物学利用率为100%,则断奶仔猪对碱式氯化铜和柠檬酸铜的相对生物学利用率分别为119.39%和136.09%。
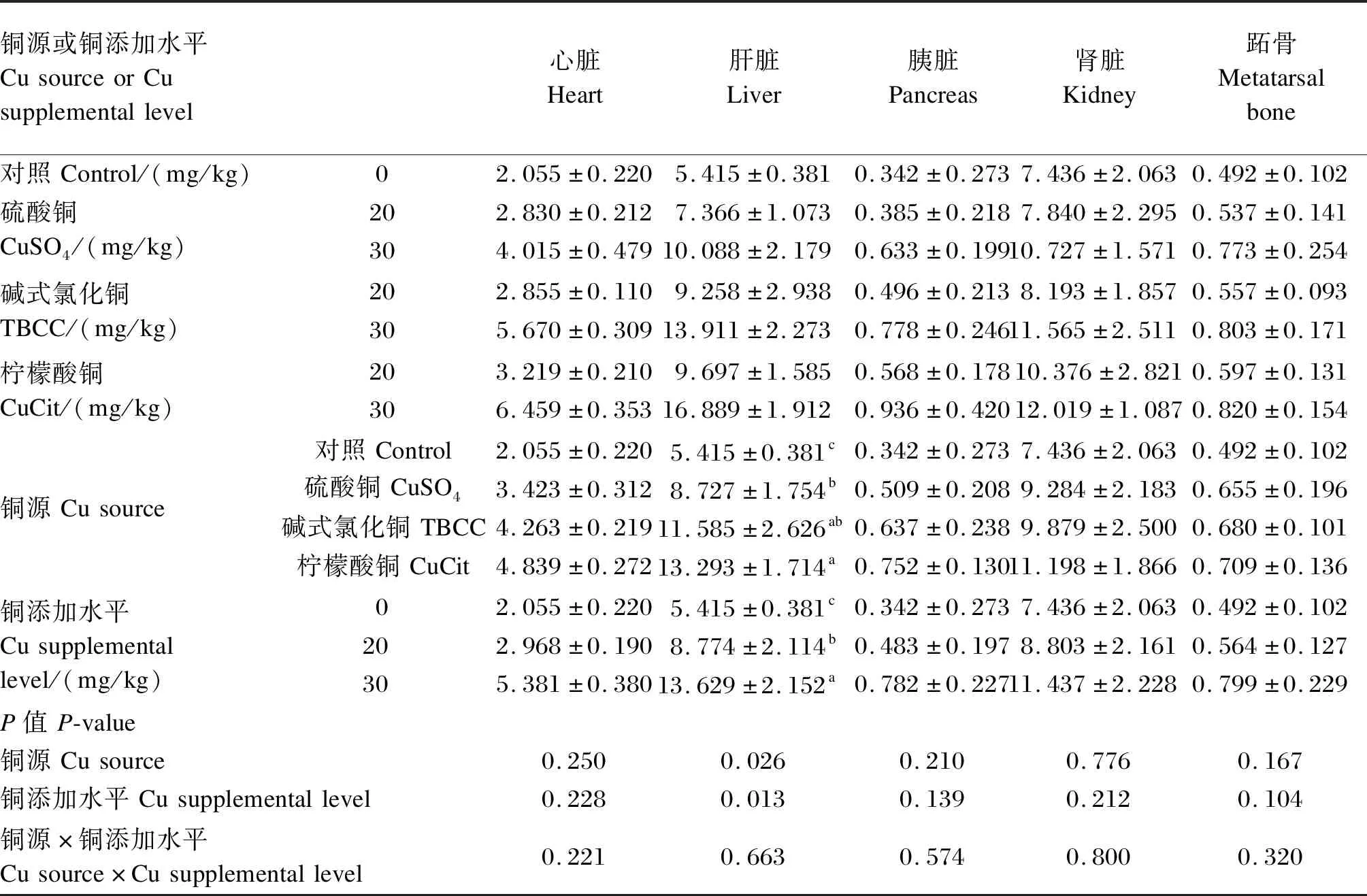
表4 不同铜源和铜添加水平对断奶仔猪组织铜含量的影响Table 4 Effects of different Cu sources and Cu supplemental levels on tissue Cu content of weanling piglets mg/kg
3 讨 论
3.1 不同铜源和铜添加水平对断奶仔猪生长性能的影响
铜作为动物机体必需的微量元素之一,对保证断奶仔猪健康生长具有极其重要的作用。实际生产中,缺铜容易导致仔猪产生共济失调、关节肿胀、骨质脆弱以及营养性贫血等症状,进而影响其生长速度[11-12]。研究证明,饲粮中额外添加125~250 mg/kg硫酸铜(以铜计,后同)能显著提高仔猪的生长性能[13-14]。然而,高铜的使用虽然对促进仔猪生长和提高饲料利用率有效,但长期添加会危害机体健康、降低动物产品品质,还会造成铜源浪费,以及带来养殖环境污染等安全隐患[15-17]。我国农业农村部发布的第2625号公告《饲料添加剂安全使用规范》规定,仔猪(体重≤25 kg)配合饲料中铜的最高限量(包含饲料原料本底值)为125 mg/kg。因而,在实现满足仔猪营养需要、改善饲料品质等预期目标的前提下,要减少饲粮中铜的用量。研究证实,低水平的有机铜完全可以满足仔猪对铜的营养需要,并且不会影响其生长性能[18-19]。Armstrong等[20]研究结果表明,仔猪饲粮中添加33、66或100 mg/kg柠檬酸铜与添加225 mg/kg硫酸铜具有同等促生长效果。Peng等[5]研究发现,饲粮中只需添加30 mg/kg柠檬酸铜就可以促进断奶仔猪生长。Yan等[6]进一步研究发现,饲粮中添加20 mg/kg柠檬酸铜与添加180 mg/kg硫酸铜相比,断奶仔猪的生长性能无显著差异。上述研究结果提示,以柠檬酸铜为铜源,饲粮中补充较低水平的铜即可满足仔猪的生长需要。本试验结果表明,饲粮中添加20或30 mg/kg硫酸铜、碱式氯化铜或柠檬酸铜,仔猪的ADG、ADFI和F/G均无显著差异,分析其原因可能是受铜的化学结构、饲粮中铜含量和猪的生长阶段等因素影响所致。因此,本试验中生长性能指标不适用于评价断奶仔猪对不同铜源的生物学利用率。
3.2 不同铜源和铜添加水平对断奶仔猪血清铜含量与含铜酶活性的影响
3.2.1 不同铜源和铜添加水平对断奶仔猪血清铜含量的影响
铜经过小肠吸收后进入血液,而血清中的铜含量可以反映其吸收率和利用率[21-22]。Pastorelli等[23]研究发现,饲粮中添加150 mg/kg硫酸铜可以提高断奶仔猪血清中的铜含量。Armstrong等[24]研究指出,断奶仔猪饲粮中添加15~125 mg/kg柠檬酸铜与添加250 mg/kg硫酸铜相比,血清铜含量差异并不显著。本试验结果显示,饲粮铜源和铜添加水平对断奶仔猪血清铜含量具有显著影响;通过多元线性回归方程计算得出:以血清铜含量为评价指标,碱式氯化铜和柠檬酸铜相对于硫酸铜(100%)的生物学利用率分别为119.39%和136.09%,说明断奶仔猪对柠檬酸铜的生物学利用率高于硫酸铜和碱式氯化铜。
3.2.2 不同铜源和铜添加水平对断奶仔猪血清含铜酶活性的影响
CP和Cu/Zn-SOD是动物体内主要的含铜酶,对调节机体的氧化与抗氧化平衡起着至关重要的作用[25]。血液中的铜主要分布于血浆和红细胞中,结合成CP的形式存在[26]。CP具有氧化酶的活性,能催化氧化多酚及多胺;同时CP还具有抗氧化的作用,可以防止组织中脂质过氧化物和自由基的生成[27-28]。Cu/Zn-SOD是一种抗氧化金属酶,能清除超氧阴离子自由基,防止自由基破坏细胞的组成、结构和功能,保护细胞免受氧化损伤[29-30]。本研究发现,饲粮中添加20或30 mg/kg硫酸铜、碱式氯化铜或柠檬酸铜对断奶仔猪血清CP和Cu/Zn-SOD活性均没有显著影响。本试验结果与Peng等[5]的研究结果一致,这可能是由于血清中作为CP和Cu/Zn-SOD活性中心的铜离子已经接近饱和,因而在不同铜源和铜添加水平组没有表现出明显差异。
3.3 不同铜源和铜添加水平对断奶仔猪组织铜含量的影响
铜在动物体内的分布十分广泛,血液中的铜经循环系统运输后到达机体各组织器官。本研究表明,仔猪体内肝脏中铜的含量最高,其次为肾脏和心脏,而胰脏和跖骨中铜的含量较低。研究发现,动物吸收的铜大部分贮存于肝脏,并且肝脏中的铜含量与饲粮中铜的添加形式和添加水平密切相关[31-32]。因此,肝脏铜含量常作为评价动物对不同铜源生物学利用率的敏感指标。目前,关于仔猪对不同铜源生物学利用率方面的研究较少。VanValin等[33]在牛上的研究结果表明,以肝脏铜含量为评价指标时,碱式氯化铜和赖氨酸铜相对于硫酸铜(100%)的生物学利用率分别为112%和103%。吴学壮等[34]以肝脏铜含量为敏感指标评价肉鸡对不同铜源的相对生物学利用率,结果发现,碱式氯化铜和蛋氨酸铜相对于硫酸铜(100%)的生物学利用率分别为127.61%和137.64%。本试验结果表明,断奶仔猪肝脏铜含量与饲粮铜添加水平之间存在显著的线性回归关系,采用肝脏铜含量为评价指标,碱式氯化铜和柠檬酸铜相对于硫酸铜(100%)的生物学利用率分别为119.39%和136.09%。本试验结果与VanValin等[33]和吴学壮等[34]的研究结果相似,提示断奶仔猪对柠檬酸铜和碱式氯化铜的生物学利用率高于硫酸铜。但是,Liu等[35]以肝脏铜含量和胆汁铜含量为评价指标时,却发现肉鸡对有机铜和无机铜的生物学利用率没有显著差异,究其原因可能是因为机体对有机铜和无机铜的吸收方式存在差异。动物消化道对铜的吸收是机体利用铜的前提,因此,有必要进一步研究不同铜源在动物消化道中的吸收规律及其作用机制。
4 结 论
本试验条件下,断奶仔猪对低铜饲粮(铜添加水平为20或30 mg/kg)中3种铜源的相对生物学利用率表现为柠檬酸铜>碱式氯化铜>硫酸铜。
