碱性磷酸酶与前白蛋白比值对肝细胞癌根治性切除术后患者预后及并发症的预测价值
2023-02-08陈胜灯牟志强陈忠垚
陈胜灯, 牟志强, 陈忠垚, 温 剑, 李 秋
西南医科大学附属医院 普通外科(肝胆), 四川 泸州 646000
原发性肝癌是目前全世界第6大常见恶性肿瘤,是肿瘤相关第3大死因[1],其发病率在全球范围内呈上升趋势[2-3]。其中,肝细胞癌(HCC)是肝癌中最常见的病理类型,占75%~85%[4],HCC根治性切除术是一种潜在治愈方法[5],但存在肿瘤复发及长期生存状况不佳等问题[6]。根治性切除术后并发症的发生率为30.9%~42.6%,这不仅会增加患者的住院时间和经济负担,而且对HCC的预后产生不良影响[7-11]。
营养不良和全身炎症反应是HCC患者预后的重要危险因素。碱性磷酸酶(ALP)与前白蛋白(PA)比值(alkaline phosphatase-to-prealbumin,APR)可用于患者营养和炎症状态的评估,已被证实与胃癌的预后相关[12],但APR对HCC的预测价值尚无相关报道。本文回顾性分析217例HCC患者的临床病理资料,探讨术前APR与HCC根治性切除术后并发症及预后的关系。
1 资料与方法
1.1 研究对象 回顾性分析2013年1月—2021年8月于西南医科大学附属医院肝胆外科因HCC行根治性切除术的400例患者的临床病理资料。纳入标准:(1)临床病理资料完整并获得随访;(2)术前无新辅助化疗、放疗或其他针对恶性肿瘤的治疗病史;(3)首次行根治性切除术,术后病理证实为HCC,手术切缘阴性。排除标准:(1)采血前1周内曾服用对ALP水平有显著影响药物;(2)合并新近发生的骨折;(3)存在肿瘤的远处转移;(4)合并HCV感染;(5)合并其他恶性肿瘤;(6)合并术前肿瘤破裂。
1.2 临床资料收集 (1)术前变量:患者的性别、年龄、合并疾病(高血压、糖尿病、慢性乙型肝炎)、Child-Pugh分级、CNLC分期、实验室检查结果(TBil、ALT、ALP、PA、Alb、AFP);(2)术中及术后情况:手术途径(开腹、腹腔镜)、切除范围、术中输血、手术时间、术中出血量及术后并发症发生情况;(3)术后病理学检查情况:肝硬化、肿瘤最大径、肿瘤数目、肿瘤切缘及肿瘤的分化情况;(4)APR采用以下公式计算:APR=[ALP(U/L)]/[PA(mg/L)]
1.3 随访 采用门诊与电话相结合的方式进行随访,随访时间截至2021年11月4日。术后1年内每3个月随访1次,术后1年后每6个月随访1次。随访内容包括:肝肾功能、甲胎蛋白和腹部超声检查,对于疑似复发的病例,进一步行CT或MRI检查。总生存期(overall survival,OS)定义为手术日期到随访截止日期,或因肿瘤复发及转移导致死亡的日期。无复发生存期(recurrence-free survival,RFS)定义为手术日期到随访截止日期,或首次复发日期。
1.4 术后并发症 术后并发症定义为术后住院期间出现的腹腔出血、消化道出血、胆漏、乳糜漏、胸腔积液、腹水、肝衰竭[13]、切口感染、肺部感染、腹腔感染、菌血症表现。采用Clavien-Dindo分级标准对术后并发症进行分级,将 Ⅰ、Ⅱ 级的术后并发症归为一般并发症,将Ⅲ、Ⅳ、Ⅴ级的术后并发症归为重症并发症[14-15]。
1.5 统计学方法 应用SPSS 25.0、MedCalc 18.2及X-Tile软件进行统计分析。定性资料组间比较采用χ2检验。采用Kaplan-Meier法估计生存率并绘制生存曲线,通过Log-rank检验比较组间差异。
采用Cox回归模型分析影响预后的独立因素。采用Logistic模型分析影响术后重症并发症的独立因素。通过受试者工作特征曲线(ROC曲线)判断对术后重症并发症的预测价值,ROC曲线下面积(AUC)的比较采用配对比较的方法。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 按照纳入和排除标准,共有217例患者进入研究,其中男189例(87.1%),女28例(12.9%),平均年龄(53.6±10.9)岁。高血压36例(16.6%),无高血压181例(83.4%);糖尿病24例(11.1%),无糖尿病193例(88.9%);HBV感染211例(97.2%),无HBV感染6例(2.8%)。
2.2 最佳截断值的确定 X-Tile统计软件确定APR的最佳截断值为0.5,以最佳截断值为界,将患者分为低APR组(APR<0.5)111例,高APR组(APR≥0.5)106例。
2.3 术前APR与HCC患者临床病理特征的关系 术前高APR组与低APR组相比,在ALT、Alb、CNLC分期、手术途径、肿瘤数量、肝硬化、术后出现并发症及重症并发症的差异有统计学意义(P值均<0.05)。而两者性别、年龄、高血压、糖尿病、慢性乙型肝炎、TBil、AFP、Child-Pugh分级、输血、术中出血量、肿瘤大小、分化程度、手术切除范围及手术时间的差异无统计学意义(P值均>0.05)(表1)。
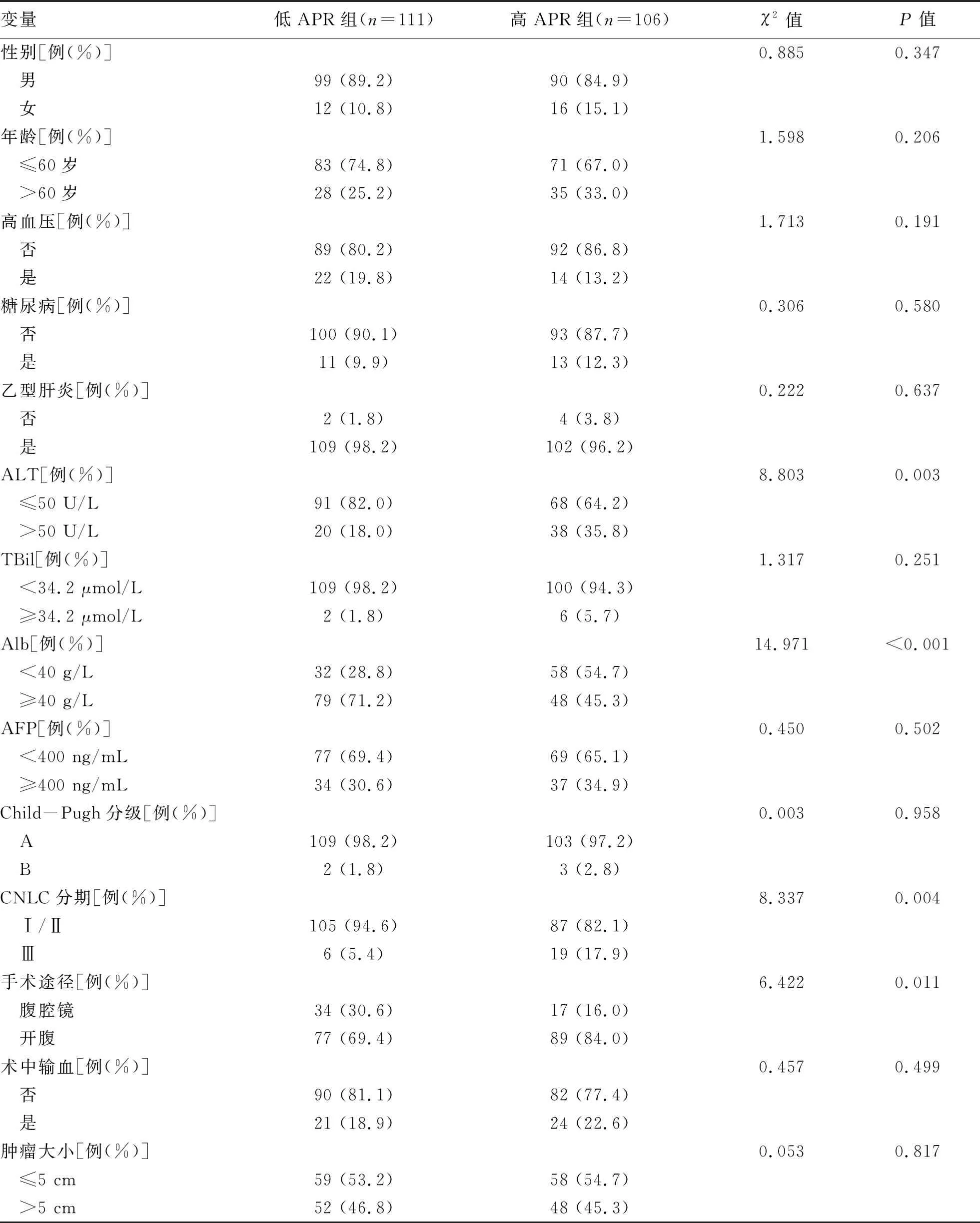
表1 术前APR与HCC患者的临床病理特征的关系
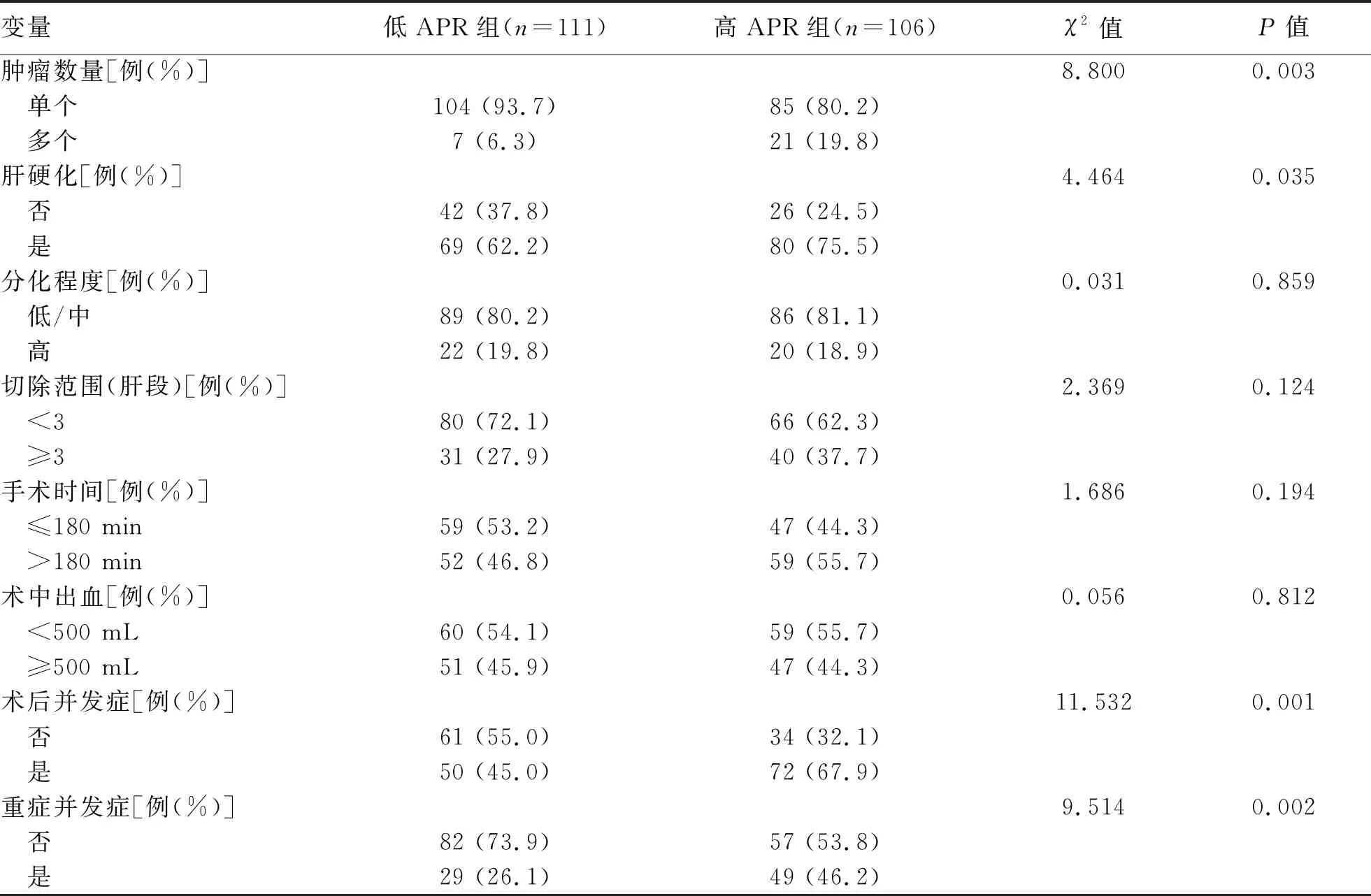
续表1
2.4 HCC根治性切除术后患者的OS及其影响因素 217例患者中,随访期间因HCC复发而死亡的74例,1、3、5年生存率分别为 82.7%、66.3%和 59.0%。单因素分析结果显示,AFP、CNLC分期、肿瘤大小、切除范围、APR、手术时间和术后并发症与HCC根治性切除术患者的OS相关(P值均<0.05)。多变量Cox回归分析显示,AFP、CNLC分期、肿瘤大小和APR水平是HCC根治性切除术后患者总生存期的独立预后因素(P值均<0.05)(表2)。
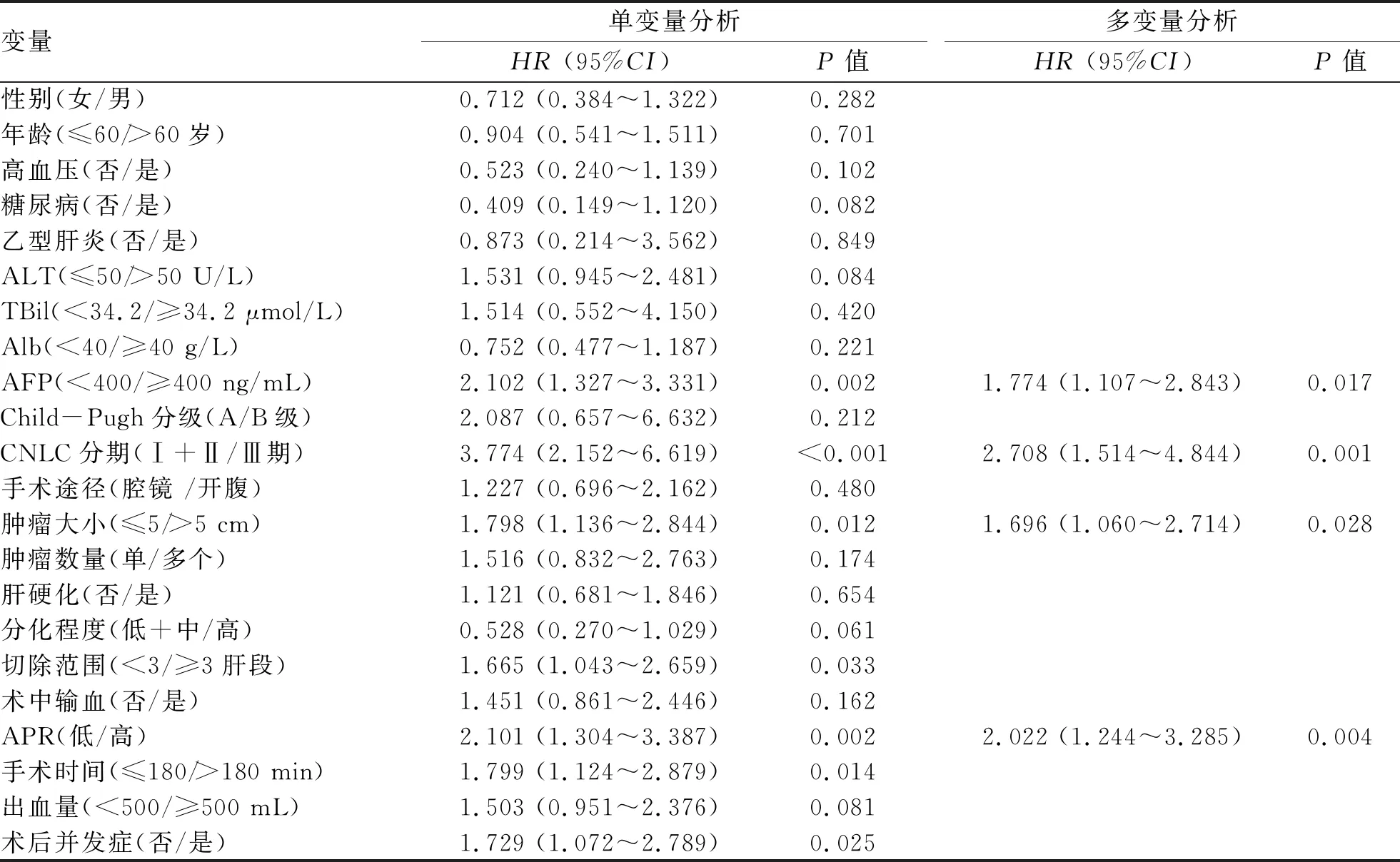
表2 HCC患者OS的单变量及多变量Cox分析
低APR组中因HCC复发而死亡的患者有26例,1、3、5年生存率为86.0%、74.9%、71.3%;高APR组中因HCC复发而死亡的患者48例,1、3、5年生存率为79.2%、57.5%、47.0%。单变量生存分析显示,低APR组和高APR组的生存率差异有统计学意义(χ2=9.825,P=0.002)(图1)。
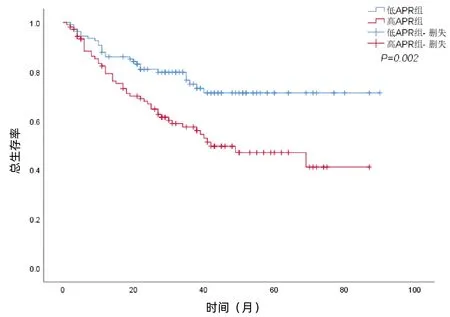
图1 HCC切除术后患者OS的生存曲线
2.5 HCC根治性切除术后患者的RFS及其影响因素 217例患者中,随访期间复发85例,1、3、5年无复发生存率分别为 79.4%、62.0%和 52.7%。单因素分析结果显示,AFP、CNLC分期、肿瘤大小、APR、手术时间和术后并发症与HCC根治性切除术患者的RFS有关(P值均<0.05)。多因素Cox分析结果显示, CNLC分期、肿瘤大小和APR水平是HCC根治性切除术后患者RFS的独立预后因素(P值均<0.05)(表3)。
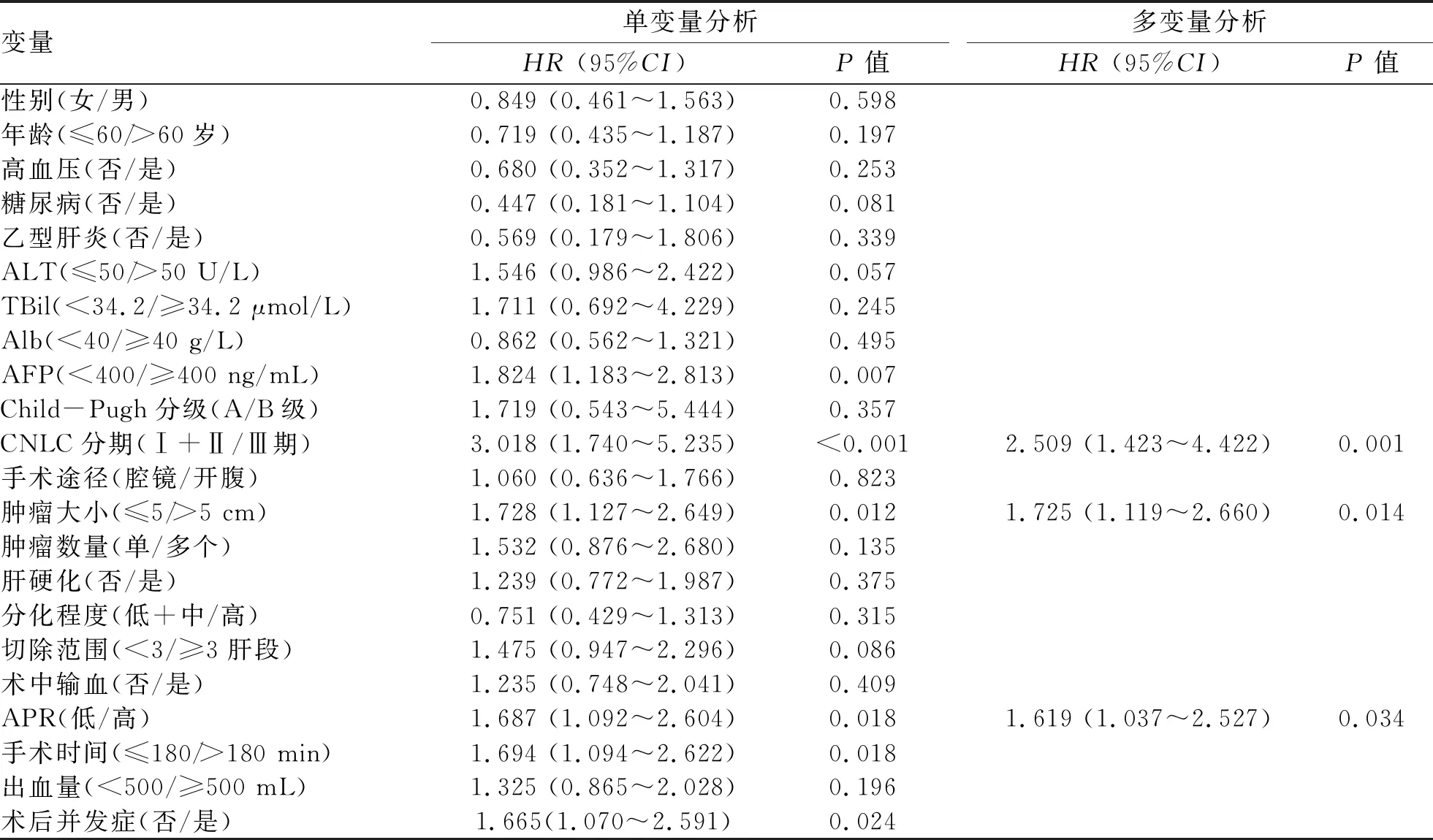
表3 HCC患者RFS的单变量及多变量Cox分析
低APR组111例,随访期间HCC复发34例,1、3、5年无复发生存率为82.3%、69.4%、61.3%;高APR组106例,随访期间HCC复发51例,1、3、5年无复发生存率为76.2%、54.4%、44.2%。单变量生存分析显示,低APR组和高APR组无复发生存率的差异有统计学意义(χ2=5.769,P=0.016)(图2)。
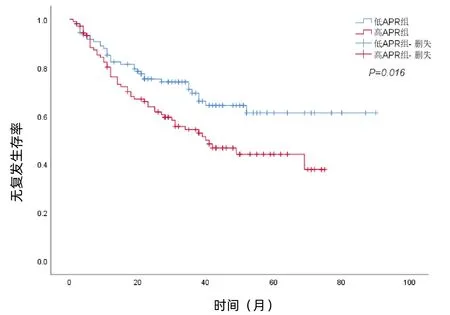
图2 HCC切除术后患者RFS的生存曲线
2.6 术后并发症发生的相关因素 56.2%(122/217)的患者术后发生并发症,重症并发症的发生率为35.9%(78/217),包括腹腔出血7例、消化道出血15例、胆漏7例、乳糜漏1例、胸腔积液47例、腹水45列、肝衰竭54例、切口感染7例、肺部感染13例、腹腔感染3例、菌血症2例。单因素分析结果显示,高血压、ALT水平、CNLC分期、手术途径、肝硬化和APR水平是HCC术后重症并发症发生的相关因素(P值均<0.05)。将以上变量纳入多因素Logistic回归分析结果显示,高血压、开腹手术、肝硬化、高APR水平是HCC术后重症并发症发生的独立危险因素(P值均<0.05)(表4)。
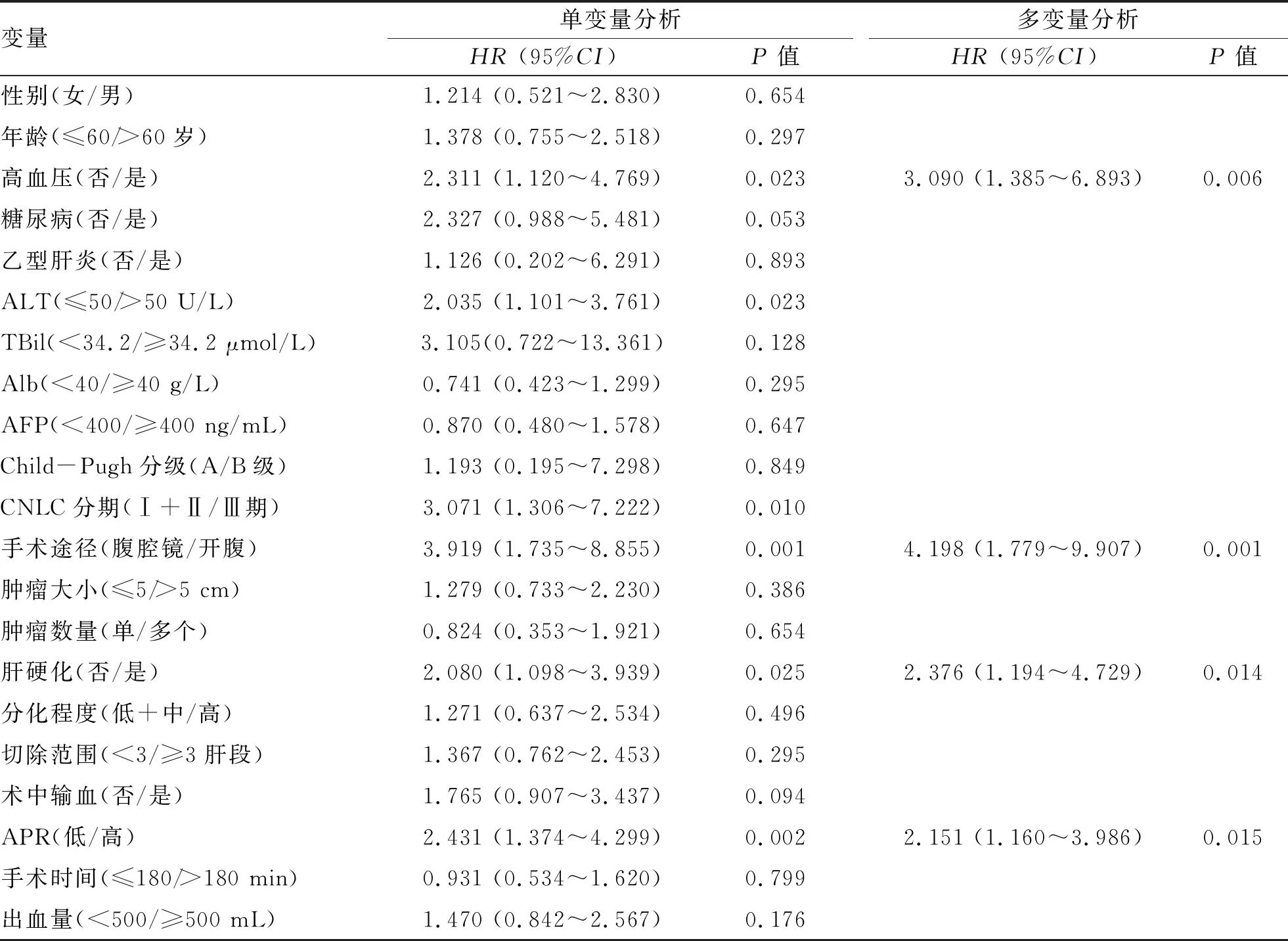
表4 HCC术后重症并发症发生相关因素的单变量及多变量回归分析
绘制术前APR、ALP和PA预测术后重症并发症发生的ROC曲线(图 3),AUC分别为0.625(95%CI:0.547~0.702),0.613(95%CI:0.534~0.693)和0.554(95%CI:0.474~0.634)。其中,APR与PA的差异具有统计学意义(Z=2.164,P<0.05)。
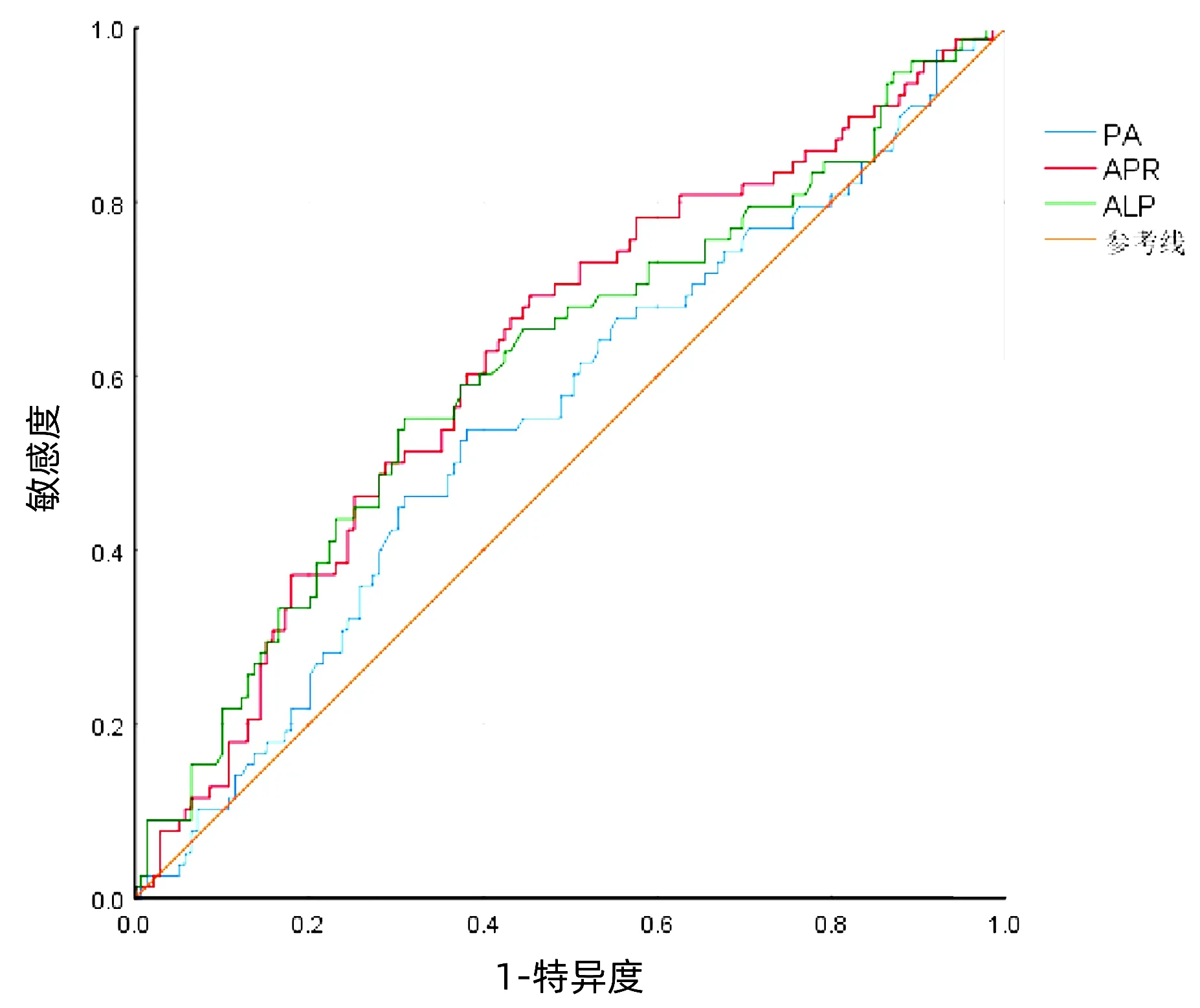
图3 HCC术后重症并发症的ROC曲线
3 讨论
ALP广泛分布于人的肝、骨、肠、肾、胎盘和多种肿瘤中, 具有诱导有机焦磷酸盐水解的催化功能,在调节炎症反应、免疫功能、矿物质代谢和血管钙化中发挥重要作用[16-18]。ALP可用于HCC破裂预测、肿瘤成像及骨肿瘤鉴别[19-21],与食管癌、胃癌、胰腺癌、结直肠癌、鼻咽癌、非小细胞肺癌、前列腺癌和肾癌的预后相关[12,22-24]。
PA,也称为转甲状腺素,主要在肝脏产生,是一种结合和运输甲状腺激素和维生素A的蛋白[25]。与白蛋白相比,PA的生物半衰期较短,几乎不受外源性白蛋白补充剂的影响[26],故能更客观地反映患者近期营养状况和肝病严重程度,将其纳入术前评估,可对手术进行风险分层、预测术后并发症[27-34]。此外,PA的合成受到炎症环境的抑制作用,故能反映机体的炎症反应强度[27,35]。有研究[30,36-37]表明HCC患者术前较低的PA水平与较差的预后相关。
APR作为ALP与PA的比值,首次由Li等[12]提出,并证明APR是胃癌术后预后的独立危险因素。本研究中,APR水平与患者临床病理特征关系的分析结果显示,高APR与患者较高的CNLC分期、肝硬化萎缩、肿瘤数目及术后并发症有关。李长贤等[38]研究显示,不同CNLC分期HCC患者的术后复发模式及预后不同,肿瘤的数目是影响患者长期生存的独立因素。Kim等[39]研究发现,肝硬化是HCC预后和复发的重要因素。有研究[7,9]显示,术后并发症可影响HCC术后的长期生存及早期复发。本研究结果显示,术前APR与HCC患者根治性切除术后预后相关,生存曲线结果提示高APR、低APR两组患者总生存率及无复发生存率差异有统计学意义(P<0.05)。多变量Cox回归分析显示,APR为HCC根治性切除术后患者死亡及复发的独立预后因素(P<0.05)。
高APR组术后重症并发症发生率为46.2%,明显高于低APR组的26.1%(P<0.05),笔者提出可以利用APR预测HCC术后重症并发症的发生。经单因素及多因素Logistic分析显示,APR是HCC根治性切除术后重症并发症的独立预后因素。APR与HCC术后重症并发症关系的AUC为0.625,高于ALP、PA,其中APR与PA的AUC有明显差异,说明采用APR预测术后重症并发症的发生有一定的准确性。
APR在一定程度上反映了HCC患者的全身炎症反应、机体免疫力及营养状态。高APR患者可能存在较强的全身炎症反应、营养不良、免疫功能低下、肿瘤细胞较强侵袭性等情况,暗示患者术后预后不良。对于此类患者,术后应密切随访,必要时可采取更加积极的治疗策略。但目前APR与HCC间的分子机制尚不清楚,有待进一步研究。本研究样本量较小,为单中心回顾性研究,结论尚需多中心、前瞻性研究结果来证实。
伦理学声明:本研究于2022年5月30日通过西南医科大学第一附属医院伦理委员会审批,批号:KY2022194,均取得所有患者或家属知情同意。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:陈胜灯负责选题,收集分析资料,撰写文章;牟志强、陈忠垚参与选题,收集资料;温剑、李秋指导撰写文章,提供修改意见并最终定稿。
