肝癌肝切除术后感染风险预测模型的建立与评价
2023-02-08朱明强杨大帅熊祥云裴俊鹏丁佑铭
朱明强, 杨大帅, 熊祥云, 裴俊鹏, 彭 阳, 丁佑铭
武汉大学人民医院 肝胆外科, 武汉 430060
肝癌位居世界常见恶性肿瘤第六位,是导致癌症相关死亡的第三大原因,绝大多数为肝细胞癌[1-2]。肝切除术仍然是治疗原发性肝癌的一线治疗方法[3-4]。随着患者选择、手术技术和围手术期护理的改进,肝切除术后病死率有所下降,但术后并发症的发生率(20%~70%)仍然很高[5-6]。有研究[7-9]报道,术后感染发生率为5%~20%,术后合并感染的患者预后较差。既往有关肝切除术后感染并发症的风险预测模型存在样本量较小、仅关注腹腔内感染与术后总并发症等局限性[10-11]。因此,本研究分析了肝癌肝切除术后发生感染的影响因素并建立了列线图风险预测模型,以期及时发现高风险患者并优化肝癌患者的围手术期管理,从而改善预后。
1 资料与方法
1.1 研究对象 回顾性收集2020年1月—2022年4月本院肝胆外科行肝癌肝切除术患者的临床资料。纳入标准:(1)病理诊断为肝癌且临床资料完整;(2)年龄>18岁;(3)首次行肝切除术患者;(4)肝功能Child-Pugh分级A或B 级且无远处转移。排除标准:(1)肝癌复发患者;(2)行二步肝切除、联合行胆肠吻合术的肝癌患者;(3)资料不完整者。根据术后早期是否发生感染,将所有患者分为术后感染组和非感染组。
1.2 术后感染的诊断标准 术后感染性并发症包括:(1)肺部感染。患者有咳嗽、发热等临床表现,肺部听诊有湿啰音,影像学检查提示肺部炎症或痰培养阳性;(2)腹腔感染。腹腔引流管内有脓性分泌液或超声穿刺证实腹腔内脓肿的存在;(3)切口感染。切口出现红、肿、热、痛等感染症状或者出现脓性分泌物;(4)泌尿系感染。患者出现尿频、尿痛等感染症状或中段尿细菌培养阳性。
1.3 收集指标 (1)一般资料:性别、年龄、高血压、糖尿病、乙型肝炎、肝硬化、肿瘤数目、肿瘤大小、Edmonson分级等;(2)术前血液学指标:术前甲胎蛋白(AFP)、ALT、AST、TBil、Alb、PT、PLT、SCr、总胆固醇、乳酸脱氢酶、ALP、ALBI评分、中性粒细胞与淋巴细胞比值(NLR)、控制营养状态评分(CONUT);(3)手术相关指标:手术部位、手术方式、肝段切除数量、引流管放置时间、美国麻醉医师学会(ASA)分级、手术时间、术中出血量、术中补液量、无肝期、血浆输注、红细胞输注、术后胆漏等。CONUT评分基于血清Alb、血清总胆固醇、总淋巴细胞计数3项参数计算,具体标准为:(1)血清Alb分为≥35.0 g/L,30.0~34.9 g/L,25.0~29.9 g/L与<25.0 g/L共4个等级,分别为0分、2分、4分和6分。(2)血清总胆固醇分为≥180 mg/dL,140~179 mg/dL,100~139 mg/dL,<100 mg/dL共4个等级,分别计0分、1分、2分和3分。(3)外周血淋巴细胞计数分为4个水平,≥1.60×109/L,(1.20~1.59)×109/L,(0.80~1.19)×109/L及< 0.80×109/L,分别为0分、1分、2分和3分。3项参数的得分相加即为总CONUT评分。
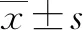
2 结果
2.1 肝癌术后发生早期感染的情况 本研究共纳入167例肝癌肝切除术患者,其中男性139例,女性28例,年龄29~79岁,平均(59.98±10.72)岁。术后感染组包括肺部感染13例,腹腔感染8例,切口感染4例,泌尿系统感染3例。在167例肝癌肝切除术患者中,共有28例(16.8%)发生术后感染。
2.2 术后感染单因素分析 比较术后感染组和非感染组的临床资料,筛选有关术后感染的影响因素。两组在糖尿病、手术方式、术前NLR、CONUT≥4分、手术时间、补液量、肝门阻断时间、血浆输注、红细胞输注、术中失血量、引流管放置时间、术后胆漏方面差异均有统计学意义(P值均<0.05)(表1)。
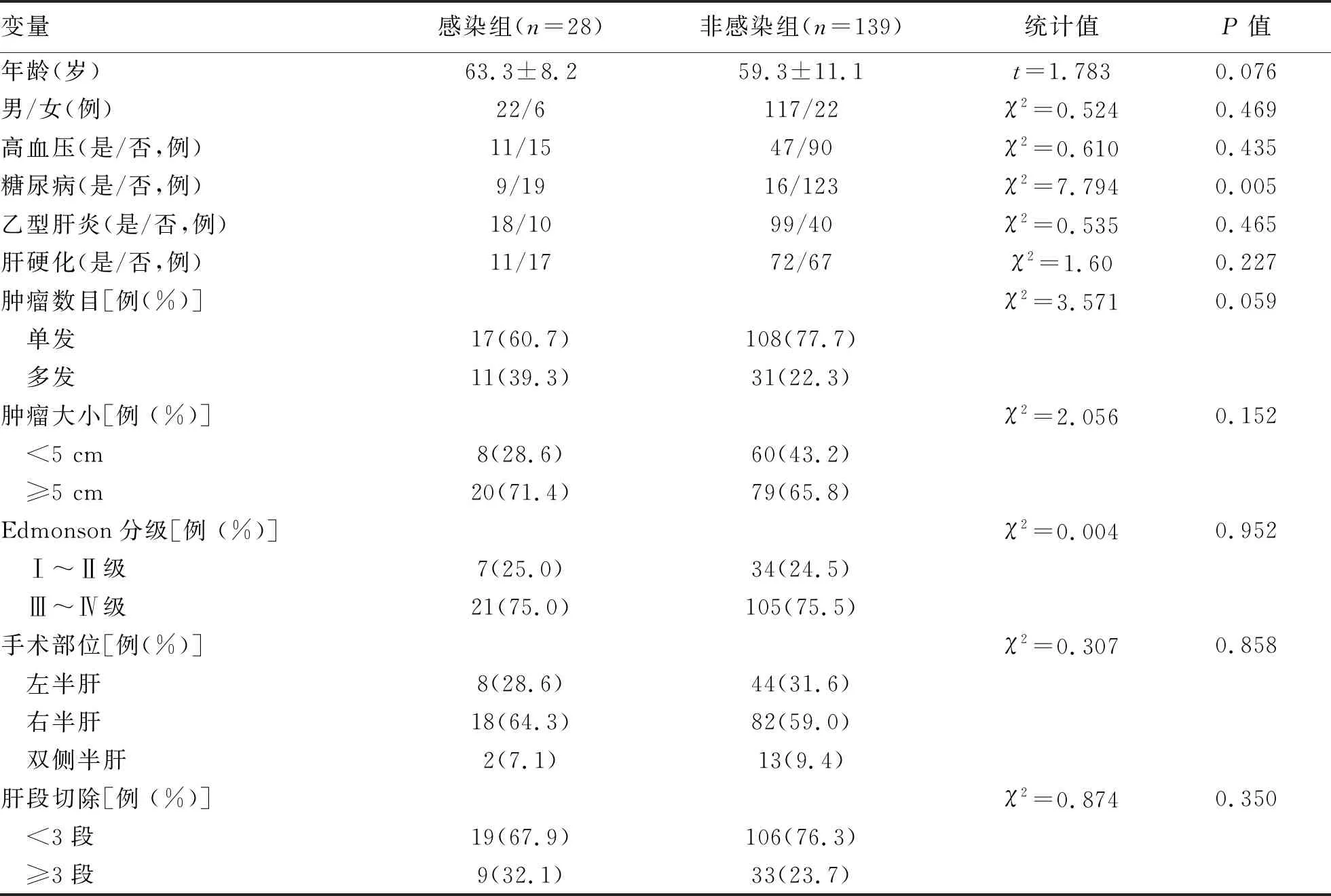
表1 肝切除术后感染影响因素的单因素分析
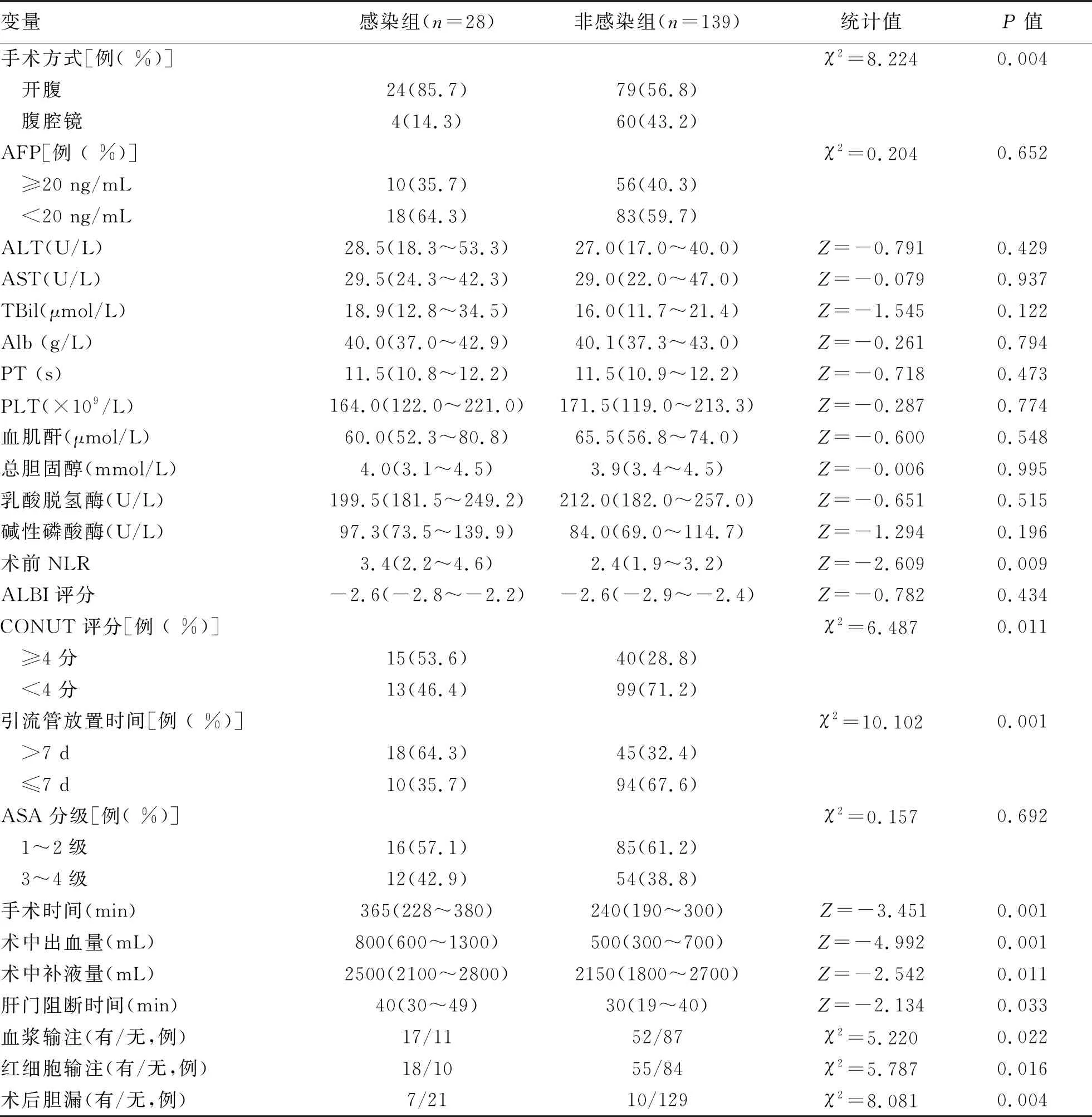
续表1
2.3 多因素分析 以肝切除术后是否发生感染并发症作为因变量,将单因素分析中P<0.05的变量作为自变量进行非条件二元Logistic回归分析。分析结果显示,糖尿病、CONUT≥4分、手术时间、术前NLR、术中失血量、引流管放置时间>7 d这6个变量是术后发生感染的独立影响因素(P值均<0.05)(表2)。
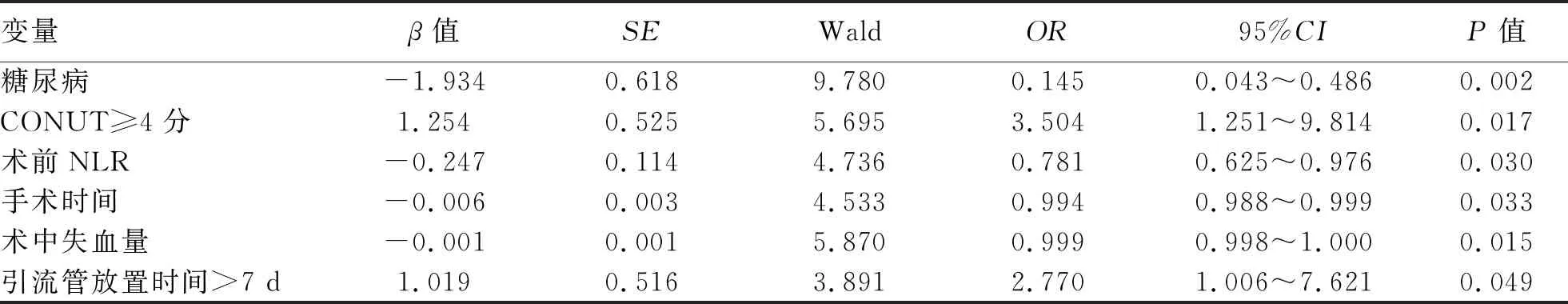
表2 肝切除术后感染影响因素的多因素分析
2.4 列线图模型的建立与验证 基于独立影响因素构建个体化列线图风险预测模型(图1),并绘制校准曲线和ROC曲线。训练集和验证集的校准曲线显示预测值与实际观测值基本一致,表明列线图模型预测的准确度较好(图2、3)。训练集和验证集的ROC曲线下面积分别为0.848、0.853,表明模型的区分度较好(图4、5)。
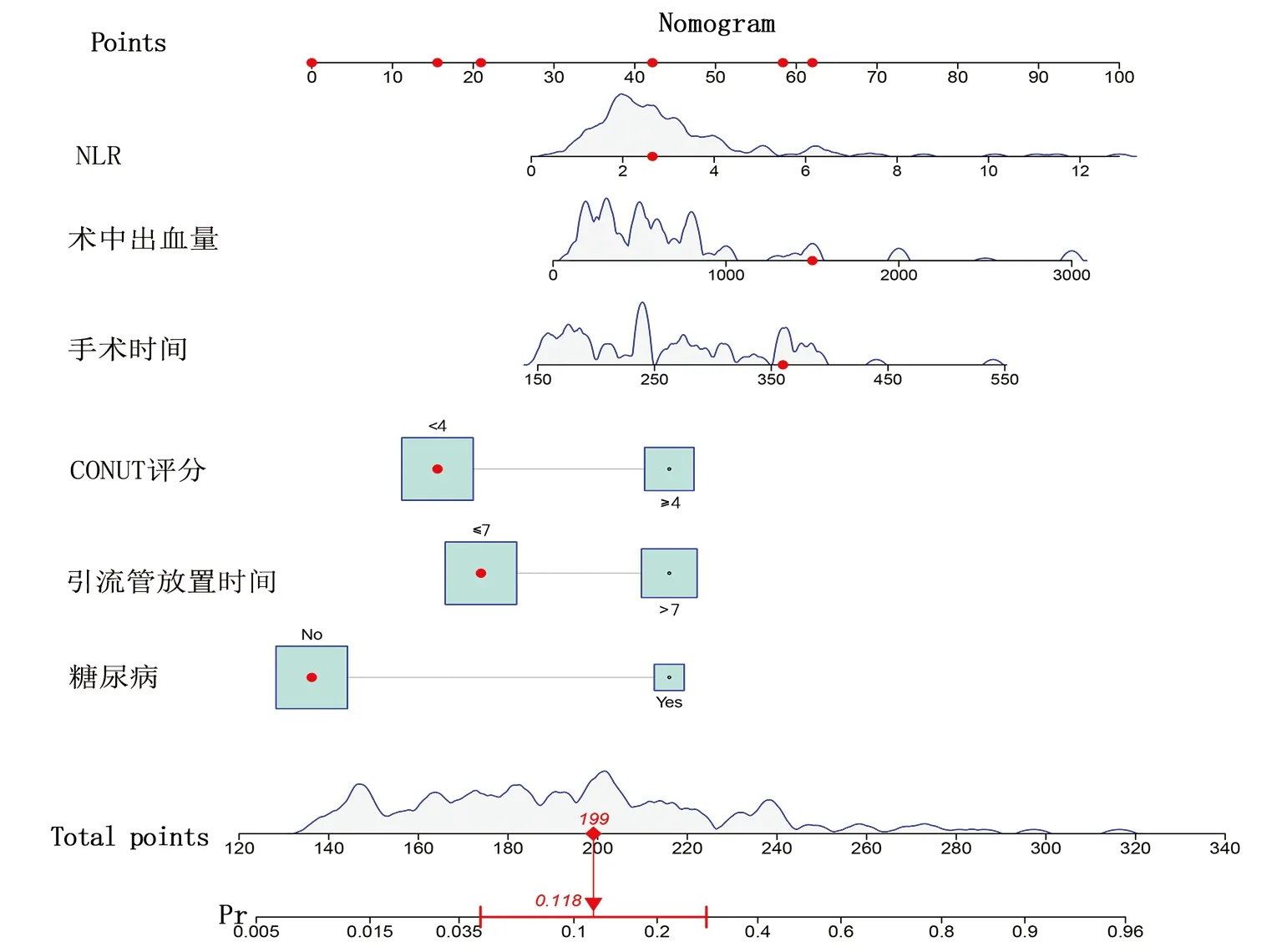
图1 肝癌肝切除术后感染发生风险的列线图模型
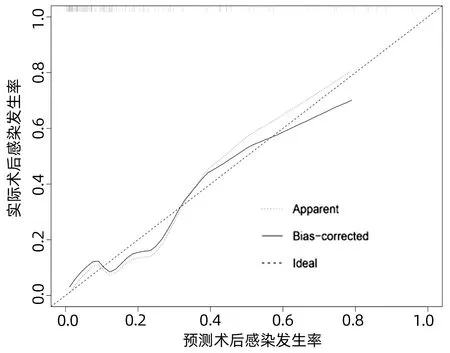
图2 训练集校准曲线
3 讨论
术后感染是肝切除术较常见的并发症,与患者的预后密切相关[12]。本研究167例肝癌肝切除患者中,术后感染并发症的发生率为16.8%。笔者建立的肝切除术后感染的可视化列线图风险预测模型利于及时筛查高风险患者以及优化肝癌患者的围手术期管理。肝癌肝切除术后感染可能与手术创伤和抗感染力度不足以及内源性因素等有关[13]。全身状况差、免疫功能低下的肝癌患者是术后感染的高危人群[14]。由于临床抗生素的滥用,致病菌菌谱可发生变化,多重耐药菌的出现可使院内感染的发生率增加,同时导致抗感染治疗更加棘手[15]。
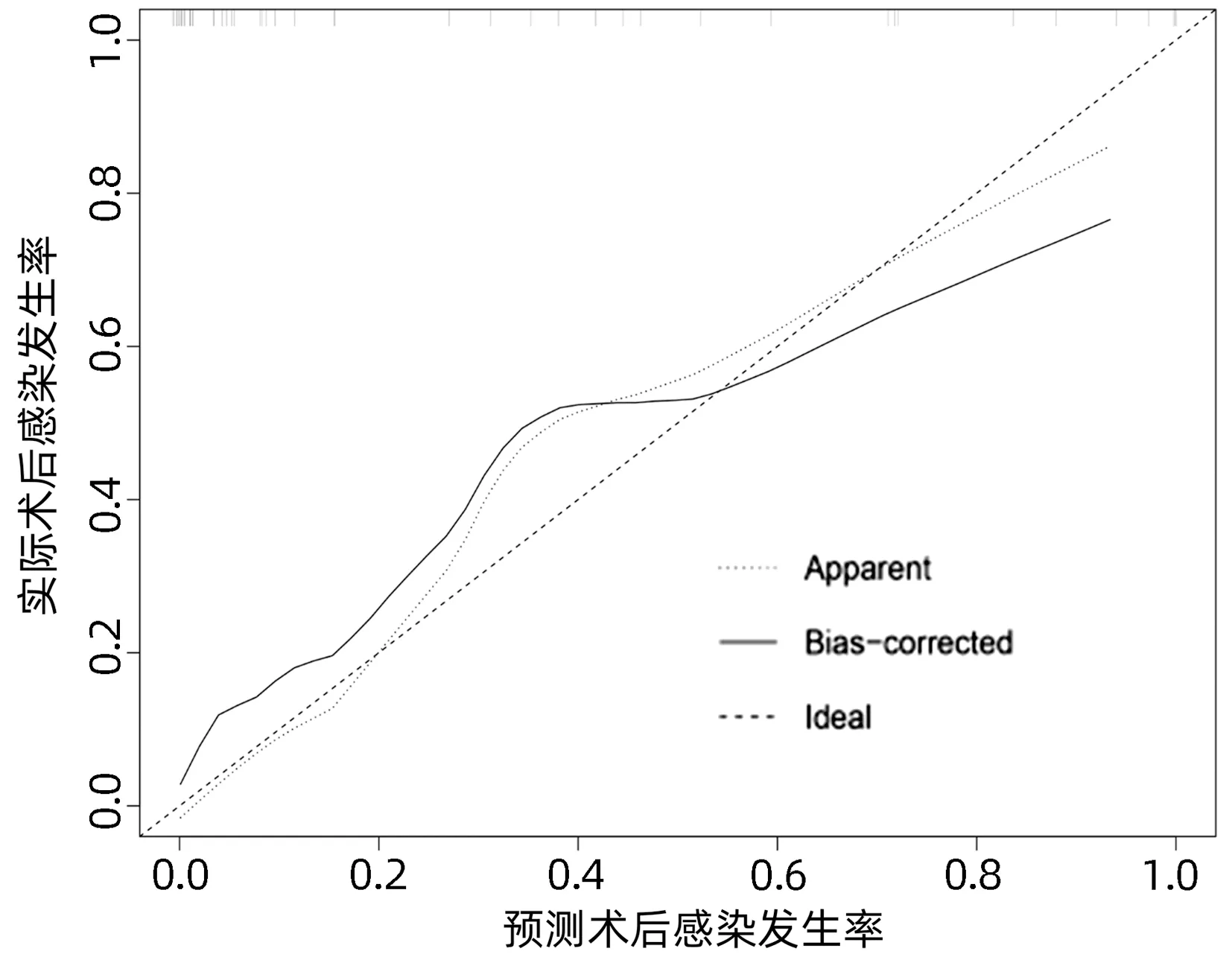
图3 验证集校准曲线
目前,有关肝癌肝切除术后总体并发症风险预测模型已有一些研究[16-17],但结合营养评分、NLR和术中预测因子的肝切除术后感染的个性化列线图风险预测模型较少。本研究所建立预测模型由糖尿病、CONUT评分、手术时间、术前NLR、术中失血量、引流管放置时间这6个变量组成,包含术前、术中及术后预测因子,这将有利于降低患者术后感染的发生率、指导肝癌患者术后治疗与康复计划、降低患者的经济负担。
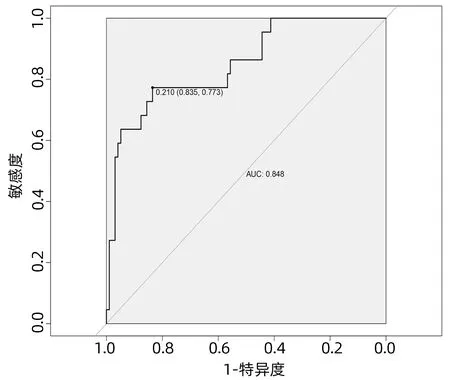
图4 训练集ROC曲线
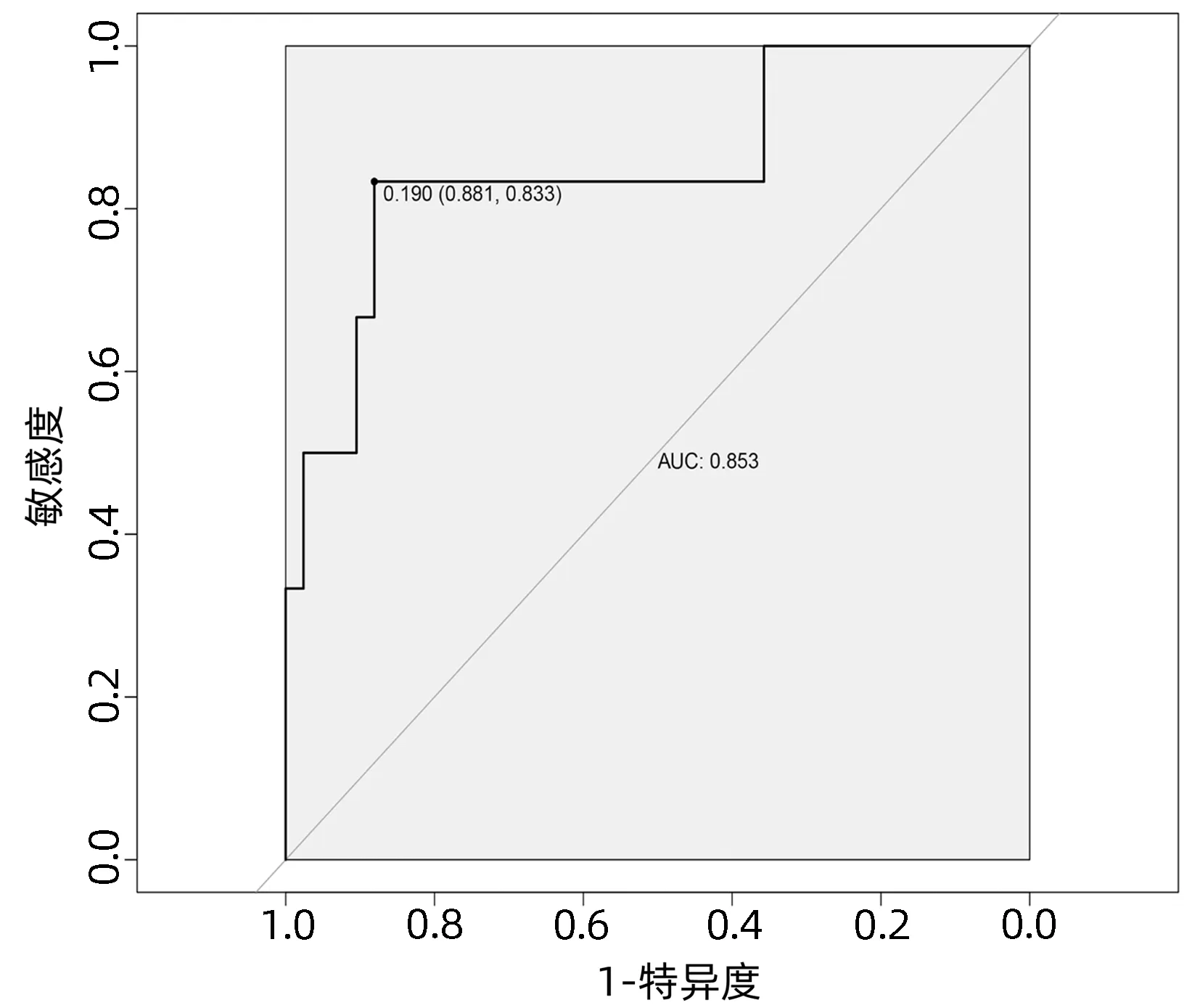
图5 验证集ROC曲线
本研究结果表明,糖尿病是肝切除术后发生感染的独立危险因素。糖尿病患者的高糖状态为致病菌的生长、繁殖提供了便利,若同时伴随免疫功能的紊乱还会增加对细菌的易感性。术前合并糖尿病、围手术期血糖控制不佳是术后发生感染的重要因素[18-19]。NLR是一种新的全身炎症反应标志物,高NLR可作为接受射频消融或肝切除的肝癌患者和其他类型癌症患者预后不良的预测因子[20-21]。Ruan等[22]发现,NLR是肝癌肝切除术后发生感染的的独立影响因素,这与本研究的结果一致。 CONUT评分映了患者的免疫营养状态,与肝癌、胰腺癌等消化系统恶性肿瘤的预后密切相关[23-24]。本研究以4分为CONUT评分的临界值,将所有患者分为CONUT<4分,CONUT≥4分两组,结果表明,CONUT≥4分是肝切除术后发生感染的独立影响因素。
本研究认为,手术时间是肝切除术后发生感染的独立影响因素,与既往研究结果一致[25-26]。长时间的麻醉状态和手术应激状态将加重患者的心肺负荷,从而增加术后感染的风险。术中出血量是肝切除术后发生感染的重要影响因素,术中大量出血可导致肝肠供血供氧不足产生应激,导致肝细胞结构和功能损伤,同时肠黏膜屏障受损可导致菌群失调引发感染[27-29]。肝切除术后为排除过多的液体和坏死的肝组织,临床上多予以留置引流管,腹腔引流管留置时间≥7 d 的患者发生术后感染的概率明显增加[30],是肝切除术后发生感染的独立影响因素,与本研究的结果相符合。因此,临床医生在工作中要根据患者的引流量情况及时拔除引流管以免增加感染的风险。
由于列线图模型将多因素分析中结果可视化、直观化,模型的评估简捷,临床资料获取方便等优点使其易于推广临床。本研究所建立的列线图模型具有良好的区分度和校准度。同时,本研究也存在一定的局限性,该预测模型属于单中心研究,尚未开展外部验证,笔者希望今后可对模型进行时间和空间的外部验证,以提高模型在临床上的适用性。
综上所述,糖尿病、CONUT≥4分、手术时间、术前NLR、术中失血量、引流管放置时间>7 d是肝切除术后发生感染的独立危险因素。以此为基础建立个体化列线图风险预测模型预测效能良好,能有效筛查高风险患者,进而指导临床医生优化对高风险患者的围手术期管理,降低患者术后感染的发生率。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:朱明强负责课题设计,资料分析,撰写论文;杨大帅参与数据分析;熊祥云、裴俊鹏参与收集数据;彭阳参与修改论文;丁佑铭负责拟定写作思路,指导撰写文章并最后定稿。
