血清定量HBsAg和HBV DNA预测HBeAg阳性慢性HBV感染显著肝炎活动的性能比较
2023-02-07陆伟张占卿阎俪黄丹林维佳周新兰丁荣蓉王雁冰李秀芬
陆伟 张占卿 阎俪 黄丹 林维佳 周新兰 丁荣蓉 王雁冰 李秀芬
作者单位:201508 上海市公共卫生临床中心肝胆内科
根据血清HBeAg是否阳性、ALT是否正常、HBV DNA水平及肝脏组织学表现,慢性HBV感染通常经历4个连续但可往复的自然史分期[1-4]:HBeAg阳性非显著肝炎活动期、HBeAg阳性显著肝炎活动期、HBeAg阴性非显著肝炎活动期和HBeAg阴性显著肝炎活动期。但是,ALT的正常参考值上限(upper limit of normal, ULN)仍存争议[1-5];基于传统的ULN,ALT对HBeAg阳性和阴性显著肝炎活动及显著肝纤维化的预测能力已面临挑战[6-9]。用于预测HBeAg阳性显著肝炎活动的HBV DNA水平的划分界限尚未定论[1-4];HBV DNA对HBeAg阳性显著肝纤维化的预测价值已遭到质疑[1-4, 10-11]。
血清HBsAg已被推广应用[2-4]。但是,用于区分自然史分期的HBsAg量化标准尚未形成[1-4]。HBsAg有两个来源:HBV共价闭合环状DNA和与宿主基因组整合的HBV DNA[12-14]。HBeAg阳性慢性HBV感染,虽然处于非显著和显著肝炎活动期患者的HBsAg与HBV DNA均呈显著正相关[15-17];但与HBV高复制相关的高水平HBsAg可能限制宿主针对HBV的免疫应答[11, 18]。因此,参照涵盖与HBsAg产生有关的HBV DNA的常规自然史分期标准的研究难以获得HBsAg预测HBeAg阳性显著肝炎活动的合理数据信息,参照常规标准的研究事先已将HBV DNA预测显著肝炎活动的性能设为“最佳”;基于涵盖HBV低复制患者的总体人群的评价也不能准确、有效地反映HBsAg预测HBeAg阳性显著肝炎活动的性能,HBsAg预测显著肝炎活动的合理截断值应在不涵盖HBV低复制患者的HBV高-中复制人群中确定和评价。
本研究在划分涵盖部分HBV中复制的疑似HBV高复制与疑似HBV低复制人群的基础上,基于疑似HBV高复制人群,参照ALT和肝脏病理学标准,对比评价HBsAg和HBV DNA预测HBeAg阳性显著肝炎活动的性能。
资料与方法
一、研究对象
选取2017年1月—2020年9月上海市公共卫生临床中心住院并行肝活检的505例慢性HBV感染患者作为研究人群;其中男性309例,女性196例;年龄10~68岁,中位值(四分位间距)34(29~40)岁。入选标准:①HBsAg和HBeAg均阳性并且均超过6个月;②有完整的住院病史记录、详细的肝脏病理学描述及配套的血清实验室数据。排除标准:①合并其他病毒性肝炎、EB病毒/巨细胞病毒感染、血吸虫肝病、脂肪性肝病(肝细胞脂肪变>5%)、药物性肝损伤、过量饮酒(折合乙醇量:男性>30 g/d,女性>20 g/d)、自身免疫性疾病、内分泌与代谢疾病、胆管及胆囊结石、肝脏肿瘤及失代偿肝病;②6个月内曾接受干扰素类或核苷(酸)类抗病毒治疗、或曾接受甘草酸类或苦参碱(素)或双环醇/联苯双酯护肝治疗以及传统中药方剂(含中成药)治疗;③肝脏标本长度<1.0 cm或汇管区<6个。
二、实验室检查
肝活检当日上午,采集空腹静脉血并分离血清。HBsAg、HBeAg采用微粒子酶免疫法和Abbott Architect I2000全自动免疫分析系统及其配套试剂检测。其中,HBsAg检测范围为0.05~250 IU/mL,如超出检测上限,被检血清稀释500倍重新检测;HBeAg检测下限为1.0 SCO。HBV DNA采用PCR探针法和Roche LightCycler 480 qPCR系统检测,试剂购自圣湘生物科技股份有限公司,检测范围为1×102~2×109IU/mL。ALT采用Abbott Architect C16000全自动生化分析系统及其配套试剂检测;参照相关文献[1-5],本研究将ALT的ULN设为3个层级,即20 IU/L、30 IU/L和40 IU/L,将ALT≥ULN定义为生化学显著肝炎活动。
三、病理学诊断
肝活检在患者签署书面知情同意书后进行。采用一秒钟经皮肝穿刺法,穿刺针规格为16 G。肝脏标本的质量评价和病理学诊断由1名资深病理学家独立完成。肝脏病理学分级和分期参照Scheuer标准[19]:坏死性炎症活动度分G0~G4五级,纤维化和结构改变程度分S0~S4五期。与评价无创指标预测肝脏病理学状态的惯用标准不同(病理学分级≥G2和分期≥S2分别定义为显著坏死性炎症和显著纤维化),本文将“肝脏病理学分级>G1(含G1~2)或分期>S1(含S1~2)”定义为病理学显著肝炎活动。
基于ALT 3个层级的ULN标准,本文将生化学/病理学显著肝炎活动也分为三个层级,依次定义为“ALT≥20 IU/L或(病理学分级>G1或分期>S1)”、“ALT≥30 IU/L或(病理学分级>G1或分期>S1)”和“ALT≥40 IU/L或(病理学分级>G1或分期>S1)”。
四、统计学方法
统计学分析和图形制作采用MedCalc 15.8软件。疑似HBV高复制人群的筛选基于ALT与HBsAg、HBeAg和HBV DNA的LOESS(locally weighted scatterplot smoothing)回归分析。ALT与HBsAg、HBeAg和HBV DNA的Spearman相关系数之间的差异比较采用Fisher Z非参数检验。生化学显著与非显著肝炎活动及病理学显著与非显著肝炎活动患者HBsAg、HBeAg和HBV DNA之间的差异比较采用独立样本Mann-WhitneyU非参数检验。HBsAg、HBeAg和HBV DNA预测生化学/病理学显著肝炎活动的性能评价采用受试者工作特征(receiver operating characteristic, ROC)曲线法,其预测生化学/病理学显著肝炎活动的ROC曲线下面积(area under ROC curve, AUC)之间的差异比较采用相依样本Hanley & McNeil非参数检验。P<0.05为差异有统计学意义。
结 果
一、疑似HBV高复制人群的筛选
分别以HBsAg、HBeAg和HBV DNA作为自变量,以ALT作为因变量,设拟合跨度为60%,进行LOESS回归分析。ALT与HBsAg、HBeAg和HBV DNA的LOESS回归曲线见图1。根据LOESS回归曲线,HBsAg、HBeAg和HBV DNA可分为高水平和中-低水平两层,即HBsAg>4.250和≤4.250 log10 IU/mL,HBeAg>2.875和≤2.875 log10 SCO,HBV DNA>7.500和≤7.500 log10 IU/mL。
参照HBsAg、HBeAg和HBV DNA的定量分层,疑似HBV高复制人群可界定为“HBsAg>4.250 log10 IU/mL或HBeAg>2.875 log10 SCO或HBV DNA>7.500 log10 IU/mL”。疑似HBV高复制人群中,高水平HBsAg、HBeAg和HBV DNA患者的构成比分别为60.6%(169/279)、82.4%(230/279)和69.5%(194/279);高水平HBeAg患者的构成比显著大于高水平HBsAg和HBV DNA患者(χ2=32.476,P<0.0001和χ2=12.686,P=0.0004),高水平HBV DNA患者的构成比显著大于高水平HBsAg患者(χ2=4.852,P=0.0276)。
二、ALT与HBsAg、HBeAg和HBV DNA的相关性
总体人群,ALT≥20 IU/L、≥30 IU/L和≥40 IU/L患者的构成比分别为93.7%(473/505)、83.6%(422/505)和73.9%(373/505);ALT与HBsAg、HBeAg和HBV DNA的Spearman相关系数分别为-0.026、0.113和0.185(P=0.5679,P=0.0109和P<0.0001)。ALT与HBeAg和ALT与HBV DNA的Spearman相关系数之间的差异无统计学意义(Z=1.167,P=0.2431),ALT与HBeAg和ALT与HBV DNA的Spearman相关系数均显著大于ALT与HBsAg的Spearman相关系数(Z=1.167,P=0.0271和Z=3.377,P=0.0007)。
高水平HBsAg人群,ALT≥20 IU/L、≥30 IU/L和≥40 IU/L患者的构成比分别为91.7%(155/169)、78.7%(133/169)和69.8%(118/169),ALT与HBsAg的Spearman相关系数为-0.238(P=0.0018);高水平HBeAg人群,ALT≥20 IU/L、≥30 IU/L和≥40 IU/L患者的构成比分别为93.5%(215/230)、84.3%(194/230)和76.5%(176/230),ALT与HBeAg的Spearman相关系数为-0.283(P<0.0001);高水平HBV DNA人群,ALT≥20 IU/L、≥30 IU/L和≥40 IU/L患者的构成比分别为94.3%(183/194)、85.1%(165/194)和77.3%(150/194),ALT与HBV DNA的Spearman相关系数为-0.052(P=0.4739)。ALT与HBsAg和ALT与HBeAg的Spearman相关系数之间的差异无统计学意义(Z=0.473,P=0.6363),ALT与HBsAg和ALT与HBeAg的Spearman相关系数大于或显著大于ALT与HBV DNA的Spearman相关系数(Z=1.796,P=0.0724和Z=2.433,P=0.0150)。
疑似HBV高复制人群,ALT≥20 IU/L、≥30 IU/L和≥40 IU/L患者的构成比分别为94.3%(263/279)、85.7%(239/279)和78.5%(219/279);ALT与HBsAg、HBeAg和HBV DNA的Spearman相关系数分别为-0.302、-0.259和-0.078(P<0.0001,P<0.0001和P=0.1927)。ALT与HBsAg和ALT与HBeAg的Spearman相关系数之间的差异无统计学意义(Z=0.548,P=0.5834),ALT与HBsAg和ALT与HBeAg的Spearman相关系数均显著大于ALT与HBV DNA的Spearman相关系数(Z=2.744,P=0.0061和Z=2.195,P=0.0281)。
三、生化学显著与非显著肝炎活动患者HBsAg、HBeAg和HBV DNA之间的差异
总体、疑似HBV高复制人群生化学显著与非显著肝炎活动患者HBsAg、HBeAg和HBV DNA之间的差异比较见表1。

SQRT: 平方根;红色框圈定部分为高水平HBsAg、HBeAg和HBV DNA

表1 生化学显著与非显著肝炎活动患者HBsAg、HBeAg和HBV DNA之间的差异比较
四、病理学显著与非显著肝炎活动患者HBsAg、HBeAg和HBV DNA之间的差异
总体、疑似HBV高复制人群病理学显著与非显著肝炎活动患者HBsAg、HBeAg和HBV DNA之间的差异比较见表2。

表2 病理学显著与非显著肝炎活动患者HBsAg、HBeAg和HBV DNA之间的差异比较
五、HBsAg、HBeAg和HBV DNA预测生化学/病理学显著肝炎活动的性能
总体和疑似HBV高复制人群,“生化学/病理学显著肝炎活动(ALT≥20 IU/L)”、“生化学/病理学显著肝炎活动(ALT≥30 IU/L)”及“生化学/病理学显著肝炎活动(ALT≥40 IU/L)”的流行率分别为96.83%(489/505)和96.06%(268/279)、92.08%(465/505)和89.96%(251/279)及86.93%(439/505)和84.59%(236/279)。
HBsAg、HBeAg和HBV DNA预测生化学/病理学显著肝炎活动的ROC曲线见图2,预测生化学/病理学显著肝炎活动的AUC和基于Youden指数确定的最佳截断值及对应的诊断参数见表3。
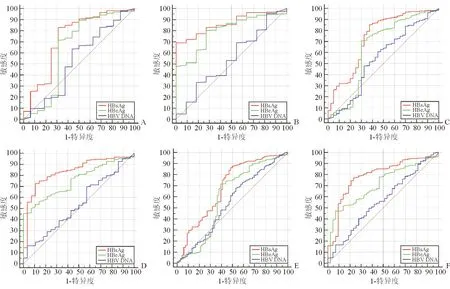
A、C和E: 总体人群; B、D和F: 疑似HBV高复制人群. A和B: 预测生化学/病理学显著肝炎活动(ALT≥20 IU/L); C和D: 预测生化学/病理学显著肝炎活动(ALT≥30 IU/L); E和F: 预测生化学/病理学显著肝炎活动(ALT≥40 IU/L).

表3 HBsAg、HBeAg和HBV DNA预测生化学/病理学显著肝炎活动的AUC、最佳截断值及对应的诊断参数
参考HBsAg、HBeAg的系列相同实测值对应的预测“生化学/病理学显著肝炎活动(ALT≥20 IU/L)”的特异度与预测“生化学/病理学显著肝炎活动(ALT≥40 IU/L)”的灵敏度之差的最小值,优选易于记忆的HBsAg、HBeAg预测生化学/病理学显著肝炎活动的实用截断值。HBsAg、HBeAg和HBV DNA预测生化学/病理学显著肝炎活动的实用截断值及对应的诊断参数见表4。

表4 HBsAg和HBeAg预测生化学/病理学显著肝炎活动的实用截断值及对应的诊断参数
六、HBsAg、HBeAg串联ALT预测肝脏病理状态的可靠性
基于HBsAg和HBeAg的实用截断值和ALT的三个ULN,HBsAg或HBeAg及其串联ALT的患者肝脏不同病理学分级和分期的构成比见表5。
表5 HBsAg或HBeAg及其串联ALT的患者肝脏不同病理学分级和分期的构成比
讨 论
慢性HBV感染持续和发病的病毒学机制尚未阐明。本研究ALT与HBsAg、HBeAg和HBV DNA的散点图显示,总体人群、疑似HBV高复制或HBsAg、HBeAg和HBV DNA各自的高水平人群,ALT≥40 IU/L的构成比均超过2/3,提示生化学显著肝炎活动在HBV高复制人群也广泛存在。本研究ALT与HBsAg、HBeAg和HBV DNA的相关分析显示,总体人群,ALT与HBsAg无显著相关性,与HBeAg和HBV DNA均呈显著正相关;疑似HBV高复制或HBsAg、HBeAg和HBV DNA各自的高水平人群,ALT与HBsAg和HBeAg均呈显著负相关,与HBV DNA无显著相关性。提示高水平HBsAg、HBeAg可能通过限制针对HBV的免疫应答诱导慢性HBV感染的持续[20-22],中-低水平HBeAg可能通过激活针对HBV的免疫应答导致慢性HBV感染的发病。
本文结果也支持实验研究提出的关于慢性HBV感染持续和发病机制的推论:高水平和中-低水平的血清HBsAg可能分别通过诱导免疫耗竭和免疫忽视参与慢性HBV感染的持续,高水平和中-低水平的血清HBeAg可能分别通过诱导免疫耗竭和免疫激活参与慢性HBV感染的持续和发病[23-25];血清HBV DNA水平可能反映肝细胞内HBV转译水平,高水平和中-低水平的HBV转译所产生的肝细胞HBcAg/HBeAg以及血清中-低水平的HBeAg均为免疫攻击的主要靶标。HBeAg诱导免疫耗竭和免疫激活的兼性效应可能与其成功的近视进化(short sighted evolution)有关[26]。
预测慢性HBV感染显著肝炎活动的ALT水平尚未达成共识[1-4]。在参考相关文献[1-5]的基础上,我们预设了三3个层级的ULN,即ALT≥20 IU/L、≥30 IU/L和≥40 IU/L,作为生化学显著肝炎活动的标准。基于3个层级ULN标准的比较分析显示,总体人群,仅HBV DNA显示了一致结果:生化学显著肝炎活动患者HBV DNA水平显著高于非显著肝炎活动患者;疑似HBV高复制人群,HBsAg、HBeAg和HBV DNA均显示了相似结果:生化学显著肝炎活动患者HBsAg、HBeAg水平均显著低于非显著肝炎活动患者,而生化学显著与非显著肝炎活动患者HBV DNA水平之间的差异均无统计学意义。
目前被广泛使用的Scheuer、Ludwig、Ishak和METAVIR肝脏组织学评分系统,对慢性肝炎肝脏病理学分级和分期的判别标准高度一致[27]。本文采用Scheuer标准,将病理学分级>G1或分期>S1作为病理学显著肝炎活动的标准;参照该标准的比较分析显示,无论总体人群或疑似HBV高复制人群,病理学显著肝炎活动患者HBsAg、HBeAg和HBV DNA水平均显著低于非显著病理学肝炎活动患者。提示采用病理学与采用生化学标准的显著肝炎活动患者HBsAg、HBeAg和HBV DNA水平的分布不完全一致:ALT水平和病理学分级或分期分别是反映HBsAg、HBeAg和HBV DNA动态变化的相对灵敏和相对特异的指标。
为此,我们采用生化学与病理学标准相结合的方式,即以“ALT≥三个层级的ULN或(病理学分级>G1或分期>S1)”作为生化学/病理学显著肝炎活动的标准,评价了HBsAg、HBeAg和HBV DNA预测三个层级生化学/病理学显著肝炎活动的性能。本文ROC曲线分析显示,总体人群,HBsAg和HBeAg预测三个层级生化学/病理学显著肝炎活动的AUC分别均小于0.75和均小于0.70;疑似HBV高复制人群,HBsAg和HBeAg预测三个层级生化学/病理学显著肝炎活动的AUC分别均大于0.75和均大于0.70;无论总体人群或疑似HBV高复制人群,HBV DNA预测三个层级生化学/病理学显著肝炎活动的AUC与对角参考线下面积之间的差异均无统计学意义。提示HBsAg和HBeAg对HBeAg阳性显著肝炎活动有良好预测意义,而HBV DNA对HBeAg阳性显著肝炎活动没有预测价值。
基于ROC曲线分析,我们优选了HBsAg和HBeAg预测生化学/病理学显著肝炎活动的实用截断值。其中,HBsAg预测生化学/病理学显著肝炎活动的实用截断值与我们前期参照欧洲肝病学会指南(2017)标准的研究结果相一致[18]。基于本文资料,ALT≥20 IU/L、≥30 IU/L和≥40 IU/L的患者,其病理学分期≤S2的构成比分别为90.6%、83.2%和79.6%,≥S4的构成比分别为9.4%、10.8%和12.1%;HBsAg>4.699 log10 IU/mL(>5×104IU/mL)和HBeAg>3.156 log10 SCO(1.45×103SCO)的患者,其病理学分期≤S2的构成比分别为98.6%和94.4%,≥S4的构成比分别为0.0%和3.3%。“HBsAg>4.699 log10 IU/mL且ALT<40 IU/L”或“HBeAg>3.156 log10 SCO且ALT<40 IU/L”的患者,病理学分期≤S2的构成比均为100%。提示ALT预测广泛肝纤维化(病理学分期≥S3)和肝硬化(病理学分期≥S4)的能力非常有限;但是,HBsAg或HBeAg单独或串联ALT预测广泛肝纤维化和肝硬化的性能近乎超卓。
概言之,HBeAg阳性疑似HBV高复制人群,ALT与HBsAg和HBeAg均呈显著负相关,与HBV DNA无显著相关性;HBsAg和HBeAg对显著肝炎活动有显著预测价值,HBV DNA对显著肝炎活动无预测意义。以HBsAg>5×104IU/mL或HBeAg>1.45×103SCO且ALT<40 IU/L为标准,对排除HBeAg阳性患者广泛肝纤维化和肝硬化有卓越性能。
利益冲突声明:所有作者均声明不存在利益冲突。
