毛蕊异黄酮抑制胃癌干细胞样细胞的增殖、迁移与侵袭并诱导凋亡*
2023-02-07杜亚青李向英张丽晓王云芳
杜亚青, 李向英, 张丽晓, 王云芳, 韩 敏
(邢台市人民医院中医内科,河北 邢台 054001)
随着饮食和生活的不规律,我国胃癌(gastric cancer, GC)的发病率呈逐渐增加趋势,且随着人口老龄化,GC总例数也将快速增加[1]。尽管在过去的几十年里,GC的治疗取得了显著的进步,但5年生存率仍不理想[2]。因此,寻找新的有效的抗胃癌药物是当务之急。
中药因其具有多靶点和低毒的作用,已广泛应用于治疗多种肿瘤的治疗中[3]。特别是,近期有报道称从天然药物中提取的某些单体小分子不仅具有抗肿瘤和调节免疫的作用,甚至还能抑制肿瘤干细胞(cancer stem cell, CSC)的恶性生物学行为[4-5]。CSC是指在肿瘤中有具有自我更新且能产生异质性肿瘤细胞的肿瘤细胞群,其具有高致瘤性、强自我更新能力且其对目前常用的化疗药物极不敏感。毛蕊异黄酮(calycosin)是从黄芪提取出来的一种具有抗氧化、抗辐射和抗肿瘤等多种药理活性的黄酮类化合物[6-7]。近来研究发现,毛蕊异黄酮不仅能抑制胃癌细胞增殖和迁移[8],还能增加胃癌细胞对顺铂、阿霉素或5-氟尿嘧啶的敏感性[9]。而目前尚不清楚毛蕊异黄酮是否能对胃癌干细胞产生抑制作用,因此本研究评估了毛蕊异黄酮对胃癌干细胞增殖、迁移和侵袭以及凋亡的影响。
材料和方法
1 细胞与实验试剂
AGS细胞(武汉普诺赛生命科技有限公司);胎牛血清(FBS)、DMEM培养基和含谷氨酰胺-DMEM/F12培养基(Gibco);B27 (Invitrogen);表皮生长因子和碱性成纤维细胞生长因子(Peprotech);牛血清白蛋白、细胞计数试剂盒-8 (CCK-8)、Annexin V- FITC/PI凋亡检测试剂盒、线粒体膜电位检测试剂盒(JC-1)(北京索莱宝科技有限公司);胰岛素(Novo Nordisk);毛蕊异黄酮(上海源叶生物科技有限公司);CD44、SOX9和OCT4抗体(南京巴傲得生物科技有限公司—Bioworld);Bax、Bcl-2、Cyto-c、cleaved caspase-3和cleaved caspase-9抗体(Abcam);TUNEL染色试剂盒(红色荧光)、线粒体/细胞质分离试剂盒、GAPDH抗体、COX Ⅳ抗体和HRP标记的山羊抗兔Ⅱ抗(上海碧云天生物技术有限公司)。
2 方法
2.1 AGS细胞培养与AGS干细胞分离 将AGS细胞在含10% FBS的DMEM培养基中常规大量培养。然后将AGS通过成球培养,从中分离出AGS胃癌干细胞样细胞(AGS-CSC)[10]。具体方法:AGS细胞以1×104的密度铺板在超低粘附6孔板(康宁)中,用含2% B27、20 μg/L表皮生长因子、10 μg/L碱性成纤维细胞生长因子、0.4%牛血清白蛋白和5 mg/L胰岛素和谷氨酰胺-DMEM/F12培养基培养,每3 d向培养基中补液一次,并将细胞在培养基中维持7 d(观察肿瘤球),并将肿瘤球解离成单细胞悬浮液,并重新培养7 d以再次获得肿瘤球。将第2代肿瘤球,分散为单细胞,将此细胞(AGS-CSC)通过干细胞鉴定后用于后续实验。
2.2 集落形成实验检测集落形成情况 将AGSCSC细胞以每孔1 000细胞接种在6孔板中24 h。第2天起,将细胞与不同浓度(0、30、60和120 μmol/L)的毛蕊异黄酮一起孵育,并继续培养10 d,每3 d换液一次。用0.5%结晶紫对细胞染色20 min,并对细胞集落拍照和计数。
2.3 CCK-8检测细胞活性 用细胞计数试剂盒-8(CCK-8)测定法评估毛蕊异黄酮对AGS-CSC细胞的细胞活性影响。步骤简述如下:将AGS-CSC细胞用不同浓度(0、30、60和120 μmol/L)的毛蕊异黄酮预处理30 min,然后按每孔1×104细胞接种到96孔板并培养24 h,随后加入10 μL CCK-8溶液并继续孵育2 h,通过酶标仪检测490 nm波长处吸光度(A)值。
2.4 细胞划痕实验 将AGS-CSC细胞用不同浓度(0、30、60和 120 μmol/L)的毛蕊异黄酮预处理 30 min,铺板在6孔板中,然后用20 μL移液枪头划痕,用PBS洗2次,加入无血清培养基培养24 h,拍摄图像。
2.5 细胞迁移和侵袭实验 Transwell实验用于评估细胞迁移和侵袭。将AGS-CSC细胞用不同浓度(0、30、60和 120 μmol/L)的毛蕊异黄酮预处理 30 min,收获细胞,然后用不含FBS的培养基分别调整细胞浓度为1×108/L。各取100 μL细胞悬液加入Transwell小室(其中,铺有基底胶的Transwell小室用于检测细胞侵袭,未铺基底胶的Transwell小室用于检测细胞迁移),同时,将底室加600 μL含有10%FBS的培养基中。将细胞培养24 h后,擦除Transwell小室滤膜上表层的细胞,用0.2%结晶紫对穿至滤膜下表层的细胞染色,使用显微镜观察并拍照,并计数。
2.6 细胞凋亡分析 将AGS-CSC细胞接种在6孔板中,用不同浓度(0、30、60和120 μmol/L)的毛蕊异黄酮24 h。然后分别用Hoechst 33342/TUNEL双重染色免疫荧光观察TUNEL阳性细胞以及Annexin VFITC/PI双重染色流式细胞术检凋亡细胞数的方法评估毛蕊异黄酮对AGS-CSC细胞凋亡的影响。方法简述如下:
Hoechst 33342/TUNEL双重染色免疫荧光法:用PBS洗涤细胞两次,然后用4%多聚甲醛固定20 min,洗涤后,用含0.3% Triton X-100对细胞打孔(5min),再次洗涤后,用100 μL TUNEL检测工作液孵育30 min,PBS洗涤后,加入Hoechst 33342染核5 min,荧光显微镜下观察。
Annexin V- FITC/PI双重染色流式细胞术:用不含EDTA的胰酶消化收集细胞,用PBS重悬细胞俩次,加入200 μL结合液再次悬浮细胞一次,避光下加入5 μL Annexin V- FITC染色液室温5 min,加入10 μL PI染色液室温10 min,流式细胞仪检测。
2.7 线粒体膜电位评估 通过JC-1染色评估线粒体膜电位。将AGS-CSC细胞接种在6 孔板中,用不同浓度(0、30、60和120 μmol/L)的毛蕊异黄酮处理24 h,吸出培养液,用PBS洗涤细胞一次,加入1 mL细胞培养液,然后加入1 mL JC-1染色工作液并充分混合并于37°C下孵育20 min。 孵育后,吸出上清液并用JC-1染色缓冲液洗涤两次,加入2 mL培养基,在荧光显微镜下观察,拍照。
2.8 Western blot检测蛋白表达 分别用RIPA裂解缓冲液和线粒体/细胞质分离试剂盒提取细胞总蛋白和线粒体蛋白/细胞质蛋白,并用BCA法对蛋白浓度进行定量。取等量蛋白样品在8~12% SDS-PAGE上分离,然后转移到硝酸纤维素膜上。在5%脱脂乳中封闭后,将膜与分别与Ⅰ抗[Cyt C、cleaved caspase-3和cleaved caspase-9均为1∶1 000稀释;Bax、Bcl-2、CD44、SOX9、OCT4和COX Ⅳ均为1∶2 000稀释;GAPDH为1∶8 000稀释]在4 ℃下孵育过夜。次日,用TBST洗涤后,室温孵育HRP-山羊抗兔IgG (H+ L)(1∶2 000稀释)1 h。再次洗涤后,用ECL化学发光试剂使条带显像,并用凝胶成像系统拍照,用ImageJ软件分析蛋白相对表达量。以GAPDH作为总蛋白和细胞质蛋白内参照,COX Ⅳ作为线粒体蛋白的内参照;蛋白相对表达量=目的条带灰度值/对应内参条带灰度值×100%。
3 统计学处理
所有实验重复至少3次。所有结果表示为平均值±标准差(mean±SD),并使用GraphPad Prism 9软件进行分析。用t检验对两组间数据比较;用单因素方差分析比较多组间数据差异,用Bonferroni法对各组均数进行两两比较;P<0.05则认为差异有统计学意义。
结 果
1 AGS-CSC的鉴定
成球实验的结果如图1A所示,进一步用Western blot检测了干细胞相关标记物CD44、SOX9和OCT4的表达,结果显示,与AGS细胞相比,AGS来源的胃癌干细胞样细胞AGS-CSC的干细胞标志物蛋白水平均显著增加(图1B)。

Figure 1. Identification and culture of gastric cancer stem celllike cell line AGS-CSC. A: representative image of sphere formation assay(×100); B: protein detection of stem cell-related markers.图1 胃癌干细胞样细胞AGS-CSC的鉴定
2 毛蕊异黄酮抑制AGS-CSC的增殖
随后,我们利用得到的AGS-CSC细胞进行培养,并在0、30、60和120 μmol/L的浓度的毛蕊异黄酮刺激下检测细胞的集落形成和细胞活性。如图2所示,随着毛蕊异黄酮浓度的升高,AGS-CSC的集落形成数显著降低,细胞活性也显著降低,至浓度为120 μmol/L时,集落形成数和细胞活性达到最低(P<0.01),此实验证实,毛蕊异黄酮以剂量依赖性的方式抑制AGS-CSC细胞的增殖。
3 毛蕊异黄酮抑制AGS-CSC细胞的迁移和侵袭
通过细胞划痕愈合和Transwell实验评估AGSCSC的迁移和侵袭能力。如划痕愈合实验(图3A)所示,毛蕊异黄酮可剂量依赖性方式抑制AGS-CSC细胞的迁移,同样在Transwell迁移测定中观察到类似的结果(图3B)。此外,Transwell侵袭实验(图3C)显示可剂量依赖性方式抑制AGS-CSC细胞的侵袭。以上实验证明毛蕊异黄酮能抑制AGS-CSC细胞的迁移和侵袭。
4 毛蕊异黄酮促进AGS-CSC细胞的凋亡
采用TUNEL染色和流式细胞术检测不同浓度的毛蕊异黄酮对AGS-CSC细胞凋亡水平的影响,结果显示,与0 μmol/L组比较,AGS-CSC细胞的TUNEL阳性细胞数(图4A)和凋亡比例(图4B)以剂量依赖性方式随毛蕊异黄酮剂量的增加而增加(P<0.01)。
5 毛蕊异黄酮对AGS-CSC细胞线粒体膜电位及线粒体通路相关蛋白表达的影响

Figure 2. Calycosin inhibited the proliferation of AGS-CSC cells. A: representative images of colony formation assay of AGS-CSC after application of different concentrations of calycosin; B: statistical results of relative colony number of AGS-CSC cells;C: CCK-8 assay was used to detect the cell viability of AGS-CSC under different concentrations of calycosin. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 μmol/L group.图 2 毛蕊异黄酮抑制AGS-CSC细胞的增殖
JC-1染色(图5A)显示,线粒体膜电位随着毛蕊异黄酮处理剂量的增加而降低。随后,通过Western blot实验研究了线粒体凋亡相关蛋白的表达水平是否受毛蕊异黄酮的影响,如图5B~D所示,毛蕊异黄酮以剂量依赖性上调促凋亡蛋白Bax的表达,同时下调抗凋亡蛋白Bcl-2的表达,增加细胞色素C的释放,并增加cleaved caspase-3和-9的表达水平(P<0.05或P<0.01)。
讨 论
胃癌的化疗失败在很大程度上与胃癌分期、化疗药物耐药、化疗不良反应和毒副作用等因素有关[11]。其中,CSC是化疗耐药特别是继发性肿瘤的化疗耐药的原因之一,且其也与肿瘤的复发以及不良预后密切相关[12]。据报道CSC对目前常用的化疗药物不敏感[12-13],因此,寻找抑制胃癌CSC的药物对胃癌的治疗具有重要意义。中药在肿瘤的治疗中不仅能发挥调节免疫作用,甚至还具有直接治疗、增加化疗疗效的作用,特别是,近来研究发现的某些中药单体还具有抑制CSC的作用[3-5]。毛蕊异黄酮作为一种从名贵中药材黄芪中提取的黄酮类化合物,其被证明在胃癌细胞中不仅能发挥抗肿瘤作用还具有对化疗药物的增敏作用,但目前并不清楚其是否能对胃癌干细胞发挥抑制作用[8-9]。本研究通过成球培养方法从AGS细胞系中获得AGS来源的胃癌干细胞样细胞AGS-CSC,并且进一步发现毛蕊异黄酮能抑制AGS-CSC细胞增殖、迁移和侵袭,并能促进其凋亡,说明毛蕊异黄酮具有抑制AGS-CSC细胞的恶性生物学行为的能力。
本研究进一步探讨了毛蕊异黄酮抑制AGS-CSC细胞命运的机制。影响细胞凋亡的途径主要有线粒体途径、死亡配体途径和穿孔素/颗粒酶途径等,其中线粒体途径是最主要的凋亡途径(约占90%)[14]。越来越多的证据[15-17]表明,毛蕊异黄酮在多种肿瘤细胞中可通过调节PI3K/AKT/mTOR信号、Wnt信号或p38信号上调 Bax/Bcl2比率,进一步增加线粒体极化,最终诱导细胞凋亡。且已有文献[18-19]报道,毛蕊异黄酮可通过p活化的线粒体凋亡途径诱导人骨肉瘤和肝癌细胞的凋亡。因此,在本研究中, 我们研究了毛蕊异黄酮对AGS-CSC细胞的线粒体凋亡途径的影响。本研究显示毛蕊异黄酮能上调Bax,并下调Bcl-2表达,进一步降低线粒体膜电位和细胞色素C释放,促进凋亡执行蛋白cleaved caspase-9和3的表达,最终诱导细胞凋亡。此外,本研究还具有一定的局限性,比如,毛蕊异黄酮如何与膜表面受体结合进入AGS-CSC,然后通过何种途径激活的线粒体凋亡途径,还有,毛蕊异黄酮对其他胃癌干细胞样细胞是否也具有一致的抑制作用,这些都需要进一步确定。
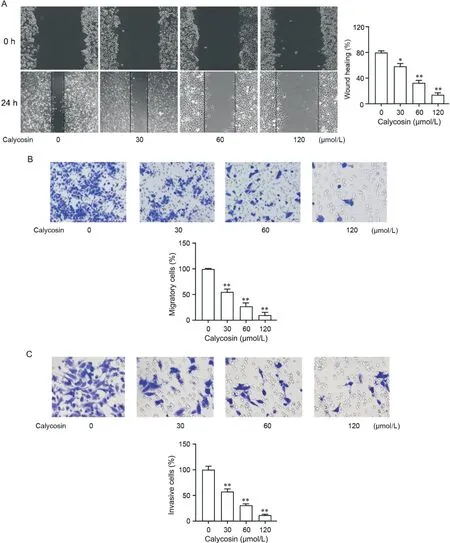
Figure 3. Calycosin inhibited the migration and invasion of AGS-CSCs cells. A: representative images (×40) and statistical results of wound-healing assay of AGS-CSC cells; B: representative images(×200) and statistical results of Transwell migration assay of AGS-CSC cells; C: representative images (×400) and statistical results of Transwell invasion assay of AGS-CSC cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 μmol/L group.图3 毛蕊异黄酮抑制AGS-CSC细胞的迁移和侵袭
总之,本研究显示,毛蕊异黄酮可抑制AGS-CSC增殖、侵袭与迁移并能促进其凋亡,且能激活线粒体凋亡途径。这些结果提示,毛蕊异黄酮不仅是潜在的抗胃癌药剂,且其可能还能抑制胃癌干细胞的恶性生物学行为。
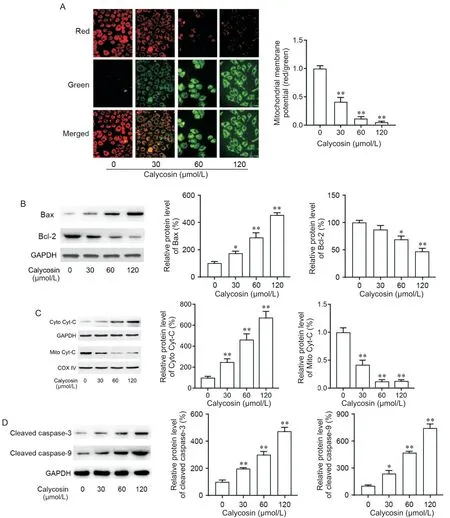
Figure 5. Effects of calycosin on mitochondrial apoptosis pathway in AGS-CSC cells. A: representative JC-1 staining images of GSCSC cells (×400) and statistical results of mitochondrial membrane potential; B, C and D: Western blot was used to detect the effect of calycosin on the expression of mitochondrial apoptosis pathway-related proteins. Mean±SD. n=3. *P<0.05,**P<0.01 vs 0 μmol/L group.图5 毛蕊异黄酮对AGS-CSC细胞线粒体凋亡通路的影响
