沉默驱动蛋白KIF11影响caspase-1介导的细胞死亡方式*
2023-02-07马慧敏王运宜夏雨晴
唐 洁, 陈 柯, 马慧敏, 余 琦, 王运宜, 夏雨晴, 徐 龙△
(1嘉兴学院预防医学教研室,法医与病理实验室,浙江 嘉兴 314001;2嘉兴中医医院病理科,浙江 嘉兴 314001)
程序性细胞死亡在胚胎发育和组织稳态中具有重要作用,包括凋亡、自噬、焦亡和铁死亡等多种不同细胞死亡方式,参与这一精细而复杂的过程[1-2]。细胞焦亡是新近发现的一种不同于凋亡的,有炎症和免疫调控参与的细胞死亡方式[3]。研究发现,细胞焦亡与肿瘤、神经退行性疾病和炎症等病理条件相关。因此,明确细胞死亡方式可进一步了解疾病的发生发展,为临床治疗提供靶向治疗方向。近年来,caspase-1被认为是细胞焦亡的启动子,其通过激活不同的炎症小体,触发受体相互作用蛋白激酶(receptor-interacting protein kinases, RIPKs)调节器,参与多种疾病的病理生理过程[4]。Caspase-1或其上游激活因子AIM2、NLRP3在多种肿瘤中含量较低或不存在,包括结肠、胃、前列腺、胰腺和乳腺肿瘤[5-6]。抑制caspase-1可增强乳腺癌和非小细胞肺癌的生长和转移;反之,则抑制结肠、胰腺和肾癌细胞的生长,与神经母细胞瘤的自发消退,以及急性髓性白血病和骨肉瘤的良好临床反应相关[7-8]。这些结果表明,caspase-1依赖性的细胞死亡方式可能在各种疾病和抗肿瘤效应中有着十分重要的作用。
驱动蛋白家族成员11(kinesin family member 11, KIF11)是一种微管依赖的运动蛋白,由位于10q24.1的KIF11基因编码,是驱动蛋白家族的主要成员之一,主要在有丝分裂纺锤体形成中起作用,已被证明与许多肿瘤的不良预后相关,其过表达与肾癌不同分型高度相关[9-10]。抑制KIF11可诱导细胞凋亡,促进肿瘤侵袭和转移[11-12]。研究表明,KIF11 可能参与多种肿瘤的发病机制,被认为是胰腺癌、非肌肉浸润性膀胱尿路上皮癌、非小细胞肺癌和胶质母细胞瘤的潜在标记分子,抑制KIF11可引起有丝分裂阻滞,促进细胞凋亡,然而其参与乳腺癌机制仍不清楚[13]。实验室前期研究发现,转染显性负的KIF11到细胞中可诱导核固缩和细胞死亡,但免疫细胞化学却检测不到激活的caspase-3,表明抑制KIF11后介导的细胞死亡方式并非是细胞凋亡。已有研究表明,KIF11氨基酸序列有2个caspase-1切割位点[14-16]。因此,本研究将通过构建RIPK2和caspase-1的质粒共转染到野生型、KIF11低表达和过表达的786-O细胞中,利用活细胞成像观测细胞的死亡方式的差异。
材料和方法
1 材料
人肾透明细胞腺癌786-O细胞购自ATCC。细胞坏死试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购买来自碧云天试剂有限公司。质粒构建的上下游引物由华大基因有限公司设计合成。
2 方法
2.1 生物信息分析 TIMER2.0数据库(http://timer.cistrome.org/)用于分析不同肿瘤类型的免疫浸润,提供多种免疫反卷积方法估计的免疫浸润丰度,来全面探索肿瘤免疫学、临床和基因组的特征。The UALCAN 数据库(http://ualcan.path.uab.edu/)主要基于TCGA数据库中的相关肿瘤数据进行生物标记物鉴定、表达谱分析,生存分析等。
2.2 细胞培养 根据细胞培养方法和细胞特性进行细胞传代和接种。通过构建pCIG-RIPK2、pTEX-caspase-1、pCAS9-KO1、pCAS9-KO2、pCAS9-Scramb、pUC19-KIF11-L-PURO-R和KIF11-RFP和KIF11-GFP融合蛋白质粒,利用慢病毒感染细胞的方法构建KIF11低表达和KIF11过表达的786-O细胞系。
2.3 Western blot Western blot实验方法根据抗体说明数书进行操作,将转染后的细胞提取总蛋白质。检测蛋白浓度,上样蛋白总量在60 μg,接着电泳,转膜,封闭,Ⅰ抗、Ⅱ抗、孵育,曝光,GAPDH作为内参。KIF11抗体为鼠抗KIF11抗体(sc-374212, 1∶1 000),cleaved消皮素D(gasdermin D, GSDMD)抗体为兔抗cleaved GSDMD抗体(#36425, 1∶1 000),Ⅱ抗为羊抗鼠和羊抗兔 IgG-HRP 抗体(#7076s和#7074s, 1∶5 000),GAPDH蛋白抗体为鼠抗(#97166s, 1∶2 000),caspase-1 p20抗体为兔抗(#4199, 1∶1 000),GSDMD抗体为兔抗(#69469,1∶1 000),IL-1β抗体为兔抗(#12703, 1∶1 000),cleaved IL-1β抗体为兔抗(#83186,1∶1 000)。
2.4 Confocal实验 把细胞接种到30 mm的玻璃皿中,接种的细胞数大约是5×104。等待24 h之后,依照上面的转染步骤转染细胞。观察24 h以内的细胞形态学的动态变化。设定参数:实验要求在20×的显微镜下观察,首先切换到荧光显微镜的观察界面,然后在20×的镜头下找到细胞。然后再切换到Locate的状态下设置参数,参数设定包括视野范围:371.6×371.6。后期处理:使用ZEN软件处理,添加标尺和时间序列导出视频(avi)和图片(TIFF)。
2.5 LDH测定 把细胞接种到96孔板中,24 h贴壁。转染RIPK2和caspase-1质粒后,24 h后,根据LDH检测试剂说明书,测定上清液LDH水平。
2.6 荧光染色法 将细胞接种到60 mm的培养皿中,每种细胞分别接种两个皿,接种的细胞数在1×106左右。置于培养箱中培养24 h;根据上面阐述的转染步骤,其中一个皿用来同时转染RIPK2和caspase-1,另外一个皿用于转染pCIG,置于培养箱中培养24 h;在每个培养皿中分别加入5 μL的PI 和Hoechst 33342,在摇床上摇晃5 min。在荧光显微镜下观察,然后拍照,并计数不同细胞之间能够染上PI的数目进行比较。
2.7 免疫组化 组织固定、脱水、包埋制成蜡块。连续切片,大约3 mm左右覆于黏附载玻片上,65 ℃烤片2 h。首先进行脱蜡、梯度乙醇,入水洗净;EDTA水浴加热20 min,逐步冷却,用水冲洗;放入过氧化氢10 min,TBST冲洗,滴加Ⅰ抗(KIF11),室温1 h;TBST冲洗3次,滴加Ⅱ抗30 min;TBST冲洗3次;配制DAB显色液,显微镜下控制显色时间。
3 统计学处理
采用SPSS 22.0进行统计学处理,实验数据均用均数±标准差(mean±SD)表示,多组之间的结果采用单因素方差分析,进一步采用LSD-t检验进行两两组内分析。两组间定量资料采用独立样本t检验,以P<0.05为差异具有统计学意义。
结 果
1 KIF11在大多数肿瘤组织中高表达,临床预后较差,且和caspase-1、GSDMD表达呈正相关
使用TIMER和UALCAN数据库发现(图1),在大多数常见的肿瘤中,KIF11在肿瘤组织中的表达高于正常癌旁组织(图1A)。肾透明细胞癌中KIF11表达显著高于正常癌旁组织(图1B,P<0.01)。免疫组化结果分析,KIF11定位在肾小管细胞的胞核和胞质,并且在肾癌中表达高于正常组织(图1C)。在肾透明细胞癌中,其中肿瘤组织533例,正常组织72例,分析发现KIF11高表达的生存期显著低于KIF11低表达患者(图1D,P<0.05)。KIF11与GSDMD、caspase-1的表达呈正相关(P<0.01,图1E、F)。因此,KIF11作为一个致癌基因,在恶性肿瘤中高表达,且影响肿瘤患者的预后。同时,KIF11表达和炎症因子caspase-1、细胞焦亡相关基因GSDMD呈正相关。
2 构建KIF11敲除和高表达的786-O细胞系
利用Crisper-Cas9的基因编辑技术构建KIF11敲除的786-O细胞系(图2A),发现使用Crisper-Cas9的基因编辑技术无法完全敲除KIF11基因,推测只能敲除KIF11基因的其中一条等位基因。KIF11作为细胞有丝分裂调控的重要基因,完全敲除KIF11,可能会导致细胞死亡。通过构建KIF11-GFP和KIF11-RFP融合蛋白质粒,通过慢病毒转染,筛选出稳定高表达KIF11的786-O细胞系(图2B)。
3 共转染RIPK2和caspase-1呈现KIF11水平依赖性的不同细胞死亡形式
共转染RIPK2和caspase-1质粒后,通过共聚焦显微镜连续观察24 h的WT,KIF11+/-和KIF11+/+细胞系不同时段的细胞形态学变化(图3)。在WT和KIF11+/+中,细胞发生凋亡,形成很多大小不一样的凋亡小体。相反,在KIF11+/-中,细胞没有形成类似凋亡小体的形态学改变,细胞膨胀变大,细胞内GFP荧光消失,细胞内容物漏出,导致细胞焦亡。因此,低表达KIF11促使细胞更容易发生焦亡。
4 凋亡小体和焦亡细胞的形态学和大小差异
在转染RIPK2和caspase-1到KIF11表达不同的786-O细胞中,发现焦亡小体(图4A)和凋亡小体的(图4B、C)细胞形态学改变。焦亡体细胞体积变大,凋亡体细胞会分裂形成大小不一的凋亡小体,有的会产生排列整齐如同绳株状结构。通过测量凋亡体细胞和焦亡细胞的大小(图4D、F),发现和正处于有丝分裂中期的正常细胞相比,凋亡细胞的体积明显减少,但焦亡细胞体积明显增大。因此,通过细胞形态学和细胞大小可以明显区别焦亡体和凋亡小体。
5 KIF11低表达的细胞更容易发生细胞焦亡

Figure 1. KIF11 as an oncogene was analyzed from TIMER and UALCAN database. A: differences in the expression of KIF11 between different tumors and normal tissues as well as in various common cancers; B: the expression of KIF11 in renal clear cell carcinoma (KIRC) was higher than that in normal tissues; C: the expression of KIF11 in paracancerous tissues and renal cancer was detected by immunohistochemistry(scale bar=50 μm); D: survival analysis between high and low KIF11 expression patient; E and F: the expression of KIF11 was positively correlated with caspase-1 and GSDMD. Mean±SD.**P<0.01 vs normal group.图1 通过TIMER数据库分析致癌基因KIF11
在转染RIPK2和caspase-1到KIF11表达不同的786-O细胞中,24 h后加入PI和Hoechst染色,发现KIF11+/-细胞的PI染色明显的高于KIF11+/+和WT细胞(P<0.01,图5A、B)。通过检测LDH水平,发现KIF11+/-细胞的LDH明显高于KIF11+/+和WT细胞(P<0.01,图5C)。另外,通过Western blot分析,发现细胞焦亡通路相关蛋白被激活。RIPK2/caspase-1转染的细胞中caspase-1 p20、GSDMD-NT和cleaved I L-1β蛋白表达上调,同时,在KIF11低表达的细胞中更为显著(图6)。因此,KIF11低表达的细胞更容易发生细胞焦亡。
讨 论
KIF11是驱动蛋白家族11号成员,属于驱动蛋白5家族,在四聚体微管交联、细胞有丝分裂以及细胞周期和分化中具有重要作用[17]。大部分研究显示, KIF11高表达和肿瘤患者的生存期和治疗预后相关[18]。在更高级别的疾病和恶性乳腺癌细胞中,KIF11显著上调,当KIF11表达降低时,可观察到细胞增殖、集落形成、侵袭和迁移能力减弱,但是细胞更容易发生凋亡[19]。通过生信分析,发现KIF11在大多数恶性肿瘤中高表达,特别是乳腺癌,非小细胞肺癌和肾透明细胞癌中。免疫组化结果显示,KIF11在肾癌中的表达明显高于正常组织,且定位在肾小管的胞核和胞质中。在肾透明细胞癌中,KIF11低表达的患者有更长的生存期,且KIF11的表达与炎症相关因子caspase-1和焦亡相关蛋白GSDMD的表达成正相关关系。
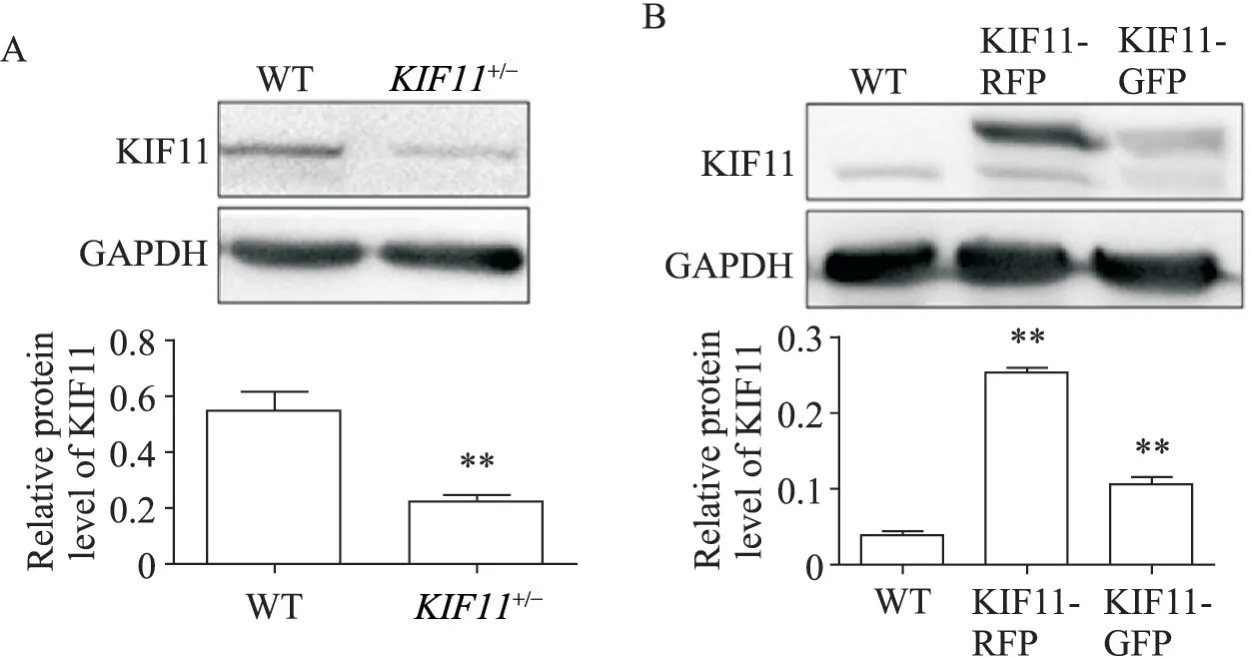
Figure 2. The cell lines with low expression (A) and over-expression (B) of KIF11 were constructed in 786-O cells. The protein levels of KIF11 were detected by Western blot. Mean±SD. n=3. **P<0.01 vs WT group.图2 构建低表达和过表达的KIF11的786-O细胞系

Figure 3. Co-transfection plasmids of RIPK2 and caspase-1 made a distinction form of cell death in WT, KIF11+/- and KIF11+/+ cell lines. The observation by confocal microscope at continuing 24 h to detect a series of morphological changes.图3 共转染RIPK2和caspase-1,观察野生、KIF11低表达和过表达的786-O细胞系死亡方式的差异

Figure 4. The morphology and size distinguished from WT, KIF11+/- and KIF11+/+ cell lines by co-transfection plasmids of RIPK2 and caspase-1. A~C: the morphology changes by confocal microscope were observed; D~F: the size of apoptotic body and necroptotic body in comparison with normal cells.图4 不同死亡方式的形态学和尺寸差异
前期研究发现,在KIF11的氨基酸序列上有两个caspase-1的酶切位点。因此,我们通过构建野生、KIF11低表达和KIF11高表达的786-O细胞系,探究了caspase-1与KIF11之间的关系。Caspase-1是一个炎症小体相关蛋白,炎症小体招募ASC后结合procaspase-1,形成一个新的复合物,激活成熟的caspase-1,释放炎症因子 IL-1β 和 IL-18[20-21]。最近大量研究发现,激活的caspase-1,能够切割下游的GSDMD,引起细胞焦亡,刺激机体的不同的免疫效应[22]。本研究发现,共转染RIPK2和caspase-1到3种KIF11表达水平不同的细胞中可激活细胞焦亡通路,伴随caspase-1 p20、GSDMD-NT和 cleaved IL-1β 表达上调,在KIF11低表达的细胞发生明显的细胞焦亡,野生和过表达的细胞相对较少。因此,我们推测,KIF11低表达是不是能够介导细胞焦亡的发生。随后,通过PI和Hoechst染色和LDH释放实验,发现KIF11低表达的细胞PI染色和LDH明显上调。以上结果表明,KIF11作为一个癌基因,在caspase-1的介导下能够影响细胞死亡方式。
综上所述,本研究通过生物信息学分析验证了KIF11作为一个癌基因,在多种恶性肿瘤中高表达,同时通过RIPK2激活caspase-1,能够调控KIF11介导的细胞焦亡的发生。不同细胞死亡方式激活机体不同的免疫效应,通过抑制细胞内KIF11的表达,不仅能够抑制恶性肿瘤的侵袭和转移,还可激活机体内免疫效应,进一步清除肿瘤细胞。因此,KIF11抑制剂和小分子药物的开发,可为临床抑制恶性肿瘤,提高肿瘤患者的生存期提供新的研究方向。对于其他恶性肿瘤的发生,低表达KIF11是否仍然能够介导caspase-1依赖性的细胞焦亡,仍需进一步研究论证。

Figure 5. KIF11+/- cell lines were more likely to induce pyroptosis by co-transfection plasmids of RIPK2 and caspase-1. A and B: PI-positive cell number was increased in KIF11+/- cells were measured by microscope (×20); C: the intracellular LDH release was significantly increased in KIF11+/- cells; D: the protein expression of cleaved GSDMD was detected by immunofluorescence staining. Mean±SD. n=3. *P<0.05, **P<0.01 vs WT group.图5 KIF11低表达的细胞更容易发生细胞焦亡

Figure 6. Pyroptosis pathway was activated by co-transfection of RIPK2/caspase-1. Pyroptosis-related proteins were detected by Western blot. Mean±SD. n=3. *P<0.05, **P<0.01 vs WT-pCIG group; ##P<0.01 vs WT group; △P<0.05, △△P<0.01 vs KIF11+/- group.图6 共转染RIPK2和caspase-1激活细胞焦亡通路
