按揉承山穴对CCI 模型大鼠机械足反射阈值及坐骨神经形态学影响研究
2023-02-04王建珠鲍云帆杨小存田志刚唐燕定
王建珠,鲍云帆,杨小存,田志刚,唐燕定,郝 锋*
1.南京中医药大学针灸推拿学院,江苏 南京 210023;2.南京医科大学附属儿童医院,江苏 南京 210093
疼痛是临床中多种疾病共有的症状之一。 2020年,国际疼痛研究学会(International Association for the Study of Pain, IASP)将疼痛定义修订为:“疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验,或与此相似的经历。 ”[1-2]神经病理性疼痛(neuropathic pain, NP)是常见的一种疼痛,由外伤或疾病引起,造成外周神经损伤,患者会表现出自发性疼痛、感觉异常、痛觉过敏等症状体征,且疼痛感明显、持续时间长[3],是人类最难治疗的疾病之一。 神经病理性疼痛作为推拿临床的常见病种,近年来逐渐成为推拿基础研究的热点之一[4-5],但推拿手法的镇痛机制仍有待深入研究。 相关研究发现,推拿对坐骨神经慢性压迫损伤(chronic constriction injury of the sciatic nerve, CCI)模型大鼠的疼痛有良好的镇痛效应,并改善其后肢步态,延缓腓肠肌的萎缩[6-7]。神经源性肌肉萎缩是常见的肌萎缩原因之一,当运动神经元或者神经纤维损伤时,它们所支配的肌肉就会发生以萎缩为主的改变[8]。 本研究拟观察推拿按揉法(下文简称按揉法)在承山穴操作对CCI 模型大鼠机械足反射阈值(paw withdrawal threshold, PWT)及坐骨神经形态学的影响,为推拿手法的镇痛作用提供理论依据。
1 材料
1.1 实验动物
清洁级雄性SD 大鼠共24 只,体质量180~220 g,由上海斯莱克实验动物有限责任公司提供[实验动物许可证号:SCXK(沪)2017-0005]。分笼成对饲养,正常饮水,室温(22±1) ℃,湿度40%~50%,12 h/12 h昼夜节律交替。 饲养地点为复旦大学上海医学院实验动物科学中心,清洁级。 动物保护及动物使用规范均按照国际疼痛研究学会的规定严格进行。
1.2 主要药品和仪器
大鼠推拿操作固定装置(自制);剃毛器(型号:HP6341/00,美国Philips 公司);医用缝合针(型号:4-0 角针1/2,上海汉康医疗器械有限公司);可吸收外科缝线(型号:4-0,山东博达医疗用品有限公司);von-Frey 纤毛(型号:NC12775,美国Stolting 公司);石蜡切片机(型号:RM2415,德国Leica 公司);切片漂烘温控仪(型号:QP-B1,安徽电力科学研究所);电子光镜(型号:CX-31,日本Olympus 公司);无线触觉力测量指套(型号:Grip 系统,美国Finger TPS公司)。
2 方法
2.1 动物分组
将24 只SD 雄性大鼠按照随机数字表法分为空白组(N 组)、模型组(M 组)和按揉承山穴组(T组),每组8 只。
2.2 CCI 模型制备
参照CCI 大鼠模型制备方法[9]进行造模,于大鼠右后肢进行造模手术。 具体操作步骤[10]:(1)使用戊巴比妥钠对大鼠进行麻醉,待大鼠深度麻醉后,剔除大鼠右后肢手术部位的鼠毛;(2)深度麻醉成功后将大鼠侧卧位,用手术镊将大鼠舌头拉出口腔防止窒息,用聚维酮碘及乙醇对手术部位皮肤进行消毒;(3)用手术剪在大鼠右股骨中段后方约1 cm 处,以平行于股骨的方向切开皮肤、暴露肌肉,再用尖头弯钳经过股二头肌间隙对肌肉进行钝性分离,直至可见坐骨神经[11],接着用实验动物手术扩张器在切口处打开手术视野,用玻璃分针将坐骨神经和粘连的软组织轻柔分离;(4)在坐骨神经分成三支前的神经主干部位游离约7 mm 左右的坐骨神经,在离坐骨神经分叉处上方约2 mm 处起,用生理盐水浸泡过12 h 的铬制羊肠线(规格为4-0)结扎坐骨神经,结扎线间隔约1 mm,共扎3 道,结扎时应随时观察结扎线的松紧度,保证坐骨神经的血供,结扎的松紧度以打结时大鼠后肢肌肉出现轻微抽动并且线结能在游离出的坐骨神经上轻微滑动为宜;(5)结扎完毕后用生理盐水进行局部冲洗,逐层缝合手术部位的肌肉及皮肤,并对模型大鼠用硫酸阿米卡星(10 mg/kg)进行预防性腹腔注射,防止发生感染;(6)术后大鼠用红外灯保暖处理,直至大鼠恢复知觉。 术后模型大鼠成对饲养,自由饮水和进食。
2.3 推拿干预方法
对CCI 模型大鼠右后肢承山穴行拇指按揉法[12]干预,10 min/次,1 次/d,连续干预14 d。 手法操作时,操作者右手拇指戴上由美国Finger TPS 公司生产的无线触觉力指套,按揉法操作的干预参数设定压力为5 N,频率为2 Hz。
2.4 各组动物的处理
N 组不作特殊处理;M 组仅进行CCI 模型造模;T 组行CCI 模型造模术,并于术后第4 天起对模型大鼠右后肢承山穴行拇指按揉法干预,方法见“2.3 推拿干预方法”。
2.5 观察指标及检测方法
实验进行阶段,分别于造模前、造模后1 d、3 d、7 d、10 d、14 d、17 d 观察各组大鼠PWT。待实验干预结束后,对各组实验动物取材,将各组大鼠坐骨神经行HE 染色后在电子光镜下观察神经纤维的变化。
2.5.1 PWT 测定 采用von-Frey 方法测试各组大鼠的PWT。 用不同粗细的纤毛刺激大鼠足底,能够引起大鼠缩爪反应的最小纤毛克数即为PWT[10,13]。将大鼠置于孔径为正方形(规格为10 mm×10 mm)的金属网格平台,使用透明有机玻璃框架(规格为20 cm×20 cm×20 cm)将大鼠隔开,框架顶部盖有预留直径1 cm 透气孔的有机玻璃盖。正式测试前须将大鼠置于测试环境中连续适应3 d。 正式测试时,大鼠需静置于测试笼中30 min 以适应环境,然后再开始测试[10]。测试方法:用1~26 g 不同等级的von-Frey 纤毛进行测试,由低刻等级逐级向高刻等级进行测试,测试时用von-Frey 纤毛刺激大鼠的右后肢足底心,加压至纤毛弯曲至90°左右,同等压力持续5 s,如果大鼠在5 s 内出现缩足,记录相应等级克数为1个“+”,如未缩足,则记录相应等级克数为1 个“-”;每个von-Frey 纤毛克数等级测试5 次,每次测试间隔5 min,5 次测试中出现3 次大鼠缩足反应(记作3 个“+”号),则停止向高一等级克数测试, 改为向低一等级克数重复测试,确定下一等级不出现3 个“+”号。 PWT 为首个出现3 个“+”的von-Frey 纤毛克数等级[10,14]。
2.5.2 HE 染色 (1)取材:用25%乌拉坦将大鼠深度麻醉后断头处死,并迅速将大鼠置于冰上进行取材。剪开局部皮肤,用手术剪在大鼠右股骨中段后方约1 cm 处,以平行于股骨的方向切开皮肤、暴露肌肉,再用尖头弯钳经过股二头肌间隙对肌肉进行钝性分离[11],暴露坐骨神经,剥离包裹在坐骨神经周围的软组织,迅速剪取结扎部位上方5~10 mm 长度的坐骨神经,用生理盐水冲洗,迅速置于装有多聚甲醛的1.5 mL EP 管中进行后固定待用[10]。(2)包埋及切片:用石蜡对组织进行包埋,组织切片采用石蜡切片机。(3)HE 染色流程:修蜡块、切片、展片、贴片、烤片(55~60 ℃)[10],二甲苯2 min,100%无水乙醇2 min,95%乙醇2 min,80%乙醇2 min,70%乙醇2 min,蒸馏水2 min,Harrys 苏木素1 min,自来水洗5 min,1%盐水乙醇液分化30 s(分色),饱和碳酸锂30 s,自来水2 min,蒸馏水2 min,0.5%伊红5 min,蒸馏水速洗,95%乙醇2 min×2 次,100%乙醇2 min×2次,石碳酸二甲苯30 s,二甲苯3 min×3 次,中性封固树胶。
3 结果
3.1 大鼠右后足PWT
与N 组相比,M 组大鼠的PWT 在造模后1 d出现下降(P<0.05),3 d、7 d、10 d、14 d、17 d 持续降低(P<0.01)并逐渐保持稳定,说明CCI 模型大鼠在造模后出现了机械痛觉过敏。
与造模前相比,T 组大鼠的PWT 在造模后1 d出现了明显下降,在3 d 达到最低(P<0.01),说明CCI 模型大鼠造模成功。 从第4 天起行按揉承山穴操作干预,至14 d,PWT 与造模前相比差异有统计学意义(7 d,P<0.01;10 d、14 d,P<0.05);至17 d 与造模前差异无统计学意义(P>0.05)。
与N 组相比,T 组大鼠的PWT 在CCI 造模术后有明显降低(1 d、3 d、7 d,P<0.01;14 d,P<0.05),10 d 及17 d 的PWT 与N 组差异无统计学意义(P>0.05)。 详见表1、图1。
表1 各组大鼠右后足PWT 变化(±s,n=8,g)

表1 各组大鼠右后足PWT 变化(±s,n=8,g)
注:与N 组相比,*P<0.05,**P<0.01;与造模前相比,#P<0.05,##P<0.01。
组别N 组M 组T 组造模前17.1±5.7 16.4±3.9 15.8±4.5造模后1 d 18.5±6.4 9.0±3.5*8.6±3.6**##造模后3 d 16.5±5.2 6.8±1.5**7.1±4.4**##造模后7 d 17.1±5.7 7.3±2.1**8.8±4.5**##造模后10 d 16.5±6.3 6.0±1.9**9.9±2.5#造模后14 d 17.8±5.1 6.0±1.1**10.1±2.2*#造模后17 d 16.4±3.9 6.5±2.1**12.0±3.3
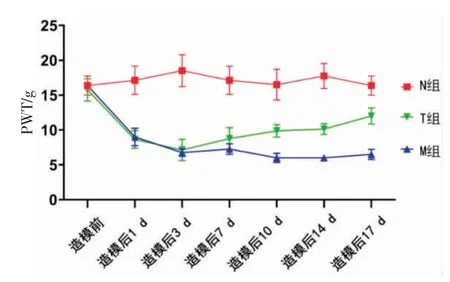
图1 各组大鼠右后足PWT 变化
3.2 各组大鼠坐骨神经HE 染色结果
坐骨神经切片HE 染色观察可见:N 组大鼠坐骨神经横切面完整,神经纤维排列紧密,神经纤维外膜、神经束膜及神经内膜完整,神经外膜较疏松且可见血管,神经突起被髓鞘包绕,髓鞘完整,未见脱髓鞘样改变;M 组大鼠坐骨神经外膜及神经束膜增厚明显,结构相对完整,神经内膜疏松碎裂,内可见血管,部分神经纤维呈脱髓鞘样改变,髓鞘肿胀、分裂;T 组大鼠坐骨神经外膜及神经束膜增厚明显,结构相对完整,神经外膜较致密,外可见结缔组织包裹,神经内膜及外膜内均可见血管,神经内膜较疏松,可见裂隙,部分神经纤维呈脱髓鞘样改变,部分髓鞘空泡状,可见髓鞘完整的正常形态神经纤维。 详见图2~3。
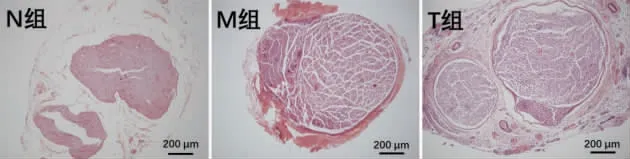
图2 各组大鼠坐骨神经HE 染色结果(×100)

图3 各组大鼠坐骨神经HE 染色结果(×400)
4 讨论
颈肩腰腿痛是中医推拿科常见病种,全球颈肩腰腿痛发病率占疼痛疾病的50%~60%[15],其中相当部分患者属于神经病理性疼痛,诸如颈椎间盘突出症、腰椎间盘突出症、外周神经干或神经分支卡压综合征等[16]。 古籍中早有推拿镇痛的理论记载,如《医宗金鉴·正骨心法要旨》中载有:“按其经络,以通郁闭之气,摩其壅聚,以散瘀结之肿”,说明推拿是行气止痛、消散瘀滞的要法[17-18]。 虽然临床中推拿干预神经病理性疼痛有很好的镇痛效果,但目前研究还存在不足,推拿手法镇痛机制尚未明确。
目前,神经病理性疼痛研究的动物模型中,CCI模型是最常用的动物模型[19]。 承山穴为临床治疗腰腿痛穴位处方中出现频次排名第五的腧穴[20],承山穴作为针灸处方中的主穴,出现的频率也较高[21]。WU 等[22]通过解剖研究发现,承山穴和坐骨神经之间通过感觉和运动通路相关联,虽然承山穴和坐骨神经相关的感觉和运动神经源在标记数量上有所不同,但它们却分布在相同的脊柱节段和中枢靶区。而曹乾安等[23]通过力敏腧穴探查发现,承山穴是腰痛患者的力敏穴位之一,承山穴的力敏阈值也随治疗过程中病情的缓解而逐渐升高。 胡涛涛[24]在其实验研究中认为,神经功能恢复、再生神经纤维密度、再生神经髓鞘形成、腓肠肌恢复率等是坐骨神经损伤修复的重要指标。 基于以上研究基础,本研究团队认为,神经解剖学的连接可能是承山穴治疗坐骨神经疾病作用机制的重要环节,推拿按揉承山穴有助于CCI 大鼠坐骨神经损伤的修复,从而达到镇痛效应。
本实验结果显示,模型组大鼠在CCI 造模后1 d其PWT 即出现了降低,直至实验结束,说明造模后大鼠出现了明显的痛觉过敏现象。 按揉承山穴组大鼠的PWT 在造模后的1 d 和3 d 出现了明显的下降,说明CCI 模型造模成功,术后第4 天起推拿按揉法介入,从术后7 d 开始,按揉承山穴组大鼠的PWT 有升高趋势,尤其是10 d 和17 d 的PWT 接近正常水平,说明按揉承山穴对CCI 模型大鼠有显著的镇痛效应。坐骨神经HE 染色结果显示,模型组大鼠的坐骨神经脱髓鞘明显,而按揉承山穴组大鼠坐骨神经外膜及神经束膜较空白组有所增厚,结构相对完整,神经外膜较致密,外可见结缔组织包裹,内含丰富血供,神经内膜较疏松,可见裂隙及部分神经纤维呈脱髓鞘样改变,部分髓鞘空泡状,可间见结构完整的神经纤维,说明按揉承山穴对坐骨神经的损伤起到了良性的作用。 本实验研究结果表明,按揉承山穴有明确的镇痛效应,且对损伤的坐骨神经形态学产生了一定的良性影响,其镇痛机制可能与延缓周围神经损伤及神经损伤脱髓鞘后髓鞘再生有关。本实验为推拿手法镇痛提供了一定的理论依据与实验基础,按揉承山穴镇痛作用与神经损伤修复之间的关系还有待进一步深入研究。
