基于网络药理学探讨逍遥散调控多囊卵巢综合征子宫内膜容受性的作用机制及实验验证
2023-02-04何忆清李哲靓余歌星苏艳红刘慧萍
王 茜,何忆清,李哲靓,余歌星,苏艳红,刘慧萍,杨 硕*
湖南中医药大学,湖南 长沙 410208
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是引起育龄期女性不孕的主要疾病之一,占育龄期女性的6%~10%,且发病率呈逐年上升趋势,严重影响女性生殖健康[1]。 其中,排卵障碍与子宫内膜容受性不良是PCOS 患者不孕最重要的两大因素, 现代医学尝试多种方法,往往导致高排低孕,疗效不佳。如何提高临床妊娠率和胚胎质量,同时降低子宫内膜容受性不良造成的生化妊娠、自然流产等风险,一直是生殖医学界亟待解决的难点问题。 本课题组前期临床研究发现,补肾调泡周期治疗组(以逍遥散、三子汤为基础)总疗效明显优于对照组(克罗米芬组)(P<0.01),且治疗组治疗后宫内膜厚度及内膜类型明显优于对照组,A 型、B 型子宫内膜所占比例明显高于对照组,差异均具有统计学意义(P<0.01)[2]。 补肾调泡周期疗法在提高胚胎着床率和临床妊娠率方面取得了显著的临床疗效。 但其有效性分子机制不明,有待进一步实验探索。
逍遥散出自宋代《太平惠民和剂局方》,方由柴胡、当归、白芍、白术、茯苓、生姜、薄荷、甘草组成,具有调和肝脾、疏肝解郁、养血健脾之功效[3]。 研究表明[4-7],逍遥散能增加子宫内膜厚度,改善子宫内膜血供,为胚胎着床创造适宜的微环境。 近年来,中医药改善子宫内膜容受性的相关研究日益增多,研究结果表明,中医药能提高子宫内膜容受性且疗效显著[8]。 为进一步探究逍遥散通过何种机制发挥改善PCOS 子宫内膜容受性的作用,本研究运用网络药理学方法,对逍遥散改善PCOS 子宫内膜容受性的核心中药、核心成分、作用靶点、信号通路加以预测及分析。结合体外细胞实验加以验证,在分子水平层面初步探究逍遥散改善子宫内膜容受性的作用机制,为其后续进一步动物实验研究与临床应用提供依据。
1 材料与方法
1.1 网络药理学分析
1.1.1 逍遥散方组成分、靶点收集 应用中草药系统药理学平台TCMSP(http://tcmspw.com/index.php/)和中医百科全书ETCM(http://www.tcmip.cn/ETCM/index.php/)数据库,输入关键词“柴胡”“当归”“白芍”“白术”“茯苓”“甘草”“生姜”“薄荷”。 以口服生物利用度(oral-bioavailability, OB)≥30%、类药性(druglikeness, DL)≥0.18 为筛选条件,构建活性成分数据库,并利用TCMSP 数据库中靶点预测模型预测所筛选出化合物的潜在作用靶点;ETCM 数据库中以类药性评分(drug-likeness grading)≥0.49 为活性成分筛选条件,以候选基因评分(candidate target genes)>0.8 为靶蛋白筛选条件,将两个数据库中的数据合并,删除重复项,构建成分对应靶蛋白数据库。
1.1.2 PCOS 子宫内膜容受性基因收集 以“polycystic ovary syndrome”为检索式在人类基因组注释数 据 库GeneCards(https://www.genecards.org/)和 在线《人类孟德尔遗传》数据库(online mendelian inheritance in man, OMIM)(https://www.ncbi.nlm.nih.gov/omim/)数据库检索,合并删除重复靶点,得到PCOS 疾病靶点。 在美国国立生物技术信息中心(National Centerfor Biotechnology Information, NCBI)(https://www.ncbi.nlm.nih.gov/)的基因表达数据库GEO(Gene Expression Omnibus, GEO)(https://www.ncbi.nlm.nih.gov/geo/)以“endometrial receptivity”进 行 检索,查看所有结果。 具体数据筛选标准如下:(1)物种为人;(2)样本数量>30[9];(3)子宫内膜容受性不良;本研究使用基因芯片数据集GSE111974 进行后续分析,该数据集包含正常子宫内膜组织24 例,反复植入失败子宫内膜组织24 例。 利用R 语言(https://www.r-project.org/) 对每个样本进行背景校正处理;设置|log2FC|>1,P<0.05 为DEG 截取阈值;最后运用R 语言对差异基因进行可视化分析。 将PCOS 疾病靶点与子宫内膜容受性不良差异表达基因取交集,得到PCOS 子宫内膜容受性不良相关基因。
1.1.3 逍遥散调控PCOS 子宫内膜容受性靶点基因预测 将逍遥散活性成分对应靶蛋白与“1.1.2”项下筛选的PCOS 子宫内膜容受性不良相关基因进行匹配取交集,得到逍遥散调控PCOS 子宫内膜的靶基因,绘制韦恩图展示交集。
1.1.4 PPI 网络的构建 将上述“1.1.3”项下获得的交集基因靶点信息提交至功能蛋白联系网络数据库(STRING)(https://string-db.oyrg/),设置生物种类为人,置信度>0.7,得到的PPI 网络图,应用R 语言统计出现频次前20 的靶点并绘制条形图。
1.1.5 GO 富集与KEGG 通路分析 在R 语言安装“Biconductor”与“Cluster Profiler”软件包,以P<0.01为卡值进行靶点基因的GO 与KEGG 富集分析,结果用条形图展示。
1.1.6 逍遥散调控子宫内膜容受性核心中药、 成分筛选 通过靶点基因映射,建立中药、活性成分、通路间的对应关系。将“中药-成分”“成分-核心靶点”“核心靶点-通路”对应关系及属性导入Cytoscape(https://www.bytesin.com/software/Cytoscape/),建立逍遥散调控PCOS 子宫内膜容受性“中药-成分-核心靶点-通路”网络。并使用Cytoscape 的Network Interpretation工具进行网络分析,以Degree≥10 筛选网络中核心中药[9]。
1.2 体外实验验证
1.2.1 被试药物 逍遥散汤剂组方:柴胡6 g,当归10 g,白芍10 g,白术10 g,茯苓10 g,生姜3 g,薄荷3 g,炙甘草5 g。 根据上述网络药理学“1.1.6”的筛选结果,逍遥散核心中药即柴胡、白芍、薄荷、炙甘草4 味。 因此逍遥散核心中药组方:柴胡9 g,白芍15 g,薄荷4.5 g,炙甘草7.5 g(剂量为原方剂量1.5 倍,当药味减少可适当增加药物剂量,符合临床用药规律[10])。以上饮片购自湖南中医药大学第一附属医院门诊部中药房。 阿司匹林肠溶片(批号:210503,规格:50 mg/片,湖南新汇制药股份有限公司)购自湖南中医药大学第二附属医院。
1.2.2 动物和含药血清制备 健康SD 大鼠20 只,雌性,SPF 级,体质量220~250 g,购自湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘)2019-0004,动物质量合格证号:430727211102348847,动物饲养于湖南中医药大学实验动物中心,昼夜交替12 h,温度22~26 ℃,湿度40%~50%。 动物实验经湖南中医药大学实验动物伦理委员会批准(伦理号:LL2021101306)。 按“1.2.1”项剂量分别称取逍遥散及逍遥散核心中药,将薄荷、生姜以外的饮片分别混合并浸泡30 min,煎煮2 次,第1 次加10 倍量水,煎煮30 min,第2 次加8 倍量水,煎煮20 min,在煎煮结束前5 min 加入薄荷、生姜,合并两次煎液离心滤过,滤液减压分别浓缩至含生药浓度为2.66、2.40 g·mL-1,阿司匹林肠溶片用0.5%羧甲基纤维素钠配制成含药浓度为10 mg·mL-1的溶液。参照国锦等的方法[11],20 只SPF 级SD 雌性大鼠,常规适应性喂养1 周后,按随机数字表法分为空白组、逍遥散组,逍遥散核心中药组、阿司匹林组,每组5 只,各含药血清组均以临床等效剂量的5 倍进行灌胃,给药剂量分别为30 g·kg-1、18.9 g·kg-1、39.375 mg·kg-1,空白组给予等体积的生理盐水灌胃,2 次/d,连续3 d,末次灌胃后1 h,大鼠腹腔注射2%戊巴比妥钠麻醉,腹主动脉采血,随后脱颈椎处死。 全血静置2 h待血液凝固后3000 r·min-1离心(离心半径17.8 cm)15 min,取上层血清,于恒温水浴锅56 ℃灭活30 min,经0.22 μm 过滤器滤过后分装,于-80 ℃保存。
1.2.3 细胞 人子宫内膜Ishikawa 细胞, 购自中国武汉普诺赛生命技术有限公司,批号:CL-0283,STR鉴定正确。
1.2.4 试剂 胰蛋白酶-EDTA 消化液(0.25%)含酚红(批号:PB180226)、青霉素-链霉素溶液(批号:PB180120)、PBS 缓冲液(批号:PB180327)、RPMI-1640 培养基(批号:PM150110)、Ishikawa 细胞专用培养基(批号:CM-0283)购自武汉普诺赛生命科技有限公司;蛋白酶抑制剂混合物(批号:CW2200S)购自江苏康为世纪生物科技股份有限公司;BCA 蛋白定量试剂盒(批号:E-BC-K318-M)购自武汉伊莱瑞特生物科技股份有限公司;ECL 高效化学发光试剂盒(批号:GE2301-100)购自美国Genview 公司;环氧合酶2(COX2)抗体、血管内皮生长因子(VEGF)抗体(批号分别为:R23969、251622)购自成都正能生物技术有限责任公司;GAPDH 抗体、整合素αvβ3抗体、蛋白激酶C(PKC)抗体、血管内皮生长因子受体-2(VEGFR2)抗 体(批 号 分 别 为:AF7021、AF6086、AF6196、AF6281)购自美国Affinity 公司;HRP 标记的山羊抗兔IgG 抗体(批号:E-AB-1003)购自武汉伊莱瑞特生物科技股份有限公司;超纯总RNA 提取试剂盒(批号:5003050)购自杭州新景生物试剂开发有限公司;逆转录试剂盒、扩增试剂盒(批号:E047-01B、E096-01A)购自上海近岸科技有限公司;VEGF、VEGFR2、COX2、PKC、整合素αvβ3、GAPDH 引物由北京擎科生物科技有限公司合成。
1.2.5 仪器 CO2培养箱(德国Heraeus 公司);SWCJ-1FD 超净工作台(苏州苏净仪器自控设备有限公司);Heraeus Fresco 17 型超速冷冻离心机(美国Thermo Fisher Scientific 公司);Cytation 3 型多功能酶标仪 (美国Bio-Tek 公司);T100 Thermal Cycler qRT-PCR 仪;Chemi-DoC-XRS+化学发光成像分析仪;Mini-PROTEAN Tetra 型 电 泳 槽、Mini Trans-Blot 型转印槽(美国Bio-Rad 公司)。
1.2.6 细胞分组及干预 子宫内膜细胞Ishikawa 为贴壁细胞,细胞置于Ishikawa 细胞专用培养基,37 ℃、5% CO2培养。 稳定传代,将处于对数生长期的Ishikawa细胞以2×106/孔接种于6 孔板,待细胞贴壁,用不含胎牛血清的RPMI-1640 培养基饥饿处理24 h,使细胞周期同步化。设置空白对照组、逍遥散组、逍遥散核心中药组和阿司匹林组;各组分别加入含10%血清的RPMI-1640 培养液,干预24 h。
1.2.7 Western blot 检测含药血清对人子宫内膜Ishikawa 细胞VEGF、VEGFR2、COX2、PKC 和整合素αvβ3 蛋白表达的影响 按“1.2.6”项下方法处理细胞和分组,用等渗PBS 润洗2~3 次,充分去除残留的培养基,收集各组细胞,加入含蛋白酶抑制剂的RIPA 裂解液,冰上裂解30 min,将细胞和裂解液转移至1.5 mL EP 管中,提取细胞总蛋白。 按BCA 蛋白定量试剂盒说明书操作进行蛋白质量浓度测量,然后配制上样体系。 蛋白样品经SDS-聚丙烯酰胺凝胶电泳,转至PVDF 膜上,加入5%牛奶室温封闭60 min,分 别 加 入GAPDH(1∶8000)、VEGF(1∶2000)、VEGFR2(1∶2000)、COX2(1∶2000)、 PKC(1∶2000)和整合素αvβ3(1∶2000)抗体,4 ℃孵育过夜;TBST 清洗3次,加入山羊抗兔二抗(1∶10 000),37 ℃孵育60 min,TBST 清洗3 次;采用ECL 高效化学发光试剂盒显影,采用Image Lab软件分析条带灰度值。
1.2.8 qRT-PCR 检测含药血清对人子宫内膜Ishikawa 细 胞VEGF、VEGFR2、COX2、PKC 和 整 合素αvβ3 mRNA 表达的影响 按“1.2.6”项下方法处理细胞和分组,按照试剂盒说明书提取细胞总RNA,然后转录成cDNA,运用qRT-PCR 检测各组中各mRNA 的表达。 以GAPDH 为内参计算上述关键基因的相对表达量,计算公式:ΔΔCt=(样品Ct 均值-内参照Ct 均值)-(对照样品Ct 均值-对照内参照Ct均值),将各组获得目的基因和对照基因Ct 值求平均值,采用相对定量法计算各组相对于空白组的2-ΔΔCt值。 基因引物序列详见表1。

表1 qRT-PCR 引物信息
1.3 统计学分析
采用SPSS 25.0 统计软件进行统计学分析。 计量资料以“±s”表示,进行正态性检验。 服从正态分布且方差齐性的计量资料,两组间比较采用独立样本t 检验;如不满足正态分布且方差齐性时,两组间比较用Wilcoxon 秩和检验。 多组计量资料比较,符合方差齐性采用单因素方差分析,方差不齐时采用非参数秩和检验。两变量间关系运用直线相关分析。计数资料采用完全随机设计多样本比较的秩和检验。 以P<0.05 为差异有统计学意义。
2 结果
2.1 网络药理学分析
2.1.1 逍遥散方主要成分 通过对TCMSP、ETCM数据库的检索,并删除重复项后,获得161 个活性成分,其中柴胡17 个、白芍13 个、当归2 个、白术7个、茯苓15 个、生姜5 个、薄荷10 个、甘草92 个。将活性成分对应的靶点输入UniProt 数据库,删除无效与重复的靶点,得到逍遥散有效活性成分的作用靶点222 个。
2.1.2 PCOS 子宫内膜容受性基因 通过对GeneCards和OMIM 数据库检索,合并删除重复靶点,得到5451 个PCOS 疾病靶点。 应用R 语言共筛选出375个子宫内膜容受性不良差异表达基因,其中204 个上调、171 个下调(图1)。 表达出现显著差异排名前40 的基因(图2)。 将PCOS 疾病靶点与子宫内膜容受性不良差异表达基因取交集,得到102 个PCOS子宫内膜容受性不良相关基因。

图1 差异表达基因火山图
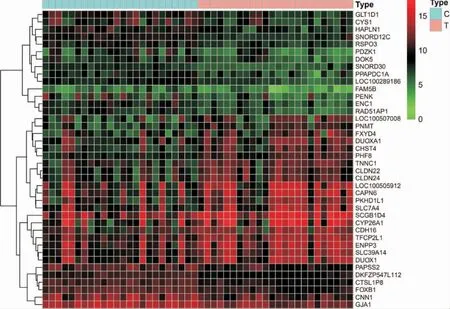
图2 排名前40 差异基因热图
2.1.3 药物-疾病相关基因共同靶点 在Venny 2.1网站(https://bioinfogp.cnb.csic.es/tools/venny/index.html)将PCOS 子宫内膜容受性不良相关基因与逍遥散活性成分靶点基因分别导入,取交集,共得出29 个交集基因,并绘制韦恩图。 详见图3。
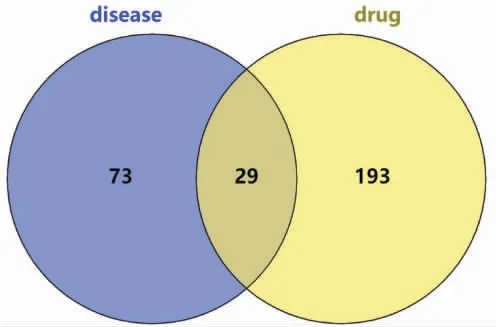
图3 PCOS 子宫内膜容受性不良相关基因与逍遥散靶点基因交集韦恩图
2.1.4 共同靶点PPI 分析 将共同靶点导入STRING数据库,获得29 个节点、73 条边的PPI 网络图,见图4。 其中蛋白互作频次较高的有前列腺素内过氧化物合酶2(PTGS2),基质金属蛋白酶2(MMP2),过氧化物酶体增生激活受体γ(PPARG)等是整个网络的节点蛋白。

图4 PPI 蛋白互作网络图
2.1.5 GO 富集和KEGG 通路分析 通过R 语言对逍遥散-疾病差异表达基因共同靶点涉及的生物学过程和分子功能进行GO 富集(图5A),结果显示共同靶点共富集得到22 个GO 条目,主要涉及脂质与动脉粥样硬化、流体剪切应力与动脉粥样硬化、蛋白多糖等分子功能;KEGG 共富集了14 条通路(图5B),关键靶标主要富集在P53、NF-κB、AGE-RAGE、VEGF等信号通路,上述通路可能是逍遥散改善PCOS 患者子宫内膜容受性的关键调节通路,而PTGS2、HMOX1、VCAM1 是各通路主要的富集基因。多项文献研究[12-15]发现,PCOS 患者子宫内膜容受性低与血管生成及VEGF 密切相关;再结合GO、KEGG的富集结果,逍遥散调控PCOS 患者子宫内膜容受性的可能机制主要与血管生成、VEGF 信号通路(图6)相关。因此,我们首先选择VEGF 信号通路进行体外实验验证。

图5 GO 功能(A)和KEGG 通路(B)富集分析条形图
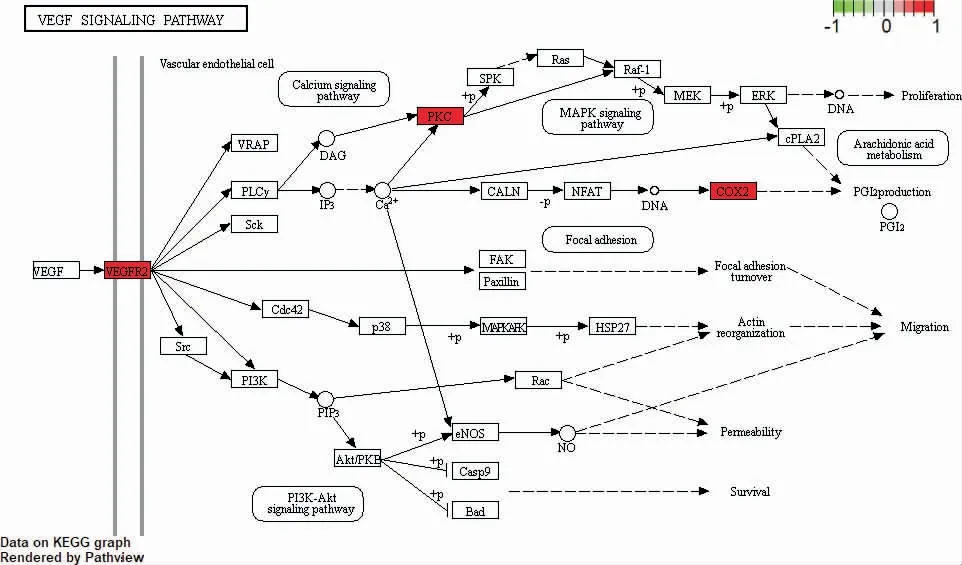
图6 VEGF 信号通路
2.1.6 逍遥散调控PCOS 子宫内膜核心中药 将29 个核心靶点通过映射,构建“中药-成分-核心靶点-通路”网络(图7)。 对“中药-活性成分-核心靶点-通路”网络中的中药、活性成分进行Degree 评价,以Degree≥10 为卡值筛选核心中药、核心成分,得出核心中药为柴胡、白芍、薄荷、甘草。
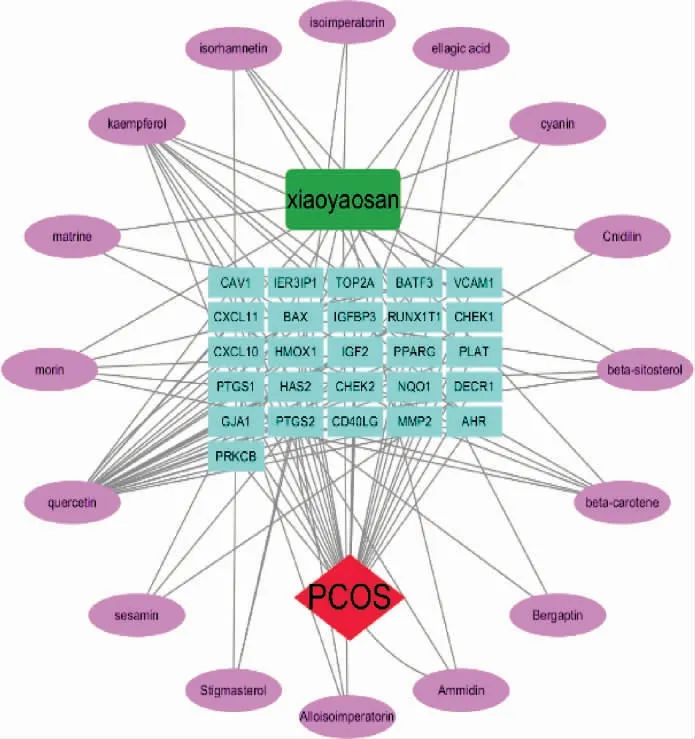
图7 “中药-活性成分-核心靶点-通路”网络图
2.2 实验验证结果
2.2.1 含药血清对人子宫内膜Ishikawa 细胞VEGF、VEGFR2、COX2、PKC 和整合素αvβ3 蛋白表达的影响 与空白组比较,逍遥散组、核心中药组、阿司匹林组细胞VEGF、VEGFR2、COX2、PKC 和整合素αvβ3蛋白表达水平均明显升高,差异有统计学意义(P<0.05,P<0.01);各给药组间差异无统计学意义(P>0.05)。详见图8。

图8 含药血清对人子宫内膜Ishikawa 细胞VEGF、VEGFR2、COX2、PKC 和整合素αvβ3 蛋白表达的影响(±s,n=3)
2.2.2 含药血清对人子宫内膜Ishikawa 细胞VEGF、VEGFR2、COX2、PKC 和 整 合 素αvβ3 mRNA 表 达的影响 与空白组比较,逍遥散组、核心中药组、阿司匹林组细胞VEGF、VEGFR2、COX2、PKC 和整合素αvβ3 mRNA 表达水平均明显增高,差异有统计学意义(P<0.05,P<0.01);各给药组间差异无统计学意义(P>0.05)。 详见图9。

图9 含药血清对人子宫内膜Ishikawa 细胞VEGF、VEGFR2、COX2、PKC 和 整合素αvβ3 mRNA 表达的影响(±s,n=3)
3 讨论
PCOS 是育龄期女性最常见的一种妇科内分泌疾病。在临床中发现PCOS 患者临床妊娠率、持续妊娠率均显著低于正常女性[16]。 相关研究表明[17],在形态学方面,PCOS 患者黄体期子宫内膜厚度较正常女性明显偏薄,子宫动脉搏动指数(plusatility index PI)与阻力指数(resistance index, RI)升高,子宫血流减少,子宫内膜种植窗期胞饮突表达缺陷。在分子生物学方面,PCOS 患者子宫内膜容受性调控因子表达降低,包括整合素αvβ3、白血病抑制因子(leukemia inhibitory factor, LIF)、同源框(homeobox, HOX)基因中HOXA10、血管内皮生长因子(vascular endothelial growth factor, VEGF)、性激素及其受体等。在临床中,即使是优秀的胚胎通过体外受精移植,也难以改变PCOS 患者的高流产率[18-19]。如何改善子宫内膜容受性,提高妊娠率,降低生化妊娠、自然流产的风险是我们攻克PCOS 不孕的最后一道障碍也是生殖医学界亟待解决的难题。
中医学中多将PCOS 归属于“月经后期”“月经过少”“闭经”“崩漏”“不孕”等范畴。 柯印霞等[20]在PCOS 中医病因病机临床分析的研究中表明,病位证素中肾、肝、脾是其主要病位;在实证证素中,气滞积分最高。 由上可知肝郁气滞是PCOS 的重要病证类型,逍遥散的功效与PCOS 的临床证素非常相符。陈兰等[21]在对照组的基础上,运用丹栀逍遥散辅治PCOS 不孕患者,与治疗前及同期对照组相比,丹栀逍遥散辅治能够增加子宫内膜厚度,降低RI、PI,提高妊娠率,有效改善子宫内膜容受性。实验研究表明[22],疏肝法能改善超促排卵小鼠子宫内膜组织形态及血管通透性,增加妊娠率及胚胎着床数。为促进中药复方逍遥散作用机制可视化、证据化的研究与发展,本研究运用生物信息学技术,系统分析了逍遥散改善PCOS 子宫内膜容受性的药效靶点及作用机制。
本研究通过网络药理学构建了逍遥散调控PCOS 子宫内膜容受性的“中药-成分-核心靶点-通路”网络,筛选出逍遥散方组核心中药4 味:柴胡、白芍、薄荷、炙甘草。PPI 交集网络中核心蛋白有PTGS2、MMP2、PPARG、VCAM1、CAV1、HMOX1、CXCL10等,核心蛋白多数存在于富集分析得到的关键通路图中;KEGG 富集分析结果显示,关键靶标主要富集在P53、NF-κB、AGE-RAGE、VEGF 等14 条信号通路。P53 信号通路在蜕膜化进程中扮演重要角色,过度激活P53 信号通路会干扰细胞周期调控因子的表达,细胞周期进入停滞状态,最终导致子宫内膜蜕膜化障碍[23]。 敲除小鼠p53 基因会直接导致LIF 水平下降,LIF 是常用的子宫内膜容受性标志物,对胚胎植入起关键作用,LIF 水平下降使子宫内膜容受性下降进而导致胚胎着床失败[24]。 研究发现,PCOS 患者的着床窗口期子宫内膜呈现NF-κB 低表达,可能使子宫内膜容受性下降[25]。KING 等[26]研究发现,NFκB 在正常对照组着床窗口期子宫内膜的腺上皮细胞和间质细胞的胞浆内均呈阳性表达,与以上研究结果一致,均提示NF-κB 可能参与胚泡着床过程。AGE-RAGE 信号通路能激活NF-κB 信号通路,能增强基质金属蛋白酶(MMPs)、血管内皮生长因子(VEGF)等的表达,从而促进炎症因子的表达和释放,诱导细胞凋亡、促进新生血管生成,从多方面调控子宫内膜[27]。 结合大量文献报道,VEGF 信号通路与所研究的内容关系密切,VEGFR2、PKC 和COX2 是其潜在作用靶点。
Ishikawa 细胞是子宫内膜上皮细胞株,表达雌、孕激素受体,免疫学和生物化学功能类似于正常子宫内膜,可表达正常子宫内膜上皮细胞的酶和结构蛋白,因此,国内外许多子宫内膜容受性相关研究选择Ishikawa 细胞作为载体[28-32]。 本研究进一步通过细胞实验证实逍遥散及逍遥散核心中药组方含药血清均能明显上调人子宫内膜Ishikawa 细胞中VEGF、VEGFR2、COX2、PKC 和整合素αvβ3 的蛋白和mRNA 表达。 整合素αvβ3 在胚泡植入中可以介导胚泡与子宫内膜的双向识别、黏附及植入,是子宫内膜容受性的标记分子之一;逍遥散及逍遥散核心中药组方能明显上调整合素αvβ3 的蛋白和mRNA表达。初步验证,逍遥散及逍遥散核心中药组方具有改善子宫内膜容受性的作用,可能通过VEGF 信号通路上调VEGF、VEGFR2、COX2 和PKC 表达,促进子宫内膜血管生成,从而改善子宫内膜容受性。 VEGF信号通路是逍遥散发挥作用的关键靶标通路,这与LIU 等[33]的研究结果一致;VEGF 是血管内皮细胞特异而强烈的有丝分裂原和血管发生的关键因子[12],由VEGF 介导的各信号通路分别参与血管新生各个过程,直接控制血管新生的发生发展,并在一定程度上决定了血管新生的结果[34]。多项研究[35-36]发现,VEGF在整个月经周期子宫内膜上均有表达, 黄体中期显著增加, 说明VEGF 与子宫内膜的容受性密切相关。 与生育正常的妇女相比,PCOS 患者子宫内膜组织中VEGF 的mRNA 水平较低,VEGF 表达水平降低,影响血管生成及发育,减少子宫内膜血流量,从而导致子宫内膜容受性下降[37]。 VEGFR2 是VEGF主要功能受体,在早期胚胎着床时即表达升高,可在时间和空间上对子宫内膜血管新生进行调节[7]。VEGF 与VEGFR2 结合后,VEGFR2 胞内区1175 位酪氨酸发生磷酸化,随后激活磷脂酶C(PLC),PLC又切割磷脂酰肌醇-4,5-二磷酸(PIP2)转化为肌醇三磷酸酯(IP3)和二酰甘油(DAG),IP3 刺激内质网中Ca2+释放进入细胞质,与DAG 共同激活传统型PKC[38-39]。目前发现PKC 有3 种亚型PKC-α、PKC-β和PKC-ε 均参与VEGF 调控的细胞增殖[40-41]。 有研究发现[42],提高PKC-α 和PKC-ε 的活性能促进人子宫内膜细胞增殖,调控子宫内膜细胞因子和着床相关因子表达,促使子宫内膜达到接受态,胚胎顺利着床。COX2 是介导前列腺素合成的关键酶,在血管通透性和血管生成中也起着关键作用,COX2 缺乏会导致植入失败,其主要原因在于血管生成减少[43]。
本研究基于网络药理学基础,结合体外细胞实验验证,初步证实:逍遥散调控PCOS 子宫内膜容受性的核心中药为柴胡、白芍、薄荷、甘草4 味;逍遥散可通过VEGF 信号通路调控血管生成提高子宫内膜容受性;逍遥散及其核心中药在调控血管生成方面与阿司匹林疗效相当。 该研究从分子、细胞水平和生物信息学技术全面阐述逍遥散药效靶点与作用机制,为深入开展基础研究及临床应用提供了参考依据。 但本研究仅通过现有数据库和相关软件初步筛选逍遥散的有效成分和靶点,仅从细胞层面对筛选的某条通路进行初步验证,仍存在一定局限性。 下一步将通过动物实验和临床研究等进一步阐释逍遥散调控PCOS 子宫内膜容受性的作用机制及量效关系。
