SERPINA1在肝癌组织的表达及临床意义*
2023-02-04彭契六朱春玲韦尚谋罗佳佳甘丽英韦邦宁
彭契六,朱春玲,张 磊,韦尚谋,罗佳佳,甘丽英,张 智,韦邦宁
(1.广西国际壮医医院检验科,南宁 530201;2.南宁市第一人民医院肝胆外科,南宁 530022;3.广西国际壮医医院肝胆外科,南宁 530201)
寻找肝癌转移复发的预警分子和预后标志物,预防和降低术后肿瘤复发转移率,已经成为肝癌研究领域的热点[1]。丝氨酸蛋白酶抑制剂A1(serine protease inhibitor A1,SERPINA1)是丝氨酸蛋白酶抑制剂家族的主要成员,主要由肝细胞合成[2]。SERPINA1具有强烈的催化反应活性,主要通过与酶的活性部位结合,抑制酶的催化作用或阻止酶原转化为活性酶,在调节酶活性和蛋白质代谢,以及细胞生长、分化、运动和信号转导方面发挥重要的作用[3]。近年的研究结果显示,SERPINA1与胃癌、口腔扁平细胞癌和结直肠癌的发生、发展和转移预后相关[4-6],但其在肝癌组织的表达及与肝癌患者预后的关系尚不清楚。本研究旨在分析肝癌组织中SERPINA1表达与肝癌患者术后转移和预后的关系,并在HepG2细胞系中通过慢病毒转染干扰SERPINA1表达,探讨SERPINA1对肝癌细胞侵袭和转移的影响,为肝癌转移的预防和早期干预提供新思路。
1 资料与方法
1.1 肝癌标本
选取2013年1月至2016年6月在南宁市第一人民医院肝胆外科行手术切除的肝癌病例68例和2019年1月至2019年8月在广西国际壮医医院肝胆外科行手术切除的肝癌病例10例,肝癌切除术后收集肝癌组织和癌旁组织(癌组织与正常组织交界处2 cm以内),-80 ℃保存备用。纳入的全部病例均经病理确诊为肝细胞癌。分析78例肝癌患者相关临床资料,所有纳入的病例均在入组前征得患者及其家属的知情同意。本研究经南宁市第一人民医院伦理委员会(NNSY20160503)和广西国际壮医医院伦理委员会(20181201)批准。
1.2 细胞株和试剂
肝癌细胞株HepG2由中国科学院上海生命科学研究院提供。逆转录试剂盒及实时荧光定量PCR(RT-PCR)试剂盒购自日本TaKaRa公司,E-钙黏蛋白(E-cadherin)抗体购自美国Abcam公司,SERPINA1抗体、荧光二抗购自美国Santa Cruz公司,基质金属蛋白酶9(MMP-9)、N-钙黏蛋白(N-cadherin)单克隆抗体购自美国Sigma公司,24孔Transwell侵袭小室购自美国Corning公司,Matrigel购自美国BD公司。
1.3 方法
1.3.1细胞培养和细胞转染
HepG2细胞采用DMEM培养基[含10%胎牛血清(FBS)]在37 ℃ 5% CO2环境中培养,当细胞生长至汇合度60%~70%,更换新鲜的培养基并加入适量的病毒悬液,继续培养24 h后,更换新鲜培养基,用嘌呤霉素筛选稳转细胞株。SERPINA1干扰RNA(siRNA)目标序列为5′- GAA CUC ACC CAC GAU AUC A-3′和5′- GAU GAA GCG UUU AGG CAU G-3′。
1.3.2RT-PCR
Trizol一步法提取总RNA,将RNA逆转录为cDNA。以cDNA为模板进行RT-PCR,检测SERPINA1的mRNA相对表达量。SERPINA1上游引物:5′-GGA ACA GGC TCA GGA CTA TCT C-3′,下游引物:5′-CAA CAT CTG GCA CTC CAC A-3′;GAPDH上游引物:5′-CAA CGA ATT TGG CTA CAG CA-3′,下游引物:5′-AGG GGT CTA CAT GGC AAC TG-3′。以GAPDH基因作为内参,采用2-ΔΔCt法计算目标基因的相对表达量。
1.3.3Western blot
将组织和转染48 h后的肝癌细胞用细胞裂解法提取细胞总蛋白,BCA定量试剂盒测定蛋白浓度。样品均定量为5 μg/μL,变性,取50 μg蛋白经8%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,70 V 100 min 电转移至PVDF膜。5%脱脂奶粉封闭2 h,分别加入SERPINA1、E-cadherin、N-cadherin、MMP-9和β-actin一抗(1∶1 000),4 ℃孵育过夜。TBST洗膜,加入相应二抗(1∶5 000)室温孵育2 h,TBST清洗后,Bio-Rad ChemiDocTMXRS+ System曝光显影,Bio-rad Quantity One软件扫描胶片的灰度值进行定量分析。
1.3.4免疫组织化学检测
组织标本用石蜡包埋,切成厚度为4 μm的薄片,采用免疫组织化学法检测SERPINA1表达,染色结果以细胞胞浆出现棕黄色或棕褐色颗粒判断为阳性。免疫组织化学检测结果采用Greenspan分级,根据阳性细胞数和染色强度进行综合评分。每张切片在光镜下随机挑选10个400倍视野,每个视野计数100个细胞。染色信号的强度分为4级:0级为“-”,1级为“+”,2级为“++”,3级为“+++”。阳性信号的面积根据阳性区域占整体切片面积的百分比分为5级:0级为0,1级为>0~25%,2级为>25%~50%,3级为>50%~75%,4级为>75%~100%。Greenspan分级将信号面积得分与信号强度得分相乘,“-”为0分;“+”为1~4分;“++”为5~8分;“+++”为9~12分。评分过程由两位不知晓样本临床资料的实验人员独立完成。Greenspan分级“-”和“+”的样本为低表达组,Greenspan分级“++”和“+++”的样本为高表达组。
1.3.5Transwell实验
取人工基底膜和无血清培养基按1∶4混匀加入Transwell小室中,凝固。无血清培养基饥饿培养24 h的HepG2细胞,无血清培养基清洗3次,将细胞悬液的细胞浓度调节为1×106/mL,每个Transwell小室下室加入500 μL含10% FBS的培养基,上室加入200 μL细胞悬液,37 ℃培养箱培养48 h。取出Transwell小室,4%多聚甲醛固定30 min,0.1%结晶紫染色5 min,PBS洗2次,用棉签擦去Transwell小室上表面细胞,显微镜下观察并计数。
1.4 统计学处理

2 结 果
2.1 随访结果
78例肝癌患者男58例,女20例;年龄31~79岁,≤50岁46例,>50岁32例;28例术前甲胎蛋白(AFP)≤400 μg/L,50例AFP>400 μg/L;34例肿瘤直径>5.0 cm,44例肿瘤直径≤5.0 cm;TNM分期Ⅰ、Ⅱ期34例,Ⅲ、Ⅳ期44例;病理分级Ⅰ、Ⅱ级33例,Ⅲ、Ⅳ级45例;肿瘤有包膜28例,无包膜50例;血管侵犯34例,无血管侵犯44例;肿瘤单发42例,多发36例。所有研究病例均获随访,随访截至2021年2月。78例行手术切除的肝癌患者随访时间2~72个月,中位随访时间28个月,5年总累积生存率17.9%(14例)。随访期间共有41例复发,复发率为52.6%。复发时间为术后2~49个月,复发中位时间为术后15个月。复发转移部位依次为肝28例、肺24例、腹腔3例、骨7例、腹膜2例、脑2例、胸膜2例、胰1例、纵隔1例、食管1例。
2.2 患者肝癌组织和癌旁组织中SERPINA1 mRNA和蛋白表达比较
肝癌组织中SERPINA1 mRNA表达明显高于癌旁组织[(1.396±0.059)vs.(1.103±0.053),t=4.872,P<0.05],SERPINA1蛋白表达亦明显高于癌旁组织[(0.894±0.086)vs.(0.583±0.095),t=5.811,P<0.01],见图1。
2.3 SERPINA1表达与肝癌临床病理特征的关系
SERPINA1主要定位于细胞质,见图2。肝癌组织SERPINA1的阳性表达率为60.3%(47/78),癌旁组织为42.3%(33/78),比较差异有统计学意义(χ2=5.03,P<0.05)。肝癌组织中SERPINA1阳性表达与TNM分期、病理分级和血管侵犯有关(P<0.05),见表1。

图2 肝癌组织SERPINA1免疫组化结果(×100)
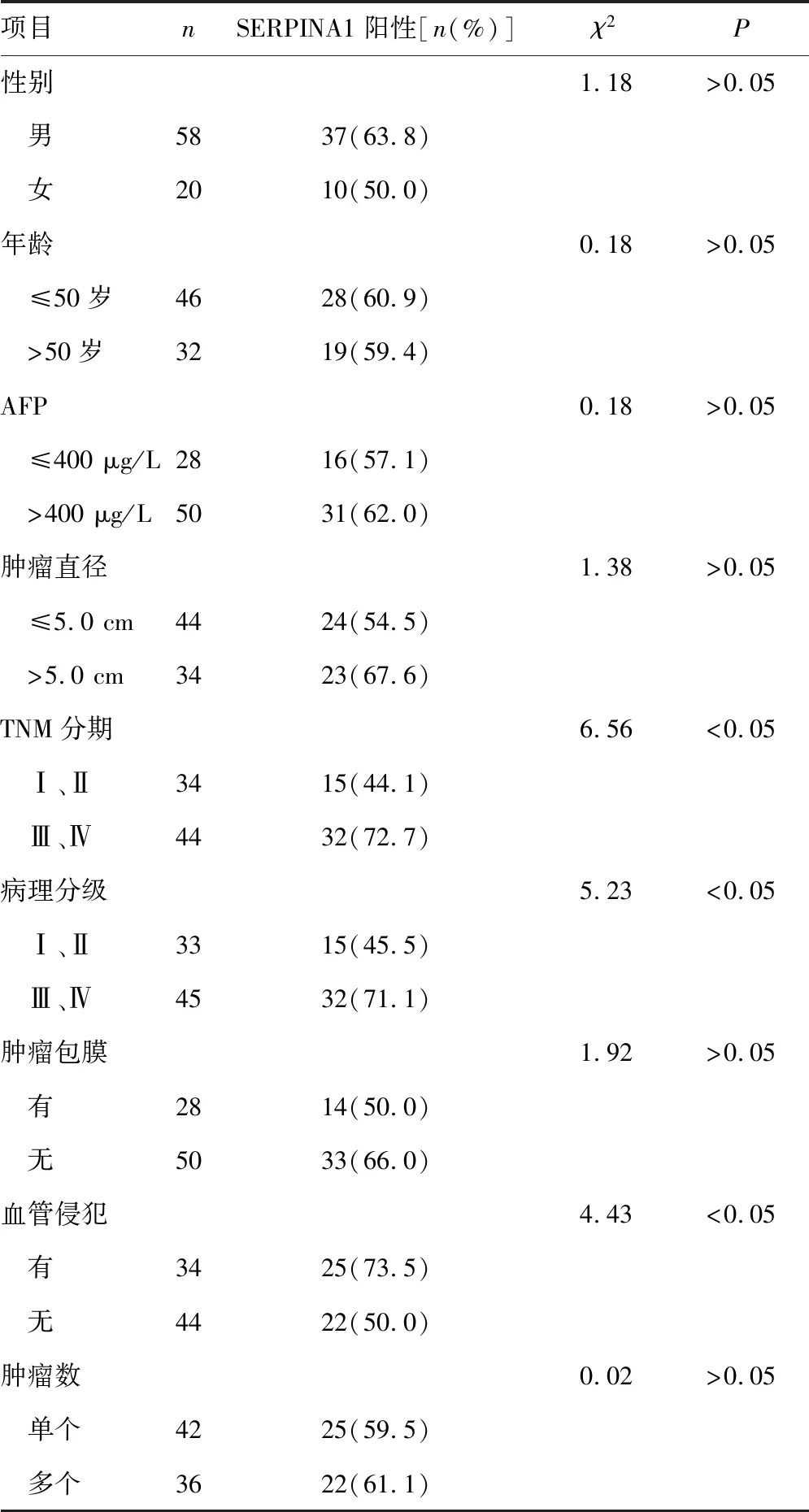
表1 肝癌组织SERPINA1表达与临床病理特征的关系
2.4 SERPINA1表达与肝癌患者预后的关系
78例肝癌患者术后1、3、5年累积复发率分别为23.1%(18/78)、46.2%(36/78)、48.7%(38/78),术后1、3、5年累积生存率分别为83.3%(65/78)、42.3%(33/78)、17.9%(14/78),见表2。SERPINA1高表达组5年累积复发率明显高于SERPINA1低表达组(χ2=7.305,P<0.01),5年累积生存率低于SERPINA1低表达组(χ2=5.899,P<0.05),见图3。

表2 肝癌患者术后1、3、5年累积复发及生存情况比较
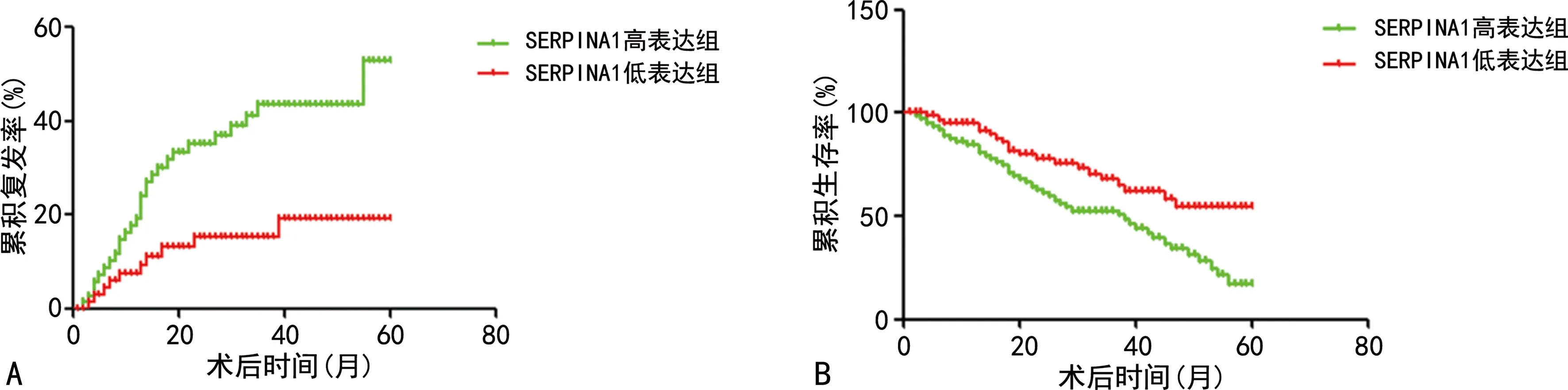
A:累积复发率;B:累积生存率。
2.5 SERPINA1表达对肝癌细胞侵袭能力的影响
与对照组比较,siSERPINA1组穿过小室基底膜的细胞数量明显减少,差异有统计学意义(P<0.05),Mock组无明显差异(P>0.05),见图4。

图4 各组细胞侵袭能力的变化
2.6 SERPINA1表达对肝癌细胞上皮-间质转化(EMT)相关蛋白的影响
与对照组和Mock组比较,siSERPINA1组E-cadherin表达上调,SERPINA1、MMP-9和N-cadherin表达下调,差异有统计学意义(P<0.05),见图5。

图5 各组EMT相关蛋白表达比较
3 讨 论
SERPINA1是丝氨酸蛋白酶抑制剂家族的主要成员,主要由肝细胞合成,少部分由巨噬细胞和单核细胞产生[7]。在人类基因组中,SERPINA1定位于第14号染色体上的q32.1,长度约为370 kb[8]。SERPINA1具有强烈的催化反应活性,能够与酶的活性部位结合,抑制酶的催化作用或阻止酶原转化为有活性的酶,在调节酶活性和蛋白质代谢等方面发挥重要的作用[9]。除此之外,SERPINA1还参与了生物体内多种生理和病理反应,在调节细胞生长、细胞分化、细胞运动和信号转导中发挥作用[4]。
鉴于其重要的生物学功能,SERPINA1已经引起研究者的关注,并已成为肿瘤研究领域的热点[10]。ERCETIN等[11]研究发现,SERPINA1在非小细胞肺癌组织中的表达明显高于癌旁组织,且癌组织中SERPINA1表达越高,患者的生存率越低。KWON等[12]研究发现,直结肠癌中SERPINA1表达与患者肿瘤分期、淋巴结转移和预后不良相关,过表达SERPINA1增强直结肠癌细胞株侵袭和迁移的潜能,反之,沉默SERPINA1表达抑制直结肠癌细胞株的侵袭和迁移的潜能,进一步研究发现SERPINA1通过与Snail结合参与调节直结肠癌的侵袭转移。在胃癌中,JIANG等[4]研究表明SERPINA1表达与胃癌的进展有关,SERPINA1可能是预防胃癌侵袭和转移的潜在靶标。本研究采用RT-PCR和Western blot检测肝癌组织和癌旁组织中SERPINA1 mRNA和蛋白表达,结果显示肝癌组织中SERPINA1表达明显高于癌旁组织,SERPINA1表达与肝癌病理分级、TNM分期和血管侵犯相关(P<0.05),而与肝癌其他临床病理学参数无关(P>0.05),提示SERPINA1表达可能在肝癌侵袭转移中发挥着重要的作用。
本研究采用Kaplan-Meier生存曲线分析SERPINA1表达与肝癌患者术后预后的关系,结果显示SERPINA1高表达组患者5年累积生存率明显低于SERPINA1低表达组(χ2=5.899,P<0.05),5年累积复发率明显高于SERPINA1低表达组(χ2=7.305,P<0.01),表明肝癌组织SERPINA1高表达的患者可能具有更高的复发和转移的风险。为了进一步研究SERPINA1表达与肝癌细胞侵袭迁移的关系,采用RNA干扰技术在肝癌HepG2细胞中干扰SERPINA1的表达,然后应用Transwell侵袭实验检测细胞的侵袭迁移能力,结果显示与对照组和Mock组比较,siSERPINA1组穿过Transwell小室基底膜的细胞数量明显减少,表明沉默SERPINA1的表达可以抑制肝癌细胞的侵袭迁移能力,SERPINA1与肝癌细胞侵袭迁移密切相关,与KWON等[12]研究结果一致。
EMT是指上皮细胞发生成纤维细胞形态改变,转化为具有间质细胞表型的生物学过程,是胚胎发育和器官形成的基础过程[13]。大量研究结果表明,EMT在肿瘤的侵袭转移过程中也发挥着至关重要的作用,它是上皮源性肿瘤细胞转移的关键步骤[14]。EMT程序启动后,肿瘤细胞的上皮表型向间质表型转变,主要表现为上皮细胞失去细胞间黏附和细胞极性等分化表型,获得侵袭迁移和抗凋亡等间质细胞特征,同时间质细胞和上皮细胞标志物表达发生改变,如上皮标志物E-cadherin表达下调,间质标志物N-cadherin表达上调等[15]。MMPs的重要作用是降解细胞外基质,通过影响细胞外基质导致EMT,促进肿瘤细胞移动。MMP-9已被证实在不同类型的肿瘤中促进肿瘤发生、发展,并且与肿瘤的侵袭和不良预后相关[16-17]。本研究发现,上皮标志物E-cadherin表达升高,而MMP-9和间质标志物N-cadherin表达下降,表明SERPINA1可能通过调控MMP-9和EMT相关蛋白的表达,进而影响肝癌细胞的侵袭迁移。
综上所述,SERPINA1在肝细胞癌中高表达,并与患者预后相关;SERPINA1可能通过调控MMP-9表达和肝癌细胞EMT,进而影响肝癌细胞的侵袭迁移。SERPINA1可能是预防肝癌迁移和早期干预的新的标志物。
