JAK2/STAT3/TWIST信号通路在子宫腺肌病上皮间质转化中的作用研究*
2023-02-04郑艳莉
钱 进,郑艳莉
(1.南通大学附属如皋人民医院妇产科,江苏南通 226500;2.南通大学第二附属医院/南通市第一人民医院妇产科,江苏南通 226000)
子宫腺肌病(adenomyosis,ADS)是指子宫内膜腺体和间质侵入子宫肌层[1-2],且周围肌细胞伴有代偿性增生和肥大的特征,是一种具有恶性肿瘤特点的良性妇科疾病,也是现代妇科常见疾病之一,发病率高达21.5%。想要阐明ADS的发病机制,需要明确子宫内膜上皮细胞是如何向肌层发生迁移和侵袭的,这也是近年来的研究热点和难点,现有大量研究发现上皮间质转化(epithelial-mesenchymal transition,EMT)与上皮细胞如何向间质细胞发生功能转变[3],继而获得迁移侵袭能力息息相关。
EMT是一个复杂的多步骤过程[4],是多种细胞外信号与细胞内的EMT下游信号通路及参与该过程的转录因子共同组成的复杂的信号网络,包括多条信号通路。在不同的细胞内,这些信号通路的重要性各有不同。其中JAK/STAT3/TWIST信号通路是近年来研究发现的一条由细胞因子激活的信号传导通路,主要参与细胞的増殖、凋亡及免疫调节。JAK/STAT3/TWIST信号通路的激活,在慢性炎症和免疫抑制过程中起关键作用。研究发现,在多种细胞系中可以通过激活JAK/STAT3/TWIST信号通路,提高间质细胞标志性蛋白N-cadherin和Vimentin表达,而E-cadherin表达下调,从而促进了EMT的形成,可以说JAK/STAT3/TWIST信号通路是EMT形成过程中被激活的关键信号传导通路[5-6]。本研究探讨JAK2/STAT3/TWIST信号通路在ADS EMT中的作用。
1 资料与方法
1.1 一般资料
选取2020年3月至2021年3月南通大学附属如皋人民医院就诊的35~55岁患者。因ADS行全子宫切除术且术后病理证实为ADS病例50例为试验组,所有患者均留取在位内膜及异位内膜组织,一部分组织福尔马林固定待后续病理和免疫组织化学实验,另一部分组织-80 ℃冻存待后续分子实验。因子宫肌瘤行全子宫切除术且术后病理证实无子宫内膜病变病例50例为对照组,取正常子宫内膜组织。排除标准:有生殖器官恶性肿瘤疾病;近半年服用激素类药物;产后哺乳期;合并各种内外科严重疾病。本研究经南通大学附属如皋人民医院批准(LW2110),患者知情同意。
1.2 主要试剂
一抗E-cadherin 抗体(英国Abcam公司,ab40772)、N-cadherin 抗体(美国Proteintech公司,66219-1-lg)、JAK2 抗体 (美国Proteintech公司,17670-1-AP)、STAT3抗体(美国Proteintech公司,60199-1-lg)、TWIST2抗体(美国Proteintech公司,66544-1-lg),二抗Rabbit anti-β-actin抗体(上海碧云天生物技术有限公司,AF0003),DAB显色试剂盒(武汉博士德生物工程有限公司,AR1022),聚合HRP标记抗小鼠IgG(武汉博士德生物工程有限公司,SV0001),聚合HRP标记抗兔IgG(武汉博士德生物工程有限公司,SV0002),逆转录试剂盒(南京诺唯赞生物科技股份有限公司,R223-01),SYBR-Green Master PCR Mix(南京诺唯赞生物科技股份有限公司,Q711-02/03)
1.3 方法
1.3.1石蜡切片
新鲜组织福尔马林固定48 h。乙醇梯度脱水,二甲苯透明后浸蜡。制作组织石蜡块,石蜡切片厚度4 μm,65 ℃烤片1 h。
1.3.2HE染色观察病理变化
二甲苯3次各10 min,乙醇梯度脱蜡各5 min,蒸馏水5 min。苏木素染色2 min,1%盐酸乙醇分色1 s,水洗蓝化20 min。50%乙醇5 min,70%乙醇5 min,80%乙醇5 min,伊红染色2 s。乙醇梯度脱水,二甲苯透明,封片。
1.3.3免疫组织化学染色观察E-cadherin、N-cadherin、JAK2、STAT3、TWIST的定位
切片脱蜡至水。H2O2孵育10 min,PBS洗5 min×3次。枸橼酸盐抗原热修复,PBS洗5 min。5% BSA 37 ℃孵育30 min。滴加一抗(E-cadherin、N-cadherin抗体1∶250稀释,JAK2抗体1∶50稀释,STAT3抗体1∶50稀释,TWIST抗体1∶250稀释)。4 ℃孵育过夜。PBS洗5 min×3次,二抗37 ℃孵育30 min。PBS洗5 min×3次,DAB显色,蒸馏水终止显色。苏木素复染2 min。梯度脱水和透明,封片,隔天拍照。先低倍镜观察,选择目标区域高倍镜下,随机观察5个视野,阳性表达呈棕黄色。
1.3.4Western blot检测E-cadherin、N-cadherin、JAK2、STAT3、TWIST蛋白表达
常规方法提取蛋白。配制分离胶及浓缩胶。蛋白上样量为200 μg。电泳先80 V再120 V。300 mA 90 min转膜。室温封闭2 h。一抗(E-cadherin、N-cadherin抗体1∶2 000稀释,JAK2抗体1∶500稀释,STAT3抗体1∶1 000稀释,TWIST抗体1∶2 000稀释)4 ℃过夜,PBST洗10 min×3次。二抗(1∶2 000稀释)室温90 min,PBST洗20 min×3次。ECL显色。
1.3.5qRT-PCR检测JAK2、STAT3、TWIST mRNA表达
Trizol法提取总RNA。根据试剂盒说明书行逆转录反应和QRT-PCR。JAK2:上游引物5′-TCG CTG CCG AGG GAT GTG AG-3′,下游引物5′-TCT TGT TCC TGT TGC CTG CTT CTG-3′;STAT3:上游引物 5′-GAG GCA GGA GAA TCG CTT GAA CC-3′ 下游引物5′-TCT CAG ACT GTC GCC CAG GAT G-3′;TWIST:上游引物5′-CCA TCC TCA CAC CTC TGC ATT CTG-3′,下游引物5′-GGC TGA TTG GCA CGA CCT CTT G-3′;GAPDH:上游引物5′-ACC CAG AAG ACT GTG GAT GG-3′,下游引物5′-AGG GGT CTA CAT GGC AAC TG-3′。反应体系:2×SYBR mix 10 μL,正向引物1 μL,反向引物1 μL,cDNA 1 μL,ddH2O 7 μL。反应条件:95 ℃ 5 min 预变性;95 ℃ 15 s,60 ℃ 20 s,72 ℃ 30 s,共45个循环;溶解曲线分析:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。使用2-ΔΔCT法进行相对定量分析。
1.4 统计学处理
2 结 果
2.1 HE染色观察ADS病理结构
正常内膜组织无明显异常;在位内膜组织内膜腺体和间质与肌层分界清晰,内膜未入侵肌层;异位内膜组织细胞排列紊乱,细胞核和细胞质均着色较浅,子宫内膜腺上皮与间质细胞侵入子宫肌层且形成增生见图1。

图1 HE染色观察ADS病理结构
2.2 免疫组织化学染色观察EMT相关标志物E-cadherin、N-cadherin的定位
E-cadherin、N-cadherin均特异性表达于子宫内膜上皮细胞的细胞膜上,见图2。在位内膜和异位内膜中E-cadherin表达较正常内膜明显降低,且异位内膜表达弱于在位内膜,E-cadherin在异位内膜中染色呈淡黄色,为弱阳性表达。在位内膜和异位内膜中N-cadherin表达较正常内膜明显升高,且异位内膜表达强于在位内膜,N-cadherin在异位内膜中染色呈棕黄色,为强阳性表达。
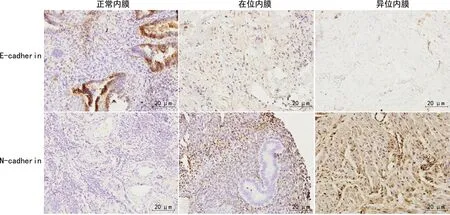
图2 E-cadherin、N-cadherin在正常内膜、在位内膜和异位内膜中的表达分布
2.3 Western blot检测EMT相关标志物E-cadherin、N-cadherin蛋白表达
与正常内膜比较,在位内膜、异位内膜中E-cadherin蛋白表达降低(P<0.01),在异位内膜中下降更明显(P<0.01);在位内膜、异位内膜中N-cadherin蛋白表达升高(P<0.01),在异位内膜中升高更明显(P<0.01),见图3。
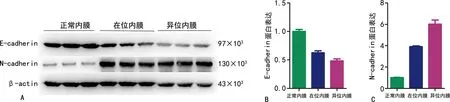
A: 蛋白印迹图;B:E-cadherin蛋白表达;C:N-cadherin蛋白表达。
2.4 qRT-PCR 检测JAK2、STAT3、TWIST mRNA表达
与正常内膜比较,在位内膜、异位内膜中JAK2/STAT3/TWIST mRNA表达升高(P<0.01),在异位内膜中升高更明显(P<0.01),见图4。
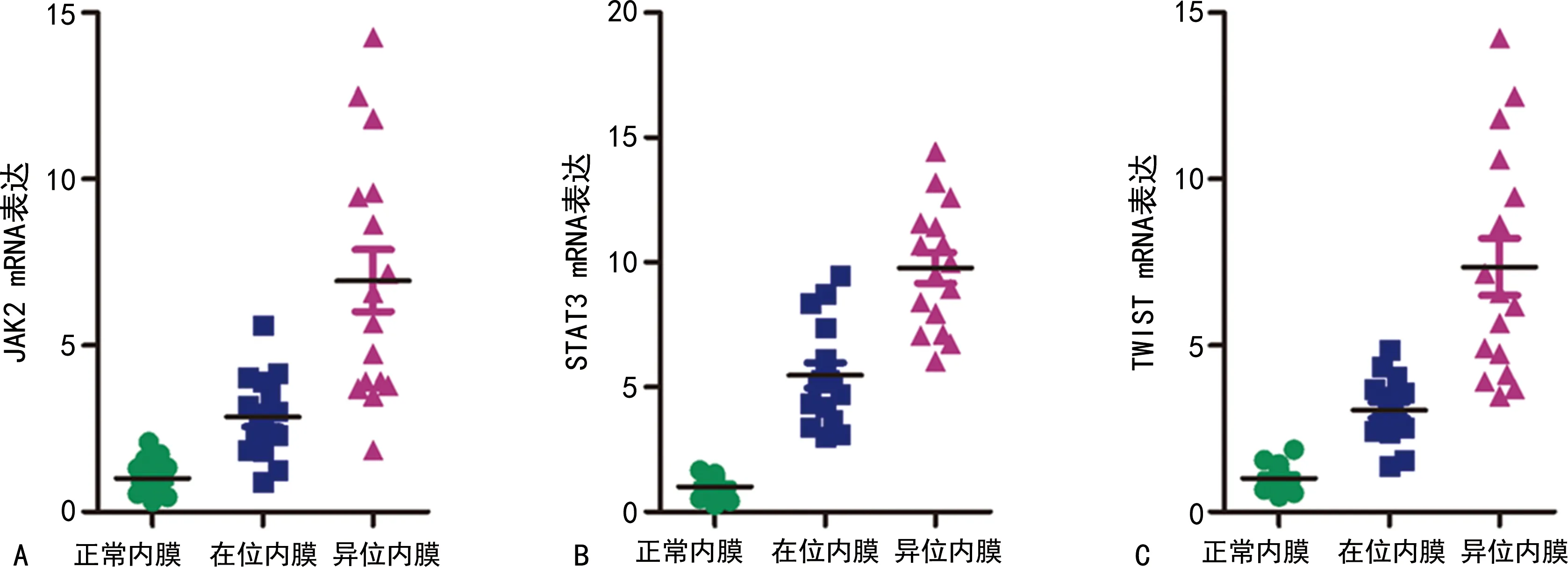
A:JAK2 mRNA表达;B:STAT3 mRNA表达;C:TWIST mRNA表达。
2.5 Western blot检测JAK2、STAT3、TWIST的蛋白表达
与正常内膜比较,在位内膜、异位内膜中JAK2、STAT3、TWIST蛋白表达升高(P<0.01),在异位内膜中升高更明显(P<0.01),见图5。
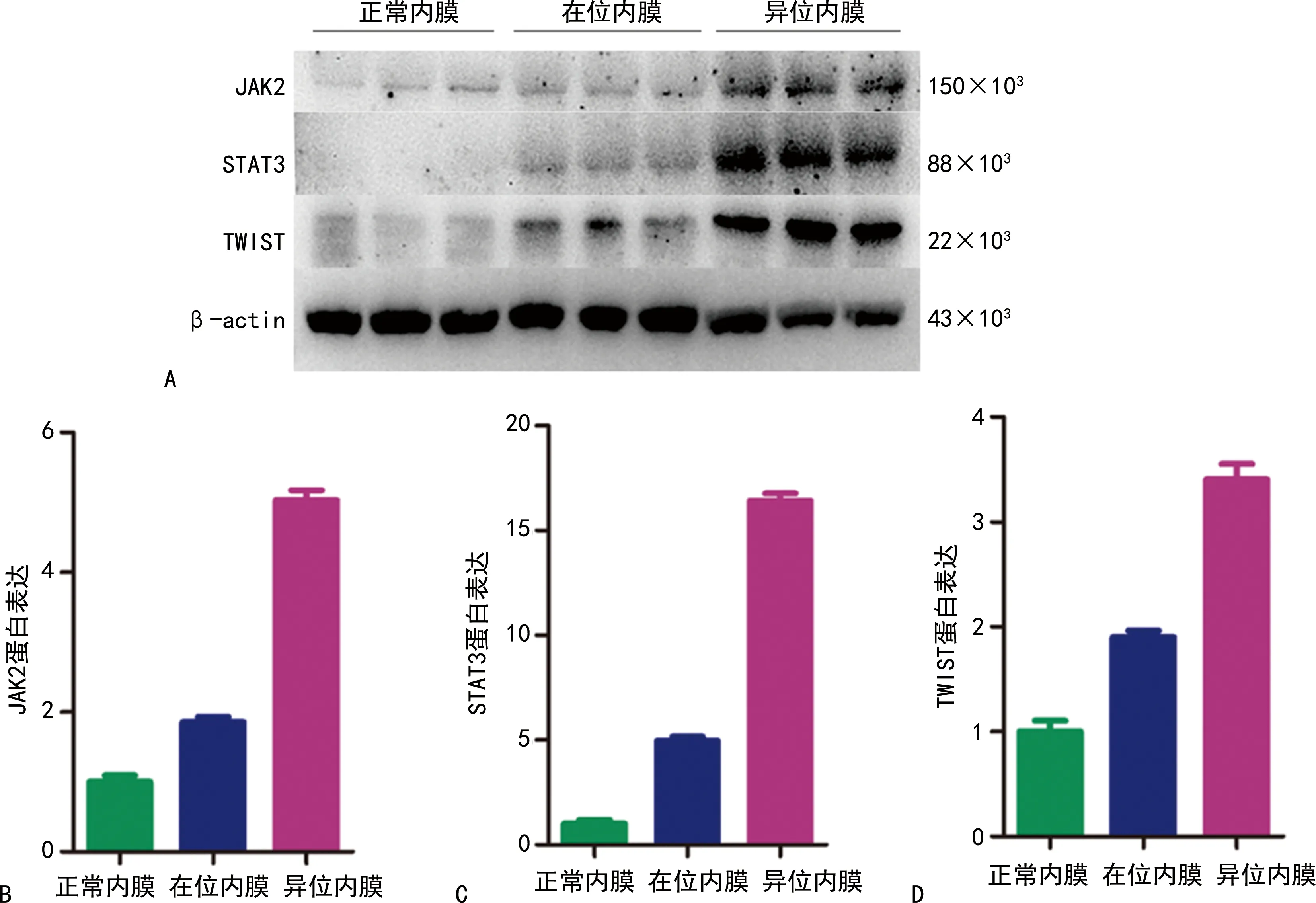
A:蛋白印迹图;B:JAK2蛋白表达;C:STAT3蛋白表达;D:TWIST蛋白表达。
2.6 免疫组织化学染色观察JAK2、STAT3、TWIST定位
JAK2、STAT3、TWIST主要特异性表达于细胞质中,见图6。在位内膜和异位内膜中JAK2、STAT3、TWIST表达较正常内膜明显升高,异位内膜表达强于在位内膜,JAK2、STAT3、TWIST在异位内膜中染色呈棕黄色,为强阳性表达。

图6 JAK2、STAT3、TWIST在正常内膜、在位内膜和异位内膜中的表达分布
3 讨 论
ADS是现代妇科常见的良性疾病,也是常见的不孕原因之一[7]。ADS虽然是良性疾病,但其生物学特性具有恶性肿瘤的特质,即可以迁移和侵袭,且极易复发[8]。
正常子宫内膜组织中的细胞主要是上皮细胞,其具有极性,特征是细胞与细胞之间存在相对紧密的连接,这对维持组织结构完整性和协调细胞功能有重要意义。而间质细胞是间质及结缔组织的主要组成成分,其结构松散,相对没有极性,移动性较高。这两类细胞不仅形态上,蛋白表达和功能更是有所差异。ADS正是上皮细胞的减少,间质细胞的异常增多。ADS子宫内膜特性的改变与EMT过程密切相关[9-10],包括细胞外基质降解、细胞运动、细胞黏附和血管生成等因素,提示EMT可能参与ADS的发生和发展。在形态学方面,正常子宫内膜上皮细胞具有规则且较大的细胞核,并且细胞和细胞之间排列规整和连续,而ADS子宫内膜上皮细胞间的排列中断[11]。ADS上皮细胞由椭圆形转变为长梭形,呈成纤维细胞样。子宫内膜上皮细胞形态的改变使细胞间接触不稳定,形成更易迁移和侵入的间质表型。在分子表达方面,CAI等[12]报道,在ADS异位病灶中,EMT标志物E-cadherin表达降低且Vimentin表达升高,而E-cadherin转录抑制因子Snail表达升高,促进ADS的发生和发展。在生物学功能方面,ADS是子宫内膜细胞侵袭性增强的结果,由于在子宫内膜和子宫肌层之间没有基底膜,组织应激损伤或局部组织炎症引发EMT过程[13]。随着ADS持续的过度活动和慢性损伤,内膜细胞持续增殖和慢性炎症进一步延缓了愈合过程,并导致病灶数目增加[14]。
本研究为了明确ADS中是否确实存在EMT现象,收集ADS患者在位和异位内膜组织,且术后病理证实无其他病症,并选取同期子宫肌瘤患者且病理证实无病变的子宫内膜组织作为对照。本研究结果发现E-cadherin和N-cadherin均特异性表达于细胞膜上。与正常内膜比较,在位内膜、异位内膜中E-cadherin表达降低、N-cadherin表达升高,异位内膜变化更明显。这正是EMT发生的分子表达特征,说明EMT可能参与了ADS的发病过程。
JAK/STAT信号通路最初是在研究干扰素对细胞的作用机制时被发现的[15],JAK 属于非受体酪氨酸激酶,STAT则是信号转导和转录激活因子的统称。人体内几乎所有的细胞都有表达 JAK[16],在正常个体的胚胎发育进程中必不可少,并在各类细胞中广泛表达,催化多种细胞因子诱导的免疫反应。细胞因子的水平、细胞膜上不同受体的表达差异,使得 JAK2/STAT3 活化后对免疫反应和炎症的双向调节作用,既可增强免疫反应又可抑制免疫反应,维持正常的免疫稳定状态。STAT3的下游因子TWIST是碱性螺旋-环-螺旋转录因子家族成员之一[17],其在胚胎发育过程中起着调节细胞迁移的作用,它可以使上皮细胞转化为间充质细胞,使细胞具有迁移转移的能力[18]。大量研究表明,TWIST是诱导EMT发生的关键性调控因子和始动因素[19]。TWIST作为EMT的主要转录因子,通过诱导EMT,使上皮细胞间连接桥梁E-cadherin的表达减少,从而增强了肿瘤细胞的侵袭性和转移力,是EMT过程中的正性调节因子。TWIST还可以作为凋亡抑制蛋白参与EMT过程,促进细胞迁移、侵袭、抗凋亡等,TWIST可通过抑制E-cadherin表达和诱导N-cadherin表达来调节EMT过程。还有研究发现,TWIST在子宫内膜异位症(EMs)的发病机制中也扮演了重要角色[20],在EMs中TWIST的表达明显上调,可能是通过诱导EMT引发的EMs。
本实验通过qRT-PCR、Western blot、免疫组织化学从基因表达、蛋白表达、定位检测JAK2、STAT3、TWIST在正常内膜、在位内膜、异位内膜中的表达,发现无论是基因表达还是蛋白表达,其表达趋势一致,均特异性表达于细胞质中,且与正常内膜比较,在位内膜、异位内膜中JAK2、STAT3、TWIST表达升高,异位内膜变化更明显。可见JAK2/STAT3/TWIST信号通路的激活与ADS的发生密切相关,且可能促进了ADS中EMT的发生。但JAK2/STAT3/TWIST信号通路又是如何促进ADS中EMT的发生,它们之间又是如何协调的,其机制还有待进一步深入研究。
