植物调节湿地CO2和CH4排放对淹水增强的响应
2023-02-03谭凤凤张昌威黄佳芳
谭凤凤,罗 敏,张昌威,陈 欣,黄佳芳,
植物调节湿地CO2和CH4排放对淹水增强的响应
谭凤凤1,罗 敏2*,张昌威2,陈 欣2,黄佳芳1,3
(1.福建师范大学地理科学学院,湿润亚热带生态地理过程教育部重点实验室,福建 福州 350007;2.福州大学环境与安全工程学院,福建 福州 350116;3.福建闽江河口湿地生态系统国家定位观测研究站(国家林业和草原局),福建 福州 350215)
在闽江河口鳝鱼滩潮汐沼泽湿地设置有植物与无植物2种中宇宙,每种中宇宙设置对照(CK)、CK−20cm、CK−40cm 3种高程处理,以此模拟研究淹水增强对有无植物2 种中宇宙的CO2和CH4排放通量的影响.结果表明,淹水增强未显著改变植物的总生物量和植物株高,但增加植物地下生物量,减少植物地上生物量.在有植物中宇宙中,土壤氧化还原电位(ORP)和溶解性有机碳(DOC)浓度随着淹水增强而增加.在无植物中宇宙中,DOC浓度也随着淹水增强而增加,但土壤ORP随淹水增强变化不显著.与CK相比,在CK−20cm和CK−40cm 2种高程处理中,有植物中宇宙中CO2排放通量分别增加43%和61%,而CH4排放通量则分别增加66%和84%.在无植物中宇宙中,CO2和CH4的排放通量随着淹水增强无显著变化.未来海平面上升50~100a内,有植被的潮汐沼泽湿地综合增温潜势会增加,土壤有机碳储量会显著下降;无植被的潮汐沼泽湿地综合增温潜势将下降,土壤有机碳储量不会显著改变.
淹水增强;CO2和CH4排放通量;海平面上升;氧化还原电位;潮汐沼泽湿地;闽江河口
海平面上升已成为21世纪人类社会关注的重大生态议题[1].位于海陆过渡带的滨海潮汐沼泽湿地仅占全球湿地面积的0.3%~5.0%,但其碳累积速率达到166~180g C/(m2·a)[2-6].滨海潮汐湿地高速的碳累积速率是高植物生产力和低有机碳厌氧矿化共同作用的结果[7].随着海平面持续高速上升,滨海潮汐湿地的生态系统服务功能将进一步退化,影响滨海潮汐湿地的固碳能力[8].目前,有大量研究聚焦海平面上升带来的淹水增强对滨海潮汐沼泽湿地固碳潜力的影响[9-15],但淹水增强对滨海潮汐沼泽湿地CO2和CH4排放带来的影响的关注度较低.
淹水增强对滨海潮汐湿地土壤有机碳分解有重要影响.淹水增强产生的厌氧环境抑制有氧呼吸和土壤氧化酶的活性,从而减缓有机质的矿化速率[4-5,14].但野外调研结果却反映出滨海潮汐沼泽湿地土壤含碳温室气体排放对淹水增强响应的不一致.例如,一项黑海榄雌和灯芯草土壤的室内培养实验表明,与每天淹水4h相比,每天淹水20h使得CO2产生速率下降18%[16].另一项在美国Everglades红树林的室外实验的研究结果也表明,当淹水水位增加8cm,CO2排放通量下降90%[17].与上述研究结果相反,在美国马里兰州的实验表明当淹水增加15~30cm,CO2排放通量增加125%~267%[18].这些不一致的研究结果表明,目前尚未厘清淹水增强对滨海潮汐沼泽湿地含碳温室气体排放的影响机制.
植物的存在可以调节湿地CO2和CH4的排放通量[9,11].首先,植物的地上或地下生物量发生变化,将进一步改变有机碳底物输入,影响CO2和CH4的排放通量[19-20].其次,维管束植物可以通过根系泌氧改变深层湿地土壤氧气的供给[21].一方面,根系泌氧加速氧化湿地土壤中生成的CH4[18];另一方面,根系泌氧可以支持深层土壤中的Fe(II)转化为Fe(III),从而为有机碳厌氧矿化提供电子受体[22-23].因此,要综合评估海平面上升对滨海潮汐沼泽湿地碳排放的影响,需要将土壤–植物作为一个整体,充分考虑植物在调节滨海潮汐沼泽湿地碳排放对淹水增强的响应中发挥的作用.
闽江河口是我国亚热带地区极具代表性的开放性河口.闽江河口区下游遍布有植物的沼泽湿地和无植物的光滩.在过去的野外调查过程中,发现沼泽湿地和光滩湿地的CO2和CH4排放通量差异显著[24],且在沼泽湿地的潮滩剖面上,CO2和CH4排放通量随着淹水的增强而增加[21],而在光滩湿地CO2和CH4排放通量随着淹水增强差异不显著[25].因此,沼泽植物有可能调节CO2和CH4排放通量对淹水增强的响应.但上述实验的结果分别来自两个不同的生境,土壤异质性和不同的水文环境会影响结果的准确性.鉴于此,本文于2017年3月~2018年2月在中国东南沿海闽江河口潮汐沼泽湿地建立了中宇宙实验[26],选取闽江河口鳝鱼滩潮汐沼泽湿地土壤作为供试土壤,将中宇宙的高程相对于对照分别降低20cm和40cm,来模拟CO2和CH4排放通量对淹水增强的响应.以期厘清植物在调节湿地碳排放对淹水增强的响应中扮演的角色,同时明晰未来海平面上升情境下,闽江河口潮汐沼泽湿地CO2和CH4排放通量的变化趋势.
1 材料与方法
1.1 实验区概况
研究样地位于中国福建省东南沿海闽江河口段下游的鳝鱼滩潮滩湿地(26°10′7″N,119°37′9″E) (图1(a)和(b)).湿地潮汐类型为典型半日潮,潮滩每日有26%~31%的时间处于浸没状态[24].供试土壤采自鳝鱼滩湿地表层0~10cm土壤.土壤盐度为4‰~ 6‰[24],土壤有机碳含量为(10.4±3.0)mg/g,土壤类型为粉砂质壤土(粘粒10.3%~13.4%,粉粒54.3%~ 58.7%,砂粒28.4%~35.2%)[27].
1.2 实验设计
本试验装置参考Morris[28]设计的“沼泽管” (Marsh organ),由高度相同的圆柱形聚氯乙烯管(内径=15cm;高度=50cm)组成的中宇宙(图1(c)),在潮汐沼泽湿地的潮沟中不同的高程设置“沼泽管”,因3个不同高程的“沼泽管”其淹水最大高度和淹水时间有差异,从而实现研究淹水增强对潮汐沼泽湿地生物地球化学循环的影响的目的[29-30].本实验将中宇宙实验设置为以下3种高程:CK(对照), CK−20cm (顶部高程比对照低20cm),CK−40cm (顶部高程比对照低40cm).其中CK处理聚氯乙烯管的顶端是参照实验所在鳝鱼滩潮滩的平均高程而设置(图1(c)).CK−20cm和CK−40cm处理聚氯乙烯管的顶端高程则比CK处理低20cm和40cm.参照全球平均海平面上升速率3.7~4.2mm/a[1],未来50和100a全球平均海平面上升的高度约为18~21cm和37~42cm,故本实验设计高程比CK处理低20和40cm的2个处理,即模拟未来50和100a全球平均海平面上升可能对闽江河口潮汐沼泽湿地带来的影响.为了降低土壤的异质性,本文将鳝鱼滩所采集的土壤,剔除石块和植物根系,充分混匀后装入聚氯乙烯管.有植物组种植本地土著种短叶茳芏()幼苗,种植时保证幼苗的长度、根茎粗细相近.种植密度参考天然短叶茳芏的密度(~160株/m2).
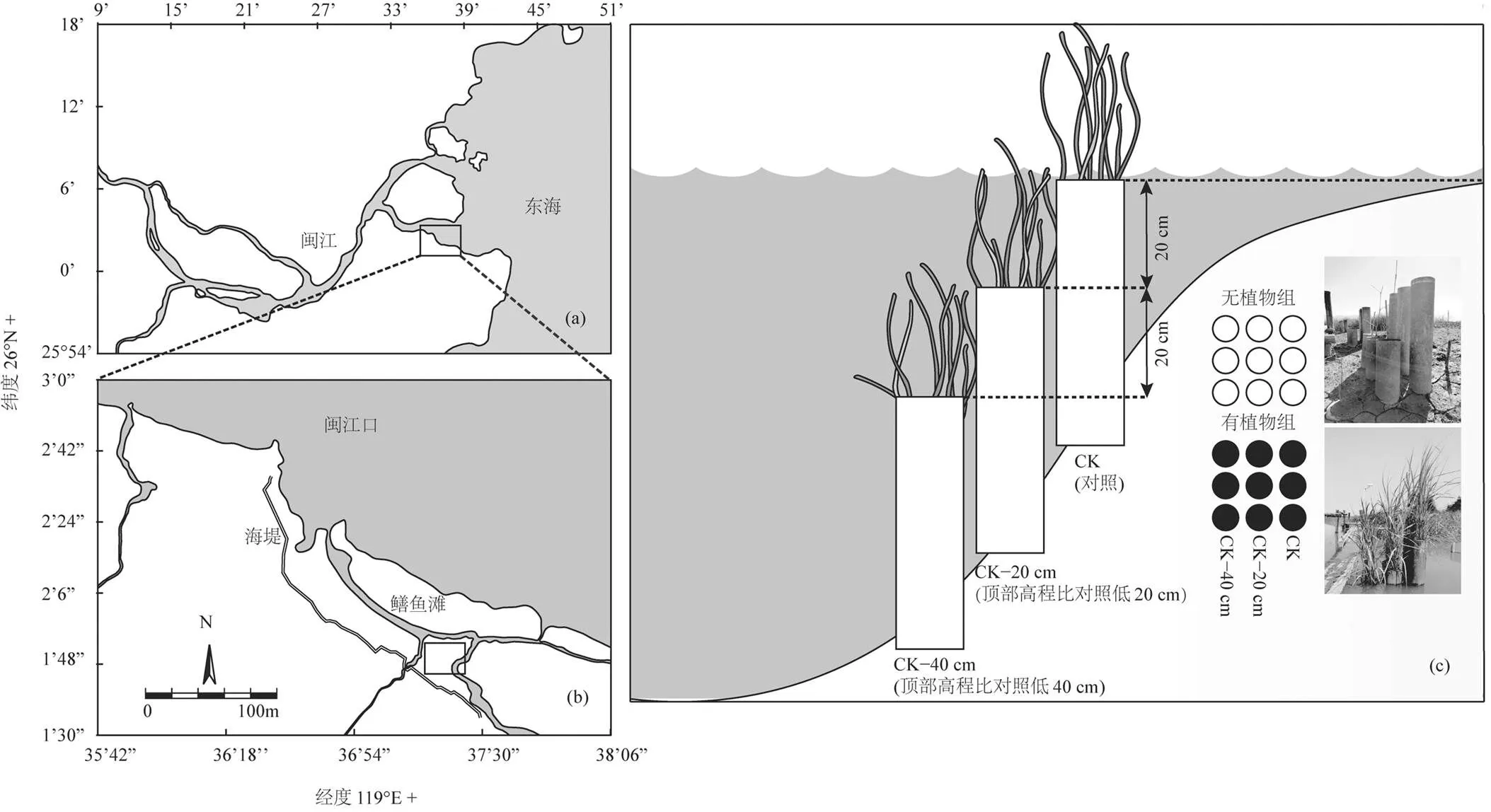
图1 研究区位置图和中宇宙实验示意
图(a)为闽江河口位;图(b)为闽江河口鳝鱼滩沼泽湿地研究区位置;图(c)为中宇宙实验示意
1.3 样品采集、处理与测定
2017年3月~2018年2月每月测定土壤氧化还原电位(ORP)和溶解性有机碳(DOC).土壤ORP利用南京传滴仪器设备有限公司FJA-6型氧化还原电位去极化法全自动测定仪测定(精度:± 0.1mV).ORP自动测定仪以Ag/AgCl为参比电极,将与仪器连接后的ORP复合电极传感器小心地插入各中宇宙实验0~10cm深度的土壤,读数稳定后记录,并将ORP读数校正为标准氧化还原电位[31].DOC的采集利用探针型Rhizon土壤溶液采样器采集[32],DOC浓度使用日本岛津TOC-VCPH总有机碳分析仪测定(检测限为2μmol/L).
植物和土壤样品于2018年6月开始采集(实验结束后),土壤采集深度为0~10cm,选择此深度是因为该深度的土壤受到潮汐浸没的影响最强[33].植物采集后,将植物的地下部分装入孔径为1mm的尼龙网中洗净.地上部分直接用水洗净,放入烘箱105℃杀青0.5h,在65℃下烘干称重并计算生物量.土壤pH值采用美国Spectrum Technologies 公司pH400便携式pH计测定,精度为0.1.土壤活性Fe(II)通过浓度为0.5mol/L的HCl浸提,土壤活性总Fe采用0.5mol/L的HCl与10mg/L的羟胺混合液提取[34-35].土壤活性Fe(III)的含量为活性总Fe和Fe(II)之差.Fe(III):Fe(II)为土壤活性Fe(III)与活性Fe(II)含量的比值.各种Fe的含量均利用日本岛津UV-2450紫外可见分光光度计测定.土壤有机碳(SOC)和总氮(TN)含量采用德国Elementar公司Elementer Vario MAX碳氮元素分析仪测定.土壤SOC测定前,土壤样品用10%稀HCl清洗以清除无机碳.土壤C:N比为土壤SOC含量与TN含量的比值.孔隙水SO42–和Cl–浓度使用美国Dionex公司 ICS-2100离子色谱仪测定(检测限分别为4和2μmol/L).
1.4 气体样本的采集与测定
2017年3月~2018年2月每月采用静态箱-气相色谱法测定CO2和CH4排放通量.静态箱由亚克力管制作,管的内、外径(内径15cm,外径16cm)均与种植植物的中宇宙圆柱形聚氯乙烯管一致,高度为120cm.温室气体采集时,使用PVC管箍将中宇宙(下部圆管)与亚克力管静态箱(上部静态箱)进行密封连接,管箍内径16cm,与上部静态箱及下部圆管的外径尺寸一致,同时在连接处涂上一圈凡士林以保证气密性.亚克力管距离底端60cm处设置1个金属采气嘴(内部设置有橡胶垫圈),采集气体样品.亚克力管顶部设置有通风盖.顶箱上安装小风扇,以保证箱内气体混合均匀,侧壁安装温度计用于静态箱内温度测量.采样时,先将亚克力管和聚氯乙烯管连接密闭,盖上顶部通风盖,同时在亚克力管的外部罩上遮光布.利用带有三通阀的注射器在采气嘴采样.采样时间为0、15、30和45min,并将采样气体打入铝箔气袋.气体样品通过日本岛津GC-2010气相色谱仪测定.CO2和CH4排放通量计算公式[36]:
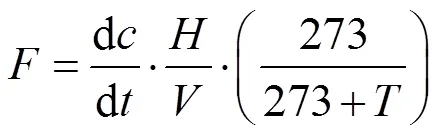
式中:为CO2或CH4排放通量,CO2为mmol/(m2·h), CH4为μmol/(m2·h);表示标准状态气体摩尔体积, 22.4L/mol; d/d是静态箱内CO2或CH4浓度随时间变化率,CO2为μL/(L·h),CH4为nL/(L·h);为静态箱内温度,℃;为静态箱内气体部分高度,m;静态箱内CO2或CH4含量变化率由不同时间段采集的4个气体样品CO2或CH4含量与时间进行线性回归分析得到,计算得到的通量数据只有当2> 0.90时才视为有效数据[37].
1.5 数据分析
所有数据先通过正态分布检验,对于不符合正态分布的数据进行log转置.利用单因素重复测量方差分别测定有植物组和无植物组,高程处理对中宇宙CO2和CH4排放通量、土壤ORP和DOC浓度的影响.不同高程处理间有无显著性差异利用事后检验分析.利用回归分析检验CO2和CH4排放通量及土壤ORP和DOC浓度的关系.数据分析显著性水平为=0.05.所有数据均以平均值±标准差的形式表示.
2 结果与分析
2.1 不同高程处理对植物生物量和植物株高的影响
中宇宙内植物地上生物量由(3.4±0.7)kg/m2变化至(5.0±0.5)kg/m2,而地下生物量由(3.3±0.5)kg/m2变化至(5.3±0.6)kg/m2(图2(a)).不同高程处理对总生物量无显著影响(>0.05),但随着高程的降低,地上生物量逐渐减少(<0.05);而地下生物量呈现逐渐增加(<0.01).植物的株高由(71.2±12.9)cm变化至(83.1±14.4)cm(图2(b)).随着高程的降低,株高没有显著的变化(>0.05).
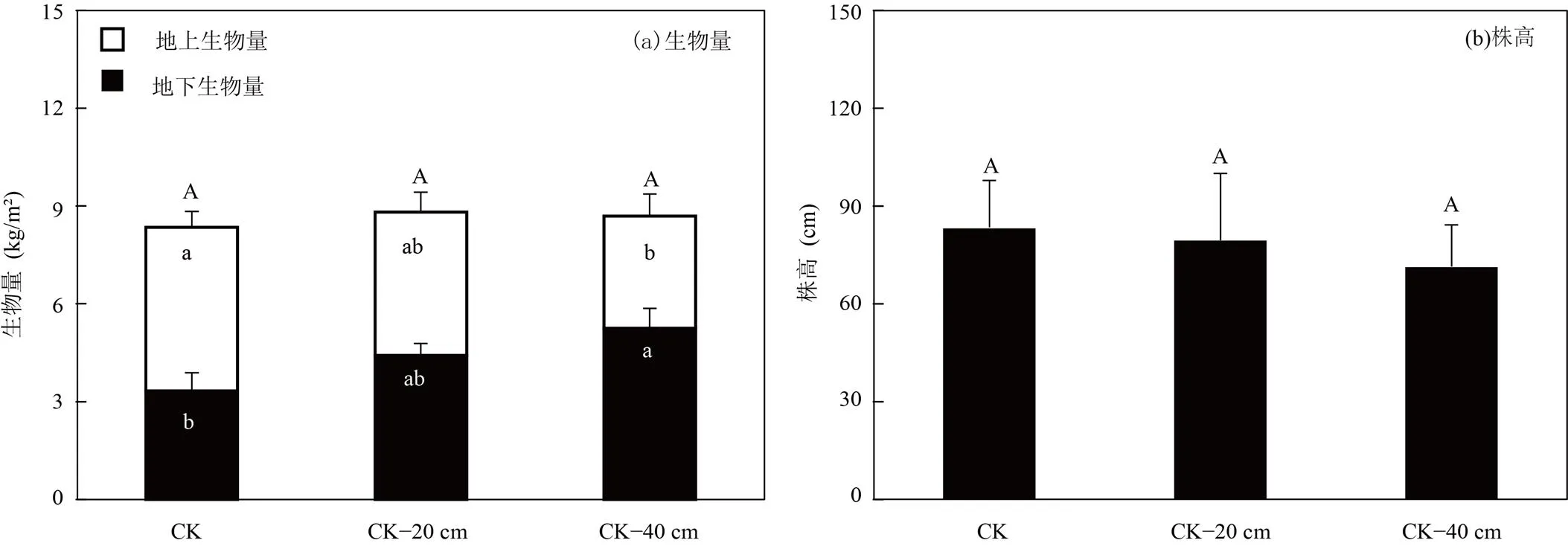
图2 闽江河口潮汐沼泽湿地3种高程处理下中宇宙植物生物量和植物株高
不同字母表示三种高程处理下植物生物量和植物株高有显著差异
2.2 不同高程处理对土壤理化性质的影响
有植物组的土壤pH值由(6.7±0.2)变化至(6.8±0.3),无植物组的土壤pH值由(6.3±0.2)变化至(6.8±0.1)(图3(a)),有植物组和无植物组的中宇宙土壤pH值无显著差别(>0.05),不同高程处理对有植物组和无植物组的土壤pH值无显著影响(>0.05).有植物组的土壤Fe(III):Fe(II)比值由(0.28±0.04)变化至(0.42±0.09),无植物组的土壤Fe(III):Fe(II)比值由(0.10±0.05)变化至(0.11±0.03)(图3(b)).有植物组的土壤Fe(III):Fe(II)比值显著高于无植物组(<0.05).淹水增强显著促进有植物组的土壤Fe(III):Fe(II)比值增加(<0.05),淹水增强对无植物组的土壤Fe(III):Fe(II)比值无影响(>0.05).有植物组的土壤SOC的含量由(9.4±1.2)mg/g变化至(13.7±1.3)mg/g,无植物组的土壤SOC的含量由(9.2±1.2)mg/g变化至(9.6±2.0)mg/g(图3(c)),有植物组的土壤C:N比值由(11.5±0.5)变化至(14.9±0.7),无植物组的土壤C:N比值由(8.7±1.7)变化至(9.2±1.2)(图3(d)).不同高程处理对有植物组的SOC含量和C:N比值影响显著(<0.05),随着高程的降低,有植物组的土壤SOC含量逐渐降低(图3(c)),土壤C:N比值逐渐增加(图3(d)).对无植物组的SOC含量和C:N比值无显著影响(>0.05).有植物组的孔隙水Cl–浓度由(82.5±25.5)mmol/L变化至(85.5±6.5)mmol/L,无植物组的孔隙水Cl–浓度由(83.6± 24.1)mmol/L变化至(89.6± 14.9)mmol/L(图3(e)),有植物组的孔隙水SO42–浓度由(4.5±0.9)mmol/L变化至(5.2±0.6)mmol/L,无植物组的孔隙水SO42–浓度由(3.5±1.6)mmol/L变化至(4.7±1.0)mmol/L(图3(f)).高程处理对有植物组和无植物组的孔隙水Cl–和SO42–浓度无显著影响(>0.05).
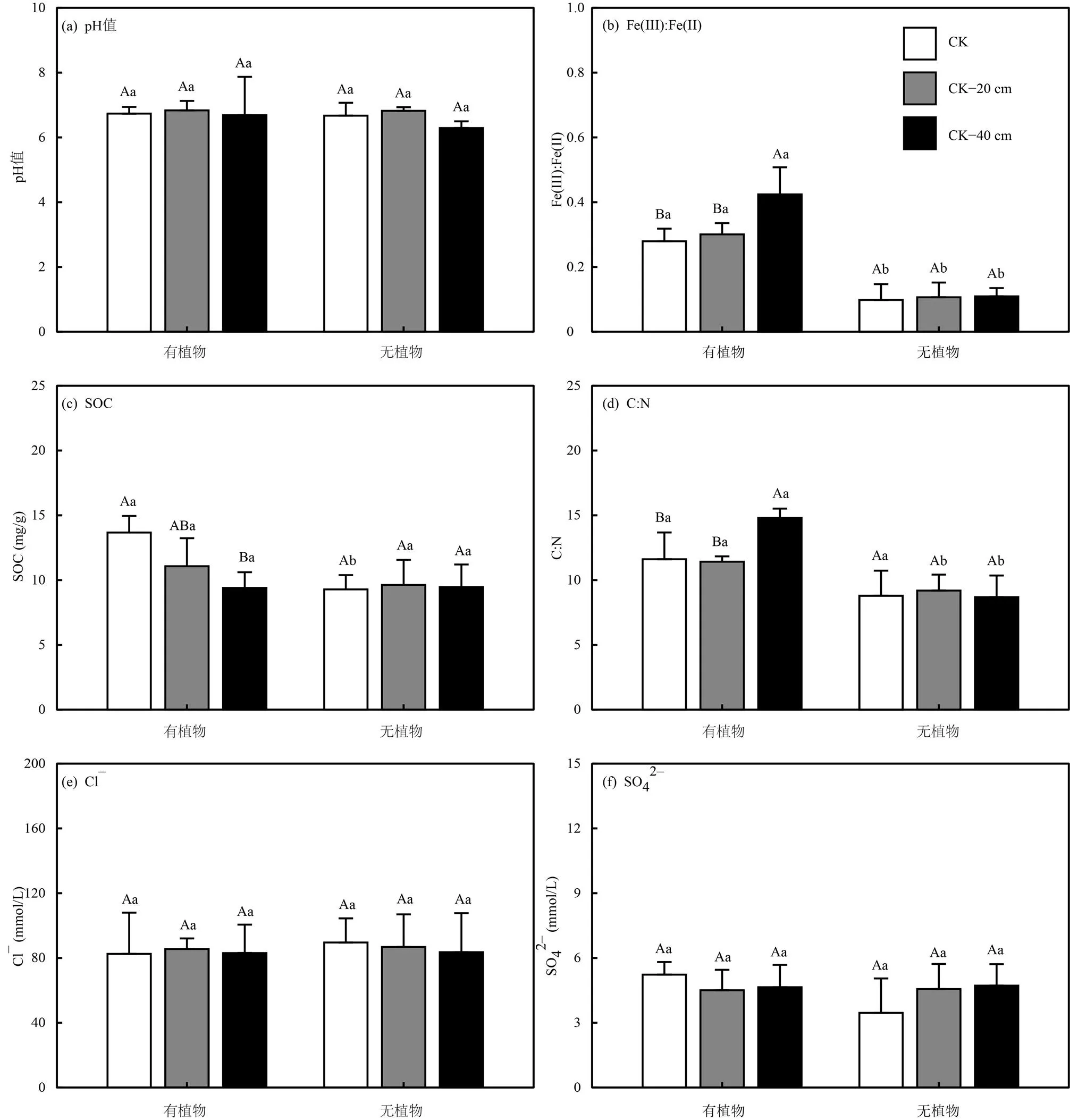
图3 闽江河口潮汐沼泽湿地3种高程处理下有植物组和无植物组中宇宙土壤理化性质
不同大写字母表示不同高程处理下差异显著;不同小写字母表示有无植物组差异显著
有植物组的土壤ORP由(–292.2±12.0)mV变化至(91.5±3.1)mV(图4(a)),无植物组的土壤ORP变化范围为(–235.3±13.1)mV至(–29.2±37.3)mV(图4(b)).高程降低对植物组的土壤ORP具有显著影响(< 0.001),有植物组土壤ORP随着高程降低而增加(图4(a)和表1).高程降低对无植物组的土壤ORP无显著影响(>0.05)(图4(b)和表1).
有植物组DOC浓度由(1.5±0.5)mg/L 变化至(51.2±3.5)mg/L(图4(c)),无植物组DOC浓度由(0.6±0.0)mg/L变化至(10.2±2.3)mg/L(图4(d)).相对于对照处理,高程降低处理显著增加植物组和无植物组的DOC浓度(<0.01;图4(c)和4(d)).与对照相比,高程降低20cm和40cm,有植物组的DOC的浓度分别增加32%和81%(表1),无植物组DOC的浓度分别增加为11%和45% (表1).
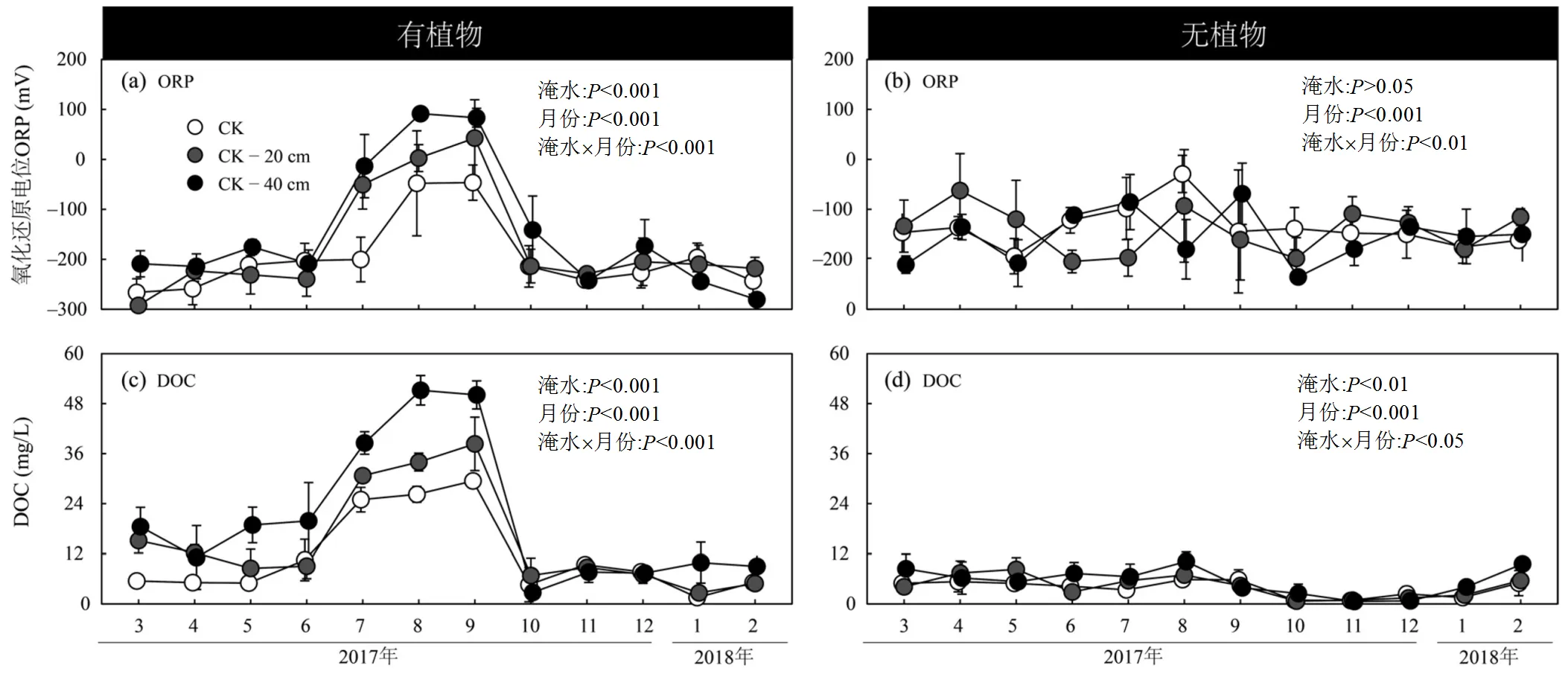
月份 月份
Fig. 4 Dynamics of soil ORP and DOC concentrations in the tidal wetlands of the Minjiang Estuary under three elevation treatments between planted and unplanted mesocosms
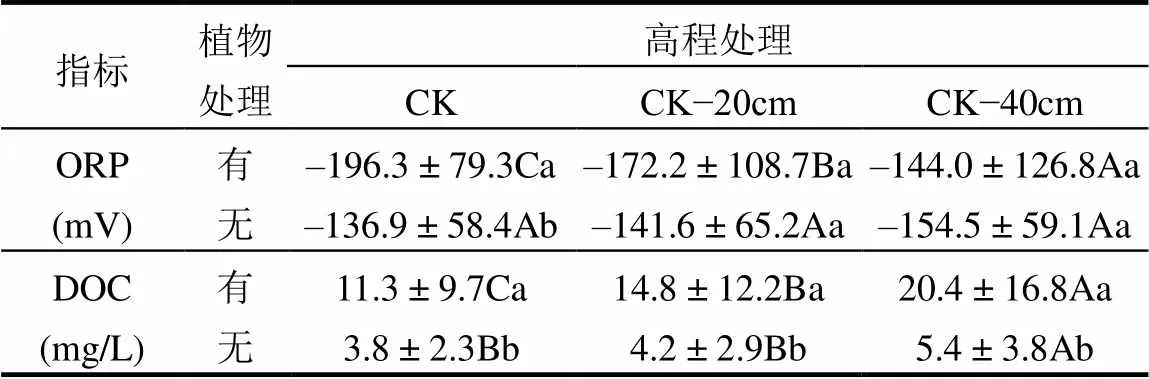
表1 三种高程处理下闽江河口潮汐沼泽湿地有植物组和无植物组土壤ORP和DOC浓度变化
注:不同大写字母表示不同高程处理下差异显著;不同小写字母表示有无植物处理下差异显著.
2.3 高程处理对CO2和CH4排放通量的影响
有植物组和无植物组中宇宙的CO2排放通量有显著差别(图5(a)和5(b)).有植物组CO2排放通量由(23.0±6.6)mmol/(m2·h)增加至(415.6±27.8)mmol/ (m2·h)(图5(a)),无植物组CO2排放通量由(9.7± 5.2)mmol/(m2·h)增加至(158.8±30.5)mmol/(m2·h) (图5(b)).高程处理对有植物组的排放通量具有显著影响(图5(a);<0.001),与对照相比,高程降低20cm和40cm,有植物组的CO2平均排放通量分别增加43%和61%(表2).无植物组CO2的排放通量对高程处理的响应不显著(图5(b);>0.05).
有植物组和无植物组的CH4排放通量有显著差别(图5(c)和5(d)).有植物组CH4排放通量由(11.8± 1.3)μmol/(m2·h)变化至(1721.6±105.7)μmol/(m2·h) (图5(c)),无植物组CH4排放通量由(1.1±0.4) μmol/(m2·h)变化至(281.9±26.0)μmol/(m2·h)(图5(d)).高程处理对植物组CH4的排放通量影响显著(< 0.001;图5(c)),与对照相比,高程下降20cm和40cm,有植物组CH4排放通量增加66%和84%(表2).无植物组的CH4排放通量对高程处理的响应不显著(> 0.05;图5(d)).
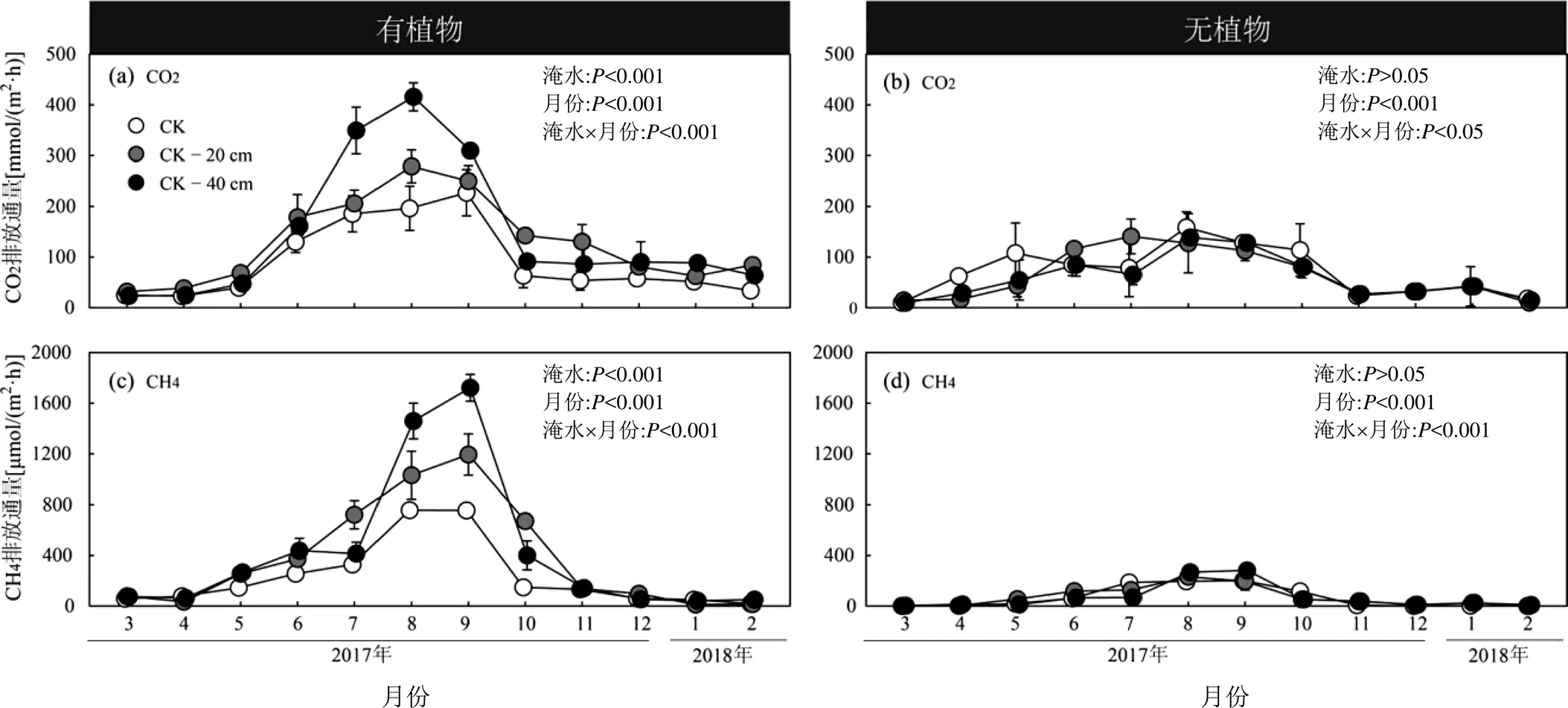
图5 闽江河口潮汐沼泽湿地3种高程处理下有植物组和无植物组中宇宙CO2和CH4排放通量变化
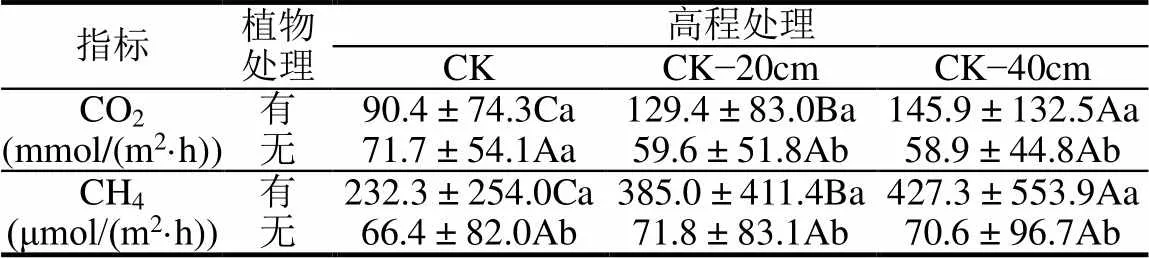
表2 三种高程处理下闽江河口潮汐沼泽湿地有植物组和无植物组中宇宙CO2和CH4排放通量的变化
注:不同大写字母表示不同高程处理下差异显著;不同小写字母表示有无植物处理下差异显著.
2.4 CO2和CH4排放通量和土壤ORP和DOC浓度相关性分析
在有植物组中宇宙中,CO2的排放通量与土壤ORP和DOC浓度呈显著正相关关系(图6(a)和6(b)),CH4的排放通量与土壤ORP无显著相关关系(>0.05),和DOC浓度呈显著正相关关系(图6(c)).无植物组中宇宙的CO2和CH4排放通量与土壤ORP和DOC浓度无显著相关关系(>0.05).
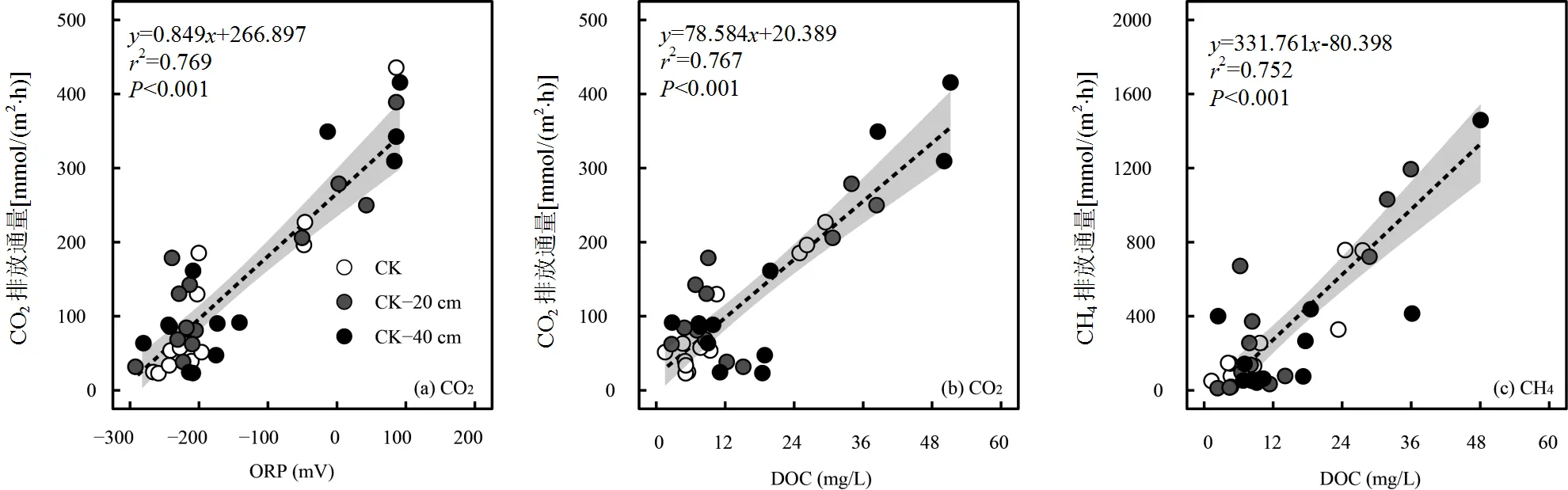
图6 闽江河口潮汐沼泽湿地有植物组中宇宙CO2和CH4的排放通量与土壤理化特征的相关性
3 讨论
3.1 淹水增强对沼泽植物生物量和株高的影响
经过1a的实验,供试植物短叶茳芏在中宇宙中长势良好.淹水增强对短叶茳芏的总生物量不存在显著影响(图2).过去的研究也报道过淹水增强对植物生物量的影响,但多数研究结果表明沼泽植物生物量随着淹水增强而下降.例如,Kirwan等[38]在4a的中宇宙实验发现淹水增强25cm,使得互花米草的生物量下降44%.Adam等[39]和Lan等[40]发现淹水增加30cm时,互花米草的生物量急剧下降.与这些研究不同,本研究所选的供试植物短叶茳芏对水淹胁迫的耐受限较大,可适应日浸没时长达12h的淹水环境[22],因此,可以较好地适应本文设计的2种高程处理(CK−20cm和CK−40cm)对植物生长带来的水淹胁迫.虽然淹水增强未显著地影响短叶茳芏植物的总生物量,但是淹水增强降低地上生物量,同时增加地下生物量(图2),该结果表明淹水增强使得植物将光合作用固定的碳由地上部分转移至地下部分.这可以视作是沼泽植物面对水淹胁迫的一种适应机制[41-42].这种机制在Mueller等[18]的文章中也有报道,即淹水增强显著增加了沼泽植物的根冠比.这主要是由于地下生物量增加,尤其是根系中的木质素和纤维素含量增加,可以使得潮汐沼泽植物的根系更好地抵抗静水压力[7].此外,发达的根系可以使得沼泽植物在淹水状态下吸收更多的营养盐,更好地适应水淹胁迫[43].综上,本研究发现,对于耐水性较好的沼泽植物短叶茳芏,淹水增强不会改变其总生物量和株高,但会促进地下生物量增加,而减少地上生物量.
3.2 沼泽植物调节土壤ORP和DOC浓度对淹水增强的响应
沼泽植物调节土壤ORP对淹水增强的响应.有植物组土壤ORP随着淹水增强而显著提高(图4(a)).有植物组土壤ORP的变化可能与植物的根系泌氧有关.根系泌氧是沼泽维管束植物为了适应水淹胁迫,将光合作用释放的一部分氧(O2)传输到根部,以保证根部正常呼吸的一种生理现象[19,44-45].通常,根系泌氧的强度与地下生物量保持良好的正相关关系[18].因此,有植物处理下,由于地下生物量随着淹水增强而增加,使得植物的根系泌氧能力也随之增强,土壤ORP也随着淹水增强而提高.此外,植物根系泌氧可以将土壤中的Fe(II)快速氧化成Fe(III),在湿地土壤的根际附件形成棕红色的“铁膜”[21].因此,土壤的Fe(III):Fe(II)比值也可表征沼泽植物根系泌氧的强度.研究结果表明,有植物组的土壤Fe(III):Fe(II)随淹水增强而增加(图3(b)),暗示着淹水促进了滨海湿地沼泽植物根系泌氧能力.在无植物处理下,土壤的Fe(III):Fe(II)比值以及土壤ORP均未随着淹水增强而发生改变(图3(b)和4(a)).这可能是由于位于潮间带的滨海潮汐沼泽湿地土壤一直处于饱水状态,使得土壤表层几mm之下,就处于完全厌氧的状态[46-48].由于没有作为“导管”的沼泽植物,空气中的氧气很难渗透至深层土壤中[47].因此,即使淹水进一步增强,土壤中的氧化还原环境并未发生显著的改变,因此,在无植物处理组土壤ORP以及Fe(III):Fe(II)的比值未发生显著改变.
沼泽植物调节土壤DOC浓度对淹水增强的响应.有植物组和无植物组土壤中的DOC含量随着淹水的增强而增加(图4(c)和4(d)).这与美国佛罗里达州大沼泽的研究结果一致,该研究发现当淹水增加8cm时,土壤DOC浓度增加4.3mg/L.这是由于淹水增强可促进土壤有机质的淋溶和水解等过程,从而促使土壤DOC的浓度增加[49].此外,在有植物组,由于地下生物量增加,根系分泌物增加也会促进土壤中DOC的累积[41].因此,在相同的淹水增强条件下,有植物组DOC增幅超过无植物组DOC的增幅.
3.3 沼泽植物调节CO2和CH4排放通量对淹水增强的响应
本研究中有植物组淹水增强显著促进中宇宙CO2排放通量,无植物组淹水增强对中宇宙CO2排放通量影响不显著(表2).结果发现有植物组,中宇宙CO2排放通量与土壤ORP和DOC浓度呈显著的正相关关系(图6(a)和6(b)).说明沼泽植物通过调节土壤ORP和DOC浓度,来调节中宇宙CO2和CH4排放通量对淹水增强的响应.
在有植物组,淹水增强过程中,土壤中ORP增加,意味着土壤中更多的Fe(II)被氧化成Fe(III).Fe(III)介导的铁异化还原是一种高效的厌氧有机质呼吸途径[48,50].故由于植物的存在,电子受体的含量随着淹水的增强而增加.此外,在有植物组,土壤DOC浓度也随着淹水增强而增加.DOC是土壤有机质的活性组分,可为土壤中的厌氧呼吸微生物提供有机质底物[51-53].因此,沼泽植物的存在, 使得土壤有机质底物随着淹水的增强而增多.由于电子受体和有机质底物同时随着淹水增加而增加,故有植物组的中宇宙CO2的产生和排放也因此增加.在无植物处理组,由于缺乏植物根系的作用,土壤ORP并没有随着淹水的增强而改变,且土壤DOC浓度增加幅度不如有植物组显著,因此,无植物处理下,中宇宙CO2排放通量对淹水的增强变化不显著.
有植物组CH4排放通量随着淹水增强而显著增加. CH4的排放量受到CH4产生、氧化以及植物传输的影响[54-60].在有植物组,一方面,随着淹水的增加,短叶茳芏枯落物加速腐烂和分解促进DOC的累积[61],而DOC的累积可为土壤中的产甲烷菌带来丰富底物,促进了CH4产生[12,22].虽然有植物组土壤ORP随着淹水增强而增加,暗示着有植物组,土壤的甲烷氧化能力也随着淹水的增加而逐渐增强[6,62-63].但研究结果表明中宇宙CH4排放通量随着淹水增强而增加,说明在有植物组,甲烷产生潜力有可能超过CH4的氧化潜力.无植物处理组,由于土壤ORP并未随着淹水增强发生改变,且DOC浓度增幅有限,使得中宇宙CH4排放通量对淹水增强不敏感.
此外,淹水还可能通过影响植物传输影响CO2和CH4排放通量.在对芦苇、水稻等物种的水位调控及密闭箱收集试验中发现,较高的水位抑制CH4的传输排放[64-65].这通常被认为是较高的水位淹没了茎基部的微孔(即CH4排放关键区域)[66].但即使淹水增加抑制植物传输,较高的CO2和CH4产生潜力使得淹水增加后,CO2和CH4排放通量增加.
3.4 沼泽植物调节含碳温室气体综合增温潜势对淹水增强的响应
本文计算了有植物组和无植物组CO2和CH4的综合增温潜势在3种高程处理下的变化规律.在百年尺度上,CH4的全球增温潜势(SGWP)为CO2的45倍[67].研究结果表明,有植物组的增温潜势要高于无植物组.在有植物组,随着中宇宙顶端高程下降20和40cm,综合增温潜势相对于对照分别增加44%和62%(表3).而在无植物组,随着中宇宙顶端高程下降20和40cm,综合增温潜势相对于对照分别下降16%和17%(表3).无论有无植物,综合增温潜势均以CO2的贡献为主,有植物组CH4对增温潜势的贡献略高于无植物组(表3).
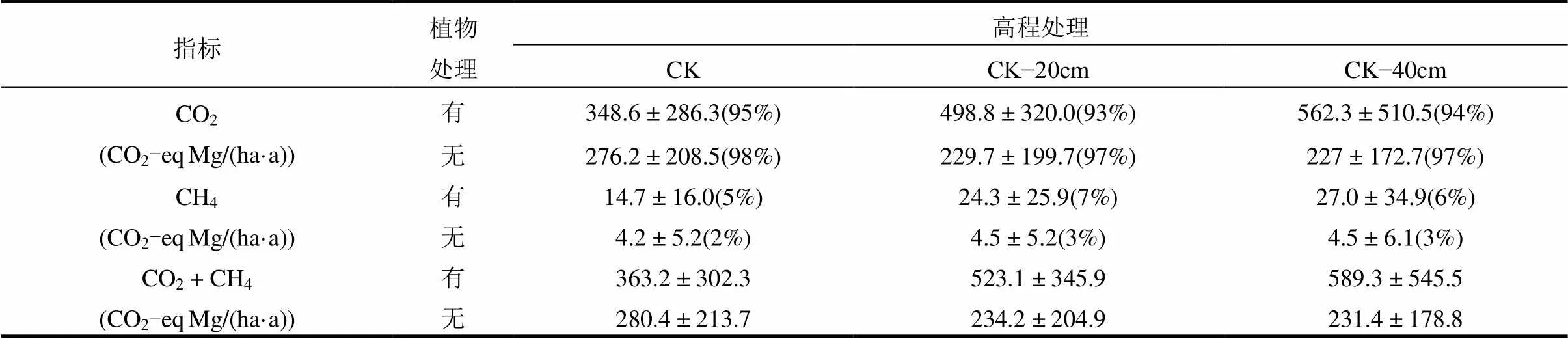
表3 3种高程处理下闽江河口潮汐沼泽湿地有植物组和无植物组中宇宙CO2和CH4排放的综合增温潜势
注:括号中的数字代表CO2或CH4对综合增温潜势的贡献率,%.
根据本文研究结果,滨海潮汐沼泽湿地在未来50~100a至百年尺度内海平面上升后,淹水增强可能带来的碳循环变化规律如图7所示.在无植物的光滩,土壤ORP不会发生显著变化,DOC浓度变化有限,使得CO2和CH4的排放通量增加并不会发生显著变化,因此,土壤SOC含量变化并不显著.在有植物的沼泽湿地,海平面上升后,地上生物量将显著减少,地下生物量增加,从而使得土壤ORP和DOC浓度增加,使得CO2和CH4的排放通量增加,土壤SOC含量显著下降.同时,海平面上升的同时,含碳温室气体综合增温潜势进一步加强,也会反过来促进海平面上升.因此,有植物的沼泽湿地沉积速率有可能将赶不上海平面上升的速率,导致大面积的沼泽湿地被浸没.在本文选择了对淹水变化耐受性较好的植物短叶茳芏,因此,淹水只改变了短叶茳芏的地上和地下生物量,并没有影响植物的分布格局.但对于对淹水耐受性不好的湿地植物,淹水增加可能会加速这些沼泽植物的死亡,从而使得这些沼泽湿地演替为光滩湿地,从而影响滨海湿地土壤碳循环.
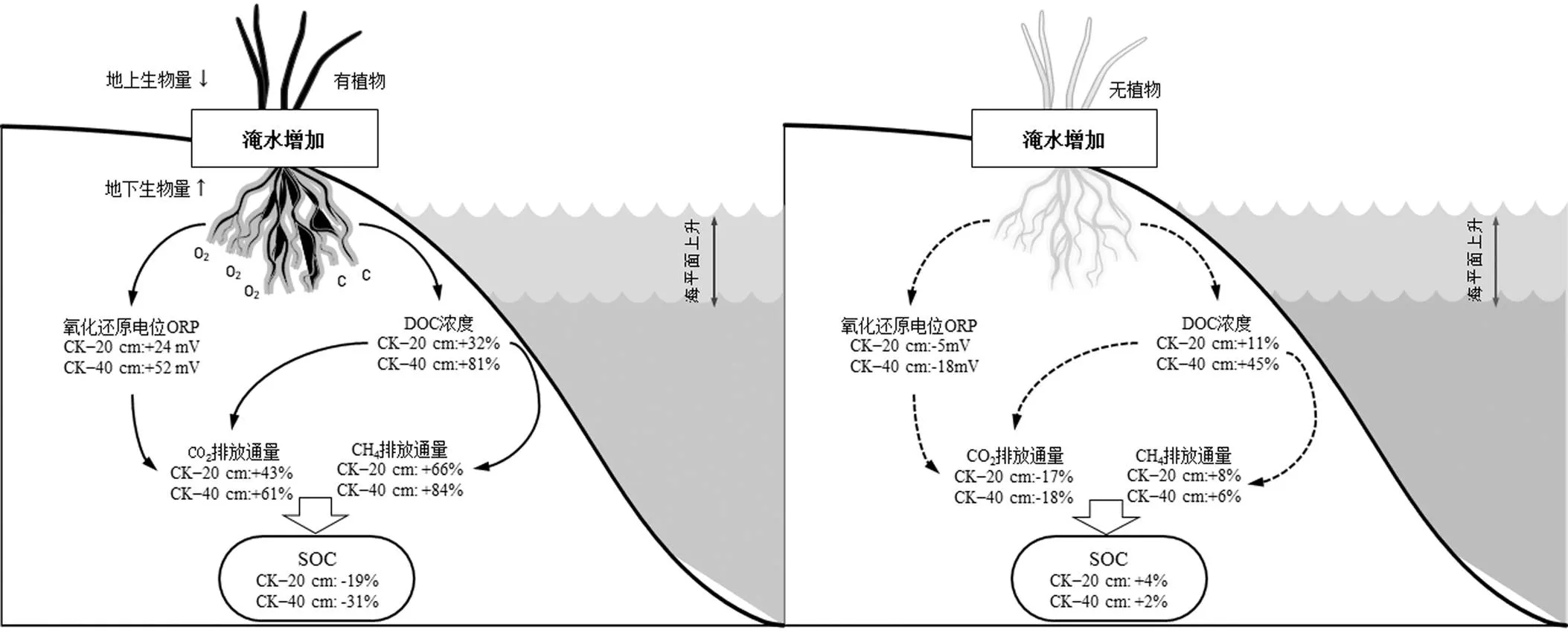
图7 植物调节CO2和CH4排放通量和土壤理化性质对不同高程处理的响应
4 结论
4.1 淹水增强未显著改变沼泽植物的总生物量和株高,但增加地下生物量,减少地上生物量.
4.2 沼泽植物调节土壤理化指标对淹水增强的响应.在有植物组,土壤ORP和DOC浓度随着淹水增强而增加.在无植物组,土壤ORP不变,DOC浓度随着淹水增强而增加,但其增长幅度不如有植物组.
4.3 沼泽植物调节CO2和CH4排放通量对淹水增强的响应.在有植物组,中宇宙CO2和CH4的排放通量随着淹水的增强而增加,而在无植物组,中宇宙CO2和CH4的排放通量随着淹水的增强无显著变化.
4.4 有植物组的增温潜势要高于无植物组的增温潜势.在有植物组,随着淹水增强,综合增温潜势增加,土壤有机碳储量下降.而在无植物组,随着淹水增强,综合增温潜势下降,土壤有机碳储量不变.
[1] Masson-Delmotte V P, Zhai A, Pirani S L et al. Climate change 2021: The physical science basis. [R]. Cambridge University Press, 2021.
[2] Chmura G T, Anisfeld S C, Cahoon D R, et al. Global carbon sequestration in tidal, saline wetland soils [J]. Global Biogeochemical Cycles, 2003,17(4):12.
[3] Duart C M, Middelburg J J, Caraco N. Major role of marine vegetation on the oceanic carbon cycle [J]. Biogeosciences, 2005,2:1–8.
[4] Mcleod E, Chmura G L, Bouillon S,et al. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Frontiers in Ecology and the Environment, 2011,9(10):552–560.
[5] 张 佩,王晓锋,袁兴中.中国淡水生态系统甲烷排放基本特征及研究进展[J]. 中国环境科学, 2020,40(8):3567-3579.
Zhang P, Wang X F, Yuan X Z. General characteristics and research progress of methane emissions from freshwater ecosystems in China [J]. China Environmental Science, 2020,40(8):3567-3579.
[6] Reddy K R, Delaune R D. Biogeochemistry of Wetlands: Science and Applications [M]. Boca Raton: Crc Press, 2008.
[7] Mitsch W J, Gosselink J G. Wetlands [M]. New York: John Wiley & Sons, 2007.
[8] Wang F, Lu X, Sanders C J, et al. Tidal wetland resilience to sea level rise increases their carbon sequestration capacity in United States [J]. Nature Communication, 2019,10:5434.
[9] Herbert E R, Boon P, Burgin A J, et al. A global perspective on wetland salinization: ecological consequences of a growing threat to freshwater wetlands [J]. Ecosphere, 2015,6(10):206.
[10] 高灯州,曾从盛,章文龙,等.水淹频率增加对闽江口湿地土壤有机碳及其活性组分的影响[J]. 环境科学学报, 2016,36(3):974-980.
Gao D Z, Zeng C S, Zhang W L, et al. Effects of increasing flooded frequency on soil organic carbon and its active composition in the Min River estuarine wetland [J]. China Environmental Science, 2016,36(3):974-980.
[11] Luo M, Huang J, Zhu W, et al. Impacts of increasing salinity and inundation on rates and pathways of organic carbon mineralization in tidal wetlands: a review [J]. Hydrobiologia, 2019a,827:31-49.
[12] Wang F, Lu X, Sanders C J, et al. Tidal wetland resilience to sea level rise increases their carbon sequestration capacity in United States [J]. Nature Communications, 2019,10(1):5434.
[13] 翟 俊,马宏璞,陈忠礼,等.湿地甲烷厌氧氧化的重要性和机制综述[J]. 中国环境科学, 2017,37(9):3506-3514.
Zhai J, Ma H P, Chen Z L, et al. Review on the importance and mechanisms of anaerobic oxidation of methane in wetlands [J]. China Environmental Science, 2017,37(9):3506-3514.
[14] Megonigal J P, Hines M E, Visscher P T. Anaerobic metabolism: linkages to trace gases and aerobic processes [J]. Biogeochemistry, 2004,8:317-424.
[15] 王 纯,刘兴土,仝 川,等.水盐梯度对闽江河口湿地土壤有机碳组分的影响[J]. 中国环境科学, 2017,37(10):3919-3928.
Wang C, Liu X T, Tong C, et al. Effects of hydrologic and salinity gradients on soil organic carbon composition in Min River Estuarine wetland [J]. China Environmental Science, 2017,37(10):3919-3928.
[16] Lewis D B, Brown J A, Jimenez K L. Effects of flooding and warming on soil organic matter mineralization inmangrove forests andsalt marshes [J]. Estuarine Coastal and Shelf Science, 2014,139:11-19.
[17] Chambers L G, Davis S E, Troxler T, et al. Biogeochemical effects of simulated sea level rise on carbon loss in an Everglades mangrove peat soil [J]. Hydrobiologia, 2014,726:195-211.
[18] Mueller P, Jensen K, Megonigal J P. Plants mediate soil organic matter decomposition in response to sea level rise[J]. Global Change Biology, 2016,22(1):404-14.
[19] Wolf A A, Drake B G, Erickson J E, et al. An oxygen mediated positive feedback between elevated carbon dioxide and soil organic matter decomposition in a simulated anaerobic wetland [J]. Global Change Biology, 2007,13:2036-2044.
[20] 鲁建荣,张 奇,李云良,等.鄱阳湖典型洲滩湿地植物根系对水分垂向通量的影响[J]. 中国环境科学, 2020,40(5):2180-2189.
Lu J R, Zhang Q, Li Y L, et al. Impact of typical plant roots on vertical soil water movement in Poyang Lake Wetland: a numerical study [J]. China Environmental Science, 2020,40(5):2180-2189.
[21] Khan N, Seshadri B, Bolan N, et al. Root iron plaque on wetland plants as a dynamic pool of nutrients and contaminants [J]. Advances in Agronomy, 2016,138:1-96.
[22] Liu Y X, Luo M, Chen J, et al. Root iron plaque abundance as an indicator of carbon decomposition rates in a tidal freshwater wetland in response to salinity and flooding [J]. Soil Biology and Biochemistry, 2021,162:108403.
[23] 李杨杰,陈振楼,王东启,等.长江口盐沼带湿地生态演替过程中甲烷排放研究[J].环境科学学报, 2014,34(8):2035-2042.
Li Y J, Chen Z L, Wang D Q, et al. Methane emission in the process of wetland vegetation succession in salt marsh of Yangtze River estuary [J]. Environmental Science, 2014,34(8):2035-2042.
[24] Luo M, Huang J, Tong C,et al. Iron dynamics in a subtropical estuarine tidal marsh: effect of season and vegetation [J]. Marine Ecology Progress Series, 2017,577:1-15.
[25] 李 敬,黄佳芳,罗 敏,等.淹水增加对闽江河口淡水潮汐湿地孔隙水地球化学特征及CO2和CH4排放通量的影响[J]. 环境科学, 2019,40(12):5493-5502.
Li J, Huang J F, Luo M, et al. Effect of increasing tidewater inundation on porewater geochemistries and CO2and CH4effluxes in the tidal freshwater marshes of the Minjiang River Estuary, Southeast China [J]. Environmental Science, 2019,40(12):5493-5502.
[26] 王佳文,何 萍,徐 杰,等.水生态系统中宇宙发展现状[J]. 应用生态学报, 2021,32(3):1129-1140.
Wang J W, He P, Xu J, et al. A review on aquatic ecosystem mesocosms [J]. Chinese Journal of Applied Ecology, 2021,32(3): 1129-1140.
[27] Luo M, Liu Y, Huang J, et al. Rhizosphere processes induce changes in dissimilatory iron reduction in a tidal marsh soil: a rhizobox study [J]. Plant and Soil, 2018,433:83-100.
[28] Morris J. Estimating net primary production of salt marsh macrophytes [J]. Principles and Standards for Measuring Primary Production, 2007, 10:1093
[29] Kirwan M L, Guntenspergen G R. Feedbacks between inundation, root production, and shoot growth in a rapidly submerging brackish marsh [J]. Journal of Ecology, 2012,100:764-770.
[30] Voss C M, Christian R R, Morris J T. Marsh macrophyte responses to inundation anticipate impacts of sea-level rise and indicate ongoing drowning of North Carolina marshes [J]. Marine Biology, 2013, 160(1):181-194.
[31] James C R, Lytle D A. Relationships between oxidation-reduction potential, oxidant, and pH in drinking water [J]. Environmental Science, 2004:14-18.
[32] Seeberg-Elverfeldt J, Schlüter M, Feseker T, et al. Rhizon sampling of pore waters near the sediment/water interface of aquatic systems [J]. Limnology and Oceanography: Methods, 2005,3(8):361-371.
[33] Luo M, Zhai Z, Ye R, et al. Carbon mineralization in tidal freshwater marsh soils at the intersection of low-level saltwater intrusion and ferric iron loading [J]. Catena, 2020,193:104644.
[34] Johnston S G, Burton E D, Aaso T, et al. Sulfur, iron and carbon cycling following hydrological restoration of acidic freshwater wetlands [J]. Chemical Geology, 2014,371:9-26.
[35] Luo M, Zeng C S, Tong C, et al. Abundance and speciation of iron across a subtropical tidal marsh of the Min River Estuary in the East China Sea [J]. Applied Geochemistry, 2014,45:1-13.
[36] Gauci V, Dise N, Fowler D. Controls on suppression of methane flux from a peat bog subjected to simulated acid rain sulfate deposition [J]. Global Biogeochemical Cycles, 2002,16(1):4-1-4-12.
[37] Hirota M, Tang Y H, Hu Q W, et al. Methane emissions from different vegetation zones in a Qinghai-Tibetan Plateau wetland [J]. Soil Biology and Biochemistry, 2004,36(5):737-748.
[38] Kirwan M L, Megonigal J P. Tidal wetland stability in the face of human impacts and sea-level rise [J]. Nature, 2013,504:53-60.
[39] Adam L J, Mozdzer T J, Shepard K A,et al. Tidal marsh plant responses to elevated CO2, nitrogen fertilization, and sea level rise [J]. Global Change Biology, 2013,19(5):1495-503.
[40] Lan Z C, Chen, Y S, Shen R C, et al. Effects of flooding duration on wetland plant biomass: The importance of soil nutrients and season [J]. Freshwater Biology, 2020,66(2):211-222.
[41] 李 玲,仇少君,刘京涛,等.土壤溶解性有机碳在陆地生态系统碳循环中的作用 [J]. 应用生态学报, 2012,23(5):1407-1414.
Li L, Qiu S J, Liu J T, et al. Roles of soil dissolved organic carbon in carbon cycling of terrestrial ecosystems: A review [J]. Chinese Journal of Applied Ecology, 2012,23(5):1407-1414.
[42] Neubauer S C, Franklin R, Berrier D. Saltwater intrusion into tidal freshwater marshes alters the biogeochemical processing of organic carbon [J]. Biogeosciences, 2013,10(7):8171-8183.
[43] Zhou M H, Butterbach-Bahl K, Vereecken H, et al. A meta-analysis of soil salinization effects on nitrogen pools, cycles and fluxes in coastal ecosystems [J]. Global Change Biology, 2016,23(3):1338-1352.
[44] Armstrong W, Cousins D, Armstrong J, et al.Oxygen distribution in wetland plant roots and permeability barriers to gas-exchange with the rhizosphere: a microelectrode and modelling study with Phragmites australis [J]. Annals of Botany, 2000,86:(3)687-703.
[45] 高灯州,章文龙,曾从盛,等.闽江河口湿地土壤生物和非生物因子与水淹频率的关系 [J]. 湿地科学, 2016,14(1):27-36.
Gao D Z, Zhang W L, Zeng C S et al. Relationship between Biotic Factors, Abiotic Factors and Flood Frequency in Min River Estuarine Wetlands [J]. Wetland Science, 2016,14(1):27-36.
[46] Kostka J E, Gribsholt B, Petrie E, et al. The rates and pathways of carbon oxidation in bioturbated tidal marsh sediments [J]. Limnology and Oceanography, 2002,47(1):230-240.
[47] Taillefert M, Neubauer S, Bristow G. The effect of tidal forcing on biogeochemical processes in intertidal salt marsh sediments [J]. Geochemical Transactions, 2007,8:6.
[48] 仝 川,柳铮铮,曾从盛,等.模拟SO42-沉降对河口潮汐湿地甲烷排放通量的影响 [J]. 中国环境科学, 2010,30(3):302-308.
Tong C, Liu Z Z, Zeng C S, et al. Effects of simulated sulfate deposition on CH4fluxes from tidal wetland in the Min River estuary [J]. China Environmental Science, 2010,30(3):302-308.
[49] Chambers L G, Osborne T Z, Reddy K R. Effect of salinity-altering pulsing events on soil organic carbon loss along an intertidal wetland gradient: a laboratory experiment [J]. Biogeochemistry, 2013,115:363- 383.
[50] Canfield D E, Jorgensen B B, Fossing H, et al. Pathways of organic carbon oxidation in three continental margin sediments [J]. Marine Geology, 1993,113:27-40.
[51] Setia R, Marschner P, Baldock J, et al. Salinity effects on carbon mineralization in soils of varying texture [J]. Soil Biology and Biochemistry, 2011,43:1908-1916.
[52] 韩广轩.潮汐作用和干湿交替对盐沼湿地碳交换的影响机制研究进展 [J]. 生态学报, 2017,37(24):170-8178.
Han G X. Effect of tidal action and drying-wetting cycles on carbon exchange in a salt marsh: progress and prospects [J]. Acta Ecologica Sinica, 2017,37(24):170-8178.
[53] 高灯州,曾从盛,章文龙,等.闽江口湿地土壤有机碳及其活性组分沿水文梯度分布特征 [J]. 水土保持学报, 2014,28(6):216-221,227.
Gao D Z, Zeng C S, Zhang W L, et al. Spatial distributions of soil organic carbon and active composition along a hydrologic gradient in Min River estuarine wetland [J]. Journal of Soil and Water Conservation, 2014,28(6):216-221,227.
[54] Mer J L, Roger P. Production, oxidation, emission and consumption of methane by soils: A review [J]. European Journal of Soil Biology, 2001,7:(1)25-50.
[55] Singh J S. Methanotrophs: the potential biological sink to mitigate the global methane load [J]. Current Science, 2011,100:29-30.
[56] Olsson L, Ye S Y, Yu X Y, et al. Factors influencing CO2and CH4emissions from coastal wetlands in the Liaohe Delta, Northeast China [J]. Biogeosciences Discussions, 2015,12(4):3469-3503.
[57] Angle J C, Morin T H, Solden L M, et al. Methanogenesis in oxygenated soils is a substantial fraction of wetland methane emissions [J]. Nature Communications, 2017,8(1):1567.
[58] Wilmoth J L, Schaefer J K, Schlesinger D R. The role of oxygen in stimulating methane production in wetlands [J]. Global Change Biology, 2021,27(22):5831-5847.
[59] 王 鹏,王一丹,申 霞,等.南通沿海潮间带土-气界面CO2交换特征 [J]. 中国环境科学, 2018,38(2):675-682.
Wang P, Wang Y D, Shen X, et al. Characteristics of soil-air CO2exchange fluxes in intertidalite of Nantong [J]. China Environmental Science, 2018,38(2):675-682.
[60] 王维奇,曾从盛,仝 川,等.闽江河口潮汐湿地二氧化碳和甲烷排放化学计量比 [J]. 生态学报, 2012,32(14):4396-4402.
Wang W Q, Zeng C S, Tong C, et al. Stoichiometry of carbon dioxide and methane emissions in Minjiang River estuarine tidal wetland [J]. Acta Ecologica Sinica, 2012,32(14):4396-4402.
[61] Xiao Q T, Zhang M, Hu Z H, et al. Spatial variations of methane emission in a large shallow eutrophic lake in subtropical climate [J]. Journal of Geophysical Research Biogeosciences, 2017,122:1597- 1614.
[62] Whalen S C. Biogeochemistry of methane exchange between natural wetlands and the atmosphere [J]. Environmental Engineering Science, 2005,22(1):73-94.
[63] Wang Z H, Li J Y, Xu X Y, et al. Denitrifying anaerobic methane oxidation and mechanisms influencing it in Yellow River Delta coastal wetland soil, China [J]. Chemosphere, 2022,298:134345.
[64] 窦渤凯,王义东,薛冬梅,等.挺水和湿生草本植物传输甲烷的过程与机制研究进展 [J]. 植物生态学报, 2017,41(11):1208-1218.
Dou B K, Wang Y D, Xue D M, et al. Research advancement in the processes and mechanisms of transporting methane by emerged herbaceous plants and hygrophytes [J]. Chinese Journal of Plant Ecology, 2017,41(11):1208-1218.
[65] 马安娜,陆健健.芦苇在微咸水河口湿地甲烷排放中的作用 [J]. 生态学报, 2011,31(8):2245-2252.
Ma A N, Lu J J. Effects of Phragmites australis on methane emission from a brackish estuarine wetland [J]. Acta Ecologica Sinica, 2011, 31(8):2245-2252.
[66] Wang B, Neue H U, Samonte H P. Role of rice in mediating methane emission [J]. Plant and Soil, 1997,189:107-115.
[67] Neubauer S C, Megonigal J P. Moving beyond global warming potentials to quantify the climatic role of ecosystems [J]. Ecosystems, 2015,18(6):1000-1013.
Plants moderate the effects of emission fluxes of CO2and CH4on increased flooding in wetland soils.
TAN Feng-feng1, LUO Min2*, ZHANG Chang-wei2, CHEN Xin2, HUANG Jia-fang1,3
(1.School of Geographical Sciences, Fujian Normal University, Key Laboratory of Humid Subtropical Eco-geographical Process, Ministry of Education, Fujian Normal University, Fuzhou 350007;2.College of Environment and Safety Engineering, Fuzhou University, Fuzhou 350116, China;3.Wetland Ecosystem Research Station of Minjiang Estuary, National Forestry and Grassland Administration, Fuzhou 350215, China)., 2023,43(1):424~435
Two mesocosms, with and without plants, were established in the tidal wetlands of the Minjiang Estuary, Southeast China. Each mesocosm contained three elevation treatments: control (CK), CK-20cm, and CK-40cm. The CO2and CH4emission fluxes under each elevation treatment in the planted and unplanted mesocosms were investigated. Overall, the results showed that increased flooding did not significantly change the total biomass or stem heights of the plants, but it increased the belowground biomass and decreased the aboveground biomass. In the planted mesocosms, the soil redox potential (ORP) and dissolved organic carbon (DOC) concentration increased with increasing flooding. In the unplanted mesocosms, the DOC concentration also increased with increasing flooding, but the soil ORP did not change. In the planted mesocosms, compared to the CK treatment, CO2emission flux increased by 43% and 61%, respectively and CH4emission flux increased by 66% and 84%, respectively for the CK-20cm and CK-40cm treatments. In the unplanted mesocosms, the emission fluxes of CO2and CH4did not significantly change with increasing flooding. Within 50 to 100 years of sea level rises in the future, the sustained-flux global warming potential of vegetated tidal wetland will increase, while the soil organic carbon storage will decrease. Conversely, in unvegetated tidal wetlands, the sustained-flux global warming potential will decrease, while the storage of soil organic carbon will not change.
increased flooding;CO2and CH4eflux;sea level rise;redox potential;tidal wetland;Minjiang Estuary
X131
A
1000-6923(2023)01-0424-12
谭凤凤(1997-),女,湖南株洲人,福建师范大学地理科学学院硕士研究生,主要从事湿地生物地球化学循环研究.
2022-05-16
国家自然科学基金面上项目(32071598);福建省基金面上项目(2020J01503);福建省林业科技项目(2021FKJ30)
* 责任作者, 副教授, luomin@fzu.edu.cn
