缢蛏对潮间带原油污染的氧化应激及IBR评价
2023-02-03徐青霞潘玉英杨婷婷杨金生王滢赢唐忠伟
徐青霞,潘玉英,2*,杨婷婷,杨金生,张 萌,陈 帆,王滢赢,唐忠伟
缢蛏对潮间带原油污染的氧化应激及IBR评价
徐青霞1,潘玉英1,2*,杨婷婷1,杨金生3,张 萌1,陈 帆1,王滢赢1,唐忠伟1
(1.浙江海洋大学,水产学院,浙江 舟山 316022;2.浙江省海洋渔业装备技术研究重点实验室,浙江 舟山 316022;3.浙江海洋大学,石油化工与环境学院,浙江 舟山 316022)
通过研究不同浓度原油污染对缢蛏()鳃和内脏团抗氧化酶活性、脂质过氧化及鳃结构的影响,结合综合生物标志物响应(IBR),探讨潮间带原油污染对生物的毒性效应.结果显示:在剂量-效应方面,2种组织超氧化物歧化酶(SOD)活性和内脏团中谷胱甘肽过氧化物酶(GPx)总体上表现为低浓度诱导、高浓度抑制效应;SOD诱导与过氧化氢酶(CAT)抑制同时出现,规律大致相反.在时间-效应上,SOD活性呈升高-降低-升高的趋势, CAT与GPx呈先降低后升高的趋势;谷胱甘肽硫转移酶(GST)在鳃中呈现先升高后降低的趋势,酶活性最高为371.663U/mgprot.暴露前期(6h)缢蛏2种组织中丙二醛(MDA)含量显著增加,鳃和内脏团中MDA含量最高值分别为5.030和10.705nmol/mgprot,后期逐渐平稳.IBR结果表明鳃中生物标志物对原油污染敏感度更高.原油暴露会使鳃丝结构发生变形或引起鳃丝脱离等现象.研究表明,缢蛏鳃更适宜作为潮间带原油暴露生物监测与评价的器官.
原油;缢蛏;抗氧化酶;IBR;组织损伤
原油污染现已成为最为严重的海洋污染之一[1].石油类污染物进入海洋生态系统,很容易被周围水域的水生动物通过体表、鳃或饮食吸收,并在机体器官和组织内富集,对水生生物产生危害,产生急性和长期毒性作用[2-3].如双齿围沙蚕()会因海水中的原油产生弹跳、扭动等应激反应,随着暴露时间的延长,则会出现死亡等毒性效应[4].当石油类污染物进入生物体内,会通过自身反应产生大量活性氧自由基(ROS),如H2O2、O- 2∙.过量ROS将对生物体造成酶失活、脂质过氧化、DNA链断裂等氧化损伤[5-6].为应对过量ROS对机体的损伤,生物体会利用抗氧化酶系统清除ROS,防止氧化损伤[7].丙二醛(MDA)是脂质过氧化产物中的一类,它可与DNA、膜蛋白和酶等发生交联反应,因此MDA含量也可以作为生物标志物判断生物受污染的程度[8].
生物体在受到污染胁迫时,体内酶活性既有诱导又有抑制,且存在响应时间偏差的情况,因此单一的生物标志物不能全面反映生物受石油污染后的毒害情况[9].综合生物标志物响应 (IBR) 指标能够将不同的生物标志物综合起来进行定量分析.已有研究表明利用IBR能有效评价污染物对生物的毒性效应,根据其IBR 大小可知组织中氧化应激的能力水平[1].组织切片是一种组织损伤研究技术,能够直接观察生物组织结构受环境影响的情况,在生态毒理学研究中应用甚广[10].目前国内外一些研究表明海洋生物受到重金属、石油或其他有机物污染,会造成严重的组织损伤,出现了细胞坏死、空泡化等现象[11].目前,有关原油暴露对生物抗氧化酶影响和富集效应方面的研究较多,然而组织损伤的相关研究较少.
原油附着在细粒悬浮沉积物上或与潮滩沉积物直接接触后仍能持续存在,受污染沉积物发生再悬浮事件后亦可产生毒性,加大了对底栖动物毒害的风险[12-13].目前,海洋环境污染监测研究主要集中在海水中原油及其原油组分对海洋生物的影响,对生物体内生物标志物的变化方面也有研究,但关于潮间带生态系统原油污染对底栖生物的毒性效应研究较为少见[14].缢蛏()是一种广温广盐性潮间带贝类,常穴居于潮间带软泥内,具有极高的经济价值[15].其移动能力较弱,为滤食性生物,无固着的生活方式及对有机污染物的低酶降解率使它们能够积累高水平的有机分子[16].有研究表明,双壳类生物相较于鱼类,对石油烃、重金属等污染物具有较强的富集能力和耐受力[17-18],因此可作为本研究理想的实验贝类.
本文通过研究原油暴露对缢蛏鳃和内脏团组织抗氧化酶(SOD、CAT、GPx、GST)活性和脂质过氧化(MDA)的影响,同时运用IBR定量分析原油暴露对缢蛏可能的毒性效应,利用组织切片技术探究原油暴露对缢蛏鳃组织损伤的影响,为原油污染潮间带环境评价与保护提供基础数据.
1 材料与方法
1.1 材料


表1 实验原油组分及其含量
缢蛏()购自浙江舟山,选取平均体长(5.34±0.33) cm、平均体重(9.19±1.80) g的健康个体.沉积物取自浙江舟山长峙岛潮间带,经风干后过筛,选取孔径小于0.5mm的粉砂备用.经测定,实验所用沉积物中石油含量背景值为29.73mg/ kg,远小于《海洋沉积物质量》(GB 18668-2002)中第一类海域的石油类含量标准,符合实验所需要求[19].
1.2 仪器与试剂
主要仪器:紫外可见分光光度计(上海美谱达UV-1100B),恒温水浴箱(上海一恒HWS-24),漩涡混匀器(常州越新XH-C),移液枪(Eppendorf),电子天平(上海花潮UTP-313),石蜡切片机(德国徕卡BIOCUT),组织摊烤片机(上海卓的ZD-1145),Nikon显微镜(日本奥林巴斯).
主要试剂:正己烷、无水乙醇、冰醋酸均为分析纯,购自国药集团化学试剂有限公司;用于测定抗氧化酶活性和MDA含量的试剂盒均购自南京建成生物工程研究所.
1.3 实验设计
实验于体积为50L的聚乙烯养殖箱中进行,以海水:沉积物=8:7.5的质量比模拟潮间带淤泥质环境,总模拟环境占箱体1/3.按照《海洋沉积物质量》(GB 18668-2002)将原油污染浓度设为0,500,1000, 1500,10000和15000mg/kg,每个浓度设置3个平行[19].在处理过程中,按不同质量比先将原油与沉积物在箱体内充分混匀,再加入盐度为24的天然海水,海水与含油沉积物混匀后静置,水温控制在20℃左右.
实验开始时,在每个养殖箱中放入11只缢蛏成体,观察其生存状况并及时清除死贝(双壳紧闭且触碰无反应),实验期间不喂食.在96h急性原油暴露过程中,各组均无缢蛏死亡记录.在取样前记录缢蛏壳长、壳宽、壳高以及湿重(包括壳).分别于第3,6,12,24,48,96h时在每个养殖箱中随机取1只缢蛏,并立即解剖出鳃和内脏团,用0.86%生理盐水冲洗,吸干组织表面水分后用液氮速冻并放入-80℃冰箱保存至进一步分析.于实验第48h时从每个养殖箱中随机取缢蛏1只用于组织病理学观察.实验结束后,以随机均匀的取样原则,在每个养殖箱中各取3份上覆水和沉积物,用于测定暴露体系中上覆水和沉积物实际原油浓度.
1.4 样品处理及测定
组织样品按其质量加入4倍生理盐水,于冰浴条件下制备20%的组织匀浆,随后将组织匀浆进行离心(2500r/min,4℃,10min),取上清液用于蛋白含量及其他酶活性测定.酶活性测定过程采用南京建成试剂盒说明书进行,蛋白含量采用考马斯亮蓝法; SOD采用羟胺法;CAT采用钼酸铵法;GPx和GST采用分光光度法;MDA采用硫代巴比妥酸法.
解剖出的鳃组织立即用Bouin氏液固定,经酒精梯度脱水、二甲苯与石蜡浸蜡、石蜡包埋后,使用切片机切片,切片厚度5 μm,经烤片后用苏木精-伊红(H.E)染色,封片后使用Nikon显微镜观察细胞结构.
依据《海洋监测规范》(GB 17378-2007)[20]的第4部分海水分析和第5部分沉积物分析,采用紫外分光光度法测定各浓度组中上覆水和沉积物含油量.
1.5 数据处理及IBR计算
用SPSS 25.0对所得数据进行正态性检验和方差齐性检验后,以单因素(ANOVA)方差分析或非参数检验(Kruskal-Wallis检验)对数据进行统计和组间差异显著性分析.其中<0.05表示组间差异显著,<0.01表示差异极显著,<0.001表示差异极其显著,并使用Origin 2018进行绘图.
依据Beliaeff等[21]于2002年首次提出的理论,并参照Marigómez等[22]和Pan等[23]的修正方法计算IBR.
首先计算各生物标志物在不同取样时间下测定结果的平均值()和所有时间点的总平均值()及标准差(),对标准化得到.
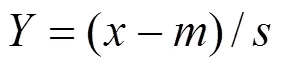
然后取标准化后各时间点的最小值(min)与相加得到得分B.
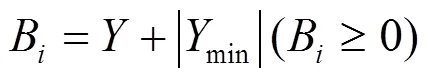
使用星状图来显示各生物标志物的处理结果,B在星状图中表示为各生物标志物下辐射线的长度.IBR通过星状图的面积计算,即为相邻生物标志物的辐射线围成的三角形面积之和.


2 结果与分析
2.1 暴露实验原油实测浓度
如表2,结果所示,除1000mg/kg浓度组外,其他各组沉积物油浓度实测值与理论配制值相比偏低,可能是由于实验过程沉积物中部分原油受生物体活动影响会释放至上覆水中,从而造成上覆水油浓度实测值升高及沉积物油浓度实测值偏低.而1000mg/kg浓度组沉积物油浓度实测值较理论配制值略有升高,可能是由于该浓度组生物扰动对沉积物原油释放影响较小,且沉积物存在含油量本底值.综上所述,各组上覆水和沉积物油浓度实测值均与暴露浓度成正比,与实验设计理论值规律相同,符合实验设计要求.
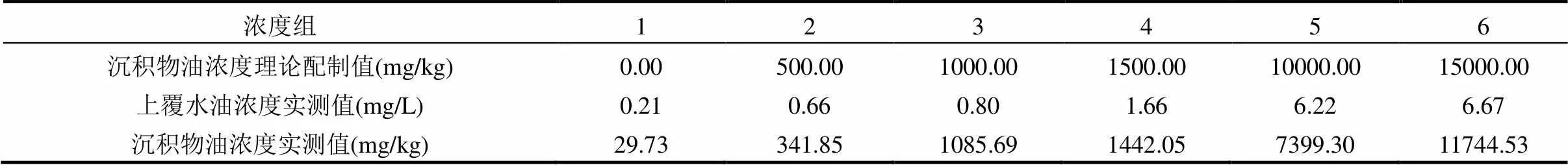
表2 各浓度组上覆水和沉积物原油含量理论值和实测值
2.2 原油对缢蛏抗氧化酶活性的影响
以SOD、CAT、GPx、GST酶活性来反映缢蛏体内抗氧化酶活性的变化情况,活性高于对照组表示被诱导,低于对照组则表示活性受到抑制.
2.2.1 鳃 如图1(a)所示,在12和96h时各浓度组SOD活性均高于对照组,表明在实验期间SOD活性被诱导,其中12h的500,1000,1500和15000mg/kg浓度组被显著诱导(<0.05).暴露6和24h,除10000mg/kg浓度组外,各浓度组SOD活性均受到抑制.各浓度组SOD活性随浓度变化规律不明显,无显著浓度效应关系,但总体上呈现低浓度(<1000mg/kg)诱导、高浓度抑制.10000mg/kg浓度组在暴露期间SOD活性均高于对照组,表明在实验期间SOD活性被诱导,于6h酶活性达到峰值122.136U/mgprot. SOD酶活性最大诱导值出现在48h 的1500mg/kg浓度组,此时酶活性被显著诱导为131.767U/mgprot(<0.05).
如图1(b)所示,随时间的增加,500mg/kg浓度组CAT活性呈降低的趋势,1000,10000和15000mg/kg浓度组CAT活性先降低后升高,1500mg/kg浓度组呈现升高-降低-升高的变化情况.相较于对照组,各浓度组随时间变化规律差异较大,随时间的增加500mg/kg浓度组从6h后受到诱导,CAT活性高于对照组,但在暴露48h后受到抑制低于对照组,其CAT活性最大抑制值为1.059U/mgprot.1000mg/kg浓度组从6h后受到诱导,CAT活性高于对照组.1500mg/ kg浓度组除暴露12和96h外,均受到抑制低于对照组.10000和15000mg/kg浓度组随时间变化情况相同,除12和48h CAT活性低于对照组外,均高于对照组.相较于对照组,CAT活性随浓度的增加变化规律不显著,暴露96h,除500mg/kg浓度组受到抑制外,其他浓度组均受到诱导,其中1500和15000mg/kg浓度组显著高于对照组(<0.05).
如图1(c)所示,暴露前期3~6h内,除6h的500和15000mg/kg浓度组外,其他浓度组GPx活性均高于对照组,表明原油暴露前期GPx活性受到诱导.暴露3h,500,1500和15000mg/kg浓度组GPx活性显著高于对照组(<0.05)并达到峰值,GPx活性分别为178.827,169.752和167.589U/mgprot.暴露12h,除500和1500mg/kg浓度组外,其余浓度组GPx活性开始受到抑制.暴露24h,各浓度组GPx活性均极显著低于对照组(<0.01).暴露48h,各浓度组GPx活性开始升高,至96h时,除500和15000mg/kg浓度组外,各浓度组活性高于对照组.
如图1(d)所示,各浓度组GST活性随时间的变化总体呈现先升高后降低的趋势.暴露3h,所有浓度组GST活性均低于对照组,表明暴露前期GST活性被抑制.暴露6h,各浓度组GST活性开始升高,其中500和1000mg/kg浓度组GST活性受到诱导高于对照组,其余浓度组GST活性仍受到抑制.暴露12~48h,各浓度组GST活性均受到诱导高于对照组,其中48h的500,1500和10000mg/kg浓度组GST活性达到各浓度组峰值,分别为371.663,359.265和356.293U/mgprot,与对照组差异极其显著(<0.001).暴露后期96h,各浓度组GST活性受到抑制均低于对照组,其中500,1000及1500mg/kg浓度组极显著低于对照组(<0.01),达到各浓度组最小值,分别为124.854,101.17和140.135U/mgprot.
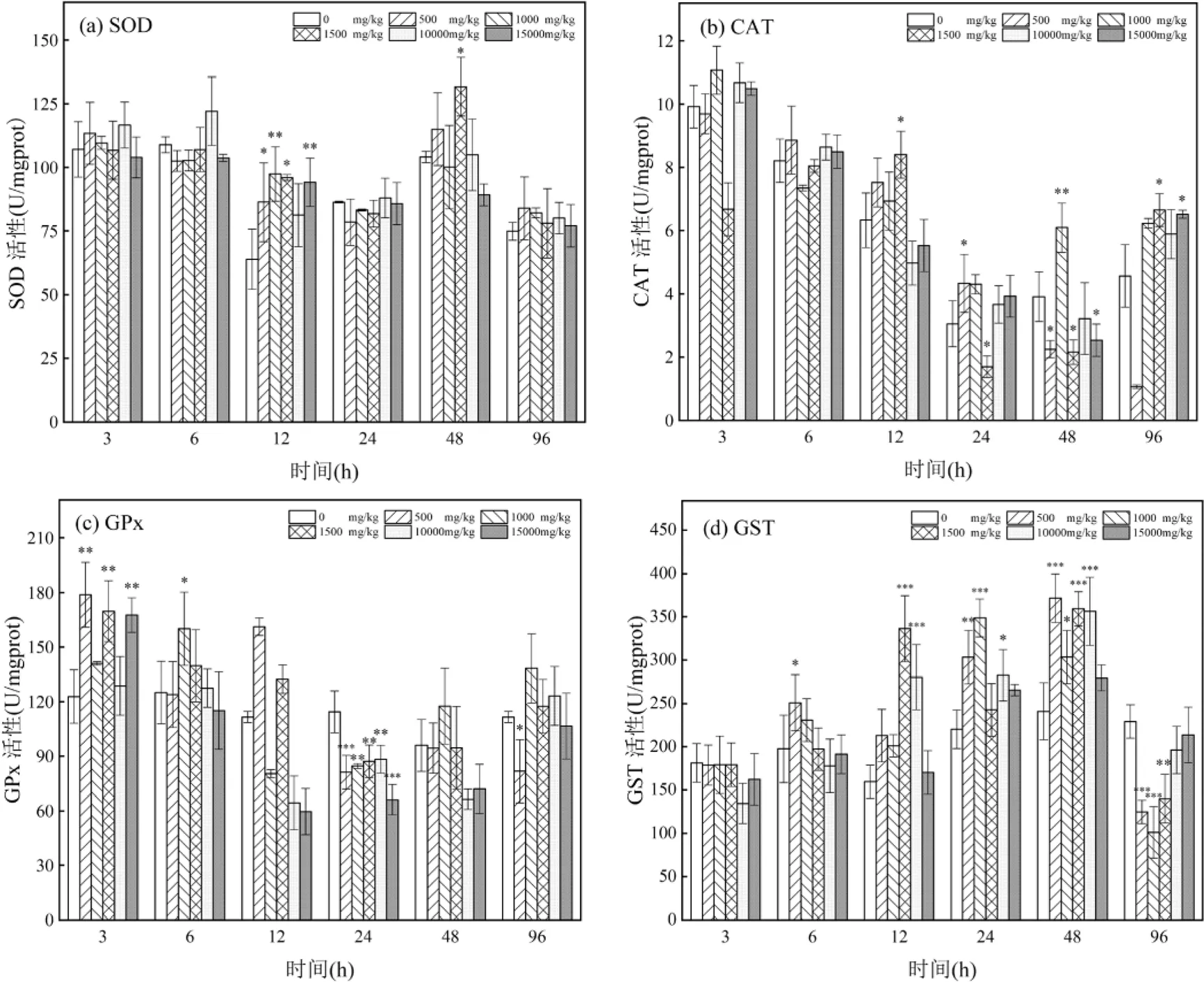
图1 原油对缢蛏鳃SOD、CAT、GPx和GST活性的影响
*表示与对照组相比差异显著<0.05,**表示与对照组相比差异极显著<0.01,***表示与对照组相比差异极其显著<0.001
2.2.2 内脏团 如图2(a)所示,除500和1000mg/kg浓度组外,各浓度组内脏团SOD活性随时间的变化呈降低-升高-降低的趋势,内脏团SOD活性明显低于鳃.内脏团SOD活性随浓度变化波动较大.暴露3h,除1000mg/kg浓度组外,各浓度组SOD活性均高于对照组,表明此时内脏团SOD活性受到诱导.暴露6h,10000mg/kg浓度组SOD活性低于对照组,表明受到抑制,其他浓度组SOD活性受到诱导均高于对照组,500和1000mg/kg 浓度组SOD活性于6h达到峰值,其活性分别为37.736和34.54U/mgprot.暴露12h, 500,1000和1500mg/kg浓度组SOD活性明显下降,10000和15000mg/kg浓度组SOD活性略有上升.暴露24h,除1000mg/kg浓度组外,其他浓度组SOD活性均有上升但仍低于对照组,1500和10000mg/kg浓度组SOD活性极显著低于对照组(<0.01).暴露48h,各浓度组SOD活性开始上升并高于对照组, SOD酶活性最大诱导值出现在48h的1500mg/kg浓度组,此时酶活性被极显著诱导为38.603U/mgprot (<0.01),与鳃中情况相同.至暴露96h,各浓度组SOD活性虽有降低但仍高于对照组.
如图2(b)所示,暴露期间各浓度组主要呈现抑制效应.暴露3h,各浓度组CAT活性均低于对照组,其中1500和15000mg/kg浓度组CAT活性极其显著低于对照组(<0.001),其活性分别为10.855和8.275U/ mgprot.暴露6h,除1500mg/kg浓度组外,各浓度组CAT活性均高于对照组.暴露12h,各浓度组CAT活性总体上虽有升高,但1500和10000mg/kg浓度组CAT活性低于对照组.暴露24h,各浓度组CAT活性持续升高,但CAT活性均低于对照组,表明CAT活性受到抑制.暴露48~96h,除48h的15000mg/kg和96h的1000mg/kg浓度组外,其他各浓度组CAT浓度仍受到抑制低于对照组. 15000mg/kg浓度组CAT活性随暴露时间的增加而升高.
如图2(c)所示,各浓度组GPx活性随时间的增加总体上呈现先降低再升高的趋势,与鳃中GPx活性变化趋势相似.暴露3h,除1500mg/kg浓度组外,各浓度组GPx活性受到抑制低于对照组.暴露6h,除10000mg/kg浓度组外,各浓度组GPx活性受到诱导高于对照组,其中500mg/kg浓度组GPx活性极其显著高于对照组(<0.001),1000mg/kg浓度组显著高于对照组(<0.05).暴露12h,各浓度组GPx活性降低,1000和1500mg/kg浓度组GPx活性低于对照组.暴露24h,各浓度组内脏团GPx活性升高但均低于对照组.暴露48h,GPx活性持续升高并高于对照组,各浓度组GPx活性均极显著高于对照组,除500mg/kg浓度组外,其余浓度组达到各组峰值,活性峰值范围为201.392~240.490U/mgprot.暴露96h,除500mg/kg浓度组GPx活性升高,各浓度组GPx活性均有降低.
如图2(d)所示,暴露3h,各浓度组GST活性受到抑制低于对照组.暴露6~12h,内脏团中GST活性受到诱导,开始高于对照组活性.暴露24~48h,除15000mg/kg浓度组GST活性高于对照组外,其余各浓度组GST活性均低于对照组.暴露96h,各浓度组GST活性均高于对照组.相较于对照组,GST活性随浓度的增加变化规律不显著.500,1000和10000mg/ kg浓度组随时间的变化情况相似,呈升高-降低-升高的趋势.1500mg/kg浓度组在暴露前期受到抑制低于对照组,于96h受到诱导高于对照组.15000mg/kg浓度组在暴露前期受到抑制低于对照组,于12h受到诱导高于对照组.
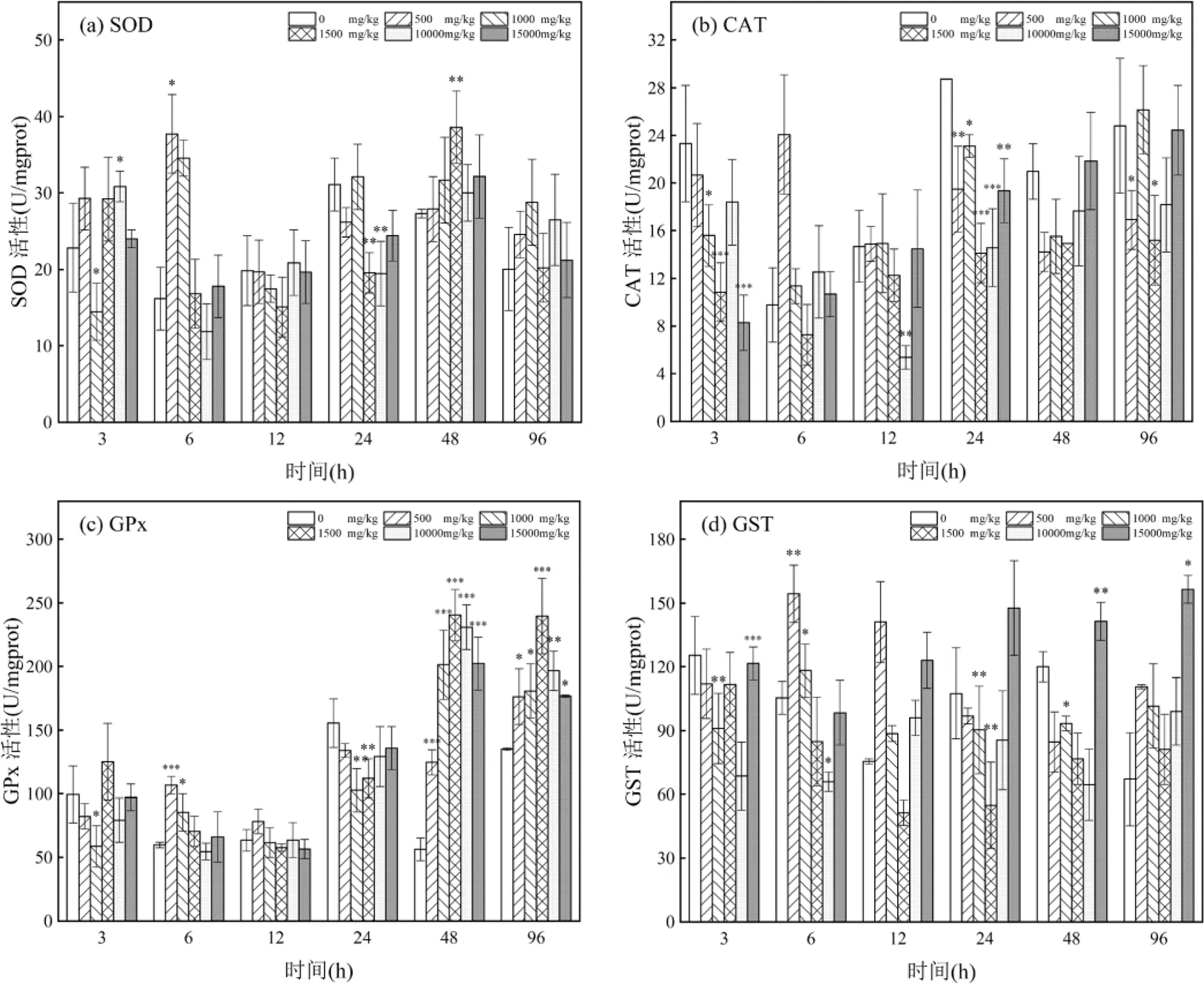
图2 原油对缢蛏内脏团SOD、CAT、GPx和GST活性的影响
*表示与对照组相比差异显著<0.05,**表示与对照组相比差异极显著<0.01,***表示与对照组相比差异极其显著<0.001
2.3 原油对缢蛏脂质过氧化程度的影响
如图3(a)所示,鳃中MDA含量随时间变化总体呈现升高-降低-升高的趋势,但各浓度组随时间变化规律各有不同.暴露6h,各浓度组MDA含量相较于3h略有升高,表明鳃中为应对原油暴露存在脂质过氧化情况,1500mg/kg浓度组MDA含量达到峰值为5.030nmol/mgprot.暴露12h,各浓度组MDA含量与6h相比有所降低.暴露24h,除15000mg/kg浓度组MDA含量略低于对照组外,其余浓度组MDA含量均高于对照组,MDA含量随浓度的增大而降低,其中500mg/kg浓度组极其显著高于对照组(<0.001), 1000mg/kg浓度组极显著高于对照组(<0.01), 1500mg/kg浓度组显著高于对照组(<0.05).暴露48~96h,MDA含量降低并逐渐低于对照组,MDA含量最低是48h的500mg/kg浓度组,含量为1.294nmol/mgprot.

*表示与对照组相比差异显著<0.05,**表示与对照组相比差异极显著<0.01,***表示与对照组相比差异极其显著<0.001
如图3(b)所示,各浓度组MDA含量随时间的变化规律不显著.暴露3h,除1500mg/kg浓度组MDA含量低于对照组外,其余浓度组MDA含量均高于对照组,其中500mg/kg浓度组极其显著高于对照组(<0.001).暴露6h,除15000mg/kg浓度组MDA含量低于对照组外,其余浓度组MDA含量均高于对照组,其中500和1000mg/kg浓度组均极其显著高于对照组(<0.001),500mg/kg浓度组MDA含量达到峰值为10.705nmol/mgprot.暴露12h,MDA含量与暴露浓度呈现低浓度(<1000mg/kg)诱导、高浓度抑制的效应关系.暴露24h,除15000mg/kg浓度组MDA含量高于对照组外,其余浓度组MDA含量均低于对照组.暴露48h,各浓度组MDA含量升高,至暴露96h又降低.500mg/kg浓度组在暴露3~12h内MDA含量高于对照组,暴露24~96h内MDA含量低于对照组.1000mg/kg浓度组除暴露24h,其余暴露期MDA含量均高于对照组.1500mg/kg浓度组除暴露6和48h,其余暴露期均低于对照组.10000mg/kg浓度组在暴露期间MDA含量变化不大.15000mg/kg浓度组于48h达到该浓度峰值,极其显著高于对照组(<0.001),于96h达到最小值为4.191nmol/mgprot (<0.01).
2.4 综合生物标志物响应(IBR)评价原油暴露对缢蛏的影响
本文共选取SOD、CAT、GPx、GST和MDA 5种生物标志物,利用IBR进行综合分析,以不同时间段为范围,绘制IBR星状图.不同浓度原油暴露96h对缢蛏鳃和内脏团的星状图如图4~5所示,IBR随时间的变化如图6所示.
2.4.1 鳃 由图4可知,除暴露12h外各时间点下,各浓度组鳃中不同生物标志物Bi值分布情况相似.暴露3h,SOD、CAT和GPx的Bi值较高,表明暴露前期SOD、CAT和GPx酶活性响应较快.暴露6h, CAT的Bi值略有下降,MDA的Bi值升高.暴露12~ 24h,GST的Bi值升高,表明GST酶开始发挥作用导致活性升高.暴露48h,SOD的Bi值升高,但MDA的Bi值降低.暴露96h,SOD和GST的Bi值降低,而MDA的Bi值升高.
由图6(a)可知,各浓度组鳃中IBR值随暴露时间的增加主要呈现升高-降低-升高的趋势,暴露前期IBR值明显大于暴露后期.暴露3~24h,除3h的1500mg/kg、6和24h的15000mg/kg浓度组外,其余浓度组IBR值均高于对照组.暴露48~96h,除48h的1000和1500mg/kg及96h的10000mg/kg浓度组外,各浓度组IBR值均低于对照组.原油暴露浓度为500mg/kg时,各时间点IBR累积值最大,为58.084.总体来看,低浓度组(£1500mg/kg)IBR值存在高于高浓度组(³10000mg/kg)现象.

2.4.2 内脏团 由图5可知,相同时间点下,各浓度组中内脏团不同生物标志物的Bi值分布情况相似.暴露3h,SOD、CAT和GST的Bi值较高.暴露6~12h,除6h的500和1000mg/kg浓度组外,其余浓度组SOD和CAT的Bi值下降.暴露24h,SOD、CAT和GPx的Bi值升高.暴露48h,SOD和MDA的Bi值升高,但CAT的Bi值降低.暴露96h,SOD和MDA的Bi值降低,但GST和CAT的Bi值升高.
由图6(b)可知,暴露3~12h,6h的500和1000mg/kg浓度组IBR值明显高于对照组,3h的500和10000mg/kg、6h的1500mg/kg以及12h的500和1000mg/kg浓度组IBR稍高于对照组,其余浓度组IBR值均低于对照组,呈现低浓度组IBR值高于高浓度现象,与鳃中情况相似.暴露24h,各浓度组IBR值均低于对照组.暴露48~96h,除500mg/ kg浓度组外,各浓度组IBR值均高于对照组.除500和1000mg/kg外,其他浓度组暴露前期IBR值小于暴露后期.暴露浓度为500mg/kg时,各时间点IBR累积值达到峰值为61.925,与鳃中情况类似.
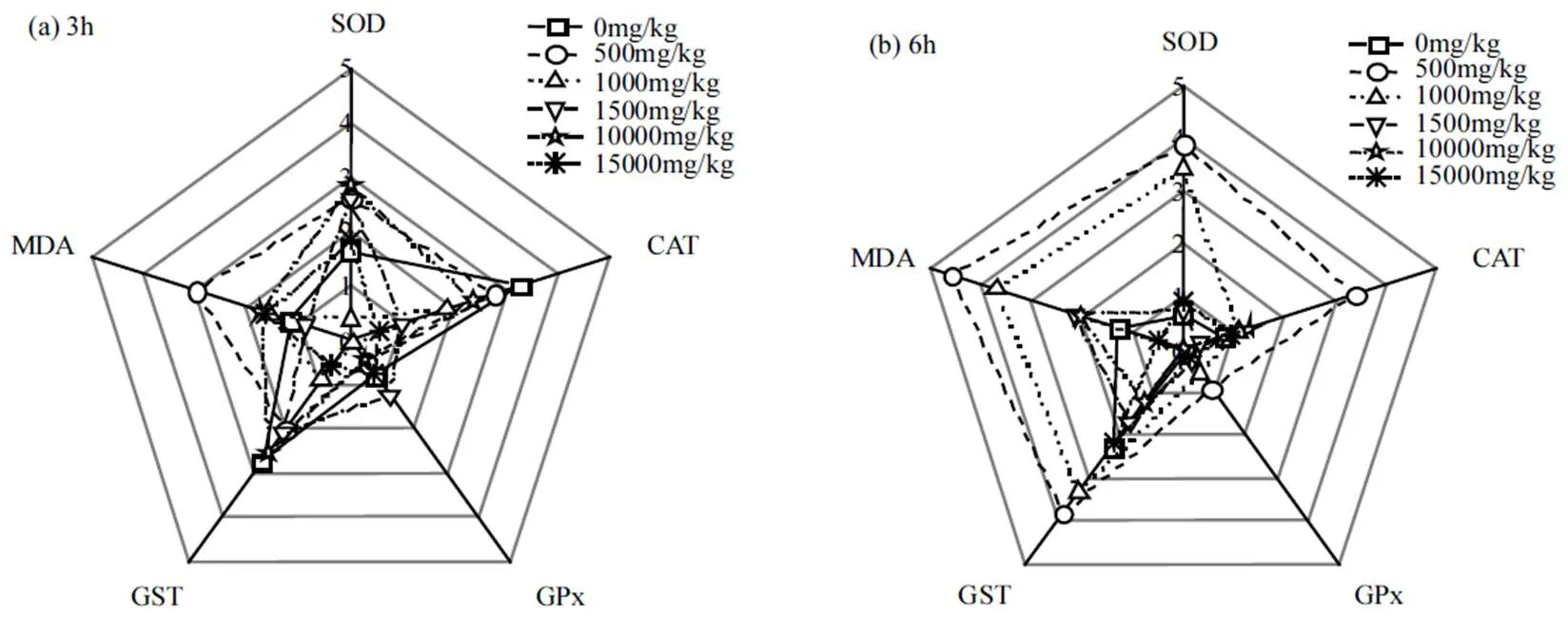
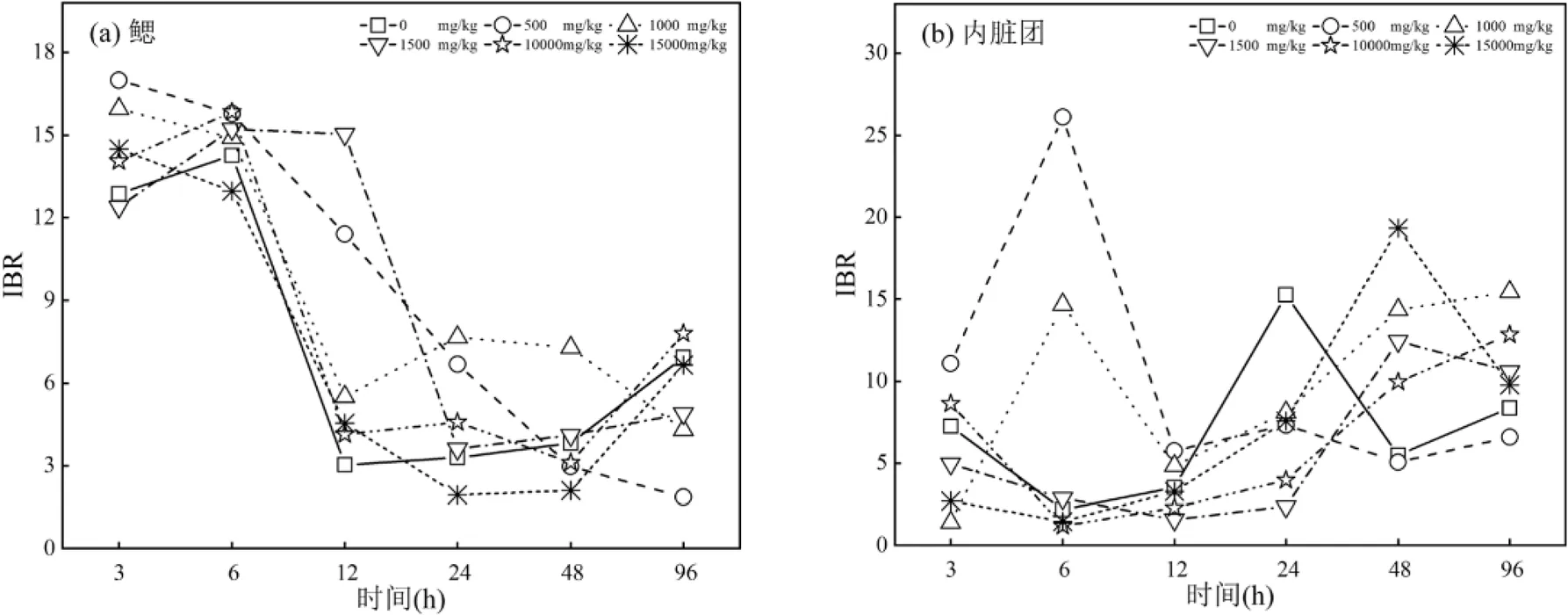
图6 不同浓度原油暴露下鳃和内脏团组织IBR随时间的变化
2.5 原油暴露对鳃组织结构的影响
缢蛏的鳃组织由位于外套膜两侧的鳃瓣组成,鳃瓣均由与身体纵轴相垂直的鳃丝组成,鳃丝中主要包含扁平细胞、柱状细胞以及少量粘液细胞等[24-25].不同浓度原油暴露48h对缢蛏鳃组织的影响如图7所示,对照组(图7a)鳃丝结构完整,纤毛无损伤,鳃丝与鳃丝之间排列紧密.原油暴露48h后,各浓度组出现鳃丝与软组织脱离的现象(图7b-f),伴随暴露浓度的增大该现象愈加明显.500mg/kg浓度组对缢蛏鳃组织影响较小,虽有轻微鳃丝脱离现象,但无明显结构变化(图7b).在1000 和10000mg/kg浓度组中,缢蛏鳃内腔出现明显变小、变窄,鳃丝变形严重(图7c、e).在1000和1500mg/kg浓度组中,鳃纤毛出现脱落现象(图7c、d).在15000mg/kg浓度组中,出现色素细胞大量增多的现象(图7f).
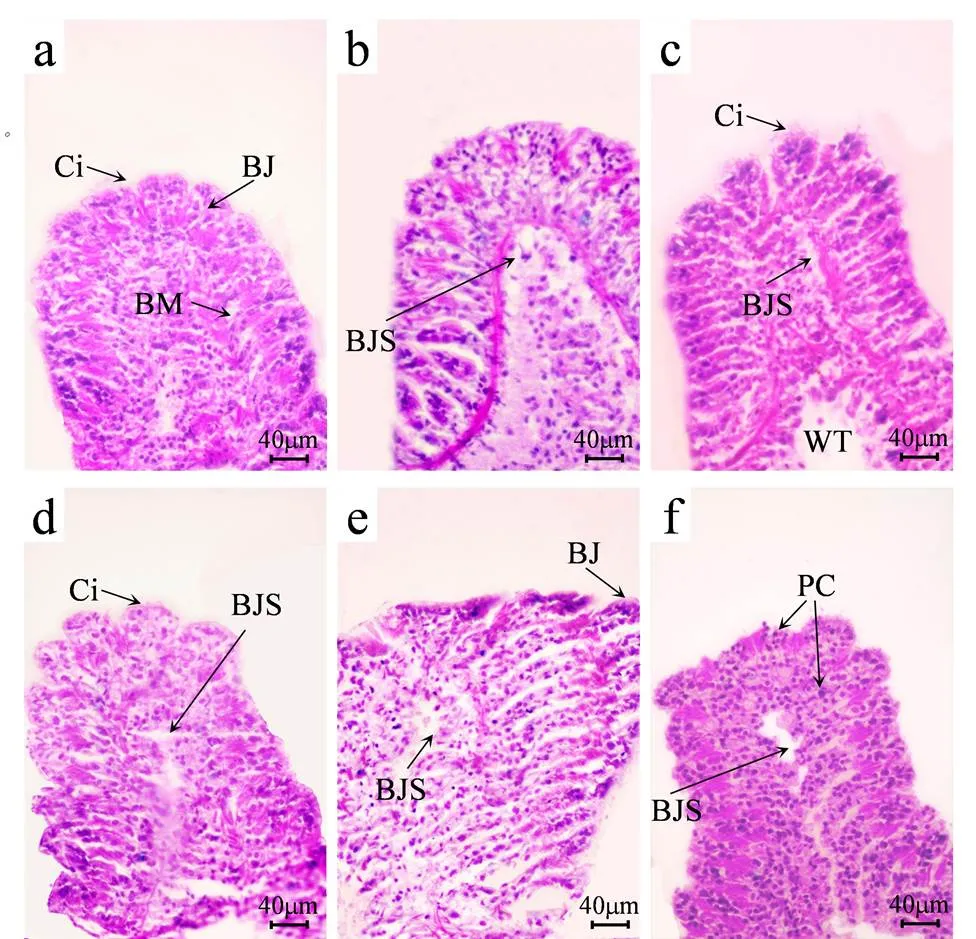
图7 不同浓度原油暴露48h对缢蛏鳃显微结构的影响
a:对照组(400×); b:500mg/kg暴露组(400×); c:1000mg/kg暴露组(400×); d:1500mg/kg暴露组(400×); e:10000mg/kg暴露组(400×); f:15000mg/kg
暴露组(400×)(BJ:鳃丝; BJS:鳃丝与软组织脱离; BM:基膜; Ci:纤毛; PC:色素细胞; WT:水管腔)
3 讨论
原油是一种具有“致癌、致畸、致突变”效应的化学混合物[26],原油泄漏发生时,会对周围生物及环境产生危害[27].抗氧化酶在细胞稳态和生理过程中发挥重要作用,当生物受到原油胁迫时,生物体会产生大量ROS并对机体造成损伤,抗氧化酶系统通过诱导或抑制效应来发挥作用,以清除过量自由基[28-29].
SOD、CAT和GPx具有协同作用[30].SOD是唯一能使自由基O- 2∙发生歧化反应生成O2或H2O2的抗氧化酶,H2O2可被CAT和GPx降解生成H2O和氧气O2,从而起到保护机体的作用[10,31-32].SOD和CAT是最早参与自由基清除的酶,SOD活性诱导通常和CAT活性抑制现象一起出现[3,33].本研究中,鳃中SOD活性在暴露初期受到诱导,增强了机体内清除自由基的能力,导致H2O2急剧增加.过量H2O2会抑制CAT活性,使其活性降低.暴露6h时SOD活性开始降低,受到抑制,CAT活性降低但高于对照组;暴露48h,SOD活性开始升高并高于对照组,此时CAT活性受到显著抑制;当暴露时间过长时,机体会因细胞损伤出现SOD活性降低,CAT活性升高的现象.GPx与CAT具有相似的作用能促进H2O2的分解,因此鳃中GPx与CAT变化规律相似[34].内脏团中GPx活性在暴露初期主要受到抑制,在暴露后期受到显著诱导,随浓度总体呈现低浓度诱导、高浓度抑制效应.生物体内抗氧化酶活性被显著诱导或时而被显著抑制,这可能是由于缢蛏受原油暴露后,机体内抗氧化酶系统失衡,这与张林宝等[35]柴油水溶性成分对菲律宾蛤仔的研究结果一致.
GST同样参与自由基的清除,促进对自由基的防御机制,可催化谷胱甘肽等生物内源性的水溶性分子与Ⅰ相代谢产物结合,形成更为亲水的物质排出体外,尤其是对于石油烃的解毒环节有重要作用[32,36-37].本研究中,鳃中GST活性在暴露3h受到抑制,6~48h内各浓度组活性高于对照组,表明其受到诱导对污染物进行解毒,96h时GST活性降低表明受到抑制.内脏团中GST活性随时间的变化与鳃中相似,出现了先诱导后抑制的现象,但两个组织中GST活性抑制响应时间存在偏差.任加云等[38]利用栉孔扇贝研究发现石油烃胁迫下鳃丝中同样呈现GST活性先诱导后抑制的情况.上述现象可能是由于生物体在暴露前期受到污染胁迫GST活性表现出诱导性,暴露后期解毒代谢过程不断进行导致谷胱甘肽(GSH)被大量消耗,从而使GST活性下降.
缢蛏受到原油污染时所产生的ROS会导致机体脂质过氧化,氧化降解的过程中会产生脂过氧化自由基(LOO-)、MDA以及丙醛等多种自由基[10].本研究中,暴露前期(6h)各处理组鳃和内脏团中MDA含量均显著增加,可能此时缢蛏处于氧化应激状态,细胞无法应对过量的自由基,导致细胞膜发生脂质过氧化反应,MDA水平升高;随时间的增加,MDA含量逐渐平稳降低或低于对照组,这可能是由于抗氧化酶清除了过氧化自由基,使MDA的积累减少[39].
不同生物标志物在生物体内存在效应不同,因此本文将SOD、CAT、GPx、GST及MDA进行综合分析.研究表明,IBR可以作为确定污染物对海洋生物群有害影响的有效工具[40],现已被广泛应用于原油、重金属或其他污染物对生物的毒害评价[39,41].本研究中,鳃和内脏团中IBR均出现低浓度组高于对照组,高浓度组低于对照组现象,且鳃中表现更明显,这与缢蛏体内SOD、GPx受原油暴露后呈现的低浓度诱导、高浓度抑制效应有关,IBR值所反应的结果与酶活性差异一致,与Pan等[23]研究结果相似.从时间上来看,鳃中IBR值暴露前期较高,而在内脏团中IBR值暴露后期较高.这可能是由于组织之间存在一种补偿机制,以保护细胞免受促氧化条件的影响[42].鳃是最先接触到原油的器官,因此其对原油暴露响应较高[10],随着暴露时间的增加,内脏团中消化腺开始发挥解毒作用,酶活性开始响应并逐渐升高,以更好的保护机体.对比图6中IBR变化趋势,鳃对原油污染敏感性和差异性更显著,更适合作为污染监测的研究器官.
滤食性贝类鳃的主要功能是呼吸和运送食物,亦是整个机体中最先与污染物接触的器官,对污染物反应敏感[43].原油中的碳氢化合物会加大鳃中呼吸上皮细胞的损伤,Agamy[44]研究表明原油会导致网纹石斑鱼()发生水肿、上皮细胞坏死等病变.而鳃丝中异常细胞增加、纤毛肿胀、细胞坏死和其他病理形态学改变也常作为双壳贝类受到外源性污染物损伤的标志.本研究中,低浓度原油暴露对缢蛏鳃造成了轻微结构损伤,随着原油暴露浓度的增加,出现了明显的鳃丝与软组织脱离、鳃丝变形和纤毛脱落等病理变化.薛秀玲等[45]通过研究有机磷农药对缢蛏鳃的影响也发现了相似的结果,有机磷农药会导致鳃出现纤毛脱落、鳃丝间隔与结缔组织增生等病理学变化.其他外源性污染物对双壳贝类也存在相似的影响.陈彩芳等[46]以Pb2+对泥蚶()进行暴露实验,结果显示Pb2+同样会造成泥蚶鳃丝脱离软骨组织的现象,高浓度暴露还会导致鳃丝呼吸上皮细胞脱落.生物体发生水肿、鳃丝脱离和坏死等病理学变化往往与外源性污染物胁迫所带来的脂质过氧化有关[47].抗氧化酶系统能够使自由基的产生与消除处于平衡状态,而重金属、原油类等外源性污染物能引发生物体的氧化应激效应,当抗氧化酶系统的防御作用小于外源性污染物的损伤作用时,过量的自由基累积会导致机体引发脂质过氧化和组织损伤[48-49].
综上,生物体是一个有机整体,原油暴露造成氧化胁迫,引起抗氧化酶活性的变化和脂质过氧化,从而会引起组织损伤,而IBR可以综合反映各生物标志物的变化情况,可作为环境污染生物监测的评价指标.
4 结论
4.1 缢蛏在原油污染暴露下,鳃和内脏团组织中抗氧化酶活性和MDA含量均受到不同程度的诱导或抑制,用于清除机体内的ROS.SOD活性总体表现为低浓度诱导、高浓度抑制效应;SOD诱导与CAT抑制同时出现,规律大致相反; MDA与SOD在鳃中变化规律相反;而内脏团中GPx与SOD变化规律相似,总体呈低浓度诱导、高浓度抑制效应.在时间-效应上,SOD活性呈升高-降低-升高的趋势,鳃中酶活性最高为131.767U/mgprot,内脏团中酶活性被极显著诱导至38.603U/mgprot;CAT与GPx活性变化规律相似,呈先降低后升高的趋势; GST在鳃中呈现先升高后降低的趋势,最高为371.663U/mgprot,内脏团中GST随时间变化不明显.原油暴露前期缢蛏鳃和内脏团中MDA含量显著增加, 2种组织最高值分别为5.030和10.705nmol/mgprot,后期逐渐恢复至平稳状态.
4.2 数据标准化后得到的星状图及IBR值,和酶活性差异结果一致,可作为生物毒性评价的有效补充指标.IBR评价发现SOD和CAT是最早参与自由基清除的酶.缢蛏的鳃组织对原油暴露的影响高于内脏团,更适合作为原油污染生物监测的器官.
4.3 组织切片结果显示原油暴露会导致鳃结构变形及鳃丝与软骨组织脱离等现象,且随暴露浓度的增加而愈加严重.
[1] 蒋 玫,李 磊,沈新强,等.基于整合生物标志物响应指数评价0号柴油对黑鲷()的毒性效应 [J]. 生态与农村环境学报, 2015,31(2):230-237.
Jiang M, Li L, Shen X Q, et al. IBR index-based assessment of Toxicity of No.0Diesel Fuel to[J]. Journal of Ecology and Rural Environment, 2015,31(2):230-237.
[2] Matzinger A, Schmid M, Veljanoska-Sarafiloska E, et al. Eutrophication of ancient Lake Ohrid: Global warming amplifies detrimental effects of increased nutrient inputs [J]. Limnology and Oceanography, 2007,52(1):338-353.
[3] Ali H, Khan E. Trophic transfer, bioaccumulation, and biomagnification of non-essential hazardous heavy metals and metalloids in food chains/webs—Concepts and implications for wildlife and human health [J]. Human and ecological risk assessment, 2019,25(5/6):1353-1376.
[4] 李井懿,童一帆,程千卉,等.海水中原油对双齿围沙蚕()的急性毒性效应及其体内抗氧化酶活性的影响 [J]. 环境科学研究, 2018,31(11):1972-1978.
Li J Y, Tong Y F, Cheng Q H, et al. Acute toxicity and the effect on antioxidant enzyme activity of polychaeteexposed to crude oil in seawater [J]. Research of Environmental Sciences, 2018,31(11):1972-1978.
[5] Shirani M, Mirvaghefi A, Farahmand H, et al. Biomarker responses in mudskipper () from the coastal areas of the Persian Gulf with oil pollution [J]. Environmental Toxicology and Pharmacology, 2012,34(3):705-713.
[6] Arojojoye O A, Oyagbemi A A, Ola-Davies O E, et al. Assessment of water quality of selected rivers in the Niger Delta region of Nigeria using biomarkers in[J]. Environmental Science and Pollution Research, 2021,28(18):22936-22943.
[7] Salgado L D, Marques A E M L, Kramer R D, et al. Sediment contamination and toxic effects on Violet Goby fish (- Gobiidae) from a marine protected area in South Atlantic [J]. Environmental Research, 2021,195:110308.
[8] 王晓艳,冯丽娟,蒋凤华,等.原油水溶性成分对栉孔扇贝抗氧化酶活性和丙二醛含量的影响 [J]. 中国海洋大学学报(自然科学版), 2013, 43(7):45-50.
Wang X Y, Feng L J, Jiang F H, et al. Effect of water-soluble fraction of crude oil the activity of antioxidant enzyme and malondialdehybe content of[J]. Periodical of Ocean University of China, 2013,43(7):45-50.
[9] 蒋 玫,李 磊,沈新强,等.基于综合生物标志物响应指数评价0#柴油和平湖原油胁迫下的缢蛏()毒性效应 [J]. 环境科学学报, 2015,35(4):1174-1182.
Jiang M, Li L, Shen X Q, et al. Investigation of toxic effects of No.0fuel oil and Pinghu crude oil onby using integrated biomarker responses [J]. Acta Scientiae Circumstantiae, 2015,35(4):1174-1182.
[10] 李 阳,薛素燕,李加琦,等.Cu2+胁迫对魁蚶生理生化和组织结构的影响 [J]. 水产学报, 2018,42(10):1531-1540.
Li Y, Xue S Y, Li J Q, et al. Effect of Cu2+stress on physiology biochemistry and histopathological structure of[J]. Journal of Fisheries of China, 2018,42(10):1531-1540.
[11] 刘 凯,陈修报,刘洪波,等.铜对背角无齿蚌幼蚌的组织损伤效应研究 [J]. 农业环境科学学报, 2021,40(6):1183-1189.
Liu K, Chen X B, Liu H B, et al. Effects of copper on tissues of juvenile[J]. Journal of Agro-Environment Science, 2021,40(6):1183-1189.
[12] Edge K J, Dafforn K A, Simpson S L, et al. A biomarker of contaminant exposure is effective in large scale assessment of ten estuaries [J]. Chemosphere, 2014,100:16-26.
[13] Sardi A E, Sandrini-Neto L, Pereira L S, et al. Oxidative stress in two tropical species after exposure to diesel oil [J]. Environmental Science and Pollution Research, 2016,23(20):20952-20962.
[14] 田丽娜,杨金生,周佑霖,等.原油对潮间带大弹涂鱼()抗氧化酶活性影响的初步探究 [J]. 海洋环境科学, 2022,41(1):135-141.
Tian L N, Yang J S, Zhou Y L, et al. The primary study on antioxidase activities ofexposed to crude oil in intertidal zone [J]. Marine Environmental Science, 2022,41(1):135- 141.
[15] 徐 娴,何 琳,林志华,等.盐度胁迫下缢蛏渗透压变化及V-ATPase H基因的表达分析 [J]. 动物学杂志, 2020,55(5):606-613.
Xu X, He L, Lin Z H, et al. Effects of salinity stress on V-ATPase H expression, enzyme activity and osmotic pressure in[J]. Chinese Journal of Zoology, 2020,55(5):606-613.
[16] Turja R, Sanni S, Stankevičiūtė M, et al. Biomarker responses and accumulation of polycyclic aromatic hydrocarbons inandduring exposure to crude oil [J]. Environmental Science and Pollution Research, 2020,27(13):15498- 15514.
[17] Axiak V, George J J, Moore M N. Petroleum hydrocarbons in the marine bivalve: accumulation and cellular responses [J]. Marine Biology, 1988,97(2):225-230.
[18] 徐俊超.东海轻质原油对4种海洋生物的毒性效应 [D]. 上海:上海海洋大学, 2017.
Xu J C. Toxic effect of Donghai light crude oil on four marine organisms [D]. Shanghai: Shanghai Ocean University, 2017.
[19] GB 18668-2002 海洋沉积物质量 [S].
GB 18668-2002 Marine sediment quality [S].
[20] GB 17378-2007 海洋监测规范 [S].
GB 17378-2007 Marine monitoring code [S].
[21] Beliaeff B, Burgeot T. Integrated biomarker response: a useful tool for ecological risk assessment [J]. Environmental Toxicology Chemistry, 2002,21(6):1316-1322.
[22] Marigómez I, Garmendia L, Soto M, et al. Marine ecosystem health status assessment through integrative biomarker indices: a comparative study after the Prestige oil spill "Mussel Watch"[J]. Ecotoxicology, 2013,22(3):486-505.
[23] Pan Y, Tian L, Zhao Q, et al. Evaluation of the acute toxic effects of crude oil on intertidal mudskipper () based on antioxidant enzyme activity and the integrated biomarker response [J]. Environmental Pollution, 2022,292:118341.
[24] 崔龙波,侯竹美,周雪莹.缢蛏鳃的光镜与扫描电镜研究 [J]. 水产科学, 2006,25(3):129-132.
Cui L B, Hou Z M, Zhou X Y. Light and electron microscopic observation of gill in[J]. Fisheries Science, 2006,25(3):129-132.
[25] 温茹淑,郑清梅,徐鸿飞,等.Hg2+对草鱼鱼种肾、鳃Na+/K+-ATPase及其组织结构的影响 [J]. 江西农业大学学报, 2012,34(5):1014- 1020.
Wen R S, Zheng Q M, Xu H F, et al. Effects of Hg2+on the Na+/K+-ATPase and Histology of the Kidney and Gill in Grass Carp [J]. Acta Agriculturae Universitatis Jiangxiensis, 2012,34(5):1014-1020.
[26] Sandrini-Neto L, Geraudie P, Santana M S, et al. Effects of dispersed oil exposure on biomarker responses and growth in juvenile wolfish[J]. Environmental Science and Pollution Research, 2016,23(21):21441-21450.
[27] Pathan T S, Thete P B, Shinde S E, et al. Histopathological Changes in the Gill of Freshwater Fish, Rasbora daniconius Exposed to Paper Mill Effluent [J]. Iranica Journal of Energy & Environment, 2010,1(3):152- 153.
[28] Sardi A E, Renaud P E, Morais G C, et al. Effects of an in situ diesel oil spill on oxidative stress in the clam[J]. Environmental Pollution, 2017,230:891-901.
[29] 冯 涛,郑微云,洪万树,等.苯并(a)芘对大弹涂鱼肝脏抗氧化酶活性影响的初步研究 [J]. 应用生态学报, 2001,12(3):422-424.
Feng T, Zheng W Y, Hong W S, et al. Effect of benzo(a)pyrene on antioxidant enzyme inliver [J]. Chinese Journal of Applied Ecology, 2001,12(3):422-424.
[30] 亢玉静,郎明远,赵 文.水生生物体内抗氧化酶及其影响因素研究进展 [J]. 微生物学杂志, 2013,33(3):75-80.
Kang Y J, Lang M Y, Zhao W. Advance in antioxidant enzymes and its effect factors in aquatic organisms [J]. Journal of Microbiology, 2013, 33(3):75-80.
[31] Regoli F, Giuliani M E. Oxidative pathways of chemical toxicity and oxidative stress biomarkers in marine organisms [J]. Marine environmental research, 2014,93:106-117.
[32] Faria M, Carrasco L, Diez S, et al. Multi-biomarker responses in the freshwater mussel Dreissena polymorpha exposed to polychlorobiphenyls and metals [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009,149(3):281-288.
[33] 张欣欣,殷 悦,段美娜,等.生物降解型消油剂与180#燃料油对黄海胆()CAT和SOD活性的影响 [J]. 海洋环境科学, 2017,36(2):284-290.
Zhang X X, Yin Y, Duan M N, et al. Effect of bioremediation dispersant and 180# fuel oil on CAT and SOD in[J]. Marine Environmental Science, 2017,36(2):284-290.
[34] 刚 锰,高 翔,吕昕璐,等.0号柴油分散液对马粪海胆GPx活性的影响 [J]. 海洋环境科学, 2013,32(6):806-808.
Gang M, Gao X, Lv X L, et al. Effect of No.0 diesel dispersion on glutathione peroxidase activity of[J]. Marine Environmental Science, 2013,32(6):806-808.
[35] 张林宝,孙 伟,黄南建,等.0#柴油水溶性成分对菲律宾蛤仔抗氧化防御系统的影响 [J]. 南方水产科学, 2015,11(6):65-72.
Zhang L B, Sun W, Huang N J, et al. Effect of No.0 diesel oil water-soluble fraction on antioxidant defense systems of Manila clam () [J]. South China Fisheries Science, 2015, 11(6):65-72.
[36] Smeltz M, Rowland-Faux L, Ghiran C, et al. A multi-year study of hepatic biomarkers in coastal fishes from the Gulf of Mexico after the Deepwater Horizon Oil Spill [J]. Marine Environmental Research, 2017,129:57-67.
[37] 李 磊,刘金殿,黄士林,等.基于综合生物标志物响应评价苯并芘对脊尾白虾()的毒性效应 [J]. 海洋与湖沼, 2018,49(2):444-451.
Li L, Liu J D, Huang S L, et al. Integrated assessment of biomarker responses inexposed to benzo[a]pyrene [J]. Oceanologia Et Limnologia Sinica, 2018,49(2):444-451.
[38] 任加云,苗晶晶,李学平,等.石油烃暴露对栉孔扇贝()组织生物转化酶及DNA损伤的影响 [J]. 海洋湖沼通报, 2016, 38(3):46-54.
Ren J Y, Miao J J, Li X P, et al. Effect of petroleum hydrocarbon exposure on biotransformation enzymes activities and DNA damage of scallop[J]. Transactions of Oceanology and Limnology, 2016,38(3):46-54.
[39] Zhao Y, Sun L, Li Q, et al. Use of integrated biomarker response for evaluating antioxidant stress and DNA damage of earthworms () inethane-contaminated soil [J]. Environmental Pollution, 2020,264:114706.
[40] Xia B, Chen B, Sun X, et al. Toxicological effects of crude oil: integrated biomarker responses in the hepatopancreas of clam[J]. Asian Journal of Chemistry, 2014, 26(12):3631-3638.
[41] Kim W K, Lee S K, Choi K, et al. Integrative assessment of biomarker responses in pale chub () exposed to copper and benzo[a]pyrene [J]. Ecotoxicology & Environmental Safety, 2013,92 (1):71-78.
[42] Ferreira C P, Piazza T B, Souza P, et al. Integrated biomarker responses in oysters Crassostrea gasar as an approach for assessing aquatic pollution of a Brazilian estuary [J]. Marine Environmental Research, 2021,165:105252.
[43] 薛秀玲,袁东星,樊国峰.两种有机磷农药对缢蛏()鳃超微结构的影响 [J]. 海洋环境科学, 2007,26(6):568- 572.
Xue X L, Yuan D X, Fan G F. Effects of Dimethoate and triazophos on ultra-structural lesions in gill of[J]. Marine Environmental Science, 2007,26(6):568-572.
[44] Agamy E. Impact of laboratory exposure to light Arabian crude oil, dispersed oil and dispersant on the gills of the juvenile brown spotted grouper (): a histopathological study [J]. Marine Environmental Research, 2013,86:46-55.
[45] 薛秀玲,袁东星.有机磷农药对缢蛏[(Lamarck)]显微结构的影响 [J]. 环境化学, 2006,25(3):310-314.
Xue X L, Yuan D X. Microstructual lesions ofeffected by Dimethoate and triazophos [J]. Environmental Chemistry, 2006,25(3):310-314.
[46] 陈彩芳,沈伟良,申屠基康,等.Pb2+对泥蚶鳃、肝脏等组织结构的影响 [J]. 水产学报, 2014,38(7):965-972.
Chen C F, Shen C L, Shen T J K, et al. Effect of Pb2+on the microstrucute and ultrastructure of gill and hepatopancreas in[J]. Journal of Fisheries of China, 2014,38(7): 965-972.
[47] 耿倩倩,郭萌萌,李风铃,等.BDE-47在紫贻贝中的分布、蓄积、消除和毒性效应 [J]. 中国环境科学, 2022,42(3):1385-1393.
Geng Q Q, Guo M M, Li J F, et al. Tissue distribution, accumulation, elimination characteristics and toxicity of 2,2',4,4'-tetrabromodiphenyl ether in blue mussel [J]. China Enyironmental Science, 2022,42(3): 1385-1393.
[48] Sanchez W, Palluel O, Meunier L, et al. Copper-induced oxidative stress in three-spined stickleback: relationship with hepatic metal levels [J]. Environmental toxicology and pharmacology, 2005,19(1): 177-183.
[49] 王 涛,王 玮,陈同庆,等.急性铜胁迫对暗纹东方鲀组织铜积累、氧化应激、消化酶、组织病变及脂代谢相关基因表达的影响 [J]. 中国水产科学, 2019,26(6):1144-1152.
Wang T, Wang W, Chen T Q, et al. Effect of acute copper stress from copper accumulation, oxidative stress, digestive enzymes, tissue lesions, and gene expression related to lipid metabolism in[J]. Journal of Fishery Sciences of Chinas, 2019,26(6):1144-1152.
Oxidative stress and IBR evaluation ofon intertidal oil pollution.
XU Qing-xia1, PAN Yu-ying1,2*, YANG Ting-ting1, YANG Jin-sheng3, ZHANG Meng1, CHEN Fan1, WANG Ying-ying1, TANG Zhong-wei1
(1.College of Fisheries of Zhejiang Ocean University, Zhoushan 316022, China;2.Key Laboratory of Marine Fishery Equipment and Technology of Zhejiang, Zhoushan 316022, China;3.College of Petrochemical Engineering & Environment, Zhejiang Ocean University, Zhoushan 316022, China)., 2023,43(1):328~340
To discuss the toxic effect which induced by intertidal crude oil pollution to organisms, antioxidant enzyme activities and lipid peroxidation in gills and visceral mass, the changes of gills structure as well as Integrated Biomarker Response (IBR) ofexposed to different oil concentration were studied. The results showed that superoxide dismutase (SOD) activities in gills and visceral mass as well as glutathione peroxidase (GPx) activities in visceral mass appeared low concentration induction and high concentration inhibition effect in terms of dose-response. SOD induction and catalase (CAT) inhibition appeared at the same time while the rules were roughly opposite. In the time-effect, the SOD activities showed an increase-decrease-increase trend, while CAT and GPx activities showed the decrease-increase trend. The Glutathione S-transferase (GST) activities in gills showed an increase-decrease trend, the maximum value was 371.663U/mgprot. The malondialdehyde (MDA) content in the two tissues ofincreased significantly in the early stage of exposure (6h), the highest MDA content in gills and visceral mass were 5.030 and 10.705 nmol/mgprot, respectively, then gradually stabilized in the later stage. IBR results showed that biomarkers in gills were more sensitive to crude oil contamination. The crude oil exposure can deform the gills filament structure or cause their detachment. The results showed that gills ofwere more suitable as the organ for biological monitoring and evaluation of oil exposure in intertidal zone.
crude oil;;antioxidant enzyme activity;IBR;tissue damage
A
1000-6923(2023)01-0328-13
徐青霞(1998-),女,浙江绍兴人,浙江海洋大学硕士研究生,主要研究方向为沉积物石油污染生物毒性效应.
2022-06-02
浙江省自然科学基金资助项目(LY19D060003);浙江省大学生科技创新活动计划(新苗人才计划)项目(2021R411006);国家级大学生创新创业训练计划项目(202110340052);浙江省属高校基本科研业务费项目(2019J00023)
* 责任作者, 副教授, panyuying@zjou.edu.cn
