抑制PERK对LPS诱导的奶牛乳腺上皮细胞自噬的影响
2023-02-03孟梅娟李雪睿常广军沈向真
孟梅娟,汪 艳,霍 然,李雪睿,常广军,沈向真
(南京农业大学动物医学院,南京 210095)
牛奶是奶牛养殖产业重要的经济产品,奶牛乳腺健康是奶产量的决定因素。乳腺炎是奶牛养殖业中常见的临床疾病,严重影响动物健康,降低奶产量,增加奶牛淘汰率,给奶业带来严重的经济损失[1]。与此同时,乳腺炎的发生也会造成乳腺结构的破坏,危害动物健康,导致严重的动物福利问题[2]。因此,阐明乳腺炎发生的分子机制对奶牛业的可持续发展具有重要的意义。乳腺上皮细胞是奶牛乳腺中最重要的组成成分,负责分泌乳汁和抵御病原的入侵[3-4]。内质网是乳中蛋白质、脂类、糖类的合成和加工场所,对应激极为敏感。内质网作为早期应激反应,能够敏感地感知外界压力[5]。当乳腺受到外界刺激,可破坏内质网的自我平衡,通过增加内质网中未折叠和错误折叠蛋白的数量来引起Ca2+水平的失衡[6],葡萄糖调节蛋白78(glucose regulated protein 78 kD,GRP78)从蛋白激酶R样内质网激酶(PRKR-like endoplasmic reticulum kinase, PERK)是肌醇依赖酶1(inositolrequiring enzymel,IRE1)和激活转录因子6(activating transcription factor 6,ATF6)中解体,蛋白表达上调[7],从而引发奶牛内质网应激。自噬是一个动态过程,是生物体的一种自我保护机制。在正常状态下,自噬可以保护细胞,清除外来物,为细胞活动提供能量。当发生亚急性瘤胃酸中毒(subacute rumen acidosis,SARA)时,脂多糖(lipopolysaccharide,LPS)通过血液运输到乳腺组织,导致奶牛乳腺上皮细胞损伤。当组织或细胞受损、炎症、氧化应激或内质网应激时,可促进自噬[8]。研究发现,内质网应激与自噬信号的调节机制有关[9]。内质网应激可以通过调节LC3和ATG5的转录表达来影响自噬体的形成[10]。内质网释放的Ca2+在细胞自噬中也发挥了重要作用[11-12]。Ca2+可以通过激活CAMKKβ和AMPK,进而抑制mTOR信号通路,诱导细胞自噬的发生[13]。当内质网应激受到外界压力诱导时,内质网可通过未折叠蛋白反应诱导细胞自噬[14]。然而,目前,关于在LPS刺激下,奶牛乳腺上皮细胞内质网应激和自噬之间关系的研究相对较少。因此,本文探讨抑制内质网应激对LPS诱导的奶牛乳腺上皮细胞自噬的影响。为调控LPS引起的反刍动物乳腺炎,维护乳腺的正常功能提供依据。为临床防控乳腺炎提供新的靶点和理论依据。
1 材料与方法
1.1 细胞培养和试验设计
试验中使用的奶牛乳腺上皮细胞(BMECs),购自上海通派生物技术有限公司。参照Zhao等[15]分离、鉴定并构建该细胞系。BMECs在本试验中培养良好,作者课题组已经有多篇文章将BMECs作为体外模型进行研究[16-19]。细胞在完全培养基(90%RPMI 1640+10%胎牛血清+5%青霉素-链霉素)中进行复苏、传代,同时冻存部分细胞以备后续试验。本试验中使用的是第4~7代的细胞。
试验设计: 1)采用CCK8法筛选LPS和GSK2606414对奶牛乳腺上皮细胞的安全浓度。2)为了研究LPS能否引起奶牛乳腺上皮细胞内质网应激和自噬,试验分为2组:对照组(CON)和LPS组(LPS)。选用4 μg·mL-1的LPS刺激奶牛乳腺上皮细胞12 h,测定内质网应激和自噬相关基因mRNA和蛋白的表达。3)为了研究抑制PERK是否能缓解LPS诱导的奶牛乳腺上皮细胞自噬,首先,选用PERK的抑制剂GSK2606414(GSK),用不同浓度的GSK(0、2.5、5、10 μmol·L-1)预处理细胞12 h,再用4 μg·mL-1LPS处理细胞12 h,测定PERK、ATF4、eIF-2α和CHOP的mRNA表达,筛选出GSK最佳抑制浓度。然后试验分成4组,对照组(CON)、LPS组(LPS)、GLPS组(10 μmol·L-1GSK预处理12 h,接着4 μg·mL-1LPS刺激12 h)和GSK组(10 μmol·L-1GSK孵育12 h),测定自噬相关基因和蛋白的表达。
1.2 细胞活力的测定
将细胞接种于96孔细胞板中,每孔加入100 μL含有5×103个BMECs的细胞悬液,每组设置6个复孔,在37 ℃和5% CO2的培养箱中进行培养。当细胞长至70%~80%后,分别加入不同浓度的LPS和GSK2606414处理12 h,每孔中加入10 μL CCK-8溶液,孵育1~4 h。用酶标仪在450 nm波长下读取细胞OD值,计算细胞活力。
1.3 Lyso-Tracker Red 染色
为了检测奶牛乳腺上皮细胞的自噬状态,应用Lyso-Tracker Red染色来检查溶酶体。将奶牛乳腺上皮细胞接种在12孔板中,每组3个重复,4 μg·mL-1的LPS处理12 h后,按照说明书操作步骤对细胞进行染色,最后使用激光共聚焦显微镜进行拍摄。
1.4 细胞总RNA提取、cDNA反转录和实时荧光定量PCR的检测
细胞接种于12孔细胞板中,每组3个重复,在相应细胞处理结束后,吸走培养上清,用预冷的1×PBS轻柔地清洗2次,加入500 μL的RNA提取试剂RNAiso plus,根据试剂说明书进行操作,得到奶牛乳腺上皮细胞的总RNA。用分光光计Nano Drop 2000检测总RNA的浓度。然后用cDNA逆转录试剂盒按说明书将RNA逆转录为cDNA(TaKaRa生物科技,大连)。使用ABI 7300快速实时PCR系统(Applied Biosystems, Foster City, CA, USA)进行实时荧光定量PCR。选用甘油醛磷酸脱氢酶(GAPDH)作为内参基因,采用相对定量方法2-ΔΔCt进行定量分析。引物由上海捷瑞生物工程有限公司根据表1所示的序列合成。每个结果重复3次进行验证。

表1 用于实时荧光定量PCR分析的引物Table 1 Primers used in quantitive real-time PCR analysis
1.5 细胞总蛋白提取和目的蛋白表达水平的检测
细胞接种于6孔细胞板中,每组3个重复,在相应细胞处理结束后,弃去细胞上清,用PBS清洗2次,加入150 μL的蛋白提取试剂RIPA(已加入1/100体积的蛋白酶抑制剂PMSF),静置3 min后,用细胞刮刀将裂解细胞收集至EP管中,4 ℃条件下12 000 r·min-1离心20 min,后吸取上清,即为BMECs总蛋白。采用BCA试剂盒进行浓度测定,通过计算将各组的细胞样品调整为相同的蛋白浓度(2 μg·μL-1)。将统一浓度后的蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,然后转移到硝化纤维膜(Millipore, Danvers, MA),在7.5%脱脂牛奶中室温封闭1 h,最后与指定的一抗(表2)4 ℃孵育过夜。用TBST洗涤后,与特定的二抗孵育2 h。再次洗涤蛋白带后。选用Omni-ECLTMPico光化学发光试剂盒,按照试剂盒说明书,进行孵育显影。用ChemiDoc MP成像系统进行曝光并拍照,用Bio-Rad Image Lab 5.2.1软件进行结果处理和分析。
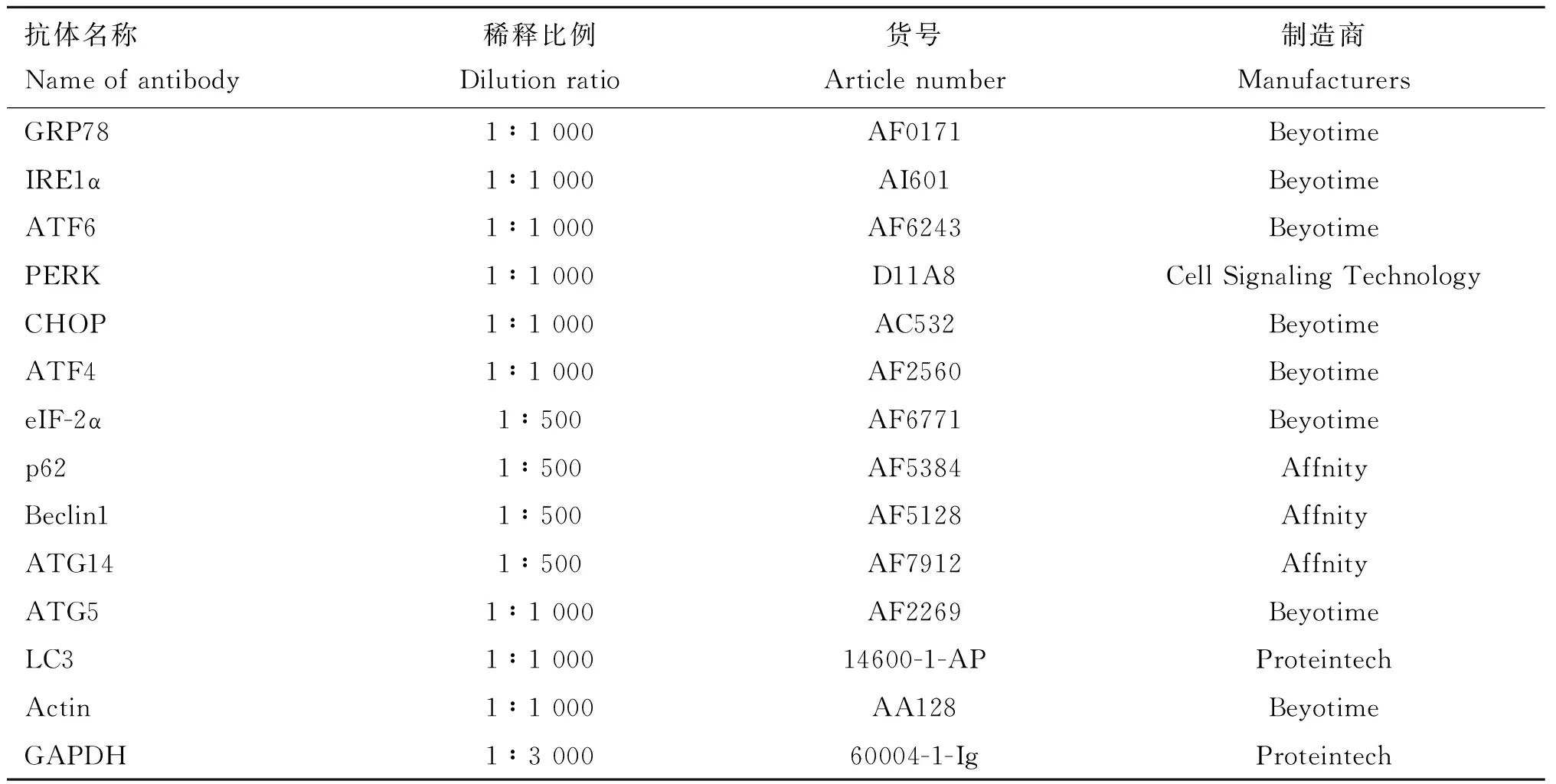
表2 Western blot检测的抗体信息Table 2 Antibody information for Western blot determination
1.6 细胞的免疫荧光检测
将无菌的细胞爬片放置于24孔板中,接种BMECs,每组3个重复,经过相应细胞处理后,进行细胞免疫荧光检测。具体操作步骤:将处理好的细胞弃去上清后,用1×PBS清洗3次,每次5 min。加入4%多聚甲醛,固定20 min。弃去4%多聚甲醛后,同上清洗。加入0.3% Triton X-100,通透15 min。弃去通透剂后,同上清洗。加入含5%牛血清白蛋白的封闭液,封闭1 h。弃去封闭液后,加入相应的一抗(表2),4 ℃条件下,孵育过夜。将一抗回收后,同上清洗。加入相应的二抗,37 ℃条件下,暗盒孵育1 h。将二抗回收后,同上清洗。加入DAPI染液,暗盒孵育5 min。弃去DAPI染液后,同上清洗。最后,在干净的载玻片上滴加荧光防淬灭剂,将细胞爬片小心抠出,倒扣在载玻片上,4 ℃避光保存。使用激光共聚焦显微镜进行拍摄,Image J进行荧光分析。
1.7 数据统计方法
2 结 果
2.1 LPS可引起奶牛乳腺上皮细胞内质网应激
当细胞受到外界刺激发生内质网应激时,会启动未折叠蛋白反应(unfolded protein response,UPR)以维持细胞稳态。因此,介导UPR的3种关键跨膜感应蛋白(IRE1α、PERK和ATF6)的上调是公认的内质网应激的指标。由图1可知,0~4 μg·mL-1LPS不影响奶牛乳腺上皮细胞的活力(P>0.05,图1A)。选择4 μg·mL-1的LPS进行后续试验。与对照组相比,LPS可显著升高内质网应激相关蛋白PERK(P<0.01)、IRE1α(P<0.05)、ATF6(P<0.01)、GRP78(P<0.05)和CHOP(P<0.01)的mRNA表达(图1B)。Western blot结果表明,与对照组相比,LPS显著升高PERK(P<0.05)、ATF6(P<0.01)、GRP78(P<0.01)和CHOP(P<0.01)的蛋白表达(图1C~H)。免疫荧光结果进一步证实,与对照组相比,LPS可升高GRP78的荧光强度(图1I)。因此,LPS可诱导奶牛乳腺上皮细胞发生内质网应激,并激活PERK和ATF6信号通路。
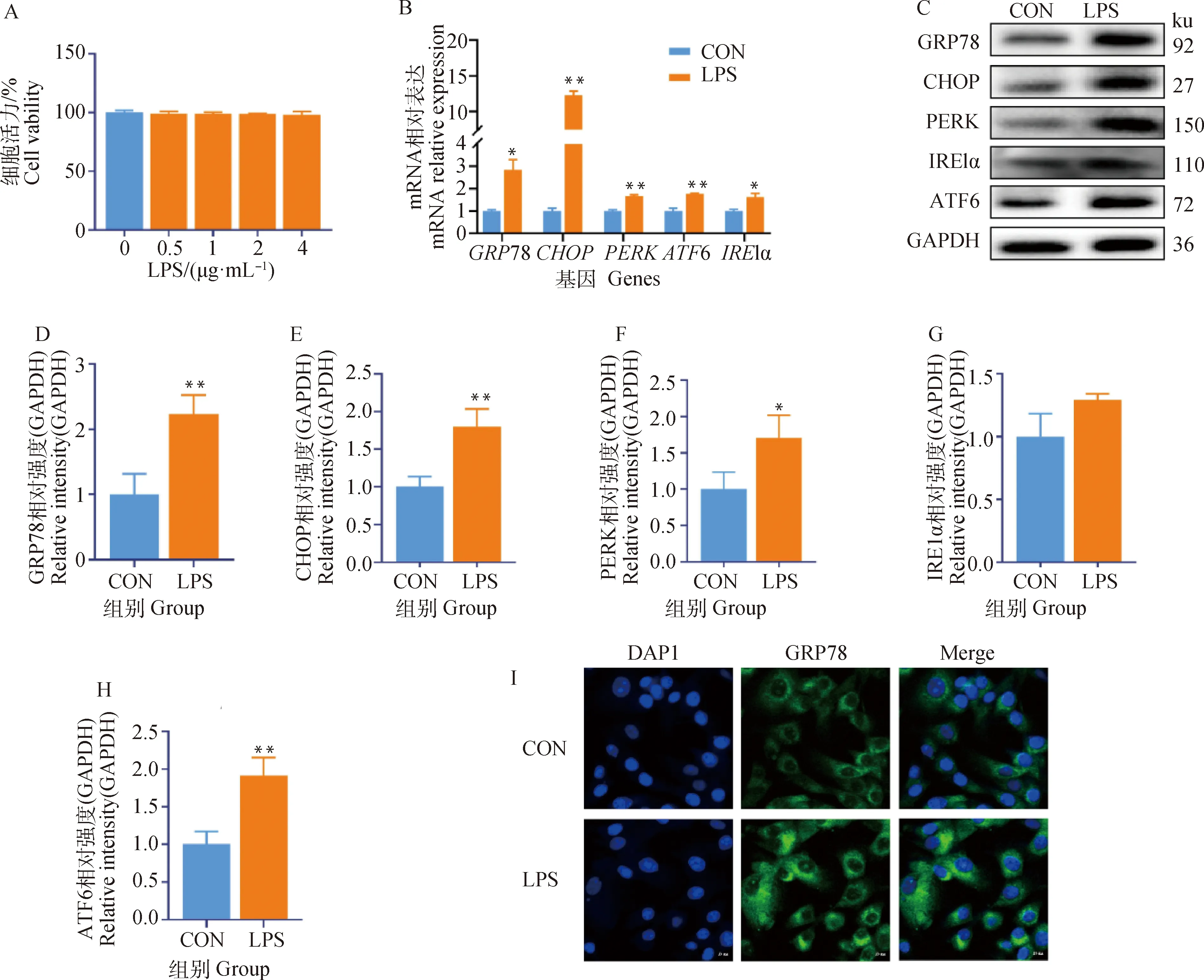
A. LPS的细胞活力;B. 内质网应激相关基因;C. Western blot条带;D~H. GRP78、CHOP、PERK、IRE1α、ATF6灰度值分析;I. GRP78的免疫荧光结果(比例尺=10 μm)。与对照组相比,*.P<0.05,**.P<0.01A. The cell viability of LPS; B. The expression of ER stress-related genes; C. Western blot bands; D-H. Gray value analysis of GRP78, CHOP, PERK, IRE1α and ATF6; I. Immunofluorescence results of GRP78 (scale bar=10 μm). Compared with control group, *.P<0.05, **.P<0.01图1 LPS对奶牛乳腺上皮细胞内质网应激相关基因和蛋白的影响Fig.1 Effects of LPS on endoplasmic reticulum stress related genes and proteins in BMECs
2.2 LPS可引起奶牛乳腺上皮细胞自噬
由图2可知,与对照组相比,LPS可极显著升高LC3、ATG5、ATG14、Beclin1的mRNA表达(P<0.01,图2A),并且LPS可极显著降低p62的mRNA表达(P<0.01,图2A)。Western blot结果显示,与对照组相比,LPS可极显著升高ATG5、ATG14、Beclin1以及LC3Ⅱ/Ⅰ的蛋白表达(P<0.01,图2C~E,G、H),并且LPS可极显著降低p62的蛋白表达(P<0.01,图2C、F)。此外,免疫荧光的结果表明,与对照组相比,LPS可以降低p62的荧光强度(图2B)。Lyso-Tracker Red是一种溶酶体红色荧光探针,能通透细胞膜,可用于活细胞溶酶体特异性荧光染色。与对照组相比,LPS增加了溶酶体的形成(图2B)。由以上结果可知,LPS可诱导奶牛乳腺上皮细胞发生自噬。
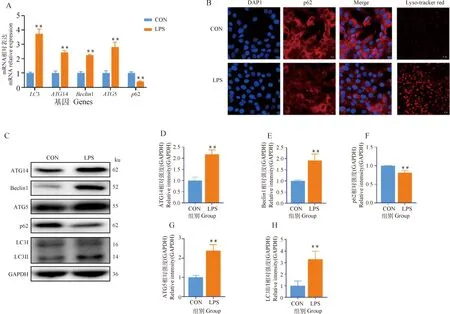
A.自噬相关基因;B. p62和溶酶体的荧光强度(左3列图,比例尺=10 μm;右1列图,比例尺=20 μm);C. Western blot条带;D~H. ATG14、Beclin1、p62、ATG5、LC3Ⅱ/Ⅰ灰度值分析。与对照组相比,**.P<0.01A. Autophagy related genes; B. Fluorescence intensity of p62 and lysosomes (left 3 column figures, scale bar=10 μm; right 1 column figures, scale bar=20 μm); C. Western blot bands; D-H. Gray value analysis of ATG14, Beclin1, p62, ATG5 and LC3Ⅱ/Ⅰ. Compared with control group, **.P<0.01图2 LPS对奶牛乳腺上皮细胞自噬相关基因和蛋白的影响Fig.2 Effects of LPS on autophagy related genes and proteins in BMECs
2.3 抑制PERK可缓解LPS诱导的奶牛乳腺上皮细胞自噬
为了研究PERK是否参与LPS诱导的奶牛乳腺上皮细胞自噬,选用PERK抑制剂GSK2606414(GSK)预处理奶牛乳腺上皮细胞12 h,再用4 μg·mL-1LPS刺激12 h。如图3所示,0~10 μmol·L-1GSK对奶牛乳腺上皮细胞的活力无显著影响(P>0.05,图3A)。与对照组相比,LPS显著提高了PERK、ATF4、eIF-2α和CHOPmRNA的表达(P<0.01),而5和10 μmol·L-1GSK预处理后显著降低了PERK、ATF4、eIF-2α和CHOPmRNA的表达(P<0.01,图3B)。其中,10 μmol·L-1GSK抑制效果最佳。因此,后续选择10 μmol·L-1GSK进行试验。Western blot结果显示,与LPS组相比,GSK预处理可显著降低PERK(P<0.01)、ATF4(P<0.01)、eIF-2α(P<0.05)、CHOP(P<0.05)蛋白表达(图3C~G)。以上结果表明,PERK抑制剂可显著抑制LPS诱导的PERK/eIF-2α/CHOP通路的激活。
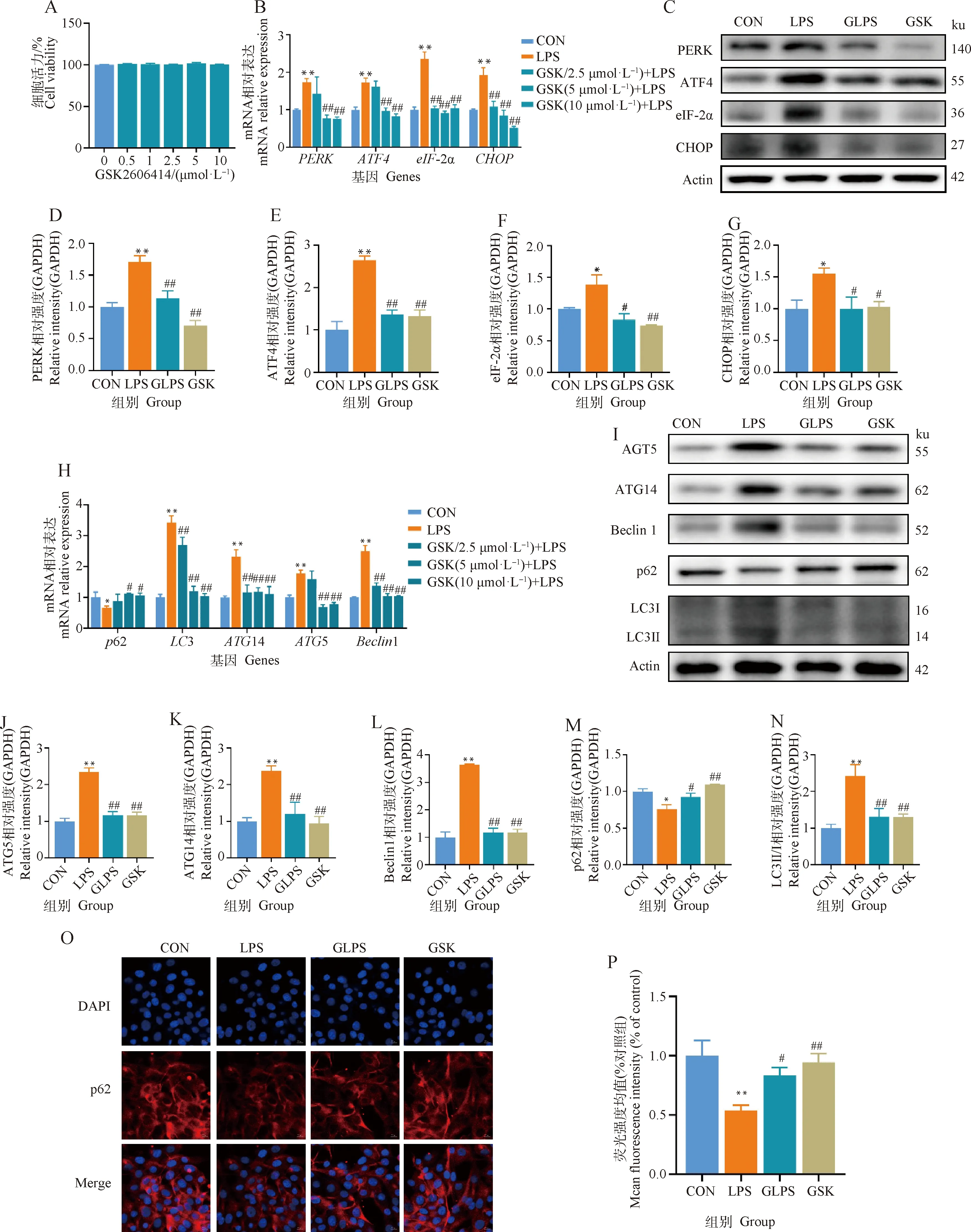
A. GSK2606414(GSK)的细胞活力;B. 基因表达;C. Western blot条带;D~G. PERK、ATF4、eIF2α、CHOP灰度值分析;H. 自噬相关基因;I. Western blot条带;J~N. ATG5、ATG14、Beclin1、p62、LC3Ⅱ/Ⅰ灰度值分析;O. p62的免疫荧光(比例尺=10 μm);P. 荧光强度相对定量结果。与对照组相比,*.P<0.05,**.P<0.01。与LPS组相比,#.P<0.05,##.P<0.01A. The cell viability of GSK2606414 (GSK); B. mRNA expression; C. Western blot bands; D-G. Gray value analysis of PERK, ATF4, eIF2α and CHOP; H. mRNA expression of autophagy-related genes; I. Western blot bands; J-N. Gray value analysis of ATG5, ATG14, Beclin1, p62 and LC3Ⅱ/Ⅰ; O. Immunofluorescence results of p62; P. Relative quantification of immunofluorescence results (scale bar=10 μm). Compared with control group, *.P<0.05, **.P<0.01; Compared with LPS group, #.P<0.05, ##.P<0.01图3 抑制PERK对LPS诱导的奶牛乳腺上皮细胞自噬影响Fig.3 Inhibition of PERK alleviates LPS - induced autophagy in BMECs
接着研究抑制PERK是否可以缓解LPS诱导的奶牛乳腺上皮细胞自噬。由图3可知,与对照组相比,LPS可极显著提高LC3、ATG14、ATG5、Beclin1 mRNA表达(P<0.01,图3H),显著降低p62 mRNA表达(P<0.05,图3H)。而加入PERK抑制剂GSK后,与LPS组相比,GSK预处理可极显著降低LC3、ATG14、ATG5、Beclin1 mRNA表达(P<0.01,图3H),以及显著升高p62 mRNA表达(P<0.05,图3H)。Western blot结果进一步表明,与LPS组相比,GSK预处理可极显著降低ATG14、ATG5、Beclin1、LC3Ⅱ/Ⅰ的蛋白表达(P<0.01,图3I~L、N),以及极显著升高p62蛋白表达(P<0.01,图3I、M)。免疫荧光结果显示,与LPS组相比,GSK预处理可极显著增加p62的荧光强度(P<0.01,图3O、P)。以上结果表明,抑制PERK可缓解LPS诱导的奶牛乳腺上皮细胞自噬。
3 讨 论
内质网应激和自噬是维持细胞内环境稳态的重要方式。内质网对于细胞蛋白质的合成和正确折叠、钙稳态以及细胞自噬等方面具有重要作用。当细胞受到刺激后,大量异常折叠蛋白堆积于细胞内,并启动未折叠蛋白反应(unfolded protein reaction,UPR),激活下游3条信号通路(IRE1α、ATF6和PERK),从而诱导细胞内质网应激[20]。GRP78是内质网的一种分子伴侣,参与内质网的蛋白质折叠和加工。维持内质网的内稳态,当发生内质网应激时,GRP78大量表达[21]。GRP78的高表达可以作为内质网应激和UPR激活的标志[22]。IRE1α、PERK和ATF6的3种通路共同促进C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP homologous protein, CHOP)的表达,导致内质网应激[23]。因此,GRP78和CHOP表达水平的变化是内质网应激的标记物[24]。季英磊等[25]研究表明,LPS可通过上调GRP78的表达引起肝细胞发生内质网应激,从而使肝细胞活力降低和细胞凋亡明显增多,进而对肝细胞造成损伤。本试验结果表明,LPS可显著升高GRP78、CHOP、PERK和ATF6基因和蛋白的表达,并且免疫荧光结果也表明,LPS可升高GRP78的荧光强度。这表明,LPS可诱导牛乳腺上皮细胞发生内质网应激。
LC3是检测自噬的标记蛋白,在自噬过程中,LC3Ⅰ转化为激活的LC3Ⅱ。p62是一个重要的转运蛋白,它是LC3Ⅱ和泛素化底物降解之间的桥梁。因此,细胞内p62的含量可以反映自噬小体的降解程度[26-27],当自噬受到抑制时,p62的表达会升高,而当自噬发生时,p62的表达量会降低。Beclin1被认为是调控细胞自噬的核心基因,通过与IP3Rs结合,增强细胞内Ca2+信号通路,诱导细胞自噬,在细胞自噬过程中发挥关键作用。因此,Beclin1通常被认为是自噬活性的指标之一[28-29]。研究表明,过表达Beclin 1可诱导MCF7细胞和HT29细胞自噬[30]。本试验结果表明,LPS显著上调了奶牛乳腺上皮细胞中LC3和Beclin1的表达,提示LPS可增强奶牛乳腺上皮细胞自噬活性。与对照组相比,LPS显著降低了p62的表达,增加了自噬体的降解程度。LPS还可上调自噬相关蛋白ATG5、ATG14的表达。由此可见,LPS可诱导牛乳腺上皮细胞发生自噬。
内质网应激和自噬是两个独立的生物过程。内质网应激一方面可诱导细胞自噬,另一方面自噬可通过降解细胞内大量错误折叠的蛋白质来恢复内质网的正常生理功能[31]。本试验结果表明,LPS刺激通过上调奶牛乳腺上皮细胞内质网应激和自噬相关蛋白的表达,从而诱导奶牛乳腺上皮细胞发生内质网应激和自噬。作者探究了内质网应激和自噬之间的关系。内质网应激时,UPR可以通过多种分子机制促进自噬[32]。PERK-eIF-2α信号通路是介导内质网应激和细胞自噬之间相互作用最重要的调控通路之一[33-34]。研究表明,NEFA可以通过PERK信号通路促进牛肝细胞自噬小体的形成[35]。在小鼠胚胎成纤维细胞中,通过激活PERK-eIF-2α信号通路,上调自噬相关蛋白ATG12和LC3-Ⅱ诱导自噬[36-37]。为了进一步阐明PERK/eIF-2α/ATF4信号通路的激活与LPS诱导的奶牛乳腺上皮细胞自噬之间的关系。采用PERK抑制剂预处理细胞,再用LPS进行刺激,检测自噬相关蛋白的表达。本试验结果表明,PERK抑制剂GSK2606414可通过降低ATG5、LC3和ATG14以及升高p62的表达,来抑制LPS诱导的奶牛乳腺上皮细胞自噬的发生。因此,PERK/eIF-2α/ATF4信号通路参与了LPS诱导的奶牛乳腺上皮细胞自噬,通过抑制PERK可缓解LPS诱导的奶牛乳腺上皮细胞自噬。
4 结 论
1)LPS通过上调GRP78、CHOP、PERK、IREIα和ATF6的表达来诱导奶牛乳腺上皮细胞发生内质网应激,LPS还可以上调Beclin1、ATG14、ATG5,LC3Ⅱ/Ⅰ以及下调p62的表达诱导奶牛乳腺上皮细胞自噬。2)抑制PERK/eIF-2α/ATF4信号通路可缓解LPS诱导的奶牛乳腺上皮细胞自噬。
