副猪格拉瑟菌5型细胞致死性膨胀毒素CdtB破坏猪呼吸道上皮屏障的机制
2023-02-03刘明星张鹏云蔺辉星范红结
陈 敏,刘明星,张鹏云,蔺辉星,范红结
(南京农业大学动物医学院/农业农村部动物细菌学重点实验室,南京 210095)
副猪格拉瑟菌(Glaesserellaparasuis,GPS)是革兰阴性细菌,分布于世界各地,包含15种血清型,其中血清4型和血清5型在世界流行最为广泛[1-2]。临床上以体温升高、关节肿胀、呼吸困难、多发性浆膜炎、关节炎和高死亡率为特征,给养猪业造成巨大的经济损失[3-4]。在环境应激、机体免疫力下降以及其他病原共感染时,该菌可突破呼吸道屏障,经血液循环引起猪系统性感染,其中肺组织损伤最为严重[5]。黏膜屏障是宿主抵御呼吸道病原菌的第一道防线,其中黏膜上皮细胞间形成的顶部连接复合体(apical junctional complexes, AJC)可作为物理屏障阻挡病原菌。AJC包括紧密连接(tight junction, TJ)、黏附连接(adherens junction,AJ)和桥粒(desmosome)[6]。TJ位于极化上皮的顶端部分,调节单层上皮细胞的细胞旁通透性[7]。
细胞致死性膨胀毒素(cytolethal distending toxin, CDT)是一种由革兰阴性细菌所产生的AB2型毒素,被编码在具有3种蛋白质CdtA、CdtB和CdtC的单个操纵子中[8]。其中CdtB是活性毒性单位,对宿主细胞的损伤起主要作用,两个亚基CdtA和CdtC构成CDT与靶细胞结合以及将CdtB递送到细胞内部所需的“B2”单位[9]。在目前所知的GPS的15个血清型参考株中,均能表达CdtB[10]。细菌的外膜囊泡(outer membrane vesicles, OMVs)是细菌特有的一种生理结构,可通过与质膜融合或通过内吞途径摄取而将其内容物递送至宿主细胞,在细菌与宿主的相互作用、免疫应答等方面发挥着重要的生物学功能[11]。另外,Zhang等[12]对GPS H45菌株的外膜囊泡做了蛋白组学分析,发现其表面存在许多GPS毒力因子,如CdtA、CdtB、CdtC、vtaA9、tbpA、manB、ompP5和Tbp。然而,CDT在GPS5-SQ菌株中是否以OMVs的形式存在未见报道。另外,目前对GPS OMVs的研究仅局限于OMVs蛋白组学分析,至于OMVs在GPS致病机制中的作用亦鲜有报道。
细胞凋亡是一种程序性细胞死亡,它可以引起DNA损伤反应,导致特征性的G2/M细胞周期停滞、细胞肿胀和细胞核增大[13]。据报道,GPS的CDT蛋白全毒素会导致新生仔猪气管上皮细胞(newborn piglet tracheal cell, NPTr)出现明显的细胞膨胀和细胞凋亡[14]。在细胞凋亡过程中,Caspase可以裂解细胞骨架结构,包括紧密连接成分和黏附连接成分[15]。并且在诱导上皮细胞凋亡之后,跨上皮电阻值显著降低,最终导致通透性的增加[16]。然而,副猪格拉瑟菌是否可以通过OMVs转运CdtB蛋白引起猪呼吸道上皮细胞凋亡,进而破坏呼吸道上皮屏障未见报道。
本研究以猪呼吸道上皮细胞(swine tracheal epithelial cells, STEC)为细胞模型,通过检测OMVs和CdtB蛋白处理STEC后凋亡相关蛋白cleaved-caspase3的表达水平、紧密连接蛋白TJ的表达水平和细胞旁通透性,研究GPS通过OMVs传递CdtB蛋白引起STEC的细胞凋亡,进而突破细胞屏障的机制,其研究结果有助于进一步阐明GPS感染的致病机理。
1 材料与方法
1.1 材料
1.1.1 菌株、载体及细胞 猪气管上皮细胞(swine tracheal epithelial cells, STEC)采用DMEM培养基(含10%胎牛血清)于37 ℃、5% CO2细胞培养箱中进行培养。副猪格拉瑟菌5型GPS5-SQ菌株由本实验室分离、鉴定并保存。pET-28a载体、pET-32a载体、大肠杆菌DH5α菌株、大肠杆菌BL21(DE3)菌株均由本实验室保存;大肠杆菌Rosetta gami(DE3)plysS感受态细胞购自上海生工公司。
1.1.2 实验动物 30只体重20~25 g的6周龄SPF级雌性ICR小鼠购自扬州大学实验动物中心。
1.1.3 主要试剂 副猪格拉瑟菌适用培养基为胰蛋白胨大豆琼脂培养基(Tryptic Soy Broth,TSB),购自美国BD公司;NAD(辅酶I)和琼脂Agar购自德国BioFROXX生物试剂公司;T4 DNA连接酶和快切酶均购自大连TaKaRa生物工程公司;HRP-山羊抗小鼠IgG H&L和HRP-山羊抗兔IgG H&L二抗购自美国Invitrogen公司;Cleaved Caspase3单抗、ZO-1单抗、claudin-1单抗和occludin单抗购自美国CST公司;DiO染料购自MCE生物科技有限公司;TRITC Phalloidin 罗丹明鬼笔环肽和DAPI溶液购自北京索莱宝科技有限公司;2-吗啉乙磺酸(MES)和N-羟基琥珀酰亚胺(NHC)购自上海吉至生化科技有限公司;磁性聚合物纳米微球购自上海奥润微纳新材料科技有限公司;Annexin-V-FITC/PI凋亡检测试剂盒购自南京诺唯赞生物科技股份有限公司。
1.2 方法
1.2.1 重组质粒的构建 以GPS5-SQ基因组为模板,设计特异性扩增hbpA、ompP2、cdtA、cdtB和cdtC基因的引物(见表1),设计好的引物由南京金斯瑞生物公司进行合成。PCR反应体系为:DNA模板1 μL,上、下游引物各2 μL,2×PrimeStar Max 25 μL,ddH2O 25 μL。扩增反应条件为:预变性95 ℃2 min;变性98 ℃ 10 s、退火55 ℃ 15 s、延伸72 ℃ 1 min,30个循环,终延伸72 ℃ 10 min。PCR产物经琼脂糖电泳后回收。载体和PCR产物经内切酶进行双酶切,反应结束后回收酶切产物,经T4 DNA连接酶连接并转化至大肠杆菌DH5α感受态细胞,涂布于卡那或氨苄抗性的LB平板,37 ℃倒置培养过夜,挑取单克隆菌落培养后提取质粒进行酶切鉴定并送于南京擎科生物技术有限公司测序。

表1 本试验所用PCR引物Table 1 PCR primers used in this experiment
1.2.2 重组蛋白的表达及纯化 提取的重组质粒经测序后转化至大肠杆菌BL21(DE3)和Rosetta gami(DE3)plysS感受态细胞中,并在含有100 μg·mL-1氨苄抗生素的LB培养基中37 ℃培养。待OD600 nm为0.6时加入终浓度1 mmol·L-1的IPTG,然后放入16 ℃摇床中继续过夜诱导12 h,次日超速破碎菌体并收集上清和沉淀,经SDS-PAGE及考马斯亮蓝染色。利用His标签蛋白琼脂糖纯化树脂对重组蛋白进行纯化。
1.2.3 多克隆抗体的制备 30只体重20~25 g的6周龄SPF级雌性ICR小鼠购自扬州大学实验动物中心,随机分为6组,每组5只,分别为Omp2组、HbpA组、CdtA组、CdtB组、CdtC组及PBS组。将纯化后的重组蛋白与弗氏佐剂以体积比1∶1混匀后进行乳化。采用小鼠背部多点皮下注射的方式免疫小鼠3次。各免疫组小鼠的注射剂量为每只50 μg,首次免疫14 d后进行第二次免疫,首次免疫28 d后进行第三次免疫,分别在二免与三免后第7天收集小鼠血清保存于-80 ℃。另外,通过Mab Traap Kit抗体纯化试剂盒对CdtB组多克隆抗体进行纯化。
1.2.4 生长曲线测定 将冻存的GPS5-SQ菌液于TSA平板上复苏,待平板长出单菌落后,挑取单菌落于2 mL TSB培养基(0.03 g·mL-1的TSB, 10%的FBS, 终浓度为0.1 mg·mL-1的NAD)中37 ℃,180 r·min-1过夜培养。将菌液按照1∶100转接到新的20 mL的TSB液体培养基中,在37 ℃,180 r·min-1的恒温摇床中培养14 h,每隔2 h取样测定其在600 nm处的吸光值OD600 nm。
1.2.5 外膜囊泡的分离和标记 按照文献报道的方法,经过密度梯度离心的方法提取外膜囊泡[17]。即将2 000 mL的GPS5-SQ菌液37 ℃、180 r·min-1的恒温摇床中生长至对数生长期的后期(OD600 nm=1.2~1.4),在4 ℃下以8 000×g离心15 min去除细菌细胞。通过0.22 μm过滤器过滤灭菌后,使用100 ku超滤管通过超滤浓缩上清液,最后通过在4 ℃下以150 000×g超速离心3 h(转子类型50.2 Ti,Beckman-Coulter)收集OMVs。在用无菌磷酸盐缓冲盐水(PBS)悬浮颗粒状OMVs后,通过密度梯度离心用20%、25%、30%、35%和40%的OptiPrep [60%碘克沙醇(w/v)]进行纯化。
将纯化的OMVs进行SDS-PAGE电泳,考马斯亮蓝染色观察OMVs中蛋白质的大小。透射电子显微镜(TEM,负染)和纳米粒子直径(NTA)分析OMVs粒子形态和数目,并测定蛋白浓度。用制备的多克隆抗体进行Western blot验证,确定GPS OMVs中是否含有CDT蛋白。最后将纯化的CdtB蛋白以及OMVs分别在SDS-PAGE中进行电泳分离,用CdtB多克隆抗体进行Western blot验证,以便对OMVs进行定量。
将纯化的OMVs与蛋白酶K一起孵育,验证OMVs结构保护蛋白质免受蛋白酶降解的能力。对于标记,将OMVs与5 μg·mL-1的DiO孵育30 min,使用100 ku超滤管去除未掺入的染料,将40 μg·mL-1DiO标记的外膜囊泡在37 ℃下与STEC共孵育5 h。随后用PBS洗涤,用4%多聚甲醛固定并依次用100 nmol·L-1的TRITC Phalloidin和100 nmol·L-1的DAPI避光孵育20 min,通过荧光显微镜对细胞进行成像。
1.2.6 细胞凋亡检测 将STEC接种于6孔板中,待细胞生长至90%时,用不同浓度CdtB(50、100、500 ng·mL-1)和OMVs(20 μg·mL-1)分别与细胞共孵育36 h,阴性对照组加入无血清DMEM,阳性对照组加入1 μmol·L-1Staurosporine。待细胞处理36 h后,收集细胞并用500 μL的Annexin-V结合缓冲液重悬细胞,加入5 μL异硫氰酸荧光素(FITC)和PI避光孵育15 min,流式细胞仪检测凋亡细胞百分比。
将细胞与CdtB(500 ng·mL-1)和OMVs(20 μg·mL-1)分别孵育36 h,裂解细胞收集细胞总蛋白。定量后将pNA(10 mmol·L-1)用标准品稀释液稀释后用酶标仪检测405 nm处的吸光度,制作pNA浓度标准曲线。取50 μL待检样品的细胞裂解上清液加入40 μL检测缓冲液和10 μL的Ac-DEVD-pNA,37 ℃下避光反应l h。Caspase3的相对活性以凋亡诱导细胞与空白对照细胞的吸光度值(A405 nm)的比值表示(Staurosporine作为阳性对照,1 μmol·L-1,溶于DMSO)。
1.2.7 细胞毒性检测 细胞凋亡后,细胞浆内酶活性较为稳定的乳酸脱氢酶(lactate dehydrogenase, LDH)会释放到培养液中,通过检测细胞培养上清液中LDH的释放量从而对细胞毒性进行分析[18]。将STEC以每孔103个细胞接种于96孔细胞板,每孔200 μL,置于37 ℃、5% CO2细胞恒温培养箱中培养。试验设置空白对照组与实验组,分别于6、12、24、36和48 h收集细胞培养上清液,LDH法测定细胞存活率,每个处理组设置3个重复孔,试验共进行3次独立重复。
1.2.8 上皮屏障完整性的测定 为了在体外建立STEC单层模型,将250 μL的细胞悬液接种在Transwell的上室中[19]。用移液管将600 μL含10% FBS的DMEM培养基加入下室,置于37 ℃,5% CO2条件下的细胞培养箱中。每天更换培养基提供营养;并用细胞电阻仪检测电阻值,实时记录,待数值稳定后进行后续试验。
为评价CdtB蛋白和OMVs介导的屏障完整性调节的意义,单独用CdtB和OMVs处理STEC,分别于处理0、6、12、24和36 h后测定细胞的电阻值。
同上处理细胞36 h后将上室的培养基换成FD4溶液(1 mg·mL-1,用HBSS缓冲液稀释),下室换成HBSS缓冲液,未处理的细胞单层用作对照。并于0和4 h取下室100 μL液体用荧光酶标仪中在490 nm的激发波长和520 nm的发射波长下测定基底外侧小室的荧光强度;FD-4通量值(FI)的计算:每个样本的荧光强度减去0 h测得的荧光强度,数据表示为与未感染对照细胞相比的倍数变化。
1.2.9 免疫磁珠分离 通过先前报道的方法进行免疫磁性分离,并进行了一些改动[20]:用N3-dimethylpropane-1,3-diamine和N-hydroxysuccinimide活化磁珠,将纯化后的500 μg CdtB多克隆抗体与2 mg磁珠偶联。取5 mg超速破碎后的OMVs加入到偶联后的磁珠中,37 ℃孵育30 min,置磁力架上2~3 min,待磁珠充分被吸附,分别收集上清(IMC-CdtB)和其余液体(OMVs-ΔCdtB)。
1.2.10 蛋白免疫印迹 将STEC接种于12孔板中培养,待细胞长至90%时用CdtB蛋白、OMVs、OMVs-ΔCdtB等处理细胞36 h。然后用RIPA细胞裂解液在冰上裂解细胞以提取细胞总蛋白,进而在SDS-PAGE中进行电泳分离(每孔10 μg)。然后通过半干转的方法将蛋白转印至0.22 μm的聚偏二氟乙烯(PVDF)膜上。用含5%脱脂奶粉的封闭液封闭,2 h后加入用封闭液稀释的特定的一抗并以45 r·min-1转速在4 ℃摇床孵育过夜。次日将膜与HRP-山羊抗小鼠IgG H&L或HRP-山羊抗兔IgG H&L在室温下孵育1 h,经TBST洗膜用ECL发光液曝光、显影,并用Image Lab软件分析结果。
1.2.11 数据统计与处理 使用ImageJ软件对Western blot结果进行灰度分析,并利用GraphPad Prism 8.4.3软件ANOVA检验比较各组数据的差异性。
2 结 果
2.1 重组质粒的鉴定
使用限制性内切酶BamH I与SalI对pET-28a、pET-28a-hbpA和pET-28a-ompP2载体进行双酶切,使用限制性内切酶BamH I与EcoR I对pET-32a、pET-32a-cdtA、pET-32a-cdtB和pET-32a-cdtC载体进行双酶切。酶切鉴定结果如图1所示:表明成功构建hbpA-pET28a载体、ompP2-pET28a载体、cdtA-pET32a载体、cdtB-pET32a载体和cdtC-pET32a载体。
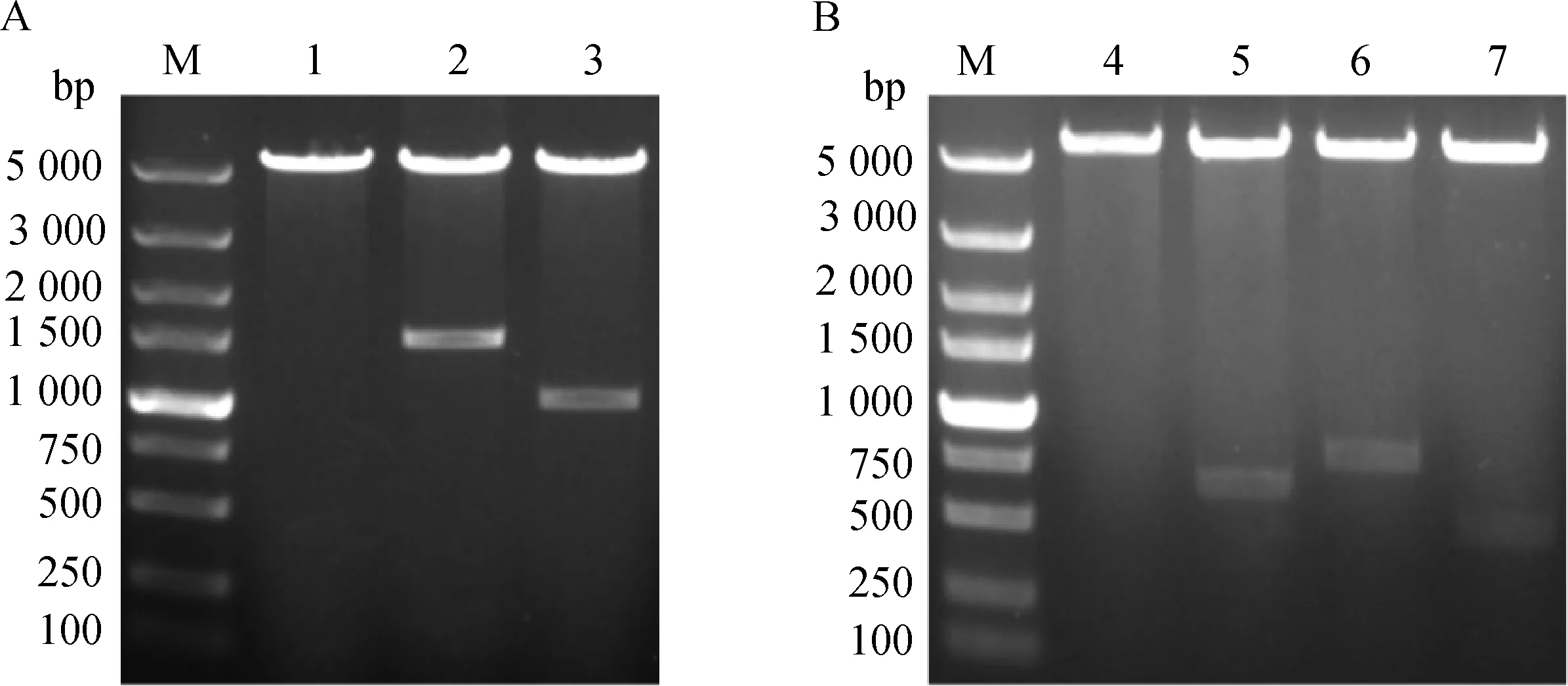
M.DL5000相对分子质量标准;1.pET-28a载体;2.pET-28a-hbpA载体;3.pET-28a-ompP2载体;4.pET-32a载体;5.pET-32a-cdtA载体;6.pET-32a-cdtB载体;7.pET-32a-cdtC载体M.DL5000 DNA Marker; 1. pET-28a plasmid; 2.pET-28a-hbpA plasmid; 3.pET-28a-ompP2 plasmid; 4.pET-32a plasmid; 5.pET-32a-cdtA plasmid; 6. pET-32a-cdtB plasmid; 7. pET-32a-cdtC plasmid图1 质粒双酶切鉴定Fig.1 Enzymatic digestion of plasmid
2.2 重组蛋白的纯化
利用His镍柱纯化5种蛋白,rHbpA、rOmpP2、rCdtA、rCdtB和rCdtC重组蛋白经SDS-PAGE电泳鉴定后,分别在60、40、40、47和21 ku附近出现蛋白条带,与预期结果一致。BCA测定5种重组蛋白的浓度分别为0.32、2.12、0.85、1.21 和0.94 mg·mL-1(图2A)。将纯化后的5种蛋白进行Western blot鉴定,一抗为鼠源抗His单克隆抗体,鉴定结果如图2B,进一步证明5种蛋白成功表达并纯化。
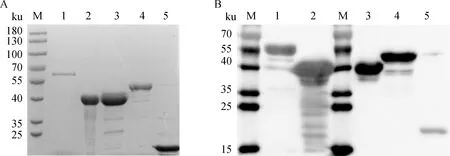
A. SDS-PAGE鉴定重组蛋白;B. Western blot鉴定纯化的重组蛋白;M.蛋白质相对分子质量标准;1~5.纯化的HbpA、OmpP2、CdtA、CdtB和CdtC蛋白A. Identification of recombinant protein by SDS-PAGE; B. Identification of purified recombinant protein by Western blot; M.Protein molecular weight standard; 1-5. Purified HbpA, OmpP2, CdtA, CdtB, CdtC proteins图2 纯化的重组蛋白 SDS-PAGE 检测及 Western blot 鉴定Fig.2 The purified recombinant protein analyzed by SDS-PAGE and Western blot
2.3 多克隆抗体的Western blot分析
将纯化后的5种蛋白以及GPS5-SQ菌体沉淀煮样后进行Western blot鉴定,一抗为制备的多克隆抗体(均1∶5 000稀释)。结果显示,本研究制备的5种鼠抗HbpA、OmpP2、CdtA、CdtB和CdtC多克隆抗体具有良好的特异性(图3A)。

A.多克隆抗体的Western blot分析。B. SDS-PAGE鉴定CdtB抗体的纯度;M.蛋白质相对分子质量标准;1~6.纯化的CdtB多克隆抗体A. Western blot analysis of polyclonal antibody. B. Identification of the purity of CdtB antibody by SDS-PAGE; M.Protein molecular weight standard; 1-6.Purified CdtB polyclonal antibody图3 多克隆抗体的Western blot分析Fig.3 Western blot analysis of polyclonal antibody
用抗体纯化试剂盒对CdtB多克隆抗体进行纯化,纯化后的抗体浓度为0.8 mg·mL-1。SDS-PAGE结果显示纯化后的抗体在55和25 ku左右出现两条特异性条带,与免疫球蛋白分子的重链和轻链大小一致(图3B)。
2.4 副猪格拉瑟菌分泌的 OMVs 中可检测到CdtB
根据生长曲线,GPS5-SQ菌株在2 h后开始进入对数期,8 h后进入平台期,对数生长后期的OD600=1.2~1.4(图4A)。在细菌生长的对数后期离心集菌,经透射电子显微镜(TEM)观察,发现细菌周围存在一些类似囊泡的结构(图4B)。经密度梯度离心获得纯化后的OMVs,SDS-PAGE观察到蛋白质主要集中在第4和第5泳道,即含有35%和40%碘克沙醇的密度层,OMVs的蛋白质大小集中在55 ~100 ku(图4C)。将样品进行TEM观察,发现OMVs的粒径在100~200 nm(图4D)。纳米粒子直径分析(NTA)结果显示,样品在100~200 nm处的粒子数目最多(图4E)。用制备的HbpA、OmpP2、CdtA、CdtB和CdtC多克隆抗体对外膜囊泡及不含外膜囊泡的细菌上清进行Western blot验证,HbpA及OmpP2结果证明所提取的样品为外膜囊泡;CDT结果证明CdtA、CdtB和CdtC在GPS中主要以外膜囊泡的形式存在(图4F)。经Western blot验证,100 μg的OMVs中含有2.5 μg的CdtB(图4G)。
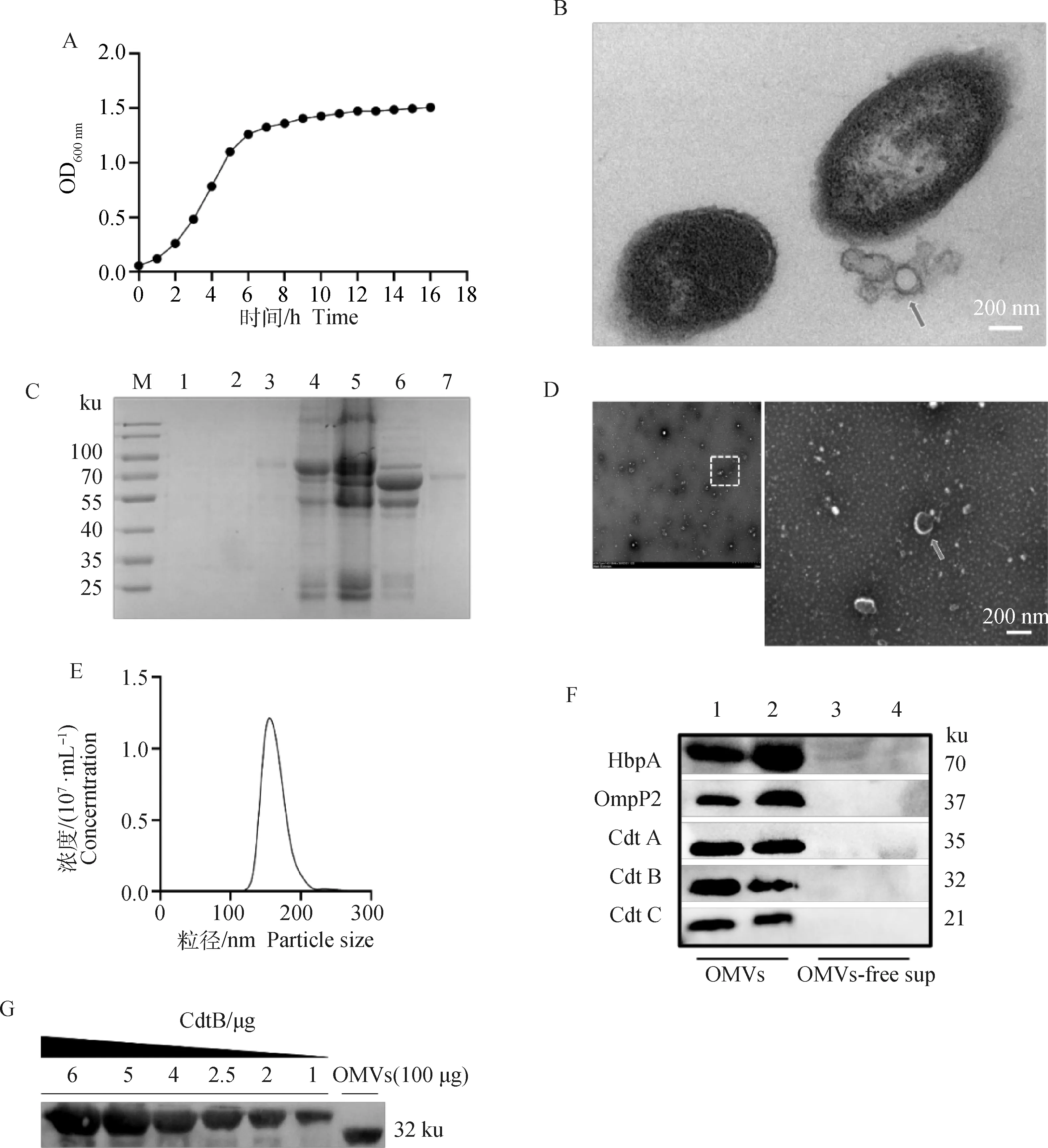
A. GPS5-SQ生长曲线;B. GPS5-SQ细胞外的OMVs(箭头处)的透射电子显微镜图片;C. SDS-PAGE分析OMVs各个密度梯度的蛋白大小。M. Maker;1~5分别为密度梯度20%、25%、30%、35%和40%的样品;6. 超速离心后的细菌上清;7. 超滤浓缩后的细菌上清(<100 ku);D. 透射电子显微镜观察OMVs的大小, 箭头指向OMVs;E. 纳米粒子直径分析粒子数目;F. 通过蛋白免疫印迹证明CdtB存在于OMVs中而非不含OMVs的上清中;1. 碘克沙醇浓度为35%的OMVs;2. 为碘克沙醇浓度为40%的OMVs;3. 为超速离心后的细菌上清(浓缩500倍);4. 超滤浓缩后的上清(<100 ku,浓缩500倍);G. 蛋白免疫印迹表明100 μg的OMVs中约含有2.5 μg的CdtBA. Growth curve of GPS5-SQ; B. Transmission electron micrographs (ultra-thin slices) image of OMVs (arrow) located at extracellular of GPS5-SQ; C. The protein size of each density gradient of OMVs was analyzed by SDS-PAGE. M. Marker; 1-5.OMVs samples with density gradients of 20%, 25%, 30%, 35% and 40% OptiPrep; 6. Bacterial supernatant after ultracentrifugation. 7.Bacterial supernatant after concentration by ultrafiltration (<100 ku); D. Transmission electron microscope observation of the size of OMVs (arrow); E. Nanoparticle diameter analysis of the number of particles; F. Distribution of CDT in OMVs and OMVs-free supernatants determined by Western blot with antibodies against Omp2 (an OMVs marker), HbpA, and CDT. 1. OMVs with iodixanol concentration of 35%; 2. OMVs with iodixanol concentration of 40%; 3. Bacterial supernatant after ultracentrifugation (concentrated 500 times); 4. Bacterial supernatant after ultrafiltration (concentrated 500 times). G. Western blot showed that 100 μg of OMVs contained approximately 2.5 μg of CdtB图4 GPS5-SQ分泌的OMVs可检测到CdtBFig.4 OMVs secreted by GPS5-SQ can carry CdtB
2.5 OMVs 可被STEC吸收
将纯化的OMVs与STEC共孵育5 h,由荧光显微镜观察可知,OMVs 可被STEC吸收至细胞核附近(图5A)。另外,将纯化的OMVs与蛋白酶K一起孵育,验证OMVs 结构保护蛋白质免受蛋白酶降解的能力(图5B),结果显示向囊泡中加入0.02% SDS对总蛋白质含量没有影响(泳道2),OMVs单独与蛋白酶K(200 μg·mL-1)孵育显示一些蛋白质降解(泳道3),当样品在SDS存在下与蛋白酶K一起孵育时,可以观察到几乎所有蛋白质的降解(泳道4)。
2.6 OMVs和CdtB可诱导STEC凋亡并增加气管上皮屏障的通透性
单层细胞跨膜电阻值(TEER值)是评估细胞屏障完整性的指标[21]。体外构建STEC呼吸道上皮屏障模型,待TEER 值趋于稳定时构建成功(图6A)。与对照组相比,CdtB(500 ng·mL-1)与OMVs(20 μg·mL-1)处理细胞36 h后电阻值显著降低(图6B)。
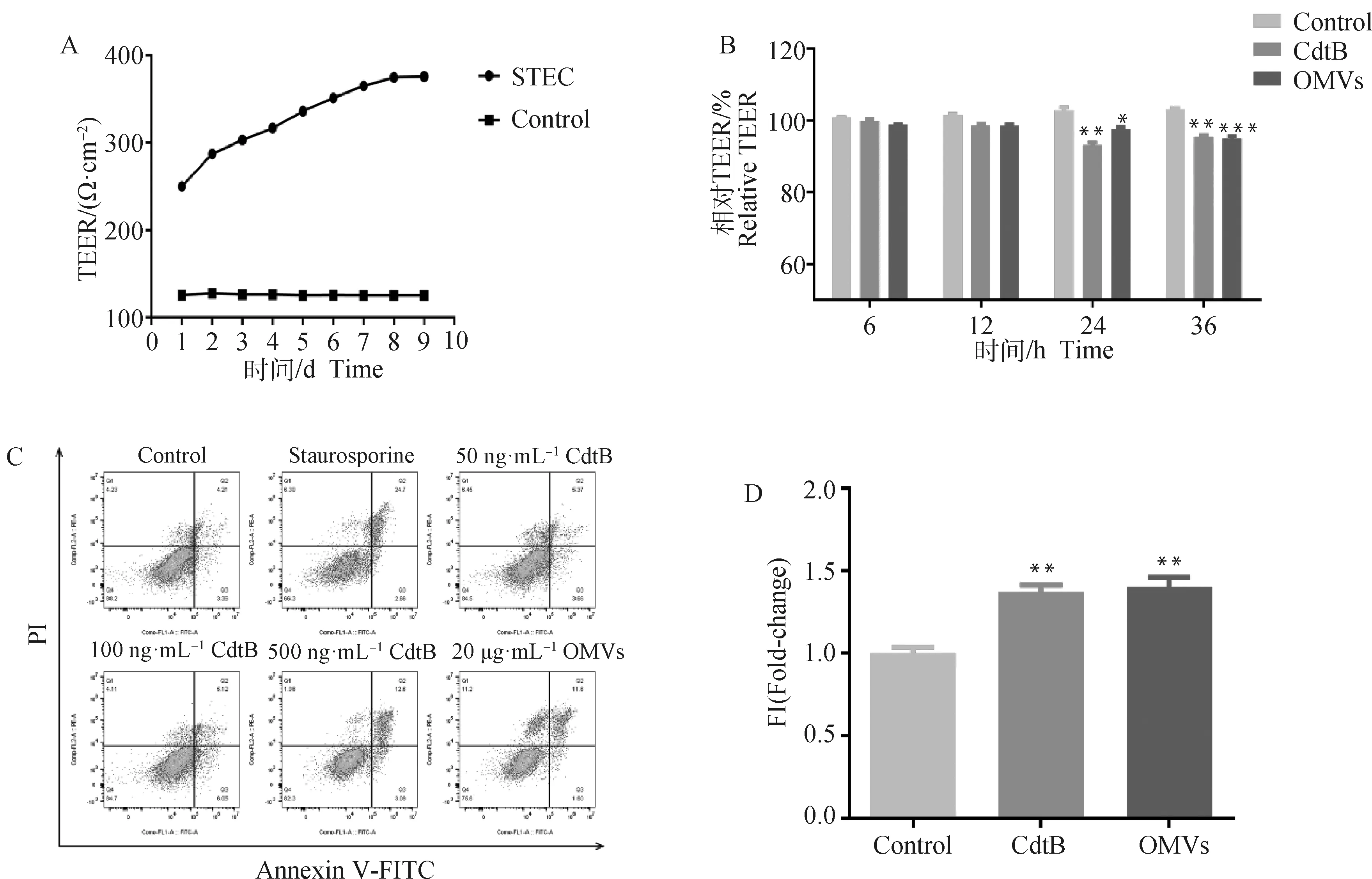
A.体外气管上皮屏障模型的构建;B.CdtB和OMVs在与STEC共孵育36 h时降低了上皮屏障的 TEER;C.流式细胞仪分析细胞凋亡数目;D.细胞旁通透性的检测,其中,“*”表示P<0.05,“**”表示P<0.01,“***”表示P<0.001。下同A. Construction of tracheal epithelial barrier model in vitro; B. CdtB and OMVs reduced the TEER of the epithelial barrier when co-incubated with STEC for 36 h; C. Flow cytometry analysis of the number of apoptotic cells; D. The detect of paracellular permeability, in which * means P<0.05, ** means P<0.01, *** means P<0.001. The same as below图6 OMVs和CdtB可诱导STEC凋亡并增加气管上皮屏障的通透性Fig.6 OMVs and CdtB induce STEC apoptosis and increase the permeability of the tracheal epithelial barrier
由流式结果分析可知(图6C),Staurosporine、不同浓度CdtB(50、100、500 ng·mL-1)和20 μg·mL-1OMVs组处理STEC 36 h后细胞凋亡比例分别为27.36%、9.03%、11.17%、15.69%和13.2%;未处理单独细胞凋亡比例为7.57%。
此外,通过检测Transwell小室下层的FITC结合的葡聚糖来分析上皮屏障的完整性。相对于对照组,CdtB与OMVs处理36 h后下室的FD-4量显著升高(图6D)。上述结果表明OMVs和CdtB可诱导STEC凋亡并增加气管上皮屏障的通透性。
2.7 OMVs和CdtB可诱导STEC凋亡并破坏STEC中的紧密连接
蛋白免疫印迹分析显示,CdtB和OMVs处理STEC 36 h后cleaved-caspase3蛋白表达水平显著增加;TJ ZO-1和Occludin的表达水平降低,而claudin-1的表达水平与对照组相比无差异(图7A、7B)。Caspase3活性检测结果表明,与对照组相比,CdtB和OMVs组Caspase3活性均显著增加,这与LDH测定结果相符(图7C、7D)。以上结果表明,OMVs和CdtB可诱导STEC发生细胞凋亡,进而导致细胞间ZO-1和Occludin的蛋白表达水平下降,最终增加气管上皮屏障的通透性。

A.通过蛋白免疫印迹分析ZO-1、Occludin、claudin-1和cleaved-caspase3的蛋白质水平;CT.阴性对照;Sta.阳性对照(Staurosporine, 1 μmol·L-1);B.蛋白质条带强度由ImageJ软件量化;C.用Caspase3活性检测试剂盒检测凋亡相关蛋白的活性;D.OMVs或CdtB与STEC孵育6、12、24、36、48 h,通过LDH检测试剂盒评估STEC的细胞毒性。ns代表组间无差异。下同A. The protein levels of ZO-1, occludin, claudin-1 and cleaved caspase3 were analyzed by Western blot; B.The intensity of the protein bands was quantified by ImageJ software. The p values were calculated with one-way ANOVA; C.The activity of apoptosis-related proteins was detected by a Caspase3 activity detection kit; D. OMVs or CdB were incubated with STEC for 6, 12, 24, 36, and 48 hours, and the cytotoxicity of STEC was evaluated by LDH detection kit. ns indicates no significant difference between groups. The same as below图7 OMVs和CdtB可诱导STEC凋亡并破坏STEC中的紧密连接Fig.7 OMVs and CdtB cause apoptosis and TJ disruption in STEC
2.8 OMVs和CdtB诱导STEC发生p53依赖的细胞凋亡
用Pifithrin-α(PFT-α,凋亡p53通路抑制剂,使用浓度为20 μmol·L-1)预处理后,Pifithrin-α+CdtB组、Pifithrin-α+OMVs组cleaved-caspase3蛋白的表达水平明显低于CdtB与OMVs单独处理组,与对照组相比,Pifithrin-α+CdtB组与Pifithrin-α+OMVs组ZO-1和Occludin的蛋白表达水平无差异(图8)。上述结果表明,OMVs和CdtB诱导STEC发生p53依赖的细胞凋亡,进而破坏STEC中的紧密连接。

A.蛋白质印迹分析ZO-1、Occludin和cleaved-caspase3的蛋白表达水平;B.蛋白质条带强度由 ImageJ 软件量化A. The protein expression levels of ZO-1, Occludin and cleaved-caspase3 were analyzed by Western blot; B.Protein band intensities were quantified by ImageJ software图8 OMVs和CdtB诱导STEC发生p53依赖的细胞凋亡Fig.8 OMVs and CdtB induce p53-dependent apoptosis in STEC
2.9 OMVs通过转运CdtB破坏STEC中的紧密连接
用先前制备的CdtB多克隆抗体检测OMVs(超声破碎后的)、OMVs-ΔCdtB和IMC-CdtB,Western blot结果显示成功从OMVs中分离出CdtB,并获得OMVs-ΔCdtB和IMC-CdtB(图9A)。用CdtB、OMVs(超声破碎后的)和OMVs-ΔCdtB与STEC共孵育36 h,未处理的细胞作为阴性对照。结果显示,与对照组相比,CdtB和OMVs组cleaved-caspase3蛋白表达水平显著增加,ZO-1和Occludin的表达水平降低;而OMVs-ΔCdtB组cleaved-caspase3、ZO-1和Occludin的蛋白表达水平无差异(图9B、9C)。以上所有研究结果表明,OMVs通过转运CdtB诱导STEC发生p53依赖的细胞凋亡,并破坏STEC中的紧密连接,最终增加气管上皮屏障的通透性。
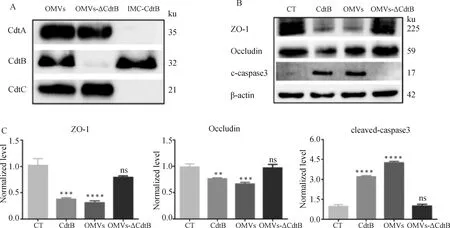
A.蛋白免疫印迹分析OMVs、OMVs-ΔCdtB和IMC-CdtB中是否含有CdtA、CdtB和CdtC蛋白;B.蛋白免疫印迹分析cleaved-caspase3、ZO-1和Occludin的蛋白表达水平;C.蛋白质条带强度由ImageJ软件量化A.OMVs, OMVs-ΔCdtB and IMC-CdtB were analyzed for the presence of CdtA, CdtB and CdtC proteins by Western blot; B.The protein expression levels of cleaved-caspase3, ZO-1 and occludin were analyzed by Western blot; C.Protein band intensities were quantified by ImageJ software图9 OMVs通过转运CdtB破坏STEC中的紧密连接Fig.9 OMVs cause TJ disruption in STEC by transporting CdtB
3 讨 论
副猪格拉瑟菌(Glaesserellaparasuis,GPS)是近年来严重危害养猪业发展的主要细菌性病原,可引起猪的格拉泽氏病[22]。作为一种呼吸道机会致病菌,副猪嗜血杆菌必须突破呼吸道上皮屏障进入血液才能诱发系统性感染。细菌穿透细胞屏障的3种方式包括直接穿透细胞、细胞旁途径和“特洛伊木马”形式。本实验室前期研究发现,GPS菌株感染STEC,其侵袭能力较弱,并且可以下调TJ ZO-1、occludin和claudin-1的表达水平[23]。因此猜测,GPS菌株是通过细胞旁途径破坏STEC中的紧密连接的。
有研究报道,GPS的CDT蛋白全毒素会导致猪肾上皮细胞(porcine kidney cells, PK-15)和猪肺泡巨噬细胞(pulmonary alveolar macrophage cells, PAMs)出现明显的细胞膨胀和细胞凋亡,其中细胞G2阻滞和p53依赖性细胞凋亡主要是由CdtB引起的[24],因此本研究从CdtA、CdtB和CdtC中选择CdtB处理STEC,检测细胞凋亡和屏障通透性之间的关系。本研究发现,副猪格拉瑟菌分泌的CDT蛋白在GPS培养物中以OMVs的形式存在,在细胞上清中未检出游离的毒素,类似现象在肠致病性大肠杆菌EHEC O157中有相关报道,并且EHEC O157 OMVs通过将CdtB毒素依次转运至肠上皮细胞的高尔基体、内质网,而后易位至细胞核,细胞DNA损伤,引起细胞周期停滞,最终通过Caspase9途径诱导细胞凋亡[25]。
细胞凋亡主要由3种途径引起:外源性或死亡受体途径、内源性或线粒体途径以及颗粒酶依赖性途径[26]。研究报道,细菌分泌的OMVs均通过线粒体途径引起宿主细胞凋亡。例如,淋病奈瑟氏菌、幽门螺杆菌、铜绿假单胞菌和尿道致病性大肠杆菌可通过分泌OMVs,通过线粒体途径引起巨噬细胞发生凋亡[27-28]。本研究发现,GPS OMVs可通过将CdtB毒素转运至STEC中引起细胞发生p53依赖的细胞凋亡。p53是一种肿瘤抑制基因,可通过上调Bax的表达水平,以及下调Bcl-2的表达共同完成促进细胞凋亡作用[14]。其中Bax可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素c的释放,促进细胞凋亡,而Bcl-2可阻止细胞色素c的释放,具有抗凋亡作用。此外,p53还可通过死亡信号受体蛋白途径诱导凋亡。但由于本研究发现CdtB引起的细胞凋亡是由OMVs转运所引起的,故CdtB可引起线粒体依赖性的细胞凋亡。
气管上皮细胞和细胞间连接结构是机体抵抗微生物入侵的重要物理屏障,其中紧密连接(TJs)对于构建上皮屏障和维持上皮极性至关重要[29]。例如猪链球菌2型(SS2)与猪圆环病毒2型(PCV2)混合感染STEC 48 h,TJ ZO-1蛋白表达水平显著降低[30];研究报道,牙龈卟啉单胞菌(P.gingivalis)产生的OMVs可以降低人肺上皮细胞A549的细胞活力,同时诱导Caspase3活化和聚ADP-核糖聚合酶(PARP)的切割,引起细胞凋亡,进而破坏紧密连接蛋白claudin-1和occludin完整分布[31]。本研究发现OMVs及CdtB诱导细胞发生p53依赖的细胞凋亡,上皮细胞凋亡之后,跨上皮阻力显著降低,构成上皮屏障的TJs ZO-1和occludin表达水平降低,最终导致通透性的增加和上皮屏障的破坏。
4 结 论
本研究建立了GPS5-SQ的体外感染模型,通过提取GPS OMVs,发现OMVs与STEC共孵育5 h后可被STEC膜融合内化至细胞核附近。另外,OMVs可以通过转运CdtB诱导STEC发生p53依赖的细胞凋亡,并下调STEC中ZO-1、occludin的表达水平,最终增加气管上皮屏障的通透性。研究结果有助于进一步阐明副猪格拉瑟菌的致病机制,可为相关疫苗的研发及新型药物靶标的发掘提供理论依据,并对研究同类呼吸道病原菌突破气管上皮屏障的机制提供参考价值。
