非洲猪瘟病毒p54蛋白单克隆抗体制备及其抗原表位鉴定
2023-02-03齐艳丽刘桃雪于海深鲁维飞褚贝贝张改平
齐艳丽,刘桃雪,于海深,张 超,鲁维飞,王 江,褚贝贝*,张改平*
(1.河南农业大学 农业部动物生化与营养重点开放实验室,郑州 450046;2.河南农业大学 河南省动物生长发育调控重点实验室,郑州 450046;3.河南农业大学 动物免疫学国际联合研究中心,郑州 450046)
非洲猪瘟(African swine fever, ASF)是一种复杂和高度致命的出血性疾病,能够感染不同品种和年龄的家猪和野猪。已被世界动物卫生组织(OIE)定义为最危险和最持久的动物疾病之一[1],临床症状主要表现为持续性发热,伴随有呼吸困难、心跳加速、分泌物增加、胃肠道黏膜和淋巴结出血等表现[2]。非洲猪瘟疫情最早于20世纪20年代在肯尼亚暴发,目前在中欧、东欧和亚洲广泛流行,给全球养殖业造成了严重经济损失[3-4]。尽管对非洲猪瘟已进行了广泛的研究,但是仍然缺乏有效的疫苗或抗病毒策略[5]。
非洲猪瘟病毒(African swine fever virus,ASFV)是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员,也是唯一已知的DNA虫媒病毒[6]。ASFV具有20面体形态,由中心核仁、核壳、内层包膜和衣壳及外包膜组成[7-8],基因组是一个线性双链DNA分子,长度为170~193 kb,有151~167个开放阅读框[9-10],编码54种结构蛋白和100多种非结构蛋白,参与病毒基因组的复制、DNA修复、转录、病毒组装及免疫逃逸等[11-12]。
p54蛋白是ASFV的重要结构蛋白之一,由E183L基因编码,位于病毒的内囊膜,在病毒感染细胞时,与细胞质动力蛋白轻链结合,参与病毒的运输[13]。p54蛋白是ASFV的主要抗原蛋白之一,被鉴定为潜在的血清学诊断抗原。血清中的p54抗体抑制病毒对猪巨噬细胞的黏附,抑制率约为60%[14-16]。因此,p54蛋白具有较好的抗原性,是理想的免疫抗原,可制备针对ASFV的中和抗体。
本研究对ASFV p54蛋白膜外区域序列(53—184 aa)进行原核密码子优化,利用大肠杆菌表达系统获得可溶性重组p54蛋白,将其作为抗原免疫BALB/c小鼠,制备了6株针对p54蛋白的单克隆抗体,具有良好的特异性,对其抗原表位进行鉴定,并在预测的三级结构中进行标注。
1 材料与方法
1.1 试验材料
小鼠骨髓瘤细胞(SP2/0)为本实验室保存、人宫颈癌细胞(HeLa,CRM-CCL-2)、人胚胎肾细胞(HEK 293T/17,CRL-11268)购自美国ATCC。感受态细胞BL21 (DE3) 购自北京全式金公司;ASFVE183L基因由金斯瑞公司优化并合成;引物由上海生工生物工程有限公司合成。pET-30a-His-p54和pCAGGS-Flag-p54为本实验室构建保存。聚偏二氟乙烯膜(PVDF)购自Millipore公司;弗氏完全佐剂、弗氏不完全佐剂、IPTG、HAT/HT培养基、融合剂PEG1450、小鼠抗Flag单抗、FITC标记的山羊抗鼠IgG均购自Sigma公司;小鼠抗His单抗购自中杉金桥公司;灭活ASF标准阳性血清购自中国兽医药品监察所;DAPI染色试剂购自Servicebio;HRP标记山羊抗鼠、猪IgG购自北京鼎国昌盛生物技术有限责任公司;蛋白质Marker购自Thermo Fisher公司;Ni-NTA Agarose购自QIAGEN公司;ProteinIso®Protein G Resin购自北京全式金生物技术有限公司;IgG抗体亚型鉴定试剂盒购自Sino Biological公司。
SPF(Specific Pathogen Free, SPF)级BALB/c小鼠购自郑州大学实验动物中心。
1.2 试验方法
1.2.1 密码子优化 基于NCBI(MK128995.1)中China/2018/AnhuiXCGQ-ASFV毒株E183L基因序列,通过在线软件Racc (http://nihserver.mbi.ucla.edu/RACC)进行大肠杆菌稀有密码子分析,根据原核表达密码子偏嗜性进行优化,基因序列由南京金斯瑞公司合成,并克隆至pET-30a载体。
1.2.2 重组蛋白的诱导表达及可溶性分析 将pET-30a-His-p54转化至大肠杆菌BL21中进行诱导表达,在37 ℃,220 r·min-1条件下的恒温摇床上震荡培养至OD600 nm达到0.6左右时,加入0、0.2、0.4、0.6、0.8、1.0 mmol·L-1的IPTG,再分别置于140 r·min-1条件下37 ℃诱导4 h、15 ℃诱导16 h,确定诱导p54重组蛋白表达的最佳条件。将诱导的菌液富集菌体,在低温条件下进行超声破碎,10 000 r·min-1、4 ℃离心,分别收集上清和沉淀。用SDS-PAGE胶进行电泳后再经考马斯亮蓝染色鉴定其可溶性。
1.2.3 重组蛋白的纯化及Western blot鉴定 最佳诱导条件大量诱导表达p54重组蛋白,参照Ni-NTA Agarose操作技术手册进行纯化,通过SDS-PAGE电泳,考马斯亮蓝染色鉴定蛋白纯度。BCA法测定p54蛋白浓度,定量为1 mg·mL-1后分装保存于-80 ℃备用。纯化后的p54蛋白经Western blot,使用小鼠抗His单克隆抗体(1∶1 000稀释)、ASF标准阳性血清为一抗,HRP标记的山羊抗鼠、猪IgG(1∶5 000稀释)为二抗进行孵育显色,鉴定重组p54蛋白。
1.2.4 免疫小鼠 将p54蛋白按照100 μg·只-1的剂量与弗氏完全佐剂1∶1乳化,背部多点皮下注射6周龄BALB/c雌鼠。2周后,用弗氏不完全佐剂与p54蛋白1∶1乳化,按照100 μg·只-1剂量连续免疫小鼠2次,间隔2周免疫1次。第3次免疫后2~3 d,对免疫小鼠进行尾静脉采血,选取血清抗体效价高的小鼠进行冲击免疫1次。
1.2.5 间接ELISA方法的建立 采用方阵滴定法,将不同浓度(5、2.5、1.25、0.625、0.312、0.156 μg·mL-1)的p54蛋白100 μL·孔-1包被于96孔酶标板,将免疫小鼠血清以不同比例(1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200)稀释作为一抗加入酶标板,未免疫小鼠血清作为阴性对照,37 ℃孵育1 h;将HRP标记山羊抗鼠IgG(1∶5 000)作为二抗加入酶标孔,37 ℃孵育1 h;单组份TMB显色液显色10 min;终止液终止反应;用酶标仪测定各孔OD450nm值。确定ELISA检测方法的抗原最佳包被浓度[17],建立间接ELISA检测方法。
1.2.6 细胞融合及筛选 分离冲击免疫小鼠的脾细胞,与SP2/0细胞10∶1进行融合。用间接ELISA方法筛选分泌抗p54抗体的阳性杂交瘤细胞,对筛选到的阳性杂交瘤细胞通过有限稀释法进行4次亚克隆,获得分泌p54单克隆抗体的细胞株。
1.2.7 单克隆抗体亚型的鉴定 使用Sino Biological小鼠单克隆抗体亚型鉴定试剂盒对p54单克隆抗体进行亚型鉴定。
1.2.8 腹水的制备及纯化 取12周龄BALB/c雌鼠,腹腔注射0.3 mL弗氏不完全佐剂,1周后,取约5×106个处于对数增殖期的6株单克隆细胞分别注入小鼠腹腔。待小鼠腹部明显膨大,抽取腹水并10 000 r·min-1离心10 min收集上清,采用硫酸铵沉淀法对获得的小鼠腹水进行纯化。
1.2.9 Western blot检测 以pCAGGS-Flag-p54转染HEK 293T/17细胞,24 h后,收取蛋白样品,进行SDS-PAGE电泳,湿转至PVDF膜,5%脱脂奶室温封闭1 h; p54单克隆抗体(1∶1 000稀释)为一抗,4 ℃孵育12 h;HRP标记的山羊抗鼠IgG(1∶5 000稀释)为二抗室温孵育1 h,显色并分析试验结果。
1.2.10 间接免疫荧光(IFA)检测 以pCAGGS-Flag-p54转染HeLa细胞,24 h后弃上清,用预冷的4%多聚甲醛于室温固定细胞20 min,0.1%Triton-X 100通透10 min;使用含10%胎牛血清的PBS于室温封闭1 h; p54单克隆抗体(1∶1 000)为一抗室温孵育1 h;FITC标记的山羊抗鼠IgG(1∶1 000)为二抗室温避光孵育1 h;DAPI避光染色10 min;PBS、ddH2O分别洗3次后加入封片剂封片,避光晾干;置于共聚焦显微镜下观察。
1.2.11 单克隆抗体效价测定 以每孔1.25 μg·mL-1p54蛋白包被于96孔酶标板,采用间接ELISA法测定单克隆抗体效价,将6株单克隆抗体分别进行倍比稀释,作为一抗进行孵育[18]。酶标仪测定各孔OD450nm值,阴性对照OD450 nm<0.2时试验成立,待检抗体OD450 nm/阴性对照OD450 nm(S/N)≥2.1的最大稀释倍数作为抗体效价。
1.2.12 交叉反应性试验 将p54重组蛋白、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)、猪细小病毒(PPV)、猪急性腹泻综合征冠状病毒(SADS-CoV)、猪圆环病毒2型(PCV2)1.25 μg·mL-1包被酶标板,以ASFV阴性血清、ASFV阳性血清作为对照,间接ELISA法对p54单克隆抗体进行交叉反应性检测[19]。
1.2.13 抗原表位鉴定 利用NetSurfP Ver.1.1 (http://gps.biocuckoo.cn/online_full.php) 预测p54蛋白的二级结构,将p54蛋白进行逐步截短并克隆至pGEX-4T-3载体中,分别命名为Δ1、Δ2、Δ3、Δ4。以制备的单克隆抗体(1∶1 000)作为一抗,通过Western blot鉴定p54单克隆抗体所识别的抗原表位区域[20-22]。
1.2.14 ASFV p54蛋白三级结构预测 使用I-TASSER (https://zhanggroup.org/I-TASSER/) 在线预测ASFV p54蛋白三级结构[23],在PyMOL软件中标注出p54单克隆抗体所识别抗原表位区域。
2 结 果
2.1 原核密码子优化
对优化后合成的E183L基因序列进行测序,与原始序列比对发现碱基序列发生改变(以红色字体表示),但氨基酸未改变(图1)。

A. “Optimized”为E183L密码子优化后序列,“Original”为E183L原始序列,优化的碱基标为红色;B. “Optimized”为密码子优化后p54蛋白的氨基酸序列,“Original”为原始p54蛋白氨基酸序列A. ‘Optimized’ refers to the optimized E183L gene sequence, ‘Original’ refers to the original E183L gene sequence, and the optimized bases are marked in red color;B. ‘Optimized’ refers to the p54 protein amino acid sequence encoded by optimized codon, and ‘Original’ refers to the p54 protein amino acid sequence encoded by original codon图1 E183L基因优化后序列比对Fig.1 Sequence alignment after E183L gene optimization
2.2 重组蛋白的诱导表达及可溶性分析
采用不同浓度IPTG和温度诱导p54蛋白表达,经SDS-PAGE电泳分析,结果显示19.9 ku的目的蛋白,IPTG浓度为0.6~0.8 mmol·L-1,温度为37 ℃,4 h诱导效果最佳;p54蛋白大部分以可溶性的形式存在于上清液中(图2)。
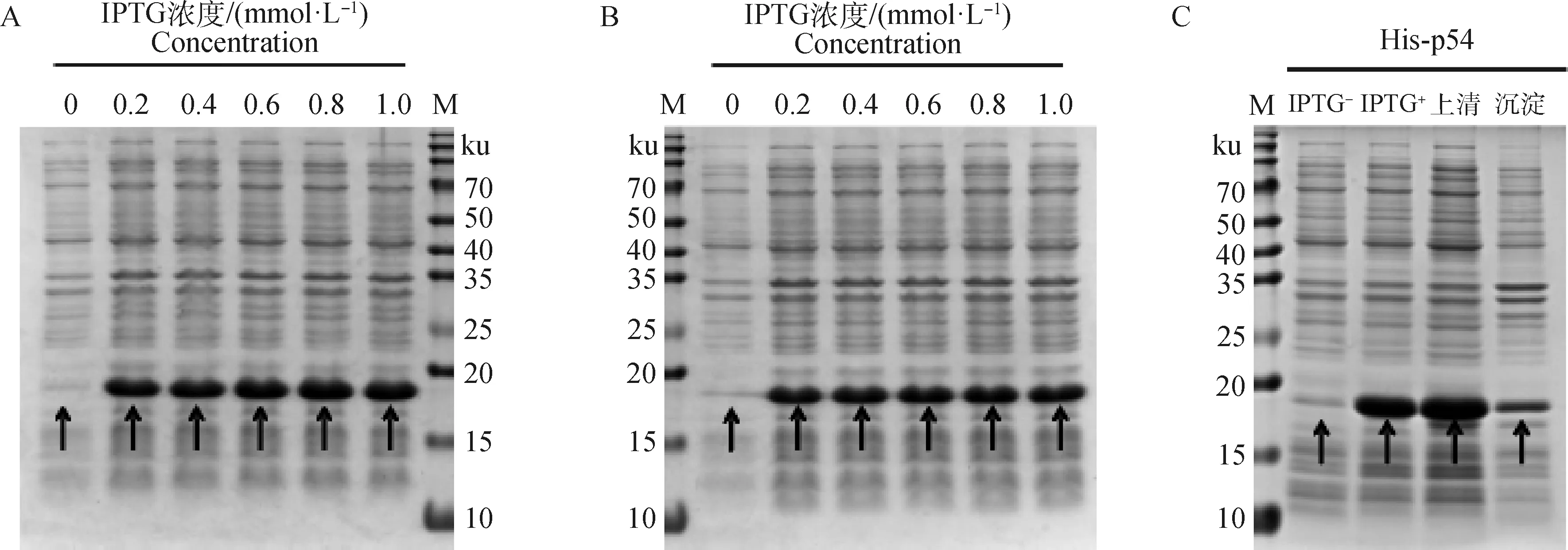
A. 37 ℃诱导4 h重组蛋白表达情况;B. 15 ℃诱导16 h重组蛋白表达情况;C. 重组蛋白的可溶性分析;M. PageRuler预染蛋白相对分子质量标准A. Expression of recombinant protein induced at 37 ℃ for 4 h; B. Expression of recombinant protein induced at 15 ℃ for 16 h; C. Solubility analysis of recombinant protein; M. PageRuler prestaining protein marker图2 重组蛋白的诱导表达及可溶性分析Fig.2 Induced expression and solubility analysis of recombinant protein
2.3 重组蛋白的纯化及Western blot鉴定
使用Ni-NTA Agarose纯化重组p54蛋白,以不同浓度的咪唑进行洗脱,收集每步骤洗脱液进行SDS-PAGE电泳分析,得到高纯度的p54蛋白,浓度为1 mg·mL-1,并进行Western blot鉴定。结果显示p54重组蛋白的最佳咪唑洗脱缓冲液浓度为100 mmol·L-1;纯化的His-p54重组蛋白能与His单克隆抗体、ASF标准阳性血清特异性结合,蛋白大小为19.9 ku(图3)。
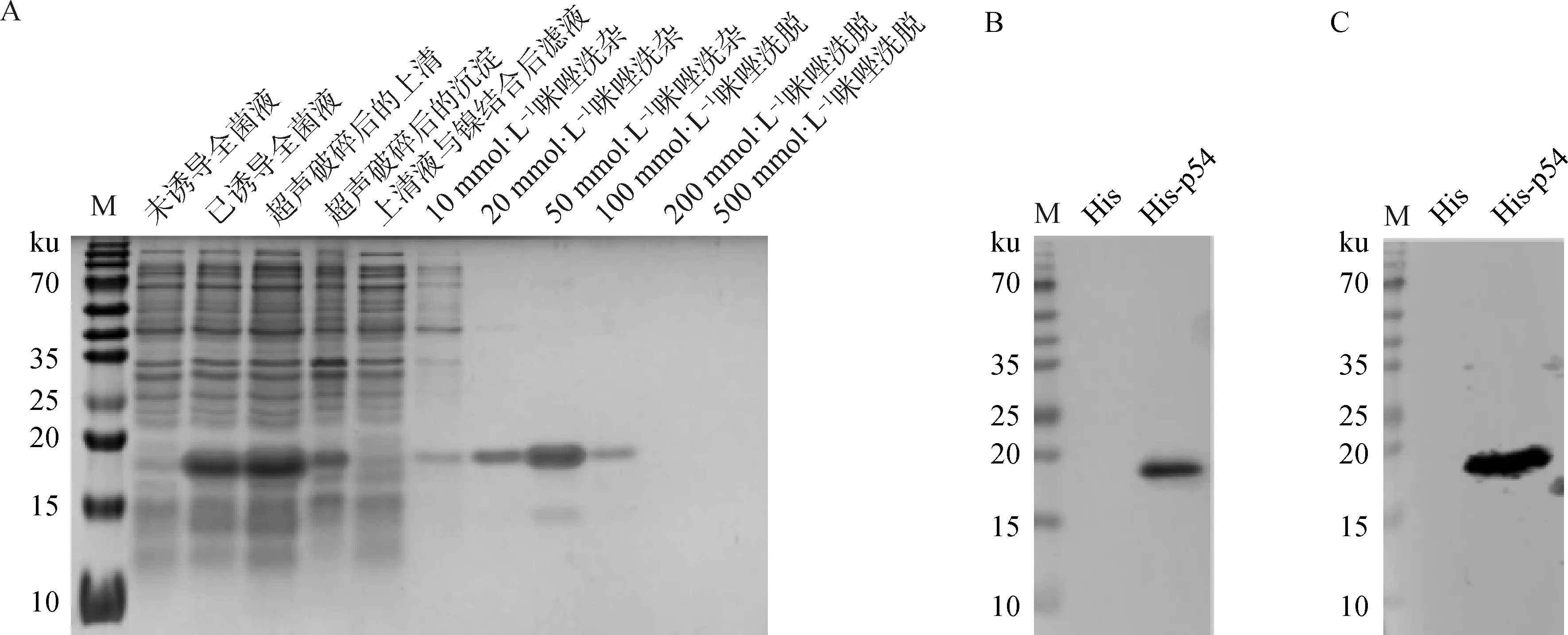
A.重组蛋白His-p54纯化结果;B. His单克隆抗体;C. ASF标准阳性血清;M. PageRuler预染蛋白相对分子质量标准A. The purification results of recombinant His-p54 protein;B. His monoclonal antibody;C. ASF standard positive serum;M. PageRuler prestaining protein marker图3 蛋白纯化及鉴定结果Fig.3 Protein purification and identification results
2.4 抗原最佳包被含量的确定
以阳性血清OD450 nm接近于1、阴性血清OD450 nm<0.2、阳性血清OD450 nm/阴性血清OD450 nm(P/N)最大值组合的p54包被含量为最佳。结果显示当抗原浓度为1.25 μg·mL-1,血清稀释度为1∶1 600时,血清OD450 nm为1.020,阴性对照OD450 nm为0.091,抗体OD450 nm/阴性对照OD450 nm(P/N)为11.147,该组合为最佳,即抗原最佳包被浓度为1.250 μg·mL-1(表1)。
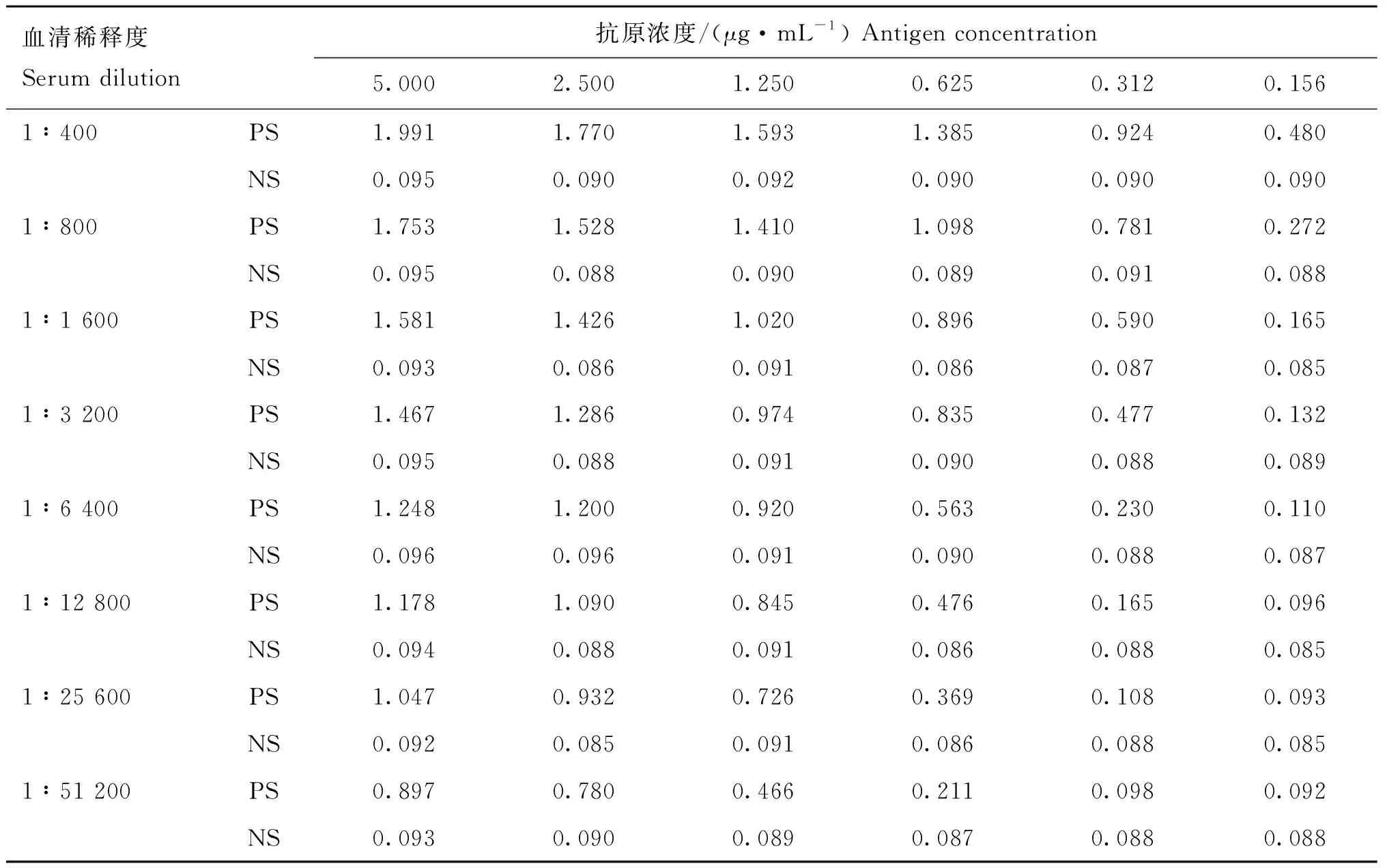
表1 ASFV p54蛋白最佳包被浓度Table 1 The optimal coating concentration of ASFV p54 protein
2.5 单克隆抗体亚型的鉴定
p54单克隆抗体28G12-1、31G7-1、31G7-2重链均为IgG2a型,35F10-1、35F10-2、38D3-1重链均为IgG1型;轻链均为κ链。
2.6 Western blot检测
经Western blot检测结果显示pCAGGS-Flag-p54成功表达,获得的6株p54单克隆抗体均能与p54蛋白发生特异性反应,蛋白大小约为25 ku(图4)。
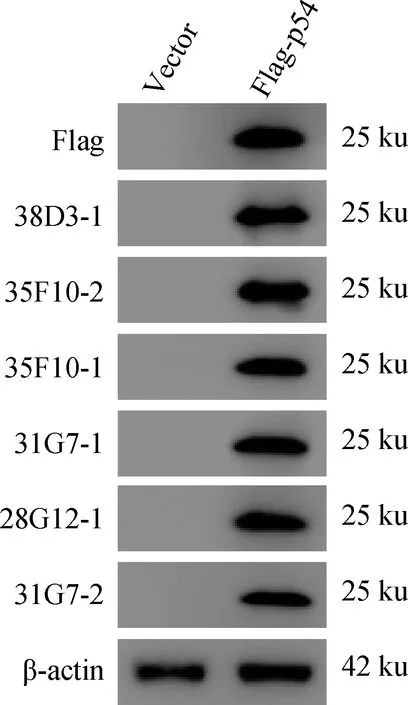
Vector. pCAGGS-Flag真核表达空载蛋白;Flag-p54. pCAGGS-Flag-p54真核表达p54蛋白Vector. pCAGGS-Flag eukaryotic expression of empty carrier protein;Flag-p54. pCAGGS-Flag-p54 eukaryotic expression of p54 protein图4 Western blot鉴定p54单克隆抗体的特异性Fig.4 Western blot analysis of the specificity of monoclonal antibodies of p54 protein
2.7 间接免疫荧光(IFA)检测
经IFA检测,共聚焦显微镜结果显示pCAGGS-Flag-p54成功表达,6株单克隆抗体均能与p54蛋白发生特异性反应,在显微镜下可见绿色荧光,定位于细胞质中(图5)。

图5 IFA鉴定p54单克隆抗体的特异性Fig.5 IFA analysis of the specificity of monoclonal antibodies against p54
2.8 单克隆抗体效价测定
经间接ELISA检测p54单克隆抗体效价,结果显示28G12-1、31G7-1、31G7-2单克隆抗体进行1∶409 600稀释时仍为阳性,35F10-1、35F10-2、38D3-1单克隆抗体的效价分别达到1∶102 400、1∶51 200、1∶25 600(图6)。
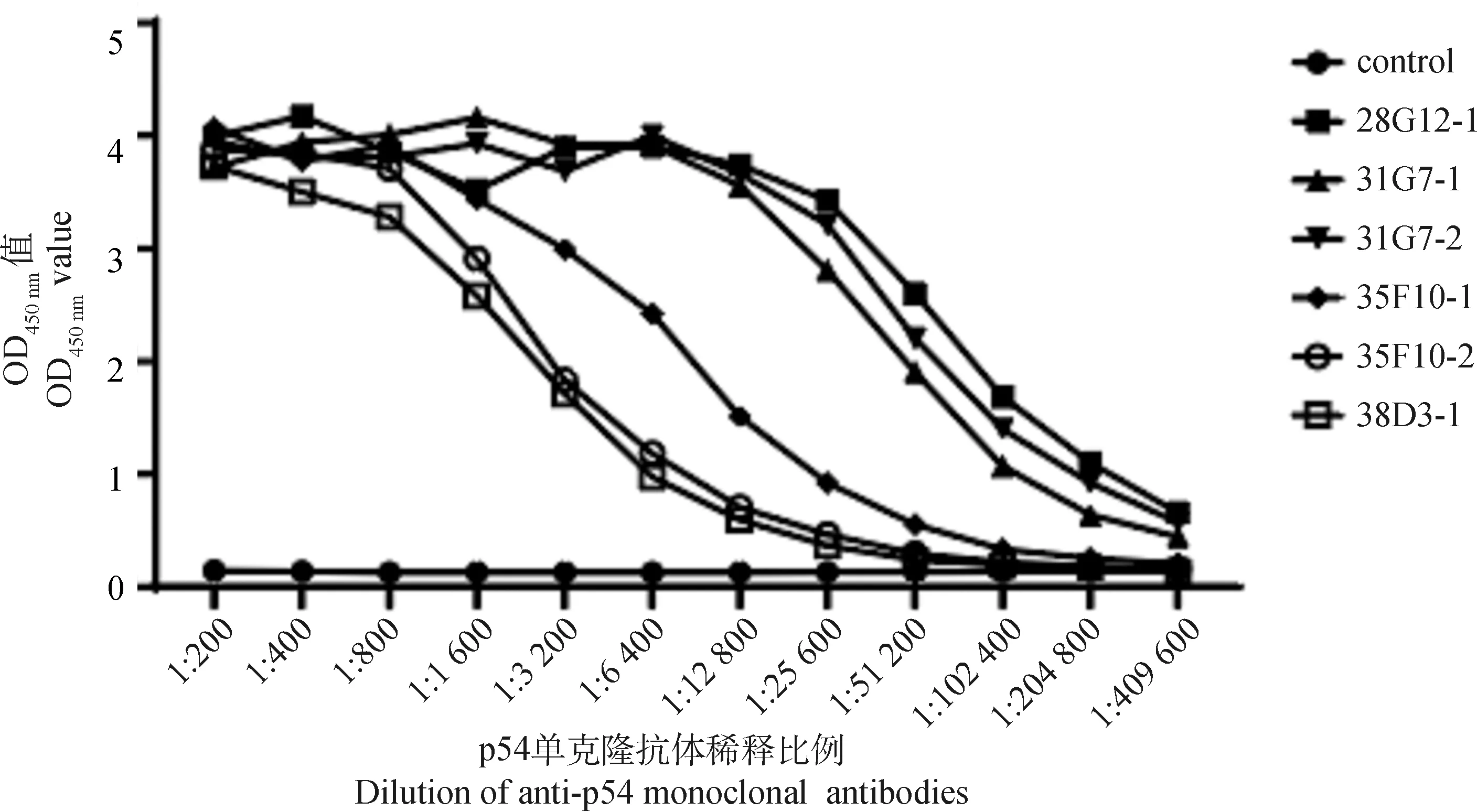
图6 ASFV p54单克隆抗体效价Fig.6 Titer of monoclonal antibodies against ASFV p54
2.9 交叉反应性试验

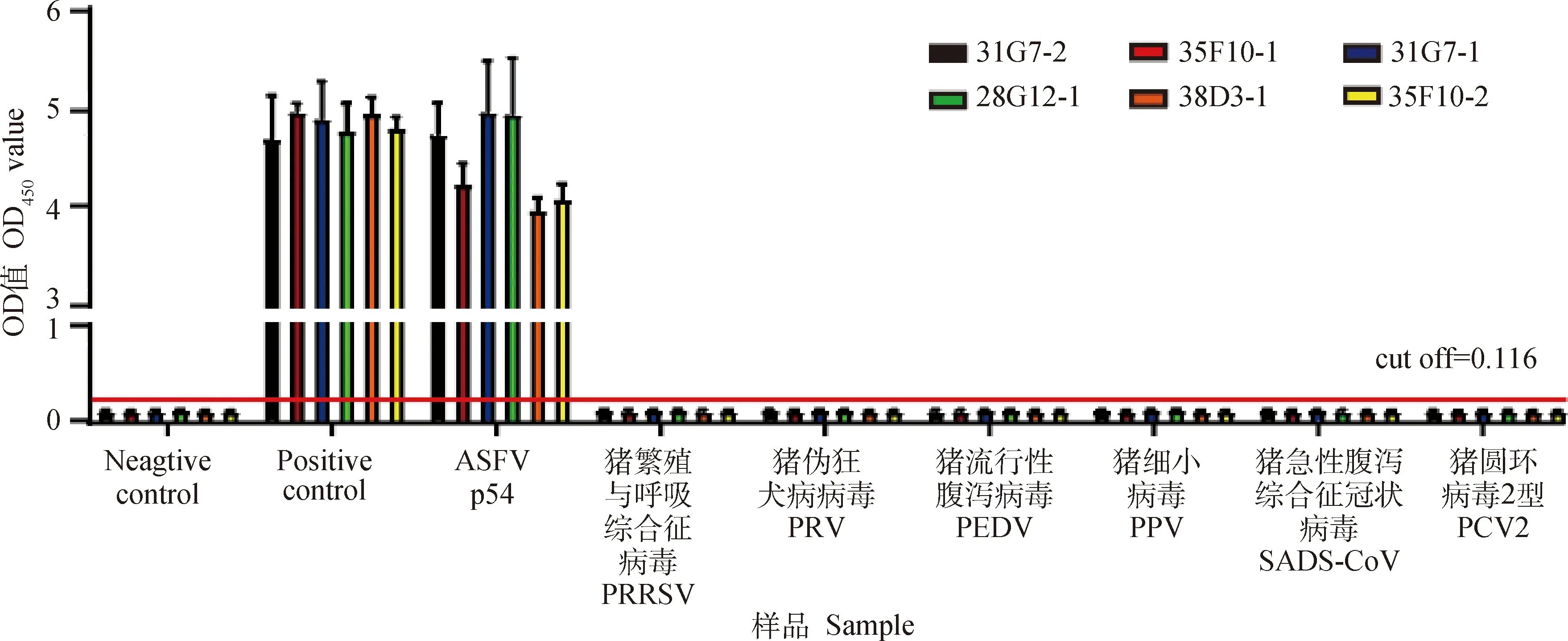
图7 ASFV p54单克隆抗体交叉反应性试验Fig.7 Cross reaction assay of monoclonal antibodies against ASFV p54
2.10 抗原表位鉴定
ASFV p54蛋白二级结构由无规卷曲、α螺旋、β折叠构成(图8);对p54肽段进行截短,保证每段α螺旋、β折叠的完整,进一步Western blot分析,结果显示肽段53—184 aa、53—126 aa、108—184 aa、127—163 aa、147—184 aa表达成功,6株单克隆抗体可识别p54蛋白C端肽段Δ3(127—163aa),不识别Δ4(147—184 aa),故抗原表位区域为127—146 aa,氨基酸序列为“VMATGGPAAAPAAASAPAHP”(图9)。
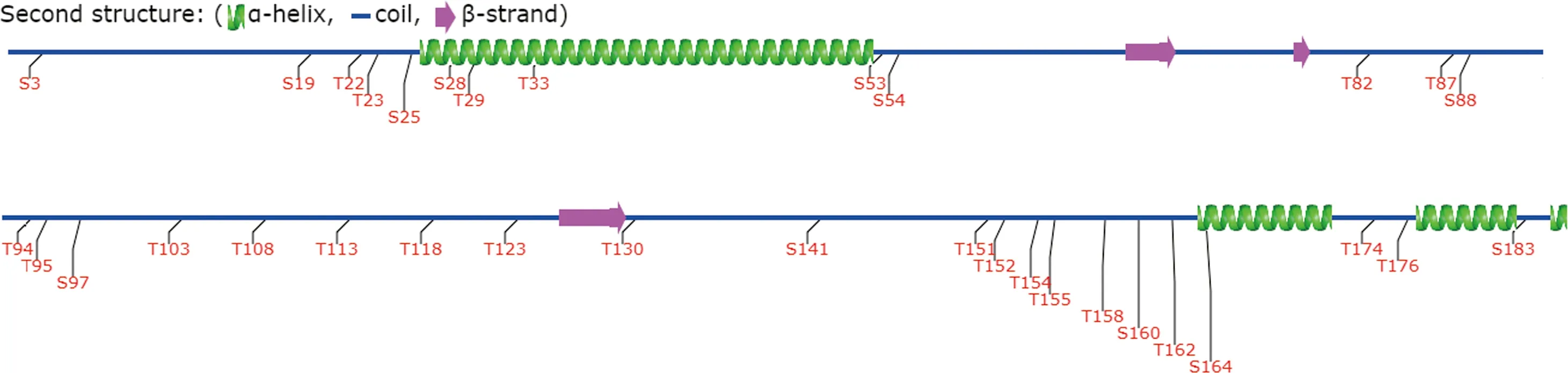
图8 ASFV p54蛋白二级结构预测Fig.8 Secondary structure prediction of ASFV p54 protein

A. ASFV p54蛋白截短示意图;B. p54蛋白抗原表位鉴定A. Truncation schematic diagram of ASFV p54 protein; B. Identification of p54 protein epitopes图9 ASFV p54蛋白抗原表位鉴定Fig.9 Epitopes identification of ASFV p54 protein
2.11 p54三级结构
在p54蛋白三级结构可视化的基础上,标注出p54单克隆抗体识别抗原表位区域127—146 aa(图10,以红色区域表示)。

图10 ASFV p54蛋白的三级结构Fig.10 Tertiary structure of ASFV p54 protein
3 讨 论
ASFV是一种使家猪和野猪高度致命的病毒,自2007年传入高加索地区以来,继续在东欧和俄罗斯传播,目前蔓延至西欧、中国和东南亚等多个国家和地区,对全球养猪业构成了严重的威胁[23-24]。针对非洲猪瘟的各种疫苗策略已经进行了研究,早期侧重于以抗原为基础的方法,旨在诱导中和血清学反应,以CD2v为抗原不能引起机体足够的免疫保护,此后,许多亚单位疫苗的方法都集中在p54和p30,数据结果显示p54和p30同时免疫机体可延缓ASF临床症状,因此深入对ASFV蛋白质组和单个蛋白质功能的研究,对合理设计靶向疫苗方法具有重要意义[25-27]。
早期准确诊断ASFV具有重要的价值,目前检测的方法大部分是以p72、p30等作为检测对象,经研究发现p54蛋白也可以作为诊断抗原用于ASFV感染中期或者后期的血清学诊断。因此本研究通过原核表达系统,建立了获得可溶性p54蛋白的体系,且蛋白纯度高,经ASFV标准阳性血清鉴定,具有良好的反应原性,可用于间接ELISA来检测ASFV的感染,对p54蛋白结晶的解析也具有潜在的研究价值[28]。进一步利用p54蛋白免疫小鼠,制备了高特异性的p54单克隆抗体,可用应用于阻断ELISA方法的建立,为血清学检测方法的进一步发展提供了材料[29-33]。
p54是位于病毒粒子内膜的II型跨膜蛋白,其C端具有多个糖基化和磷酸化位点,有动力蛋白结合域(DBD),以往对p54抗原区域的研究仅限于DBD 中149—161 aa之间的一个线性表位[34]。现已有研究证明p54蛋白的抗原表位区域还有:23—29 aa、36—45 aa、65—75 aa、72—94 aa、93—113 aa、114—120 aa、118—127 aa、137—150 aa、175—185 aa[35-36]。表位是决定病毒结构蛋白抗原性和诱导体液免疫反应的关键因素,表位的研究有助于提高检测试剂的检测效率及亚单位疫苗的研发,本研究鉴定出一个新的p54蛋白抗原表位区域127—146 aa,有望为改进ASFV检测、监测和疾病控制提供有价值的新靶点,在ASFV疫情监测和控制中具有潜在的应用价值[37-39],也为针对p54的表位疫苗的研制提供了基础。目前已有研究报道ASFV病毒颗粒[8]和p72蛋白的结构解析[40],但是没有关于p54蛋白结构解析的报道,故本研究通过I-TASSER软件在线预测ASFV p54蛋白三级结构,并标注出p54单克隆抗体识别的抗原表位区域,为ASFV p54蛋白结构的可视化提供了帮助。
4 结 论
本研究成功获得p54重组蛋白和6株具有不同亚型的p54单克隆抗体,鉴定出p54抗原表位区域为127—146 aa,为后续p54蛋白在ASFV发病机制中功能的研究奠定了基础,也为ASFV p54多肽疫苗的研发提供了帮助。
