放射性核素氯化锶联合唑来膦酸应用于乳腺癌骨转移患者中的效果
2023-02-02武健
武 健
乳腺癌作为一种女性常见的恶性肿瘤,随着疾病发展,散播的乳腺癌细胞通过上皮—间质转化过程脱离原始肿瘤病灶,随着血流及淋巴系统的循环,达到机体的任何部位,其中由于骨髓基质分泌细胞因子会吸引乳腺癌细胞,使其转移至骨骼,进而引发持续的恶性循环[1]。相关报道统计,65%~75%的晚期乳腺癌患者会发生骨转移,患者常出现疼痛、病理性骨折等症状,同时是导致乳腺癌患者死亡的主要原因之一[2],因此有效的防治措施对于提高患者生存率具有重要意义。唑来膦酸能特异性地作用于骨骼结构,防止骨骼被破坏,进而减轻因骨骼破坏导致的疼痛,是癌细胞骨转移患者的常用辅助药。而放射性核素氯化锶能够通过发射平均能量为1.463 MeV的β射线,利用其辐射效应杀死癌细胞,达到缩小病灶的作用,但在临床实际应用时部分患者易发生骨髓抑制,同时受剂量影响,单独治疗时的疗效并不理想,需要联合其他药物治疗[3]。基于此,本研究就放射性核素氯化锶联合唑来膦酸应用于乳腺癌骨转移中的效果进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2018年2月至2022年2月山东颐养健康集团淄博医院收治的70例乳腺癌骨转移患者作为研究对象,按治疗方式不同分为观察组与对照组,各35例。观察组年龄28~59岁,平均(40.16±2.55)岁,病程7个月至2年,平均(1.08±0.61)年,体重指数(BMI)为17.03~24.15 kg/m2,平均(22.57±0.66)kg/m2;对照组年龄26~58岁,平均(39.77±2.13)岁,病程6个月至2年,平均(0.91±0.53)年,BMI为17.00~24.62 kg/m2,平均(22.73±0.59)kg/m2。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
纳入标准:1)符合《乳腺癌骨转移临床诊疗专家共识》[4]中乳腺癌诊断标准,经影像学及病理学检查确诊为骨转移;2)预计生存期长于3个月;3)相关放疗及化疗终止4周以上;4)签署了知情同意书。排除标准:1)在此前的放疗及化疗中已出现严重的骨髓抑制;2)对本研究使用药物过敏;3)简易智力状态检查量表(MMSE)评分<20分;4)其他癌症导致的骨转移;5)病例资料缺失或中途退出研究。
1.2 治疗方法
对照组将0.9%氯化钠溶液100 ml与4 ml唑来膦酸(山东新时代药业有限公司,国药准字H20041979)充分混合后,以静脉滴注方式给药,每次滴注时长不得短于15 min,每3周1次。试验组在对照组基础上静脉注射放射性核素氯化锶注射液(成都中核高通同位素股份有限公司,国药准字H20080472),2.5~4.0 mCi/次,每3周1次,在使用放射性核素氯化锶治疗完成的2周后进行唑来膦酸治疗。两组患者均治疗6周,并接受为期3个月、每月1次的门诊随访。
1.3 观察指标
1.3.1 疼痛情况于治疗前后以及第1次随访时使用数字评分法(numeric rating scale, NRS)对患者的疼痛情况进行评估,用0~10的数字来表示疼痛程度,0代表无痛,10代表剧痛,由患者本人选出最能代表自己疼痛程度的数字。
1.3.2 实验室指标于治疗前后以及第1次随访时采集外周静脉血5 ml,经离心分离出上清液样本后采用全自动免疫分析仪运用化学发光免疫分析法对患者癌胚抗原(CEA)、糖类抗原125(CA125)、骨吸收指标Ⅰ型胶原羧基端肽β特殊序列(β-CTX)以及骨形成标志物总Ⅰ型胶原氨基端延长肽(TPINP)水平进行检测。
1.3.3 不良反应发生情况在治疗结束后整理统计两组患者不良反应发生情况,包括发热、呕吐以及低血钙症。
1.4 统计学分析
2 结果
2.1 NRS评分
治疗前,两组患者NRS评分比较差异无统计学意义(P>0.05);治疗后及第1次随访时,两组NRS评分降低,且试验组NRS评分低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者NRS评分比较(分,±s)

表1 两组患者NRS评分比较(分,±s)
组别 例数 治疗前 治疗后 第1次随访对照组35 7.52±1.146.05±0.79 4.53±0.61试验组35 7.71±1.025.58±0.81 3.86±0.52 t值 0.735 2.457 4.945 P值 0.465 0.017 <0.001
2.2 实验室指标
治疗前,两组患者CEA、CA125、β-CTX以及TPINP水平比较差异无统计学意义(P>0.05);治疗后及第1次随访时,两组CEA、CA125、β-CTX以及TPINP水平降低,且试验组CEA、CA125、β-CTX以及TPINP水平低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者实验室指标比较(±s)

表2 两组患者实验室指标比较(±s)
组别 例数CEA(ng/ml) CA125(IU/ml)治疗前 治疗后 第1次随访 治疗前 治疗后 第1次随访对照组 35 63.09±8.07 45.81±4.67 37.16±3.48 66.34±8.71 54.62±6.28 47.28±4.27试验组 35 62.35±8.16 43.26±4.33 32.06±3.11 67.26±8.94 51.39±6.74 40.58±4.62 t值 0.381 2.369 6.645 0.436 2.074 6.301 P值 0.704 0.021 <0.001 0.664 0.042 <0.001 β-CTX(ng/L) TPINP(mg/L)组别 例数治疗前 治疗后 第1次随访 治疗前 治疗后 第1次随访对照组 35 0.57±0.12 0.34±0.04 0.21±0.03 61.54±6.64 42.02±3.27 28.16±2.19试验组 35 0.59±0.09 0.31±0.05 0.17±0.02 62.35±6.38 40.15±3.55 25.31±2.83 t值 0.789 2.772 6.563 0.520 2.292 4.712 P值 0.433 0.010 <0.001 0.605 0.025 <0.001
2.3 不良反应发生率
试验组不良反应发生率与对照组比较差异无统计学意义(P>0.05)。见表3。
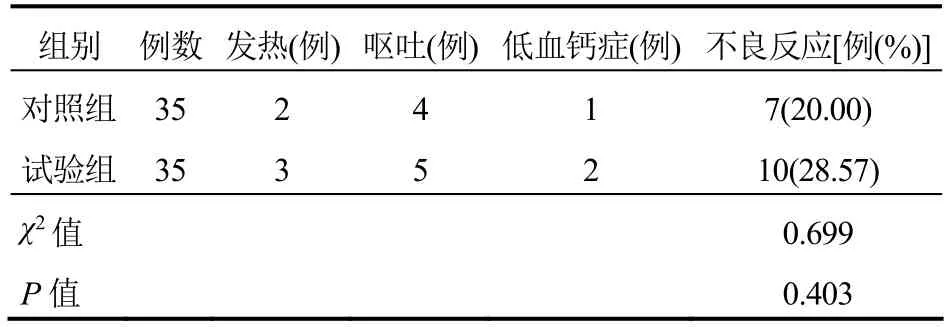
表3 两组患者不良反应发生率比较
3 讨论
在乳腺癌的骨转移中,肿瘤细胞所产生的因子直接或间接地作用于破骨细胞,使其聚集于肿瘤细胞周围并被激活进而出现一系列的症状,以骨盆、肋骨等中轴骨的转移为主[5]。疼痛作为乳腺癌骨转移患者的主要症状,可严重影响患者的日常生活,目前临床认为该症状的发生是由于骨细胞被破坏、炎症因子分泌、癌细胞不断增殖以及发生转移后局部酸化导致的,在治疗时可以此作为依据实施对症治疗[6]。
放射性核素氯化锶在进入机体后其发射的射线能够集中照射病变组织,产生电离辐射生物效应,抑制和杀灭肿瘤细胞,进而达到缓解骨痛,抑制骨转移灶出现的作用。目前,临床多数学者认为其止痛的机制可能是由于该药物中的89Sr能够使瘤体缩小,进而减轻了受累骨膜和骨髓腔的压力,同时所具有的辐射生物效应可干扰神经末梢去极化的过程,一定程度阻断了疼痛信号在神经中的传导,且可抑制缓激肽、前列腺等炎症因子的分泌[7]。唑来膦酸作为第三代双膦酸盐,其活性相较于一代双膦酸盐,达到了显著的提升,因其与骨之间高度的亲和力,因此在进入机体后能够优先到达骨代谢活跃部位,被破骨细胞摄取,抑制破骨细胞的成熟以及成熟后破骨细胞对骨小梁的溶解,同时能够对破骨细胞在骨质吸收部位的聚集、活化以及增殖产生抑制作用,进而达到减轻骨损伤,缓解疼痛的目的[8]。同时其能够对骨基质生长因子的释放产生抑制作用,使CEA降低,再通过对骨吸收的抑制,减少在癌细胞骨转移过程中对新骨形成产生刺激作用的内皮素受体A,进而使能够反映成骨细胞活性、骨形成状态及骨吸收水平的β-CTx、TPINP被降低,最终达到减缓癌细胞骨转移的目的。同时本研究结果表明采用放射性核素氯化锶联合唑来膦酸治疗,不会增加患者的不良反应发生率,安全性较高。
综上所述,在对乳腺癌骨转移患者进行治疗时采用放射性核素氯化锶联合唑来膦酸治疗方案,可有效缓解疼痛,降低肿瘤标志物水平,延缓癌细胞转移,改善病情。
