岩藻聚糖硫酸酯抗炎、抗氧化及其交互作用研究进展
2023-02-02张琳依贾哲宇任丹丹何云海汪秋宽
张琳依,夏 青,刘 岩,贾哲宇,柯 悦,程 晶,任丹丹,何云海,汪秋宽
( 1.大连海洋大学 食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,国家海藻加工技术研发分中心,辽宁 大连 116023; 2.辽宁惠康检测评价技术有限公司,辽宁 沈阳 110000 )
岩藻聚糖硫酸酯是一种主要存在于褐藻和海洋无脊椎动物中的天然活性成分。岩藻聚糖硫酸酯结构中含有L-岩藻糖和硫酸基团,是一种具有多种生物活性的酸性杂多糖,已有研究表明,其具有抗氧化、减轻炎症反应、抑制肿瘤细胞生长、预防心脑血管疾病和肾功能衰竭等生物活性[1]。因其源于天然原料,来源丰富,并且安全无毒副作用,近年来人们对岩藻聚糖硫酸酯的活性研究越来越关注。机体内的炎症反应与氧化过程是常见的生理反应,二者在疾病的产生和发展中至关重要,并且已有研究认为,炎症反应与氧化应激反应之间存在互相影响与关联[2]。笔者对岩藻聚糖硫酸酯的抗氧化活性、抗炎活性以及交互作用的研究进行综述,以期为今后进一步深入研究岩藻聚糖硫酸酯的活性功能及作用机制提供理论参考。
1 岩藻聚糖硫酸酯的抗炎活性
炎症是机体对于刺激的一种常见的抗病反应,在炎症反应过程中,机体常有红、热、肿、痛等生理学反应,同时常伴随白细胞增多的全身性反应[3]。研究表明,岩藻聚糖硫酸酯对机体的多种炎症有改善作用,如岩藻聚糖硫酸酯对特应性皮炎有潜在疗效[4]、海参岩藻聚糖硫酸酯可以减轻肥胖小鼠肝脏中的炎症[5]、含有姜黄素的壳聚糖或岩藻聚糖硫酸酯纳米载体可以抑制脑部炎症[6]、岩藻聚糖硫酸酯对骨关节炎有很强的药理效果[7]、低分子量的岩藻聚糖硫酸酯保护糖尿病肾病大鼠的肾功能并减轻炎症[8]、海藻酸钠或明胶多孔支架与岩藻聚糖硫酸酯合并可以显著减轻小鼠的神经炎[9]、岩藻聚糖硫酸酯还可以减轻抗肿瘤药物异环磷酰胺副作用带来的出血性膀胱炎[10]等。其抗炎的作用机理主要涉及抑制炎症因子的产生、干扰炎症反应的信号通路、影响炎症基因的表达及影响白细胞迁移等方面。
1.1 岩藻聚糖硫酸酯调节炎症相关因子产生
炎症因子主要是指参与炎症反应时产生的各种细胞因子。在发热状态时常见的炎症因子有白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子-α(TNF-α)等;疼痛反应时常产生的炎症因子有P物质、前列腺素E2(PGE2)、缓激肽等;会造成血管通透性升高的炎症因子有过敏毒素C3a、过敏毒素C5a、组织胺、缓激肽等;常见的造成组织损伤的炎症因子有溶酶体酶、一氧化氮等。大量研究表明,岩藻聚糖硫酸酯可以通过调节炎症相关细胞因子的产生发挥其抗炎作用。岩藻聚糖硫酸酯可以有效调节细胞中各炎症因子的水平。岩藻聚糖硫酸酯可以以剂量依赖性方式下调RAW 264.7巨噬细胞中的肿瘤坏死因子-α、白细胞介素1β和白细胞介素6[11]。Kim等[12]发现,自墨角藻(Fucusvesiculosus)中提取的褐藻多糖硫酸酯能增加白细胞介素12(IL-12)的产量。张祺等[13]认为,海参岩藻聚糖硫酸酯能够激活巨噬细胞,调节其分泌一氧化氮、白细胞介素6、白细胞介素10等细胞因子,从而发挥免疫调节作用。岩藻聚糖硫酸酯在动物体内也能发挥调节免疫因子及抗炎因子的能力。罗娟梅等[14]研究发现,海带(Laminariajaponica)岩藻聚糖硫酸酯可以显著调节小肠和盲肠中肿瘤坏死因子-α、γ干扰素(IFN-γ)和白细胞介素6等免疫因子水平。海地瓜岩藻聚糖硫酸酯能有效抑制小鼠血清白细胞介素6、肿瘤坏死因子-α、白细胞介素1β、C-反应蛋白(CRP)和巨噬细胞炎症蛋白1(MIP-1)含量[15]。在脂多糖诱导的斑马鱼(Daniorerio)胚胎炎症模型中,岩藻聚糖硫酸酯的处理会使肿瘤坏死因子-α、白细胞介素6和白细胞介素1β产生量减少[16]。除此之外,岩藻聚糖硫酸酯还能显著降低人体内各促炎因子的水平。Takahashi等[17]发现,在摄入岩藻聚糖硫酸酯2周后20名癌症晚期志愿者体内主要的促炎因子白细胞介素1β、白细胞介素6、肿瘤坏死因子-α均显著降低。
1.2 岩藻聚糖硫酸酯抑制炎症反应的信号通路以及基因的表达
机体细胞间多种生物学功能来源于细胞间的信号传导,炎症反应中常见的信号通路有Janus激酶/信号传导与转录激活子(JAK/STAT)信号通路、核因子-κB(NF-κB)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、蛋白激酶B(AKT)信号通路等。岩藻聚糖硫酸酯可以通过调节以上4种通路从而实现对炎症因子以及炎症相关酶的基因调节(图1)。
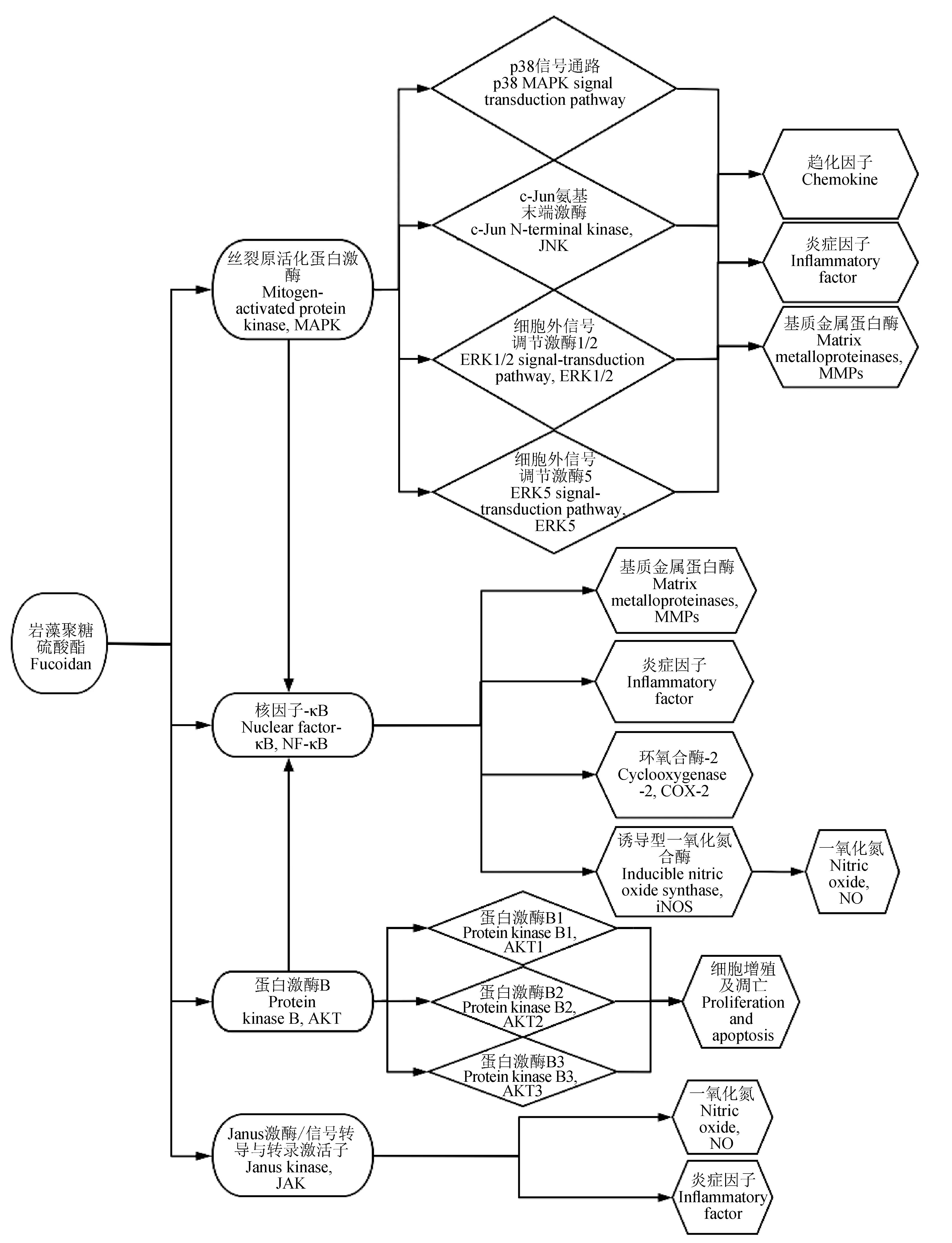
图1 岩藻聚糖硫酸酯对炎症通路以及相关基因的表达示意
1.2.1 MAPK信号通路
MAPK信号通路可以对细胞增殖、分化、转化、凋亡过程产生调节作用,是与炎症、肿瘤等疾病密切相关的通路。MAPK可分为4个亚族,他们分别是细胞外信号调节激酶1/2(ERK1/2)、p38丝裂原活化蛋白激酶、c-Jun氨基末端激酶(JNK)和细胞外信号调节激酶5(ERK5)[18]。ERK1与ERK2途径在ERK家族中被研究得较为深入,因此目前岩藻聚糖硫酸酯对ERK影响的研究大多集中于ERK1/2途径,而对ERK5研究较少。Ye等[19]发现,岩藻聚糖硫酸酯可以显著抑制脂多糖诱导的ERK1/2、JNK和p38的高磷酸化水平,岩藻聚糖硫酸酯可能通过抑制MAPKs炎症信号通路介导抗炎作用。Che等[20]也认为,岩藻聚糖硫酸酯可以以剂量无关的方式显著降低p38、ERK和JNK的磷酸化水平,从而减少白细胞介素1β、肿瘤坏死因子-α、白细胞介素6、髓过氧化物酶(MPO)的产生,因此岩藻聚糖硫酸酯对MAPK信号通路的抑制可能是其减轻脑缺血再灌注损伤造成的炎症反应的原因之一。
MAPK信号通路可以调控激活蛋白-1(AP-1)的磷酸化,活化的AP-1能调控多个细胞因子如白细胞介素-1、肿瘤坏死因子-α、白细胞介素6、白细胞介素8、巨噬细胞炎性蛋白-1α(MIP-1α)、单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶(MMP)等基因的表达。MMP-9是一种关键内肽酶,在炎症性疾病中起着关键作用。MMP-9的上调有助于细胞外基质的降解,还有助于白细胞迁移和炎症因子肿瘤坏死因子-α的释放[21]。岩藻聚糖硫酸酯可以通过调控MAPK通路减少AP-1活化进而抑制MMP-1、-2、-8、-9和-13的表达,达到显著抑制紫外线诱导的皮肤损伤的目的[22]。
1.2.2 NF-κB信号通路
在细胞的炎症反应和免疫应答等过程中,NF-κB通路通常处于关键地位,是最常见的调节炎症反应的通路,也是炎症启动的关键性通路[23]。未受到刺激时,核因子κB抑制蛋白(IκB)与NF-κB结合呈二聚体后存在于细胞质中。IκB激酶β(IKKβ)作为IκB的激酶,当IKKβ被白细胞介素6、游离脂肪酸(FFA)和肿瘤坏死因子-α等炎症因子激活后,IκB发生磷酸化并脱离NF-κB,NF-κB进一步发生表达,从而对炎症因子相关基因的转录和蛋白合成进行调节[24]。目前,NF-κB是岩藻聚糖硫酸酯抗炎机制中研究最多的一条通路。毛磊等[25]发现,梅花参(Thelenotaananas)岩藻聚糖硫酸酯能下调小鼠肝脏IKKβ和NF-κB mRNA的表达量,上调IκB-α mRNA的表达量,提示岩藻聚糖硫酸酯可以通过抑制激活蛋白-1(HMGB-1)和NF-κB来调控大鼠心肌损伤引起的炎症应答[26]。胡世伟等[15]发现,海地瓜(Acaudinamolpadioides)岩藻聚糖硫酸酯组的p-IKKβ蛋白表达量降低了29.6%,NF-κB蛋白表达量降低了52.6%,提示岩藻聚糖硫酸酯可以通过抑制小鼠肝脏组织的IKKβ/NF-κB信号通路来实现对胰岛素抵抗小鼠肝脏炎症反应的改善。Manikandan等[21]发现,岩藻聚糖硫酸酯可以通过调节p65/NF-κB转录因子实现下调白细胞介素1β、环氧合酶-2(COX-2)和基质金属蛋白酶-9基因的表达。目前,岩藻聚糖硫酸酯主要通过调节NF-κB家族中的p65途径来实现其对炎症的调控,而对NF-κB家族中其他途径鲜有研究。
岩藻聚糖硫酸酯可以通过调节NF-κB通路进而影响炎症相关酶的基因表达。环氧合酶(COX)是一种具有环氧合酶和过氧化物酶活性的双功能性膜结合蛋白,存在COX-1和COX-2两种异构体[27]。COX-2与NF-κB信号通路密不可分,它可以参与多种疾病的炎症反应过程,是导致炎症性疾病的重要机制之一[28]。一氧化氮合酶的同功酶有3种亚型,即在正常状态下表达的神经元型一氧化氮合酶(nNOS)和内皮型一氧化氮合酶(eNOS)以及在损伤后诱导表达的诱导型一氧化氮合酶(iNOS)[29-30]。宋泽[31]研究发现,大连厚叶海带(Kjellmaniellacrassifolia)岩藻聚糖硫酸酯能降低COX-2、iNOS、IκB-α、NF-κB mRNA的表达,从而从基因水平上抑制胃黏膜损伤和胃出血。
1.2.3 AKT信号通路
AKT通路可以通过下游多种途径对靶蛋白进行磷酸化而发挥凋亡作用,还可以调节细胞的增殖与凋亡。AKT可以激活IκB激酶IKKα,导致IκB磷酸化,从而使得NF-κB进行核移位进一步发生表达。Park等[32]研究发现,岩藻聚糖硫酸酯可以通过调节AKT通路的激活来达到减少BV2小胶质细胞中脂多糖(LPS)诱导的炎症反应。
1.2.4 JAK信号通路
JAK通路在细胞因子与特定受体结合之后被激活,通过对下游靶蛋白的酪氨酸残基磷酸化,以及将转录因子STAT磷酸化,从而形成二聚体进入细胞核内与靶基因相结合,以此调控下游基因的转录和细胞的增殖、分化等过程。Ye等[19]研究发现,岩藻聚糖硫酸酯可以显著下调脂多糖导致的JAK2和STAT1/3的表达增加,JAK2是STAT1/3的关键激酶,由此表明,岩藻聚糖硫酸酯可能以JAK2为靶点,进一步阻断磷酸化STAT1/3的激活以发挥抗炎作用。Yang等[33]也发现,JAK/STAT信号通路在岩藻聚糖硫酸酯对肿瘤坏死因子-α和干扰素γ刺激的一氧化氮产生的抑制作用中起重要作用。
有研究表明,岩藻聚糖硫酸酯可以通过调节多种信号通路共同发挥其抗炎能力。MAPK可以通过对IKK影响IκB的磷酸化进而影响NF-κB通路的表达[30]。Sanjeewa等[34]认为,纯化的岩藻聚糖硫酸酯通过NF-κB和MAPK信号通路共同抑制RAW 264.7细胞中脂多糖刺激的一氧化氮产生。胡世伟等[35]研究发现,冰岛刺参(Cucumariafrondosa)岩藻聚糖硫酸酯能够阻断胰岛素抵抗小鼠脂肪细胞IKKβ/NF-κB信号通路和JNK1信号通路,下调白细胞介素6基因表达,上调白细胞介素10水平,从而抑制炎症反应。Yin等[36]研究发现:仿刺参(Apostichopusjaponicus)岩藻聚糖硫酸酯可以显著抑制NF-κB p65、p38、ERK1/2的表达,并且肿瘤坏死因子-α的变化与NF-κB p65和p38磷酸化水平的变化一致;而白细胞介素6和白细胞介素1β的减少可能与iNOS和ERK1/2的磷酸化水平变化相关。海参岩藻聚糖硫酸酯可以参与显著降低AKT、糖原合成酶激酶3β(GSK3β)、哺乳动物雷帕霉素靶蛋白(mTOR)的磷酸化,还可以通过下调AKT/mTOR和AKT/GSK3β通路来抑制炎症。因此仿刺参岩藻聚糖硫酸酯的抗炎机制可能与MAPK、NF-κB及AKT通路均有关联。
1.3 岩藻聚糖硫酸酯影响白细胞迁移
选择素是一种跨膜蛋白,在感染过程中以及一些炎症反应发生过程中,选择素因其独特结构使其结合特定配体来介导白细胞和血管壁(以毛细血管后静脉为主)触碰,致使白细胞发生迁移,滚动在血管壁上,最终汇集于炎症反应区域[37]。迄今为止,研究发现的选择素有L-选择素、E-选择素、P-选择素3种类型,它们分别表达于白细胞表面、活化的内皮细胞表面,以及活化的血小板与内皮细胞表面[1]。P-选择素介导内皮细胞和中性粒细胞之间的黏附,是治疗急性炎症相关疾病的重要的靶点[38]。研究发现,硫酸化的多糖和糖脂与选择素具有强亲和力[39]。宋海燕等[40]发现,岩藻聚糖硫酸酯能结合细胞膜上纯化的P-选择素,从而限制P-选择素生理功能,因此可以减少白细胞在组织中的浸润,以达到减轻组织的损伤的结果[41]。Shu等[42]也同样发现,在H2O2刺激诱导的氧化损伤模型中岩藻聚糖硫酸酯和P-选择素之间可以特异性结合。除了P-选择素,李英俊等[43]还发现,岩藻聚糖硫酸酯与L-选择素相关,L-选择素及其内皮细胞配体可以介导白细胞与内皮细胞的初始黏附与滚动。岩藻聚糖硫酸酯处理可以显著抑制肺炎链球菌(Streptococcuspneumoniae)导致的家兔脑脊液中白细胞聚集和血浆蛋白聚集,岩藻聚糖硫酸酯还可以有效减轻家兔肠系膜和股展肌小血管中白细胞的滚动,其原因是源于岩藻聚糖硫酸酯能够阻断L-选择素的功能[1]。目前岩藻聚糖硫酸酯对于选择素的调节能力的研究基本集中在P-选择素方面,对于岩藻聚糖硫酸酯对E-选择素的调控尚不明确。
2 岩藻聚糖硫酸酯的抗氧化活性
岩藻聚糖硫酸酯具有一定的抗氧化活性,其抗氧化活性主要表现在对自由基的清除、调节抗氧化酶活性、修复因自由基攻击而引起的细胞损伤、调控氧化信号通路等4个方面。
2.1 清除自由基能力
自由基主要从损害细胞膜正常结构、导致血清抗蛋白酶失活、诱引细胞变异[44]等方面对人体产生负面影响。岩藻聚糖硫酸酯具有较强的自由基清除能力。刘旭等[45]对泡叶藻(Ascophyllumnodosum)渣和海带渣中提取的岩藻聚糖硫酸酯进行了超氧阴离子清除能力测定、还原力测定和羟自由基清除能力测定,发现从两种海藻渣中提取的岩藻聚糖硫酸酯均具有较好的自由基清除能力。Neri等[46]发现,裙带菜(Undariapinnatifida)岩藻聚糖硫酸酯具有很强的1,1-二苯基-2-三硝基苯肼(DPPH)清除活性。Borazjani等[47]研究发现,水解后的马尾藻(Sargassumangustifolium)岩藻聚糖硫酸酯具有很强的2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除活性,且呈剂量依赖性。
2.2 提高抗氧化酶活性
机体内存在多种抗氧化酶系,如过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶等。岩藻聚糖硫酸酯可以显著提高过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶等酶的活性,从而发挥其抗氧化活性。宋泽[31]发现,大连厚叶海带岩藻聚糖硫酸酯可以提高超氧化物歧化酶和谷胱甘肽过氧化物酶的活性,进而减少胃溃疡损伤。Chale-Dzul等[48]研究发现,热带海藻中的岩藻聚糖硫酸酯可以增加HepG2细胞中谷胱甘肽的水平,并提高其过氧化氢酶的活性,提升细胞内抗氧化水平。
2.3 修复细胞氧化损伤
自由基对细胞的损伤主要表现在细胞膜的磷脂、蛋白质、酶以及DNA细胞成分损伤。岩藻聚糖硫酸酯可以通过修复细胞膜的氧化损伤实现对细胞膜的保护。Kang等[49]发现,岩藻聚糖硫酸酯不仅可以清除细胞在代谢过程中产生的自由基,还能够对因自由基反应引起的细胞损伤进行修复。海带岩藻聚糖硫酸酯对胃黏膜细胞具有减少氧化损伤的保护作用,并能维持胃黏膜细胞的细胞膜完整性[50]。朱昱哲等[51]认为,海参岩藻聚糖硫酸酯可以减轻自由基对肝脏细胞细胞膜上脂质与蛋白的损伤。此外,还有研究表明低分子量的岩藻聚糖硫酸酯可以通过上调Sirt3的表达来减轻线粒体膜的氧化损伤[52]。
2.4 调控氧化信号通路
氧化损伤诱导的细胞凋亡涉及一些信号转导通路的激活和激活过程中相关基因与酶学的改变。已知的氧化通路有Kelch样ECH关联蛋白1-转录因子E2相关因子2/ARE(Keap1-Nrf2/ARE)氧化通路、p38通路[53]、5-脂氧化酶通路[54]、一氧化氮-环磷鸟苷-依赖蛋白激酶信号通路[55]等。目前,岩藻聚糖硫酸酯的氧化信号通路主要集中在转录因子E2相关因子2(Nrf2)通路的研究。Zhu等[56]发现,岩藻聚糖硫酸酯可显著调节Nrf2通路的表达,进而减少活性氧、丙二醛的产生,提高超氧化物歧化酶活性。Fernando等[57]研究提示,马尾藻岩藻聚糖硫酸酯可以通过增加Nrf2介导的血红素氧合酶1(HO-1)生成来增强细胞抗氧化防御,从而减少紫外线B(UVB)对皮肤最外层造成氧化损伤。杜娟娟等[58]也发现,昆布岩藻聚糖硫酸酯能通过Nrf2信号通路对心肌缺血再灌注模型大鼠的心肌氧化损伤起到保护作用。但是岩藻聚糖硫酸酯对其他氧化通路的作用还有待研究。
3 炎症反应与氧化应激的交互作用
3.1 氧化应激引起炎症反应
活性氧是影响细胞信号传导的重要化学物质,可对许多生理变化或发病机制过程产生影响。其中炎症过程会导致活性氧突增,而过量的活性氧则会进一步加重炎症反应。研究表明,活性氧会使机体中发生脂质过氧化、DNA氧化损伤、蛋白质氧化和单糖氧化等,从而诱导机体产生炎症、肿瘤、组织缺血再灌注损伤等病状[59]。Phull等[60]认为,氧化应激是关节炎发病机制中的关键介质之一,高水平的活性氧会直接损害软骨基质和脱氧核糖核酸、脂质、透明质酸和促进炎细胞因子产生。高浓度的活性氧可激活NF-κB,诱导肿瘤坏死因子-α的合成,引发NF-κB转录因子的表达,进而上调白细胞介素6白细胞介素1β等促炎因子的表达[2,61]。Xiong等[62]认为,在阻塞性睡眠呼吸暂停中活性氧与氧化应激和炎症有关。Kumar等[63]在其研究中也发现,活性氧水平的升降也会引起AKT、ERK1/2两条通路表达的改变,从而导致炎症产生。Zhao等[64]发现,活性氧可以激活AKT通路、NF-κB通路和MAPKs/AP-1通路这3条炎症通路,进而调控炎症因子mRNA的表达。但目前岩藻聚糖硫酸酯对活性氧引起的炎症反应的调控作用缺乏深入研究。
瘦素水平也是造成氧化应激的因素之一。瘦素水平升高致使单核细胞产生更多的活性氧簇,引起NF-κB活性的增强,促使炎症反应发生。张昕等[65]发现,从美国肉参(Isostichopusbadionotus)和海地瓜中提取的岩藻聚糖硫酸酯均能使胰岛素抵抗小鼠血清的瘦素含量明显降低,从而降低氧化应激以及氧化应激引发的炎症反应。
3.2 炎症因子及炎症小体介导氧化损伤
多项研究证明,炎症因子可诱导机体氧化的产生[66-67]。在炎症反应过程中伴有大量自由基产生,包括超氧阴离子、过氧化氢、氢自由基、一氧化氮等,能攻击生物膜中的不饱和脂肪酸而发生脂质过氧化反应,破坏脂肪酸链和细胞膜的完整性,损害蛋白的结构和功能[68-69]。Choi等[70]发现,炎症因子可导致胃黏膜氧化损伤,炎症和氧化损伤可能同时协同发生,岩藻聚糖硫酸酯的摄入有助于减轻炎症因子的产生从而减轻这类型氧化损伤。
核苷酸寡聚结合结构域样受体3(NLRP3)炎性小体作为固有免疫的重要组分在机体免疫反应和疾病发生过程中具有重要作用。它能被多种类型的病原体或危险信号所激活,在2型糖尿病、阿尔茨海默病和动脉粥样硬化等多种疾病过程中都发挥关键作用。NLRP3炎症体激活可以导致促炎细胞因子的上调[71-73]。活性氧是NLRP3炎症小体的强激活剂,所以活性氧可能是造成下游炎症激活的原因[74]。除此之外NLRP3炎症体激活也能增加活性氧释放[75],因此活性氧与NLRP3炎症体可能存在相互作用。程雨菲等[76]认为,岩藻聚糖硫酸酯能有效下调颈动脉粥样硬化小鼠体内NLRP3蛋白表达水平,可通过影响NLRP3炎症小体调节其抗炎与抗氧化作用。
3.3 多种信号通路同时影响氧化应激与炎症反应
Nrf2/HO-1信号通路不仅可以降低自由基等带来的损伤,还可以降低NF-κB的活性、下调炎症相关基因的表达水平,从而减少促炎因子的生成[77-81]等;并且Nrf2可以启动血红素氧合酶1(HO-1)的表达,而Nrf2和血红素氧合酶1均可以抑制肿瘤坏死因子-α和活性氧的产生。血红素氧合酶1可以参与体外和体内的氧化应激和炎症反应,血红素分解代谢是通过释放一氧化碳、亚铁和胆绿素来中和活性氧和一氧化氮产生的过程[68]。Fernando等[57]研究发现,羊栖菜(Sargassumfusiformis)岩藻聚糖硫酸酯可以激活Nrf2并且上调血红素氧合酶1的表达。Zheng等[82]发现,岩藻聚糖硫酸酯通过激活沉默信息调节因子1/AMP蛋白激酶/过氧化物酶体增殖物激活受体γ辅激活因子1α(SIRT1/AMPK/PGC1α)信号通路来预防小鼠的非酒精性脂肪肝,从而防止毒性相关的氧化应激和炎症。JNK是常见的可以调控炎症的通路,Wang等[83]发现,岩藻聚糖硫酸酯可以通过调节JNK途径影响氧化应激引起的线粒体膜的衰退电位来缓解线粒体膜的功能障碍。AKT通路在调控炎症时功能显著,Lekshmi等[84]发现,岩藻聚糖硫酸酯可以通过调控AKT进一步调节心肌细胞超氧化物歧化酶活性与谷胱甘肽、丙二醛含量,从而减少异丙肾上腺素诱导的心肌氧化损伤。岩藻聚糖硫酸酯或许通过阻断信号传导层面可以减少氧化与炎症的交互影响。
3.4 其他方面
除了以上3个研究领域外,还有部分文献或可印证岩藻聚糖硫酸酯在氧化应激和炎症反应之间的交互关系。
微小RNA miR-143表达可介导氧化应激并且介导炎症因子释放。研究表明,微小RNA中的miR-143与机体内的炎症与氧化应激均有关联[85-86]。方永超[87]发现,COX-2表达上调与miR-143的表达抑制有关。El-Far等[88]研究发现,岩藻聚糖硫酸酯干预会使肝癌大鼠体内miR-143的表达降低,miR-143与抗氧化和抗炎活性均相关,从而显示了岩藻聚糖硫酸酯或许可通过调节miR-143实现对炎症、氧化的同时调控。
谷胱甘肽可以影响抗氧化酶的形成并调节相关炎症通路。谷胱甘肽通过充当抗氧化酶的主要底物和重要的抗炎剂,在炎症反应中起关键作用。谷胱甘肽参与了脂多糖诱导的细胞因子转录的调节及I-κB/NF-κB信号通路的调节[89-90]。Rutkute等[91]认为,年轻肝细胞中的谷胱甘肽会导致JNK激活增加并影响白细胞介素1β。Manikandan等[21]发现,岩藻聚糖硫酸酯可以显著增加注射福尔马林小鼠爪水肿组织中的谷胱甘肽活性,岩藻聚糖硫酸酯可以调控谷胱甘肽可能是其可以减少炎症反应的原因之一。
诸多研究结果已证实,氧化损伤与炎症密切相关并有密切的交互作用,如氧化应激可以引起环氧合酶和脂氧合酶基因的表达,启动炎症介质[79]。活性氧通过调节巯基氧化来抑制酪氨酸磷酸酶,调节细胞酪氨酸磷酸化,以实现对MAPK激活的干预[92]。当骨髓细胞暴露于炎症激活第二信号(如ATP或纤维)时,能够促使NADPH氧化酶启动生成活性氧[93];氧化应激使得肠道菌罗伊氏乳杆菌(Lactobacillusreuteri)L3菌群数量显著下降,而罗伊氏乳杆菌L3可以减少炎症因子的产生并促进抗炎因子的释放,以及保护肠黏膜内的淋巴细胞[94]。但目前,人们对岩藻聚糖硫酸酯在两者交互作用方面研究还非常有限。
4 展 望
岩藻聚糖硫酸酯作为海洋多糖类化合物因其来源安全,并具有广泛的药理学活性,使其成为海藻研究的重要关注点。岩藻聚糖硫酸酯具有显著的抗氧化以及抗炎活性,并已有研究表明其氧化应激和炎症反应的部分具有交互作用,如岩藻聚糖硫酸酯可以减少活性氧过量引起的炎症反应;岩藻聚糖硫酸酯减少炎症小体介导的氧化损伤;岩藻聚糖硫酸酯可以调节共同影响炎症与氧化应激的信号通路等。有一些氧化应激与炎症反应的交互途径虽已被研究证实,但目前对岩藻聚糖硫酸酯在这些交互作用中产生的影响鲜有研究。相信在不久的将来,研究者会在岩藻聚糖硫酸酯对抗炎活性、抗氧化活性作用机制及其交互作用等领域开展更深入的探索,这将极大地促进岩藻聚糖硫酸酯在医疗用药、保健品及美妆等领域的研究与利用。
