生浆豆渣混菌发酵过程中的营养品质和功能特性变化规律
2023-02-02郑润敏戴易祎谢其辉彭露湫王承明
郑润敏,戴易祎,谢其辉,彭露湫,王承明
(华中农业大学 食品科学技术学院,湖北 武汉,430070)
在腐竹、豆浆、豆腐等豆制品加工过程中,将充分浸泡的大豆进行磨浆成为豆糊,然后将豆糊直接进行浆渣分离或煮沸后浆渣分离,得到大量的副产物豆渣,前者得到的豆渣为生浆豆渣,后者得到的豆渣为熟浆豆渣[1]。生浆豆渣含有蛋白质、脂肪、膳食纤维、维生素和矿物质等营养成分,保留了较多的可溶性蛋白及脂肪[2],但由于其水分含量很高,易于腐败变质,其中少量豆渣被用作动物饲料,大部分则成为废料物,这不仅造成了环境污染,也极大地浪费了生产资源[3]。因此,生浆豆渣是一种亟待利用的食品源和营养源。
通过微生物发酵来利用生浆豆渣是一种可行的方法。目前应用于豆渣发酵的微生物种类有很多,包括毛霉、食用真菌、酵母以及部分细菌等。高天宇等[4]为消除新鲜豆粕豆渣(豆粕提取大豆蛋白后产生的副产物)中的不良风味,采用茯苓菌进行液态发酵,发酵后豆渣中的不良风味成分明显减少,优良风味成分明显增加,整体感官品质得到提升。白海军等[5]利用植物乳杆菌、嗜酸链球菌以及双歧杆菌联合发酵芸豆渣制备可溶性膳食纤维,并将其用于大鼠灌胃给药,结果发现发酵后豆渣能够有效缓解小鼠的运动性疲劳。同时,由于豆渣富含膳食纤维,可在马克斯克鲁维酵母的发酵作用下作为诱导纤维素酶的良好载体,所生产的β-葡萄糖苷酶具备良好的活性和稳定性[6]。除了所提及的食用真菌、酵母以及细菌外,豆渣也非常适合作为毛霉的发酵基质[7]。豆渣表面粗糙且黏附力较强,可以很好地附着毛霉菌丝,同时菌丝透过底物内部基质,可以提高利用效率。雅致放射毛霉是一种可以产生多种酶系的毛霉,是我国传统发酵食品用微生物菌种之一,具有较好的食用安全性,常被用来发酵油豆腐、腐乳和豆豉等[8];运动发酵单胞菌是可以应用于食品领域的公认为安全的菌株,在改善发酵产品风味方面具有重要的作用[9]。前期试验发现,雅致放射毛霉和运动发酵单胞菌混菌发酵可以有效提升生浆豆渣的营养品质和感官评分。
目前很少有研究指出所使用的豆渣来源于何种工艺,且有关于豆渣的发酵研究多集中在其发酵前后的性质对比或是一些功能性成分的提取。因此,本研究以雅致放射毛霉和运动发酵单胞菌为发酵菌种,旨在探索生浆豆渣混菌发酵过程中的营养品质和功能特性变化规律,并利用蛋白酶、脂肪酶、纤维素酶和淀粉酶酶活力的变化进行分析,为生浆豆渣的微生物改性、工艺优化以及产品开发提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 实验原料与发酵菌种
新鲜生浆豆渣,建始县容华食品有限公司,使用前于-20 ℃保存。
雅致放射毛霉(ActinomucorelegansCICC3118)、运动发酵单胞菌(ZymomonasmobilisIFFI10232),上海保藏生物技术中心。
1.1.2 培养基
综合马铃薯培养基、马铃薯葡萄糖水培养基,海博生物技术有限公司。
1.1.3 主要试剂
30~60 ℃沸程石油醚、丙酮、甲醛水溶液、无水葡萄糖、可溶性淀粉、羧甲基纤维素钠等,国药集团化学试剂有限公司;牛血清白蛋白、阿拉伯树胶粉等,上海源叶生物科技有限公司;福林酚等,上海麦克林生化科技有限公司。
1.2 仪器与设备
KJELTEC 8400/8420全自动定氮仪,丹麦FOSS公司;JH-11-06可见分光光度计,上海菁华科技仪器有限公司;Beta2-8LD真空冷冻干燥机,日本尼康公司;GR60DA高压灭菌锅,武汉递热爱生物科技有限公司;SPX-150B Ⅲ生化培养箱、101-0AB型电热鼓风干燥箱,天津泰斯特仪器有限公司;SX2-2.5-10A马弗炉,绍兴市上虞道墟科析仪器厂;Allegra X-30R Centrifuge离心机,美国BECKMAN公司。
1.3 实验方法
1.3.1 霉菌孢子悬液与细菌菌悬液制备
挑取雅致放射毛霉菌丝接种于综合马铃薯培养基平板上,于28 ℃培养3 d进行活化,活化完成后继续挑取少量菌丝接种到装有综合马铃薯培养基的三角瓶内,于28 ℃下培养5 d充分产孢。随后向三角瓶内分数次加入100 mL带少量玻璃珠的无菌生理盐水,充分振摇至生理盐水浑浊,将其经4层无菌纱布过滤,收集滤液并用无菌生理盐水适当稀释,制得孢子数量约为105CFU/mL的霉菌孢子悬液。
挑取运动发酵单胞菌接种于综合马铃薯培养基平板上,于28 ℃培养18 h进行活化,活化完成后挑取平板中的单菌落于装有马铃薯葡萄糖水培养基的三角瓶中,放入摇床中于28 ℃、约100 r/min的条件下培养8~12 h至培养基刚好浑浊,随后用无菌生理盐水适当稀释,制得菌体数量约107CFU/mL的菌悬液。
1.3.2 发酵豆渣制备
根据前期优化的发酵条件,称取适量豆渣装入发酵罐中用锡纸包裹好,于121 ℃下灭菌15 min,充分冷却。在自然pH值(pH=5.9)条件下接入3.6%的霉菌孢子悬液以及0.3%的运动发酵单胞菌菌悬液(即100 g的新鲜豆渣中需要接入3.6 mL的雅致放射毛霉孢子悬液以及0.3 mL的运动发酵单胞菌菌悬液),混合均匀后将豆渣用专用模具定型,放入无菌一次性培养皿中,用保鲜膜包好,在保鲜膜上每隔1 cm扎上小孔透气,分别于28.6 ℃的条件下发酵3 d,每隔12 h取1次样,作为湿样,将湿样冻干、粉碎,过80目筛后作为干样备用。
1.3.3 蛋白质降解情况及蛋白酶活力测定
蛋白提取液:称取1 g(精确到0.000 1 g)的豆渣冻干粉,加入25 mL的硼酸-氢氧化钠缓冲溶液(pH=9.0)溶解,在室温下以200 W功率超声辅助提取1 h,然后在4 ℃下(8 000×g、15 min)离心,吸取上清液。
待测蛋白酶液:称取豆渣冻干粉1 g(精确至0.000 1 g),加入pH 7.5、0.1 mol/L的磷酸盐缓冲液25 mL,于室温条件下间歇振荡提取1 h,然后4 ℃离心(8 000×g、15 min),取上清液。
粗蛋白:参考GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法;氨基酸态氮:参考GB 5009.235—2016《食品中氨基酸态氮的测定》中的滴定法;蛋白酶活力:参考GB/T 23527—2009《蛋白酶制剂》中的福林法,以酪氨酸标准溶液质量浓度(0~50 μg/mL)为横坐标,对应的吸光值为纵坐标绘制标准曲线,通过标准曲线计算出蛋白酶活力(y=0.010 1x-0.004 7,R2=0.999 9)。
可溶性蛋白:采用考马斯亮蓝法测定蛋白提取液中的可溶性蛋白含量,以牛血清蛋白质量浓度(20~100 μg/mL)为横坐标,在595 nm处测定其吸光值,以对应的吸光值为纵坐标绘制标准曲线,通过标准曲线计算出可溶性蛋白含量(y=0.005 5x+0.100 2,R2=0.990 1)。吸取1 mL适当稀释的蛋白提取液加入5 mL考马斯亮蓝染色液,混匀之后避光反应5 min,通过回归方程进行计算,结果以牛血清白蛋白(bovine albumin,BSA)当量表示(mg BSA/g,以豆渣冻干粉计)。
蛋白质分子质量:采用SDS-PAGE法测定,并配制12%的分离胶与5%的浓缩胶。
1.3.4 粗脂肪含量变化及脂肪酶活力测定
粗脂肪:参考GB 5009.6—2016《食品中脂肪的测定》中的索氏抽提法。
待测脂肪酶液:称取豆渣冻干粉1 g(精确到0.000 1 g),加入20 mL蒸馏水,充分混匀,40 ℃条件下提取1 h,期间每隔10 min振摇1次,随后4 ℃离心(8 000×g、15 min),取上清液。
底物溶液:A液:用异丙醇配制50 mL 30 mg/mL的棕榈酸对硝基苯酯。B液:取2 g Tritox-100、0.5 g阿拉伯树胶溶于450 mL Tris-HCl缓冲溶液(pH 8.0,50 mmol/L)。在超声条件下,向B液中缓慢滴入A液,混合均匀,静置3 h。
脂肪酶活力:采用对硝基苯酚法测定脂肪酶活力。用异丙醇配制质量浓度为1 mg/mL的对硝基苯酚标准溶液,以对硝基苯酚的含量(0.2~1.0 mg/mL)为横坐标,在405 nm处测定吸光值,以对应的吸光值为纵坐标绘制标准曲线(y=0.548 0x+0.120 1,R2=0.998 3)。
将5 mL底物溶液加入刻度试管中,同时加入适当稀释的待测脂肪酶液1 mL,混匀,40 ℃水浴反应30 min,随后立即用流水冷却,按照上述方法进行测定,并根据回归方程进行计算。酶活力定义为在温度40 ℃条件下每1 min水解底物溶液生成1 μmol对硝基苯酚为1个酶活力单位(U)。
1.3.5 膳食纤维、可溶性总糖含量变化及纤维素酶活力测定
膳食纤维:参考GB 5009.88—2014 《食品中膳食纤维的测定》中的酶重量法,测定发酵豆渣中的不溶性膳食纤维(insoluble dietary fiber,IDF)以及可溶性膳食纤维(soluble dietary fiber,SDF)含量,总膳食纤维(total dietary fiber,TDF)含量为两者之和。
提取液制备:称取豆渣冻干粉1 g(精确到0.000 1 g)于100 mL锥形瓶中,加入20 mL煮沸的蒸馏水并于沸水浴下浸提30 min,浸提过程中适时摇动,浸提结束之后进行过滤,得到滤液。
待测纤维素酶液制备:称取豆渣冻干粉1 g(精确到0.000 1 g),加入pH 4.6、0.2 mol/L的醋酸缓冲液20.0 mL,充分混匀,4 ℃条件下振摇提取1 h,随后4 ℃离心(8 000×g、15 min),取上清液。
可溶性总糖含量:配制质量浓度为0.1 mg/mL的葡萄糖标准溶液,在比色管中分别加入0.2、0.4、0.6、0.8、1 mL的葡萄糖标准液,用去离子水补足到1.0 mL,然后向每管中加入1.0 mL 5%(质量分数)苯酚和5.0 mL浓硫酸,混匀,然后置于水浴条件下中,沸水反应20 min,流水冷却,在490 nm处测定吸光度值。以1.0 mL的蒸馏水为对照,以葡萄糖含量(0.02~0.1 mg/mL)为横坐标,以对应的吸光值为纵坐标绘制标准曲线(y=7.891 7x+0.008 9,R2=0.999 3)。取1 mL适当稀释后的待测液按照上述方法进行测定,根据回归方程进行计算。最终计算结果用葡萄糖当量表示(mg 葡萄糖/g,以豆渣冻干粉计)。
纤维素酶活力:以pH 4.6醋酸缓冲液作为空白对照,配制1 g/L的葡萄糖标准溶液,分别加入0.2、0.4、0.6、0.8、1.0 mL的葡萄糖标准液,用醋酸缓冲液补足到1 mL,然后向每管中加入0.75 mL的DNS试剂,混匀,置于沸水浴中准确反应10 min,随后立即取出,用冷水冷却,用蒸馏水定容至10 mL,在540 nm处测定吸光值。以葡萄糖含量(0.2~1.0 mg/mL)为横坐标,以对应的吸光值为纵坐标绘制标准曲线(y=1.003 8x-0.016 3,R2=0.999 9)。
将0.5 mL 5 g/L的羧甲基纤维素钠溶液(用pH 4.6 的0.2 mol/L醋酸-醋酸钠缓冲液配制)加入刻度试管中,50 ℃水浴预热10 min,加入适当稀释的粗酶液0.5 mL,50 ℃水浴30 min,按照上述方法进行测定,并根据回归方程进行计算。酶活力定义为在pH 4.6、温度50 ℃条件下每1 min水解5 g/L羧甲基纤维素钠生成1 μmol葡萄糖为1个酶活力单位(U)。
1.3.6 还原糖含量及淀粉酶活力测定
提取液制备:同1.2.5中的提取液制备。
待测淀粉酶液:称取豆渣冻干粉1 g(精确到0.000 1 g),加入pH 5.6、0.1 mol/L的柠檬酸缓冲液20 mL,充分混匀,4 ℃条件下提取4 h,随后4 ℃离心(8 000×g、15 min),取上清液。
还原糖含量:配制质量浓度为1 mg/mL 的葡萄糖标准溶液分别加入0.05、0.1、0.15、0.2、0.25 mL的葡萄糖标准液,用去离子水补足到1.0 mL,然后向每管中加入0.75 mL的DNS试剂,混匀,然后置于水浴条件下中,沸水反应10 min,流水冷却,定容到10 mL,于540 nm下测定吸光度值。以1 mL的蒸馏水为对照,以葡萄糖含量(0.05~0.25 mg/mL)为横坐标,以对应的吸光值为纵坐标绘制标准曲线(y=2.912x+0.004 4,R2=0.999 7)。取1 mL稀释后的待测液按照上述方法进行测定,根据回归方程进行计算。最终计算结果用葡萄糖当量表示(mg 葡萄糖/g,以豆渣冻干粉计)。
淀粉酶活力:以pH 5.6柠檬酸缓冲液作为空白对照,配制1 g/L的麦芽糖标准溶液,分别加入0.1、0.3、0.5、0.7、0.9、1.0 mL的麦芽糖标准液,用柠檬酸缓冲液补足到1.0 mL,然后向每管中加入1 mL的DNS试剂,混匀,置于沸水浴中准确反应10 min,随后立即取出,用冷水冷却,用蒸馏水定容至10 mL,在520 nm处测定吸光值。以麦芽糖含量(0.1~1 mg/mL)为横坐标,以对应的吸光值为纵坐标绘制标准曲线(y=1.118 5x-0.020 2,R2=0.993 1)。
将0.5 mL 2%(质量分数)的可溶性淀粉溶液(用pH 5.6的0.1 mol/L柠檬酸缓冲液配制)加入刻度试管中,同时加入适当稀释的粗酶液0.5 mL,再加入1.5 mL的蒸馏水,60 ℃水浴预热10 min,取出,每支试管中加入0.5 mL的pH 5.6柠檬酸缓冲液,60 ℃水浴反应30 min,按照上述方法进行测定,并根据回归方程进行计算。
酶活力定义为在pH 5.6,温度60 ℃条件下每1 min水解2%可溶性淀粉生成1 mg麦芽糖为1个酶活力单位(U)。
1.3.7 粒度测定
参考张瑜[10]的方法,并做一定的修改,取0.5 g(精确到0.000 1 g)豆渣干粉溶于30 mL的超纯水中,充分混匀并以200 W功率超声30 min,随后进行离心,取上清液稀释1倍。采用粒度分析仪对样品颗粒的粒度进行分析。
1.3.8 持水性、持油性、水溶性和膨胀性测定
按照LI等[11]的方法进行测定,并作适当改进。相关计算如公式(1)~公式(4)所示:

(1)
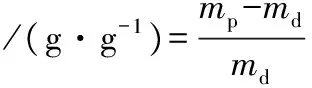
(2)

(3)

(4)
式中:md,豆渣干粉质量,g;mw,豆渣干粉湿重,g;mp,豆渣干粉与大豆油混合反应后的湿重,g;m1,残留物质量,g;Vt,水合后豆渣干粉体积,mL;V0,水合前豆渣干粉体积,mL。
1.4 统计分析
所有实验均重复3次,实验结果以“平均值±相对标准偏差”来表示。用Excel 2019和SPSS 26.0进行数据处理,用Origin 2018软件绘图。
2 结果与分析
2.1 蛋白质降解情况及蛋白酶活力变化
由图1-a可知,豆渣发酵从开始到结束,粗蛋白含量从18.22%下降到13.43%,这与李东华等[12]利用少孢根霉发酵豆渣的研究结果不同(粗蛋白含量从30.57%上升至33.68%),这是由于凯氏定氮法测定豆渣粗蛋白含量的原理是总氮量乘以转换系数 6.25,而有研究表明豆渣发酵过程中很可能会产生吡嗪、氨气等挥发性物质,造成基质中总氮量的减少,间接导致粗蛋白含量降低[13]。因此,粗蛋白含量并不能完全反应豆渣发酵过程中蛋白质水平的变化情况,仍需要借助其他指标综合评判。
由图1-a可知,发酵0 h的豆渣可溶性蛋白含量为4.47 mg BSA/g。发酵12 h后,可溶性蛋白含量没有显著性的提升(P>0.05)。发酵24 h后,可溶性蛋白含量显著增加(P<0.05),达到7.65 mg BSA/g。发酵24~60 h,可溶性蛋白含量呈现上升趋势,发酵60 h时达到最大值,可溶性蛋白含量为11.01 mg BSA/g,约为发酵0 h豆渣的2.5倍。这是因为在豆渣发酵过程中,蛋白质被分解成了多肽以及分子质量相对较小的蛋白质,从而使其溶解度得到提升。发酵60~72 h,可溶性蛋白含量出现显著性下降(P<0.05),管瑛[14]利用雅致放射毛霉DCY-1单菌发酵豆渣,同样发现豆渣中的可溶性蛋白含量在发酵后期出现了下降,这可能是由于在豆渣发酵后期,较多的蛋白质被降解成了小分子的肽和氨基酸,而考马斯亮蓝法只能检测大分子的可溶性蛋白。氨基酸态氮含量是衡量蛋白质降解程度的重要指标,代表发酵豆制品的游离氨基酸总量。根据豆渣氨基酸态氮含量的变化情况可以看出,在豆渣的发酵过程中蛋白质降解程度不断上升,这与可溶性蛋白的变化情况相似,且在发酵60~72 h时氨基酸态氮含量仍然有显著性的上升(P<0.05),说明此时蛋白质还在继续水解。
可溶性蛋白和氨基酸态氮含量的上升原因可能是微生物产生了蛋白酶,由图1-a可知,发酵前36 h,蛋白酶活力水平相对较低,只有137.55 U/g;当发酵48 h时,蛋白酶活力出现大幅度升高,达到了747.58 U/g;发酵60 h后,蛋白酶活力继续升高,达到963.02 U/g;发酵72 h时,蛋白酶活力虽然出现显著性上升(P<0.05),但升高幅度不大,处于一个比较稳定的状态,豆渣中的氨基酸态氮和可溶性蛋白含量与蛋白酶活力的变化趋势基本一致。TAN等[15]也在利用6种霉菌(米曲霉2339、米曲霉41380、米曲霉40188、总状毛霉、五通桥毛霉和雅致放射毛霉)分别发酵豆豉的研究中发现,6组豆豉中的游离氨基氮含量均在预发酵时期增长迅速,随后趋于平缓,原因可能是发酵后期酸性物质的积累会降低蛋白酶活力。
大豆蛋白的组成主要为7S球蛋白(α,α’,β亚基)和11S球蛋白(AS和BS亚基),7S球蛋白一般位于45~91 kDa,11S球蛋白一般位于14.4~42 kDa[16]。根据Marker对比可以看出,在pH 9.0时提取的生浆豆渣蛋白亚基组成与大豆中的蛋白亚基组成基本一致。
由图1-b可知,发酵0~12 h,7S球蛋白迅速水解,发酵24 h时几乎全部消失,这与GUAN等[17]的研究一致,同时11S球蛋白也出现小幅度水解,到发酵48 h时,25 kDa分子质量以上的蛋白质几乎被全部降解。而0~72 h发酵过程中,15~25 kDa分子质量的11S球蛋白含量先减少后增加,在60 h时出现较大程度的累积。结合可溶性蛋白含量、氨基酸态氮含量以及蛋白酶活力的实验结果可以推测,在0~72 h发酵过程中,混菌发酵可以通过蛋白酶水解豆渣中的蛋白质,从而产生分子质量相对较小的蛋白质和氨基酸,有利于蛋白质的有效利用。

M-Marker a-粗蛋白含量、可溶性蛋白含量、氨基酸态氮含量以及蛋白酶活力 变化情况;b-不同发酵时间的SDS-PAGE电泳图谱图1 发酵过程中蛋白质降解程度和蛋白酶活力的变化Fig.1 Changes in degree of protein degradation and protease activity during fermentation 注:不同字母表示处理组间差异性显著(P<0.05)(下同)
2.2 粗脂肪含量及脂肪酶活力变化
由图2中可知豆渣发酵过程中粗脂肪含量逐渐下降。发酵0 h豆渣中的粗脂肪含量为12.00%,发酵0~12 h没有显著性变化(P>0.05),发酵12~48 h出现显著性下降(P<0.05),因为此时处于发酵前期,微生物会同化豆渣中的脂质用于生产生物量和自身的细胞活动[18],当发酵时间48~72 h,此时脂肪酶活力出现显著性提升(P<0.05),但豆渣中的粗脂肪含量却处于一个比较稳定的状态,变化较小。因为微生物虽然会产生脂肪酶,将脂肪水解成甘油和脂肪酸[19],但其产物脂肪酸是脂溶性的,会作为粗脂肪的一部分被提取出来[20],所以酶解后粗脂肪减少的是甘油,其在脂肪中占比较少,因而粗脂肪含量变化不明显。

图2 发酵过程中粗脂肪含量和脂肪酶活力的变化Fig.2 Changes in crude fat content and lipase activity during fermentation 注:不同小写字母、大写字母表示存在显著性差异(P<0.05)
2.3 膳食纤维、可溶性总糖含量及纤维素酶活力变化
由图3-a可知,发酵0 h豆渣中的TDF占豆渣干重63.90%,IDF含量为59.01%,SDF含量仅有4.89%,SDF/TDF值为7.65%。但经过微生物的发酵,TDF下降到60.46%,IDF下降到53.25%,SDF上升到7.21%,SDF/TDF值上升到11.93%,符合优质膳食纤维中SDF/TDF值至少为10%的要求[21]。同时,IDF含量的降低也使得包埋作用减小,提高了小分子营养物质的生物可获得性。因此经过微生物发酵,豆渣中的膳食纤维品质得到提升,具备更好的营养价值与功能活性。豆渣中的SDF包括多糖和单糖等物质,IDF则包括纤维素和半纤维素等物质。HU等[3]利用马克斯克鲁维酵母发酵豆渣,研究结果发现马克斯克鲁维酵母分泌的纤维素酶(可能是β-葡萄糖苷酶)可以使IDF向SDF发生转化。因此,本研究中IDF与SDF含量的变化也很有可能和纤维素酶有关。
由图3-b可知,0~72 h时可溶性总糖含量呈现先降后升的趋势。发酵0 h豆渣中可溶性总糖含量为48.85 mg 葡萄糖/g;发酵0~36 h,可溶性总糖含量呈现下降趋势,此时可溶性总糖含量仅为22.62 mg葡萄糖/g。在发酵36 h之后的各个阶段,可溶性总糖含量均出现显著性上升(P<0.05)。发酵72 h时,豆渣的可溶性总糖含量达到了80.26 mg 葡萄糖/g。
通过纤维素酶活力的变化趋势可以看出,在豆渣发酵过程中,微生物可以提供纤维素酶,在发酵48 h之前酶活力稳步上升,在发酵48~60 h时出现大幅度升高,发酵60 h时的酶活力达到12.30 U/g,发酵72 h时酶活力变化幅度较小,为12.41 U/g。因此,发酵前36 h可溶性总糖含量下降,可能是微生物的生长繁殖需要利用到单糖类物质,而发酵前期纤维素酶活性较低,分解产生的糖量不足以平衡消耗量。在发酵36 h之后,纤维素酶会把更多的纤维素降解为溶解性更好的单糖类物质,可溶性总糖含量的增加,可以有效提升发酵豆渣的风味和细腻程度[22]。
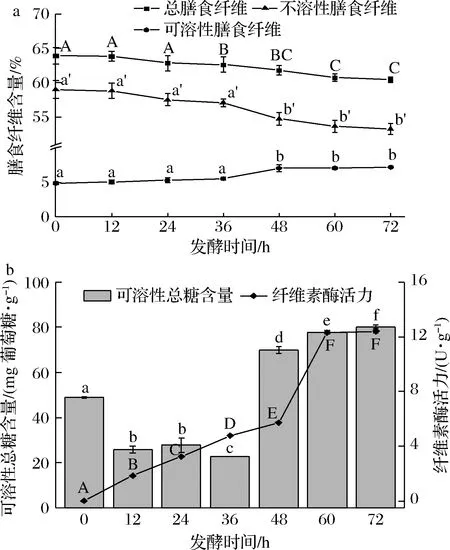
a-膳食纤维含量变化情况;b-可溶性总糖含量及纤维素酶 活力变化情况图3 发酵过程中膳食纤维含量、可溶性总糖含量和 纤维素酶活力的变化Fig.3 Changes in dietary fiber content, total soluble sugar content, and cellulase activity during fermentation
2.4 还原糖含量及淀粉酶活力变化
由图4可知,发酵0 h的豆渣还原糖含量为4.81 mg 葡萄糖/g,发酵0~12 h还原糖含量出现显著性下降(P<0.05)。发酵12~36 h,还原糖含量并无显著性变化(P>0.05),处于一个比较稳定的状态。发酵36~72 h各个阶段均出现显著性的上升(P<0.05)。发酵72 h后,豆渣中的还原糖含量达到了7.56 mg葡萄糖/g。总体而言,还原糖含量的变化趋势与可溶性总糖含量相似。
根据淀粉酶活力的变化趋势可以发现,豆渣在0~72 h发酵过程中,微生物可以提供活力较强的淀粉酶,发酵60 h前各阶段均有显著性的提升(P<0.05),发酵60 h淀粉酶活力达到了3.79 U/g。由此可判断,在发酵0~36 h时,还原糖含量下降的原因可能是微生物生长代谢所致,此时微生物生长繁殖所需的还原糖量大于淀粉水解产生的还原糖量。发酵36 h之后,淀粉酶活力变强,可以水解更多的淀粉产生还原糖,从而使得豆渣中的还原糖含量积累,在发酵中后期的含量逐渐上升。

图4 发酵过程中还原糖含量和淀粉酶活力的变化Fig.4 Changes in reducing sugar content and amylase activity during fermentation
2.5 粒度、持水性、持油性、水溶性和膨胀性变化
由表1可知,豆渣发酵过程中粒度逐渐降低,从发酵0 h的857.05 nm到发酵72 h时的200.83 nm,几乎每一个发酵阶段均出现显著性下降(P<0.05)。原因是微生物的酶作用会使大颗粒转变为小颗粒,降低基质粒度[10]。较小的粒度有利于物料内部氧气和二氧化碳的热传递和热交换,促进微生物生长的同时也会提高物料的通气效率;WANG等[23]利用超离心研磨+蒸汽加热+纤维素酶联合处理豆渣,结果发现豆渣粒度减小的同时,纤维素酶的有效作用面积和作用效果也得到提升。因此,豆渣粒度的减小可能对豆渣中酶的作用效率有促进作用。从感官上来看,豆渣粒度的减小也有利于降低豆渣渣感,使豆渣由粗糙变得细腻,口感和消化率得到提升[24]。
持水性、水溶性和膨胀性是衡量豆渣膳食纤维水合性质的重要指标,可以反应基质保留水分的能力,它们与多糖中的亲水基团有关,较好的水合性质可以使食品原料在加工过程中保持较好的黏度和质地;持油性则通常用来评估吸附脂肪的能力,较强的持油性可以有效防止烹饪过程中的脂肪流失;豆渣水合性能和持油性能与发酵过程中SDF含量、膳食纤维结构等有关[25]。
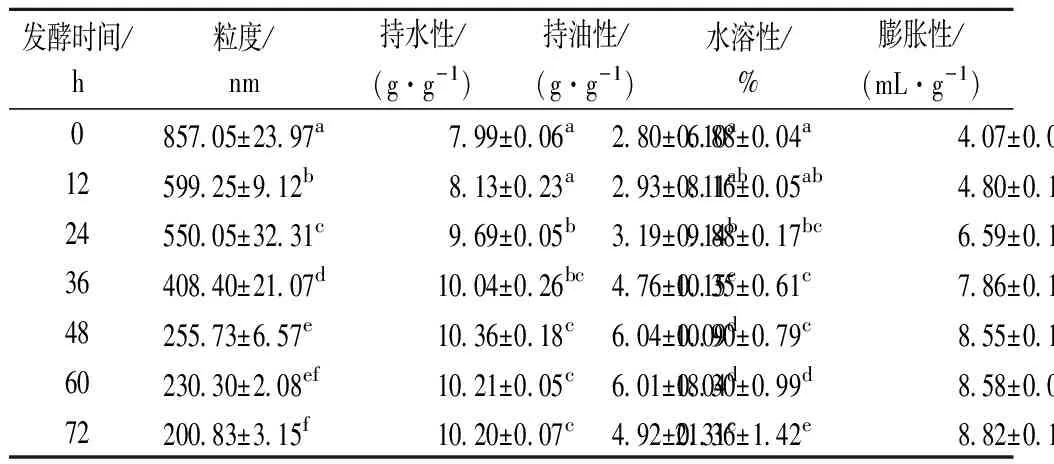
表1 发酵过程中粒度、持水性、持油性、水溶性 和膨胀性的变化Table 1 Changes in particle size, water holding capacity, oil holding capacity, water solubility, and swelling property during fermentation
由表1可知,经由微生物发酵后,4项指标均得到不同程度的提升。持水性先上升后稳定,在发酵24 h时出现显著性上升(P<0.05),发酵36~72 h无显著性变化(P>0.05),最终的持水性为10.20 g/g。持油性的变化趋势与持水性相似,在发酵24~48 h开始出现显著性上升(P<0.05),发酵48 h达到最高值6.04 g/g,但在发酵72 h时出现显著性下降(P<0.05);持水性和持油性上升是因为纤维素酶的水解会破坏纤维素和半纤维素的分子间氢键并增加颗粒的比表面积,暴露出更多的亲水基团,分散性的增加有利于提升物料与水、油之间的接触程度,持油性在发酵72 h时下降的原因可能与粒度大小有关,粒度减小会降低阳离子的交换能力,进而引起持油性的降低,但具体原因还需要进一步研究[26];水溶性在发酵过程中一直上升,在发酵前36 h有小幅度上升,发酵48~72 h后开始出现大幅度的显著性上升(P<0.05),发酵72 h达到最高值21.36%,这意味着豆渣中的可溶性物质含量会随着发酵时间的延长而增加;膨胀性的变化趋势与持水性相似,为先上升后稳定,在发酵前48 h的各个阶段均出现显著性上升(P<0.05),在此后的发酵时间里维持稳定,发酵终末的豆渣膨胀性达到了8.82 mL/g,豆渣膨胀性的增加主要是因为溶解在水中的膳食纤维颗粒会增强拉伸和膨胀效果,从而使水合后的豆渣体积扩张,膨胀性能变强,膳食纤维自身特殊的蜂窝状结构也有助于吸水膨胀[27]。
3 结论
在雅致放射毛霉和运动发酵单胞菌0~72 h混菌发酵过程中,生浆豆渣的品质会发生一定规律性的变化。营养品质方面,豆渣的粗蛋白含量逐渐下降,蛋白分子质量逐渐降低。可溶性蛋白含量逐渐上升,在发酵60 h达到峰值11.01 mg BSA/g,发酵60~72 h略有下降。氨基酸态氮含量逐渐上升,在发酵72 h达到0.31 g/100g。粗脂肪含量在发酵0~48 h逐渐下降,然后维持在7%左右。发酵过程中,部分不溶性膳食纤维向可溶性膳食纤维转化,48 h后二者含量趋于稳定,分别为54.74%和7.07%。可溶性总糖和还原糖含量的变化趋势均为先降后升,开始上升的时间点也均在48 h,发酵72 h时的含量分别为80.26、7.55 mg葡萄糖/g。功能特性方面,粒度逐渐变小,发酵72 h时下降到200.83 nm;持水性在发酵0~48 h逐渐上升,随后稳定在10.36 g/g。持油性也在48 h达到峰值6.04 g/g,但在发酵60~72 h时出现下降。水溶性和膨胀性均逐渐上升,在发酵72 h时分别达到了21.36%和8.82 mL/g。微生物在发酵过程中可以提供活性逐渐变强的蛋白酶、脂肪酶、纤维素酶和淀粉酶,提升了豆渣的营养价值,并改善了豆渣的加工特性。该研究结果为生浆豆渣的微生物改性、工艺优化以及产品开发提供理论与技术支持。
