不同乳酸菌抗氧化作用和胆固醇降解能力的初步研究
2023-02-02徐超章绍兵孟珺王敬丽朱萌茜
徐超,章绍兵,孟珺,王敬丽,朱萌茜
(河南工业大学 粮油食品学院,河南 郑州,450001)
人体所需能量很大一部分来自于自身的氧化作用,而氧化过程中会产生大量的自由基物质。这些自由基物质会加速人体的衰老并导致一系列的代谢综合征,例如糖尿病、动脉硬化、心脑血管疾病、神经紊乱疾病等[1],人体本身具有的抗氧化系统并不能完全抵御这些危害,所以寻找安全高效无毒的抗氧化药物尤为重要。人们在对乳酸菌的研究过程中发现了一些菌株具有较强的综合抗氧化能力[2],有研究表明乳酸菌在代谢的过程中可以产生一些具有抗氧化性的物质,例如阿魏酸、半胱氨酸、过氧化氢酶等。
高脂血症是指血浆中的胆固醇或者甘油三酯的水平过高,可直接引起如动脉粥样硬化、冠心病、胰腺炎等一些严重危害人体健康的疾病。根据调查显示,在近十年间中国成人血脂异常患病率大幅上升[3]。国内外的科学研究均已证实益生菌在缓解高血脂高血糖等方面有显著的效果,且与传统药物治疗相比,具有无毒副作用的优点[4]。有研究发现一些嗜酸乳杆菌、鼠李糖乳杆菌、干酪乳杆菌、植物乳杆菌等乳酸菌具有胆固醇降解能力[5]。本文以鼠李糖乳杆菌(LactobacillusrhamnosusGG)为阳性对照,对高加索乳杆菌(LactobacilluskefirBNCC 190565)、嗜酸乳杆菌(LactobacillusacidophilusATCC 4356)、布氏乳杆菌(LactobacillusbuchneriBNCC 187964)购自北京创联生物技术有限公司;干酪乳杆菌(LactobacilluscaseiCICC 23184)、植物乳杆菌(Lactobacillusplantarumsubsp.plantarumCICC 20279)这5株乳酸菌进行了筛选,初步研究其抗氧化作用和降血脂功能,旨在筛选出1~2株具有良好的抗氧化作用和胆固醇降解功能的乳酸菌。
1 材料与方法
1.1 材料与试剂
L.rhamnosusGG、L.kefirBNCC 190565、L.acidophilusATCC 4356、L.buchneriBNCC 187964购自北京创联生物技术有限公司;L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279购自中国工业微生物菌种保藏管理中心。
无水乙醇、邻二氮菲、铁氰化钾、三氯乙酸、FeCl3、Na2CO3、六水氯化铁、浓磷酸、结晶紫,天津市科密欧化学试剂有限公司;胰蛋白酶(生物技术级)、胃蛋白酶(猪源)、对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside, PNPG)、胆固醇,上海麦克林生化科技有限公司;IV型胶原蛋白、α -葡萄糖苷酶,美国sigma公司;猪胆盐,上海源叶生物有限公司;牛血清白蛋白,北京索莱宝技术有限公司;甲醇,天津市天力化学试剂有限公司;H2O2,洛阳市化学试剂厂。其余试剂均为分析纯。
1.2 仪器与设备
GL-20G高速冷冻离心机,上海安亭科学仪器厂;D3024R台式高速冷冻型微量离心机,美国SCTLOGEX;SWGCZ-2F 型超净工作台,上海笃特科学仪器厂;PHS-3C pH计,上海仪电科学仪器股份有限公司;XMTD-204数显恒温振荡器,江苏金坛市亿通电子有限公司;DPH-360电热恒温培养箱、XMTD-7000电热恒温水浴锅,北京市永光明医疗仪器有限公司;BT-1600图像颗粒分析仪,丹东百特仪器有限公司;MVS-1旋涡混合器,北京金北德工贸有限公司;TV-1901紫外可见分光光度仪,上海精密科学仪器有限公司;立式压力蒸汽灭菌锅,上海申安医疗器械厂。
1.3 实验方法
1.3.1 样品的制备
1.3.1.1 菌悬液的制备
菌株在MRS液体培养基中连续活化3代,于18 h测定OD600值,并进行活菌计数,确定此时光密度对应的活菌数。将再次活化的菌液调整到相应的光密度,离心(4 000 r/min, 4 ℃, 10 min)得到沉淀。将离心所得沉淀用生理盐水洗涤2~3次,然后重悬,根据活菌计数的结果把菌悬液统一调整为1.0×109CFU/mL,所得即为所需菌悬液。
1.3.1.2 发酵液的制备
将上述菌悬液按2%的接种量接种到MRS液体培养基中,培养18 h后,离心(4 000 r/min, 4 ℃, 10 min),所得上清液即为所需发酵液。
1.3.2 乳酸菌益生特性的测定
1.3.2.1 产酸
按2%的接种量,将菌悬液接种到MRS培养基中,放在恒温振荡器培养,培养条件为:温度37 ℃、转速180 r/min。24 h后测定pH值和滴定酸度,滴定酸度测定方法参考GB 5009.239—2016 《食品安全国家标准 食品酸度的测定》。
1.3.2.2 模拟消化道耐受性
(1) 消化液的配制:模拟胃液的配制参考中国药典,pH值为2.0。模拟肠液的配制在参考药典的同时加入猪胆盐(3 g/L),pH值为8.0。使用前均需在37 ℃条件下预热。
(2) 模拟消化:取1.0 mL菌悬液至9 mL模拟胃液,在温度为37 ℃,转速为120 r/min的恒温振荡器里模拟消化过程,分别在0、3 h时取样,进行活菌平板计数,并计算存活率。同样的方法模拟肠液及胆盐对乳酸菌的影响[6]。
1.3.2.3 黏附性
设置2个实验组,以牛血清白蛋白为空白对照,在6孔培养板中分别加入牛血清白蛋白或IV型胶原蛋白,同时每孔放置一片玻片,室温下包被12 h后弃去蛋白液,用pH值7.2的灭菌PBS清洗5次。分别加入2 mL 108CFU/mL的菌悬液,37 ℃孵育。3 h后将菌悬液弃去,用灭菌PBS洗涤4次。然后用甲醇固定,结晶紫染色,显微镜下观察,随机选择10个视野进行计数,10个视野中细菌的平均数作为平均黏附量。每种菌和不同蛋白的组合均设置3个孔位以作重复[7]。
1.3.3 乳酸菌抗氧化能力的测定[8]
1.3.3.1 羟自由基清除能力的测定方法
在试管中加入1 mL邻二氮菲(2.5 mmol/L)、1 mL无菌PBS(pH 7.2)、1 mL菌悬液或发酵液,再加入1 mL的FeSO4(2.5 mmol/L),充分混匀后加入1 mL的H2O2(20 mmol/L),37 ℃水浴1.5 h后,在536 nm波长处测定吸光度值(OD值),记为A1;将1 mL发酵液或菌悬液稀释到5 mL,测得吸光度值A2;用生理盐水代替菌悬液或发酵液,其他操作不变,测得吸光度值A3;用生理盐水代替菌悬液或发酵液,用蒸馏水代替H2O2,其他操作不变,测得吸光度值A0。羟自由基清除率计算如公式(1)所示:
(1)
1.3.3.2 还原能力测定方法
在2 mL离心管中加入0.5 mL的菌悬液或发酵液、0.5 mL的铁氰化钾(1%)、0.5 mL PBS(pH 6.6),充分振荡混合均匀,在50 ℃水浴20 min后,冰浴急速冷却,再次加入0.5 mL三氯乙酸(10%),3 000 r/min离心10 min。取其上清液1 mL,加入1 mL FeCl3(0.1%),室温放置10 min 后,在710 nm波长处测定OD值。用生理盐水代替样品作为空白组,用空白组和实验组OD值的差值来表征还原能力的强弱,计算如公式(2)所示:
还原力=A710(实验)-A710(空白)
(2)
1.3.3.3 DPPH自由基清除能力测定方法
在2 mL离心管中加入1 mL的菌悬液或者发酵液,然后加入1 mL的DPPH自由基无水乙醇溶液(0.2 mmol/L),使用旋涡混合器混合均匀,在室温条件下避光反应30 min后离心,离心条件为转速6 000 r/min、时间10 min。取其上清液在517 nm波长处测定吸光度,测得的吸光度值记为A1;用生理盐水代替菌悬液或发酵液,其他操作不变,测得的吸光度值记为A2;用生理盐水代替菌悬液或发酵液,无水乙醇代替DPPH无水乙醇溶液,其他操作不变,测得的吸光度值记为A0。DPPH自由基清除率计算如公式(3)所示:
(3)
1.3.4 乳酸菌降胆固醇能力的测定
1.3.4.1 胆固醇培养基的配制
胆固醇无法直接溶于MRS液体培养基,所以参考郭翔[5]的实验,将鸡蛋黄作为培养基的胆固醇来源。胆固醇培养基:MRS培养基+5%(体积分数)蛋黄液。
1.3.4.2 胆固醇标准曲线的制作
取2.5 g六水氯化铁溶于87%浓磷酸中,加浓磷酸定容到100 mL,贮存于棕色试剂瓶内,使用时取8 mL该液,加浓硫酸定容至100 mL,所得试剂即为磷铁硫试剂。准确称取胆固醇溶解于无水乙醇中,并用无水乙醇定容,使最终质量浓度为2 mg/mL,精确吸取2 mL该液,使用无水乙醇稀释50倍,可以于冰箱冷藏,使用前放置到室温。分别取0.0、0.2、0.4、0.6、0.8、1.0 mL胆固醇标准溶液加入试管中,用无水乙醇统一调整到1 mL,然后加入2 mL磷铁硫试剂摇匀冷却后,在550 nm波长处测定OD值。
1.3.4.3 胆固醇含量的测定
按2%的接种量在胆固醇培养基中接种乳酸菌,37 ℃、180 r/min的条件下在恒温振荡器中培养 24 h,取2 mL的菌液加入离心管中,3 000 r/min离心10 min,取其上清液加入1 mL无水乙醇涡旋振荡5 min,10 000 r/min离心10 min。再次取400 μL加入到离心管中,加入1.6 mL无水乙醇,振荡处理5 min, 10 000 r/min离心10 min。取1 mL上清液,加入2 mL磷铁硫试剂,摇匀冷却后,在550 nm波长处测定OD值。利用胆固醇标准曲线确定胆固醇含量,并计算降解率[9]。
1.3.5 乳酸菌对α-葡萄糖苷酶抑制能力的测定
参考ZHANG等[10]以及张军蒙[6]的实验方法,并略作修改,在试管中加入50 μL菌液、150 μL的PNPG (2.5 mmol/L)、300 μL PBS溶液(0.1 mol/L, pH 6.8),孵育(37 ℃, 10 min),然后加入100 μL α-葡萄糖苷酶(0.2 U/mL)在37 ℃的条件下反应20 min,最后加入2 mL Na2CO3溶液(1 mol/L)终止反应,在405 nm波长处测OD值,测得的OD值记为A1;用PBS代替α-葡萄糖苷酶,其他操作不变,测得的OD值记为A2;用生理盐水代替菌液,其他操作不变,测得的OD值记为A3;用生理盐水代替菌液,用PBS代替α-葡萄糖苷酶,其他操作不变,测得的OD值记为A0。α-葡萄糖苷酶抑制率计算如公式(4)所示:
(4)
1.3.6 数据分析
所有数据均由3次或以上平行实验计算得出平均值,使用SPSS 25和origin 2017进行数据分析处理以及绘图,使用Duncan法或t检验进行显著性分析,P<0.05时认为具有显著性差异。
2 结果与分析
2.1 乳酸菌益生特性的比较
2.1.1 不同乳酸菌产酸能力对比
有研究认为乳酸菌在肠道繁殖过程中产生的乳酸、乙酸、丁酸等短链脂肪酸可以改变肠道环境,降低肠道的酸度,从而抑制一些致病菌在人体生长,同时还能促进肠道蠕动,加速了病原体的排出。本实验使用了2种评价方法来评价乳酸菌的产酸能力,一种是测乳酸菌生长24 h前后pH值的变化大小,一种是用NaOH滴定发酵液并换算成乳酸度,用吉尔涅尔度(°T)表示。从图1-a、图1-b可看出,2种评价方法得出的结果趋势相同。6种菌中产酸能力最强的是L.rhamnosusGG、L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279,24 h的ΔpH均在2.0以上,滴定酸度也都在120 °T左右,均显著高于其他3种菌。王明好[11]对12株乳酸菌的产酸性能测定发现,其中8株菌的ΔpH为2.0~2.5,最高的一株菌ΔpH为2.42。王磊[12]对65株乳酸菌的产酸能力进行测定,发现大多数乳酸菌发酵后的酸度在100 °T左右,仅有2株菌的酸度可达到140 °T以上。综上所述,L.rhamnosusGG、L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279这3株菌的产酸能力比较优良。
2.1.2 不同乳酸菌模拟消化道耐受性对比
模拟胃液具有胃蛋白酶和低pH,模拟肠液中含有胰蛋白酶和胆盐,这些均不利于乳酸菌生长。乳酸菌在人体内发挥作用的前提是必须要对人体的胃肠液有一定的耐受性,拥有较高耐受性的菌株才能更好的在人体内存活并发挥出益生作用。由图2可知,在模拟胃液处理3 h后,存活率最高的为L.buchneriBNCC 187964和L.acidophilusATCC 4356,存活率分别为60.3%和52.5%,其次是L.plantarumsubsp.plantarumCICC 20279,存活率为47.0%,均高于L.rhamnosusGG。张军蒙[6]测定了18株乳酸菌对胃液的耐受性,结果表明,18株乳酸菌中有11株存活率在20%~45%,只有4株菌的存活率在50%以上;由图2可知,对肠液和胆盐具有较高耐受性的菌株是L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279,存活率分别为64.5%和48.3%,均高于L.rhamnosusGG。吕嘉枥等[13]对18株乳酸菌的肠液耐受力进行了测定,结果发现,其中有16株菌的存活率在20% 以上,其中有3株菌的存活率在70% 以上。综合分析,L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279具有良好的消化道耐受性。
2.1.3 不同乳酸菌黏附能力对比
乳酸菌在肠道发挥益生作用前需要在肠道内完成黏附定植,有研究表明[14]细胞外的胶原蛋白参与了细胞黏附。所以本实验用牛血清白蛋白作为阴性对照,通过比较乳酸菌对IV型胶原蛋白和牛血清白蛋白黏附量的差异来评价菌株的黏附力。由表1可知,除L.kefirBNCC 190565外,其余菌株对2种蛋白的黏附均有显著性差异,即L.rhamnosusGG、L.buchneriBNCC 187964、L.acidophilusATCC 4356、L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279均对IV型胶原蛋白具有特异性黏附作用。ARGYRI等[15]对13株乳酸菌研究发现,不同菌株的黏附能力差异显著,植物乳杆菌和鼠李糖乳杆菌具有较强的黏附能力。

图2 不同菌株在模拟胃液或模拟肠液中处理3 h后的存活率Fig.2 Survival rate of different strains treated in simulated gastric fluid or simulated intestinal fluid for 3 h
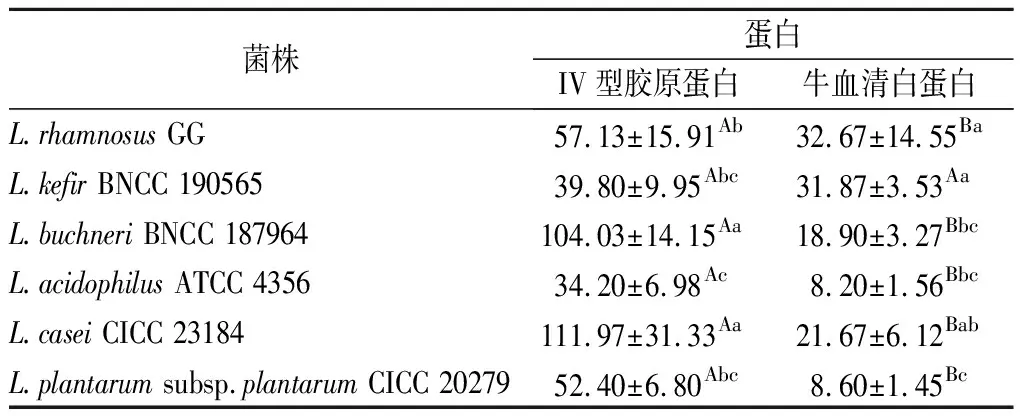
表1 不同菌株对不同蛋白的黏附量Table 1 Adhesion of different strains to different proteins
2.2 乳酸菌抗氧化能力的比较
现存的抗氧化测定方法非常多,但并没有公认的标准方法,所以在研究物质的抗氧化作用的时候,一般会选取以不同原理为基础的方法,来共同说明该物质的抗氧化能力。所以综合考虑,选择了以下3种方法共同评价乳酸菌的抗氧化能力。
2.2.1 不同乳酸菌菌悬液及发酵液对羟自由基的清除作用
人体中的自由基90%都是氧自由基,羟自由基是一种强烈的氧自由基,这种自由基会导致DNA降解、损伤细胞膜和多糖类物质,由此导致多种人体细胞损伤及脂质过氧化。刘珊春等[16]对18株乳酸菌的羟自由基清除率进行了测定,结果发现清除率最高为34.89%。由图3可知,几种菌的菌悬液中,羟自由基清除能力最强的是L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279,L.caseiCICC 23184的羟自由基清除率为40.7%,L.plantarumsubsp.plantarumCICC 20279的羟自由基清除率为38.6%,均高于L.rhamnosusGG;由图3可知,几种菌的发酵液中,对羟自由基清除能力最差的是L.buchneriBNCC 187964,清除率为16.7%,其余5种菌发酵液的羟自由基清除率均高于L.buchneriBNCC 187964,且与L.rhamnosusGG无显著性差异。考虑到乳酸菌产品通常同时包括乳酸菌菌体和分泌物,综合比较表明,L.acidophilusATCC 4356、L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279均具有较强的羟自由基清除能力。除L.rhamnosusGG外的乳酸菌菌悬液的羟自由基清除率均高于或接近于发酵液,可能是因为这些乳酸菌菌体上清除羟自由基的活性物质含量高于发酵液中的含量。

图3 不同菌株菌悬液和发酵液的羟自由基清除率Fig.3 Hydroxyl radical scavenging rates of bacterial suspensions and fermentation broths of different strains 注:不同大写字母表示同株菌不同组分有显著性差异(P<0.05),不同 小写字母表示不同菌株同种组分具有显著性差异(P<0.05)(下同)
2.2.2 不同乳酸菌菌悬液及发酵液的还原能力对比
还原能力是指抗氧化剂抵抗氧胁迫和降低螯合亚铁离子的能力,是体外检测抗氧化剂抗氧化能力的关键指标。由图4可知,几种菌的菌悬液中,还原力最强的为L.buchneriBNCC 187964和L.rhamnosusGG;几种菌的发酵液中,还原力最强的是L.acidophilusATCC 4356,其还原力强于L.rhamnosusGG。综合比较表明,除L.kefirBNCC 190565外,其余5株菌均表现出较强的还原能力。发酵液还原力显著高于菌悬液,可能是因为具有还原能力的活性物质主要存在于乳酸菌的发酵产物之中。
2.2.3 不同乳酸菌菌悬液及发酵液对DPPH自由基的清除作用
DPPH是一种人工合成的、稳定的自由基,能与自由基清除剂反应,孤对电子被配对,DPPH自由基变为DPPH-H非自由基形式,溶液从紫色变为黄色,吸光度值也会发生相应的变化。以此为原理进行的抗氧化能力评价的方法具有快速、简单、灵敏的特点,所以被广泛应用。由图5可知,6株菌的菌悬液对DPPH自由基的清除率没有显著性差异;从图5可以看出6株菌的发酵液中,L.plantarumsubsp.plantarumCICC 20279的清除能力显著高于其他5株菌。对比菌悬液和发酵液的DPPH自由基清除率,发现发酵液的自由基清除能力要远高于菌悬液。所以推测菌株的抗氧化能力主要靠发酵液中代谢物质来体现。有研究表明,乳酸菌的DPPH自由基清除能力可能和菌体产生的胞外多糖浓度正相关[17]。

图4 不同菌株菌悬液及发酵液的还原能力Fig.4 The reducing ability of bacterial suspension and fermentation broth of different strains

图5 不同菌株菌悬液及发酵液的DPPH自由基清除率Fig.5 DPPH radical scavenging rate of bacterial suspension and fermentation broth of different strains
综合3个指标比较,发现抗氧化能力较强的菌株为L.acidophilusATCC 4356、L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279。DAS等[18]报道了植物乳杆菌和嗜酸乳杆菌具有较高的抗氧化能力,与本文结果相近。
2.3 乳酸菌降胆固醇能力的比较
国外研究者发现,一些饮用乳杆菌发酵乳制品的人群中,其体内的血清胆固醇普遍较低[19]。这一现象引起了学者们的注意,在不断地研究下,人们发现不同菌类的乳酸菌具有降低胆固醇的效果。本文比较了几类被证实具有降胆固醇效果的乳酸菌,由图6可知,6株乳酸菌降解率均在50%以上。TANG等[20]所测的11株菌中胆固醇清除率最高的是一株植物乳杆菌,清除率为47.83%,比较之后可以看出本文所测6株菌均具有优秀的胆固醇降解能力。可能是乳酸菌在生长的过程中,分泌的一些代谢产物,例如胞外多糖或蛋白质,起到了降解胆固醇的作用。王霄鹏等[21]实验发现乳酸菌发酵液中的多糖、蛋白质等物质对胆固醇均具有一定的降解率。有研究证明,乳酸菌可以通过分泌胆汁盐水解酶或者吸收、分解胆固醇的方式来降低胆固醇含量[22]。

图6 不同菌株的胆固醇降解率Fig.6 Cholesterol degradation rate of different strains
2.4 乳酸菌对α-葡萄糖苷酶抑制能力的比较
α-葡萄糖苷酶是一种碳水化合物水解酶,催化α-葡萄糖从底物的非还原端释放。α-葡萄糖苷酶可促进小肠对葡萄糖的吸收,从而提高了血糖和血脂含量水平,所以可以通过抑制α-葡萄糖苷酶来达到降低血糖和血脂的目的[23]。α-葡萄糖苷酶可以降解PNPG产生对硝基苯酚(p-nitrophenol, PNP),所以可以通过测定PNP在405 nm处的吸光度来反映α-葡萄糖苷酶的被抑制程度。由图7可知,对α-葡萄糖苷酶抑制率最高的是L.buchneriBNCC 187964,抑制率为26.3%,其余5株菌对α-葡萄糖苷酶的抑制率均在10%~20%。WANG等[24]测定了L.rhamnosusGG的α-葡萄糖苷酶抑制率,其抑制率为17.21%,与本文测定的L.rhamnosusGG结果相近。本文所测的其余5株菌的α-葡萄糖苷酶抑制率均与L.rhamnosusGG相近或略高,即均具有较好的α-葡萄糖苷酶抑制效果。
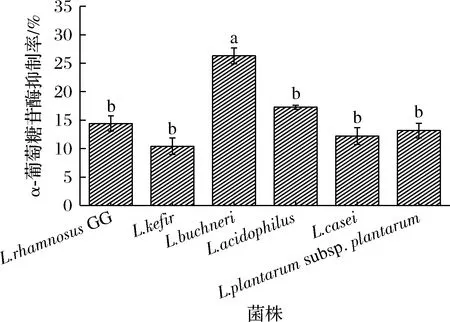
图7 不同菌株的α-葡萄糖苷酶抑制率Fig.7 α-glucosidase inhibition rate of different strains
3 结论
本文对L.kefirBNCC 190565、L.acidophilusATCC 4356、L.buchneriBNCC 187964、L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279、L.rhamnosusGG这6株乳酸菌进行了益生特性、抗氧化作用、降胆固醇能力、α -葡萄糖苷酶抑制率的测定,旨在筛选出具有较强抗氧化作用、降解胆固醇和降血糖功能的乳酸菌,以期制备出具有更强功能的乳酸菌产品。
对结果分析发现L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279具有较强的消化道耐受力,能很好的在人体内生存,且均具有良好的益生活性;抗氧化作用通常需要通过不同的指标来共同评价,考虑到乳酸菌产品通常同时包括乳酸菌菌体和分泌物,所以综合比较发现抗氧化作用较强的菌株有L.acidophilusATCC 4356、L.plantarumsubsp.plantarumCICC 20279和L.caseiCICC 23184,优于L.rhamnosusGG;6株菌对胆固醇的降解率均在50%以上,表现出很强的胆固醇降解能力;L.buchneriBNCC 187964的α-葡萄糖苷酶抑制率高于L.rhamnosusGG,其余4株菌和L.rhamnosusGG没有显著性差异。以L.rhamnosusGG为阳性对照,以抗氧化能力和胆固醇降解率为主要筛选指标,发现L.acidophilusATCC 4356、L.plantarumsubsp.plantarumCICC 20279和L.caseiCICC 23184这3株菌表现良好,但考虑到乳酸菌必须存活下来才能在人体发挥相应的作用,所以排除了肠胃液耐性较差的L.caseiCICC 23184;L.buchneriBNCC 187964具有较强的α-葡萄糖苷酶抑制率,但肠液耐受力较差,同样被排除;进行一系列的分析比较发现L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279不仅有着较好的抗氧化能力和降血脂能力,还有良好的胃肠液存活能力,具有在人体中发挥出相应作用的潜力。
