原人参二醇组皂苷选择性制备人参皂苷20(S)-Rg3和Rg5及其生成机理研究
2023-02-02张浩然朱小涵张跃伟李琳李玲成乐琴
张浩然,朱小涵,张跃伟,李琳,李玲,成乐琴*
1(吉林化工学院 化学与制药工程学院,吉林 吉林,132022)2(长春市公安司法鉴定中心,吉林 长春,130000) 3(吉林省彩森仁生物科技有限责任公司,吉林 吉林,132022)
人参(PanaxginsengC.A.Mey)是一种五加科人参属多年生草本植物,其根含有多种活性成分,具有很高的药用价值。人参作为一种中草药,在中国已有两千多年的历史,有“百草之王”的美誉,现今在中国、韩国等亚洲国家广泛使用。人参皂苷是人参的重要活性成分之一,具有增强记忆力[1]、提高免疫力[2]、改善心血管系统[3]、延缓衰老[4]、预防癌症[5]等药理作用。
稀有人参皂苷Rg3和Rg5是原人参二醇型(protopanaxadiol,PD)皂苷的降解产物,对其药理活性研究发现,它们在抗抑郁[6]、抑制肿瘤细胞增殖(乳腺癌[7]、胃癌[8])、改善糖尿病并发症[9]、改善记忆力[10]等方面具有良好的药效,同时因毒性小,成为了近年来研究热点。
稀有人参皂苷Rg3存在20(R)-Rg3和20(S)-Rg3两种差向异构体,它们的生化特性因C-20位羟基的空间排列差异而异。如20(S)-Rg3对人肝癌细胞[11],肺癌细胞[12]及卵巢癌细胞[13]等都显示出比20(R)-Rg3更强的抑制作用;20(S)-Rg3对于治疗白血病也起一定作用;20(S)-Rg3也可阻断Ca2+、K+和Na+通道并抑制内皮细胞的冠状动脉收缩[14-15],这表明Rg3的2种差向异构体在某些药物活性方面显示出一定差异。另据报道[16],20(S)-Rg3比20(R)-Rg3在生物体内显示出更好的水溶性、生物利用度及耐受性,因此20(S)-Rg3的立体选择性制备受到广泛关注。目前Rg5的制备方法主要还是借助于加工人参(如红参、黑参)中分离[17],而20(S)-Rg3的制备方法主要采用酶催化法[18-19]。通过人参的热加工可以提高人参皂苷20(R/S)-Rg3和Rg5的含量,但加工时间长,而且S-Rg3的选择性低;酶催化法立体选择性很高,但酶容易失活,而且制备成本高。
PD型皂苷的降解是复杂的反应过程。以人参皂苷Rb1为例,通过不同糖苷键的水解反应,可以生成人参皂苷Rd、F2、(R,S)-Rg3、(R,S)-Rh2、(R,S)-PPD以及绞股蓝皂苷Gypenoside ⅩⅤⅡ和Gypenoside LⅩⅩⅤ等次级皂苷;还可以经C-20位糖苷键的水解,支链又可以发生多种变化,如生成烯烃(包括顺反异构体、位置异构体)、醇、环醚等物质[20-22](图1),人参皂苷Rg5就是在支链的C-20和C-22之间生成新的E-构型双键的次级皂苷。
由此可见,在众多可能的降解产物中,如何通过控制区域选择性和立体选择性低成本制备高生物活性次级稀有皂苷Rg5和20(S)-Rg3具有重要价值。本实验以PD型皂苷为原料,通过成本低廉的盐酸作酸催化剂高立体选择性制备Rg5和20(S)-Rg3,并探讨其反应机理,为Rg5和20(S)-Rg3的制备提供新的思路。

图1 人参皂苷Rb1的部分降解产物示意图Fig.1 Schematic diagram of partial degradation products of ginsenoside Rb1
1 材料与方法
1.1 材料与试剂
PD型皂苷(80%),恒久生物科技有限公司;人参皂苷Rb1(≥98%),成都曼斯特生物科技有限公司(甲醇),色谱纯、无水乙醇(分析纯,≥99%)、浓硫酸(色谱纯),天津市永大化学试剂有限公司;浓盐酸(分析纯),哈尔滨化工化学试剂厂;乙腈(色谱纯),美国Tedia公司;氯化钠、氯化钙,天津市大茂化学试剂厂;重氧水,萨恩化学技术有限公司。
1.2 仪器与设备
DK-98-Ⅱ型电热恒温水浴锅,天津市泰斯特仪器有限公司;RE-3000型旋转蒸发仪,上海亚荣生化仪器厂;LC3000 I型高效液相色谱仪,北京钢臣科技有限公司;80-1型电动离心机,金坛市华城开元实验仪器厂;BT25S型电子天平,赛多利斯科学仪器(北京)有限公司;TS-200B型恒温摇床,上海天呈实验仪器制造有限公司;PinnacleⅡ C18色谱柱,美国Restek。
1.3 实验方法
1.3.1 PD型皂苷的纯化
向质量分数为80%的PD型皂苷中加入10倍体积乙醚回流2 h,分出乙醚,自然干燥得脱脂PD型皂苷。向预处理的D101C大孔吸附树脂中加入质量浓度为15 mg/mL的脱脂PD型皂苷溶液,在恒温摇床中60 ℃、250 r/min条件下吸附12 h。将吸附人参皂苷的大孔树脂依次使用体积分数为30%、80%乙醇水溶液于60 ℃、250 r/min下分别静态解吸12 h,并将80%乙醇解析液用旋转蒸发仪浓缩,干燥得到含量为89.33%的PD皂苷,其中人参皂苷Rb1、Rc、Rb2、Rb3和Rd的含量分别为41.39%、13.19%、3.63%、4.52%和26.60%。
1.3.2 人参皂苷20(S)-Rg3和Rg5的制备方法
取1.5 mL离心管,分别加入1.5 mg纯化PD皂苷和100 μL乙醇至PD皂苷溶液质量浓度为15 mg/mL,再加入等体积的酸溶液,在恒温水浴锅中磁力搅拌下加热反应,并分别探索酸的种类、酸浓度、乙醇浓度、反应温度和反应时间对人参皂苷20(S)-Rg3和Rg5的收率影响。反应产物经冷却,加入适量的饱和碳酸钠溶液调pH至6左右,在45 ℃温度下用旋转蒸发仪浓缩至干。残留物用3 mL色谱纯甲醇溶解,0.45 μm滤膜过滤,进行HPLC分析,根据Rg3的2种差向异构体的收率(Y)计算20(S)-Rg3的非对映异构体过量百分比(de%)。计算如公式(1)所示:
(1)
式中:YS-Rg3表示差向异构体S-Rg3的收率;YR-Rg3表示差向异构体R-Rg3的收率。
1.3.3 HPLC分析方法
本实验中采用的色谱条件为:色谱柱PinnacleⅡC18(250 mm×4.60 mm,5 μm);流速1.0 mL/min;检测波长203 nm;柱温为室温;进样量15 μL;流动相A:乙腈;流动相B:纯净水(超声除气处理);梯度洗脱程序按照张仔豪等[20]的方法进行。
1.3.4 无水甲醇-盐酸溶液的制备
三口烧瓶中加入氯化钠固体,安装滴液漏斗和导气管。滴液漏斗中加入浓硫酸,室温下缓慢滴加到氯化钠中,此时产生的氯化氢气体由导气管经过氯化钙干燥管进入由冷肼冷却的无水甲醇溶液得到无水甲醇-盐酸溶液,用氢氧化钠重复标定3次,测得浓度为0.931 8 mol/L,密封,置于冰箱冷冻室备用。
1.3.5 20(S)-Rg3的生成机理研究
取1.5 mL离心管,加入100 μL质量浓度为15 mg/mL的人参皂苷Rb1,再分别加入浓度为0.02 mol/L无水甲醇-盐酸水溶液和无水甲醇-盐酸重氧水溶液,在恒温水浴锅中搅拌下60 ℃加热反应3.5 h。待反应产物冷却,加入适量饱和碳酸钠溶液将pH调至6后,在45 ℃温度下用旋转蒸发仪浓缩,残留物用3 mL色谱纯甲醇溶解,0.45 μm滤膜过滤,进行LC-MS分析,并根据Rg3的主要分子离子峰探索20(S)-Rg3的生成机理。
2 结果与分析
2.1 人参皂苷20(S)-Rg3和Rg5的制备条件优化
2.1.1 酸种类对制备人参皂苷20(S)-Rg3和Rg5的影响
固定PD皂苷质量浓度为15 mg/mL,依次加入100 μL浓度为0.02 mol/L无水乙醇-盐酸、无水乙醇-硫酸、无水乙醇-磷酸、无水乙醇-D-乳酸、无水乙醇-L-乳酸以及无水乙醇-乙酸溶液,在60 ℃条件下反应4 h。反应液经后处理,通过HPLC进行人参皂苷的定量分析,并以酸种类为横坐标,以20(S)-Rg3、20(R)-Rg3和Rg5的收率为纵坐标绘制如图2所示。

图2 不同种类的酸对制备20(S)-Rg3和Rg5的影响Fig.2 Effects of different acids on the preparation of 20(S)-Rg3 and Rg5
由图2可知,无机酸作酸催化剂时,均能生成人参皂苷Rg5,其中盐酸作酸催化剂时,Rg5的收率明显高于硫酸和磷酸催化剂。与此形成鲜明对比的是,D-乳酸、L-乳酸和乙酸等有机酸作酸催化剂时,几乎不生成人参皂苷Rg5。在人参皂苷Rg3的生成方面,同样盐酸显示出最好的收率,而且20(S)-Rg3的选择性非常高。因此,无论是从20(S)-Rg3和Rg5的收率方面还是20(S)-Rg3的立体选择性方面考虑,盐酸都是比较好的选择。
2.1.2 盐酸浓度对制备人参皂苷20(S)-Rg3和Rg5的影响
固定PD皂苷质量浓度为15 mg/mL,依次加入100 μL浓度为0.01、0.02、0.03、0.04、0.05 mol/L的盐酸乙醇溶液,在60 ℃反应4 h。实验结果如图3所示。
由图3可知,酸浓度对20(S)-Rg3、20(R)-Rg3和Rg5的影响有规律性变化。当酸浓度为0.01~0.02 mol/L时,20(S)-Rg3和Rg5的收率随酸浓度的增大而增大,当酸浓度进一步增大时,因20(S)-Rg3和Rg5的分解,收率逐步减小。对应不同酸浓度下的Rg3的de%值为89.67%、98.28%、97.55%、96.28%、96.93%,说明在0.02 mol/L及以上浓度盐酸催化下,均显示出非常高的非对映体过量百分比(de%)。

图3 盐酸浓度对制备20(S)-Rg3和Rg5的影响Fig.3 Effect of hydrochloric acid concentration on the preparation of 20(S) -Rg3 and Rg5
2.1.3 乙醇浓度对制备人参皂苷20(S)-Rg3和Rg5的影响
为了考察乙醇浓度对反应的影响,固定PD皂苷质量浓度为15 mg/mL,分别加入100 μL浓度为0.02 mol/L的用体积分数为99%、95%、90%、85%、80%的乙醇-水溶液配制的盐酸溶液,在60 ℃反应4 h。实验结果如图4所示。

图4 乙醇浓度对制备20(S)-Rg3和Rg5的影响Fig.4 Effect of ethanol concentration on the preparation of 20(S) -Rg3 and Rg5
由图4可知,人参皂苷Rg5、20(S)-Rg3和20(R)-Rg3的收率随着乙醇浓度的升高显示出不同的变化规律。人参皂苷Rg5的收率随着乙醇浓度的升高显示逐渐上升趋势;20(S)-Rg3的收率先上升后小幅下降,并在90%~100%(体积分数)乙醇溶液中保持基本稳定;而人参皂苷20(R)-Rg3收率变化规律不同于人参皂苷Rg5和20(S)-Rg3,显示出逐渐下降的变化趋势。这说明乙醇浓度的变化对Rg5的收率影响明显高于其对Rg3的收率影响,而且随着乙醇浓度的升高,20(S)-Rg3和20(R)-Rg3收率的不同变化规律对于提高20(S)-Rg3立体选择性非常有利,这也可以从随着乙醇浓度的升高,de%值(64.73%、51.70%、70.61%、86.81%、98.28%)逐渐增大的变化趋势得到印证。
2.1.4 反应温度对制备人参皂苷20(S)-Rg3和Rg5的影响
固定PD皂苷质量浓度为15 mg/mL,加入0.02 mol/L无水乙醇-盐酸溶液100 μL,分别在40、50、60、70、80 ℃下进行反应4 h。实验结果如图5所示。

图5 反应温度对制备20(S)-Rg3和Rg5的影响Fig.5 Effect of reaction temperature on the preparation of 20(S) -Rg3 and Rg5
由图5可知,反应温度对Rg5的收率影响非常显著。在反应温度为40~70 ℃,人参皂苷Rg5的收率呈现上升趋势,而温度进一步升高,因为皂苷的分解加速,收率逐渐降低;20(S)-Rg3的收率在40~60 ℃缓慢升高,进一步升高温度开始下降;而20(R)-Rg3在40~60 ℃几乎不生成,而随着温度的进一步升高,20(R)-Rg3的收率逐渐缓慢升高,到60~70 ℃时其收率与20(S)-Rg3的收率曲线发生交叉,这说明较高的反应温度不利于20(S)-Rg3的立体选择性制备。而反应温度由低到高的de%为99.85%、97.29%、98.28%、67.59%、86.85%[67.59%、86.85%是20(R)-Rg3对20(S)-Rg3的过量百分比],说明在40~60 ℃,20(S)-Rg3对20(R)-Rg3的de%很高,而进一步升高温度,反而是20(R)-Rg3对20(S)-Rg3的de%升高。综合考虑Rg5和20(S)-Rg3的收率和de%,选择60 ℃进行了进一步的优化。
2.1.5 反应时间对制备人参皂苷20(S)-Rg3和Rg5的影响
固定PD皂苷质量浓度为15 mg/mL,依次加入100 μL浓度为0.02 mol/L的无水乙醇-盐酸溶液,在60 ℃分别反应1.5、2、2.5、3、3.5、4 h,实验结果如图6所示。

图6 反应时间对制备20(S)-Rg3和Rg5的影响Fig.6 Effect of reaction time on the preparation of 20(S)-Rg3 and Rg5
由图6可知,反应时间对Rg5的收率影响较大,但对20(S)-Rg3、20(R)-Rg3影响不是很大。在反应时间为3.5 h时,人参皂苷Rg5和20(S)-Rg3的如率达到最高,在反应时间高于3.5 h,人参皂苷Rg5的收率有所降低。对应反应时间由小到大的20(S)-Rg3的de%值分别为90.73%、93.77%、90.89%、92.88%、98.28%,表明在60 ℃条件下在无水乙醇溶剂中整体显示出较高水平,且4 h时de%值最高,此时Rg5和20(S)-Rg3的收率分别为50.12%和15.32%。
为了考察其他醇溶剂对反应的影响,在上述较优反应条件下,用无水甲醇为溶剂进行了反应。反应产物的HPLC分析结果表明(图7),甲醇为反应溶剂时与乙醇一样主要生成人参皂苷Rg5,同时也会高立体选择性生成20(S)-Rg3。

图7 无水甲醇和无水乙醇中PD人参皂苷的 酸水解产物HPLC对比图Fig.7 HPLC comparison of acid hydrolysates of PD ginsenosides in anhydrous methanol and ethanol
由图7可知,无论是无水甲醇或无水乙醇作为溶剂,PD型人参皂苷在酸催化下的结构转化产物主要都是人参皂苷Rg5。人参皂苷Rz1和人参皂苷Rk1是人参皂苷Rg5的同分异构体,其中Rg5和Rz1是内烯烃,是符合Zaitsev’s规则产物,相对较稳定,Rk1是端烯烃,是非Zaitsev’s规则(Hofmann规则)产物,相对不稳定。由于人参皂苷Rg5是能量上更稳定的E-构型结构,因此很容易判断3种同分异构体中其主要生成物为人参皂苷Rg5。人参皂苷Rg3作为PD型皂苷在C-20位的糖降解产物,由于降解方式的不同可分为构型保持的20(S)-Rg3和构型发生Walden翻转的20(R)-Rg3,仅从C-20位羟基的空间排列不同,无法从稳定性直接判断哪一种构型为主产物,为此对人参皂苷S-Rg3的生成机理进行了进一步的探索。
2.2 人参皂苷S-Rg3的生成机理
由文献[23-24]可知,人们普遍认为酸性条件下人参皂苷Rg3是通过碳正离子中间体机理生成,即反应是SN1机理。而在实验过程中发现,酸性条件下水解PD型皂苷,有时R-Rg3的生成远多于S-Rg3[24],有时如同本文中S-Rg3的生成远多于R-Rg3,因此对其生成机理产生了浓厚兴趣。为了探索本研究中高立体选择性生成S-Rg3的反应机理,利用Winstein离子对机理进行了2种Rg3差向异构体的生成预测,同时选择PD皂苷中含量最高的人参皂苷Rb1为原料,利用同位素标记法进行了人参皂苷的水解反应。
如图8所示,假设人参皂苷Rg3是SN1反应产物,按照Winstein离子对机理,PD型皂苷在酸性条件下质子化后生成自由三级碳正离子的过程中,分别经过三级碳正离子和二糖(或单糖)的紧密离子分子对、溶剂分离子分子对以及最后的自由碳正离子和二糖(或单糖)阶段,而亲核试剂在其中任何一个阶段都可以进攻碳正离子。如果亲核试剂H2O在紧密离子分子对阶段或溶剂分离子分子对阶段进攻碳正离子,由于糖分子的空间阻碍,H2O主要从糖的反向进攻碳正离子,因此主要得到构型发生Walden翻转的R-构型产品;当亲核试剂H2O在自由离子阶段进攻碳正离子时,碳正离子和糖之间足够远离,不会阻碍亲核试剂的进攻路线,此时H2O从碳正离子正反两端进攻几率相等,会得到1∶1的R-Rg3和S-Rg3。显然,酸性条件下的Rg3的生成如果为SN1反应机理,理论上构型翻转的R-Rg3多于构型保持的S-Rg3。而本实验中生成S-Rg3的立体选择性非常高,这表明S-Rg3的生成主要反应机理并非SN1机理,可能是SN2机理。
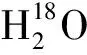
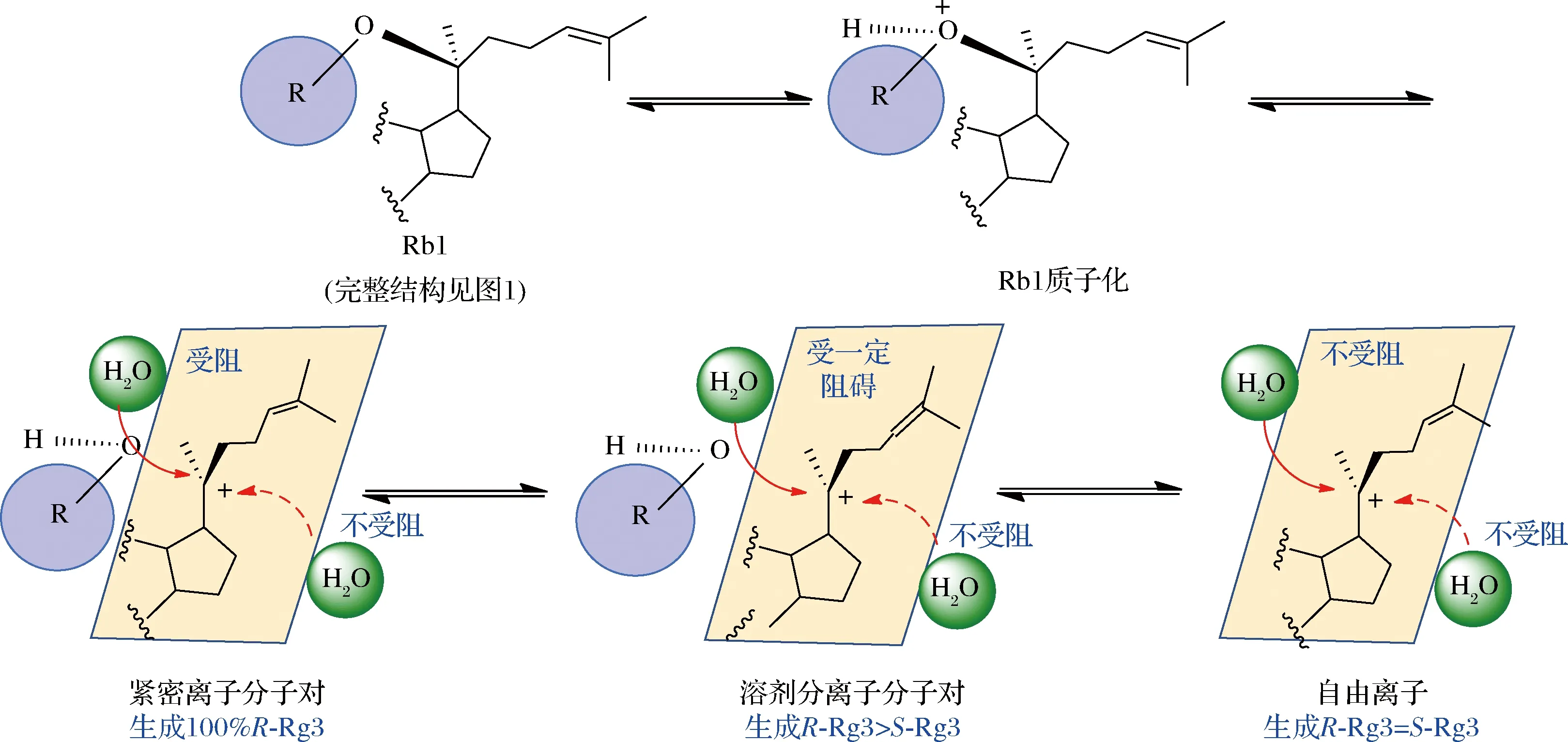
图8 基于Winstein离子对机理的人参皂苷Rg3的生成示意图Fig.8 Schematic diagram of ginsenoside Rg3 based on Winstein ion pair mechanism

A-99%甲醇;B-95%甲醇;C-50%甲醇图9 甲醇水溶液中的Rb1的酸催化反应产物的LC-MS 分析图Fig.9 LC-MS analysis of acid catalyzed reaction products of Rb1 in methanol aqueous solution
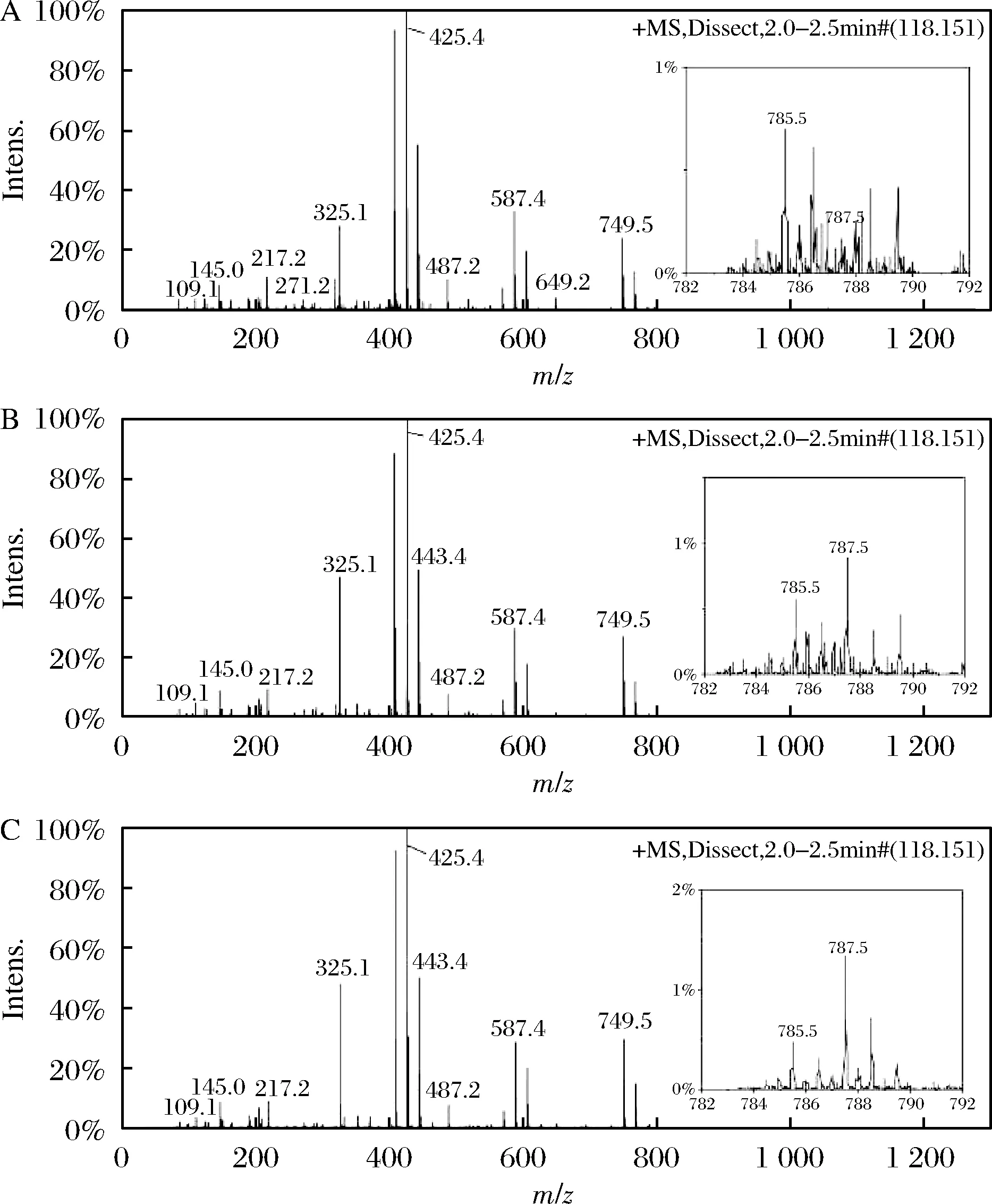
A-99%甲醇;B-95%甲醇;C-50%甲醇图10 甲醇重氧水溶液中的Rb1的酸催化 反应产物的LC-MS分析图Fig.10 LC-MS analysis of acid catalyzed reaction products of Rb1 in methanol heavy oxygen aqueous solution
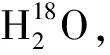
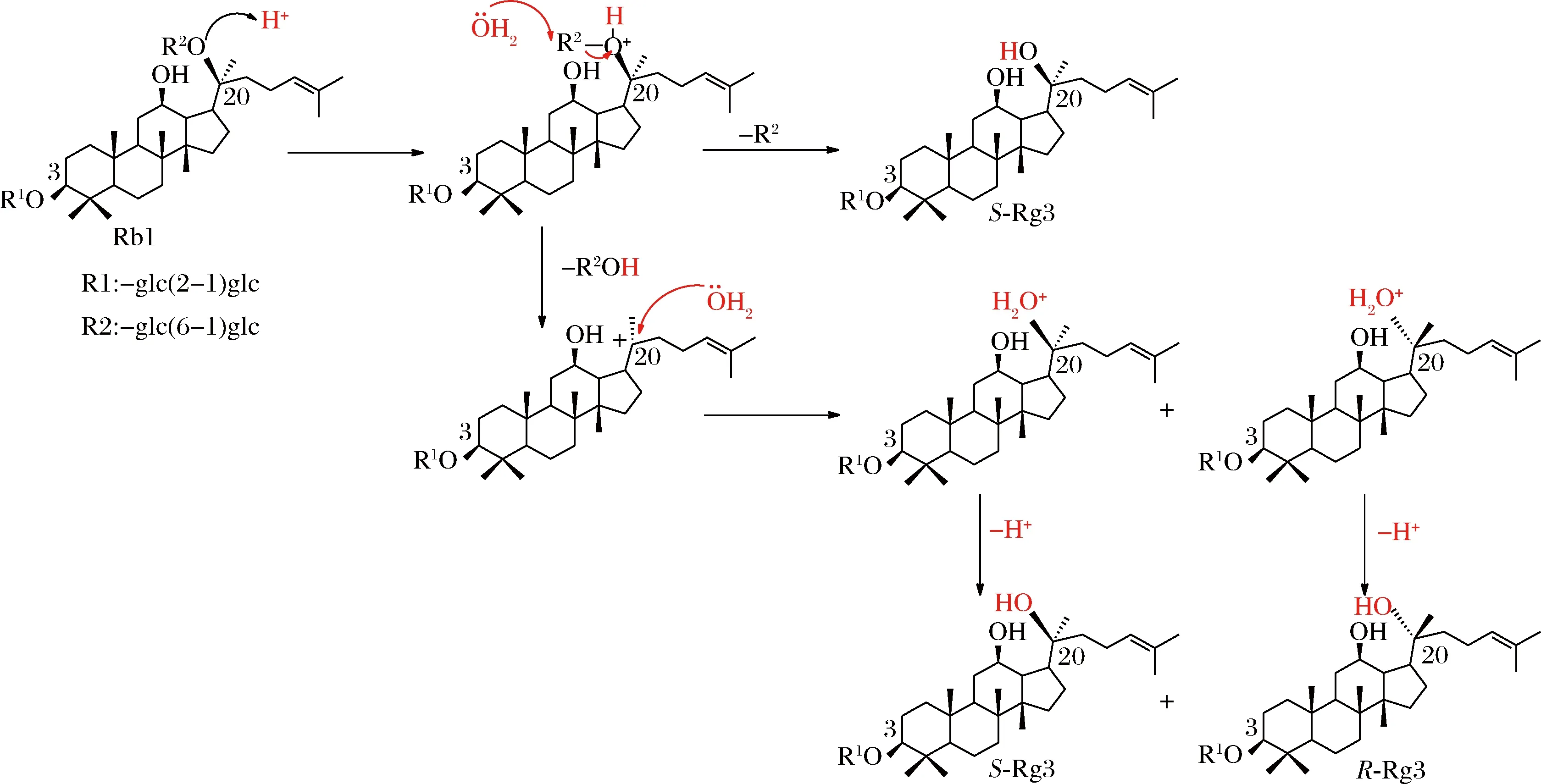
图11 立体选择性生成S-Rg3的反应机理Fig.11 Reaction mechanism of stereoselective formation of S-Rg3
3 结论
PD型人参皂苷在结构上因含有双键及C-3和C-20位连有不等糖基数目的糖苷键,降解产物复杂多样。本文利用价格相对低廉的PD型皂苷为原料,探索了通过酸催化法高立体选择性制备人参皂苷Rg5和20(S)-Rg3的方法,并研究了立体选择性生成20(S)-Rg3的生成机理。实验表明,酸的类型和溶剂的种类以及溶剂中水含量对于人参皂苷Rg5的收率以及立体选择性生成S-Rg3有非常大的影响。通过盐酸作催化剂,无水乙醇或甲醇作反应溶剂进行皂苷降解反应,可以得到较高收率的人参皂苷Rg5,同时可以高立体选择性得到20(S)-Rg3。通过同位素标记法进行Rg3的生成机理研究表明,水含量对Rg3的生成机理影响显著,水含量越多,越有利于进行SN1反应生成Rg3差向异构体混合物,水含量越少,越有利于进行SN2反应生成构型保持的S-Rg3。S-Rg3的制备过去主要依赖于酶催化方法,虽然选择性很高,但酶的底物特异性导致皂苷的适用范围受限,而且酶容易失活,难以保存,导致成本较高。本研究表明,利用简单的化学方法可以实现较高收率制备稀有人参皂苷Rg5,同时又可以像酶催化一样高立体选择性制备人参皂苷S-Rg3,从而降低S-Rg3的制备成本,这对于同时选择性制备高附加值稀有皂苷具有重要参考价值。
