m6A甲基化酶相关基因在牛骨骼肌生成中的表达
2023-02-01杨昕冉马鑫浩杜嘉伟昝林森
杨昕冉,马鑫浩,杜嘉伟,昝林森,2
m6A甲基化酶相关基因在牛骨骼肌生成中的表达
杨昕冉1,马鑫浩1,杜嘉伟1,昝林森1,2
1西北农林科技大学动物科技学院,陕西杨凌 712100;2国家肉牛改良中心,陕西杨凌 712100
【】近年来,RNA m6A甲基化修饰在肌肉发育中的作用不断被发现,通过探究m6A甲基化酶相关基因,包括,,,和,在牛肌肉组织以及骨骼肌卫星细胞(skeletal muscle satellite cells, SMSCs)增殖和分化过程中的表达,同时分析体外成肌分化过程中m6A甲基化水平的变化,为阐明m6A修饰在骨骼肌发育中的作用及机制提供参考。【】使用实时荧光定量PCR(RT-qPCR)技术检测m6A甲基化酶相关基因在新生和成年牛不同部位骨骼肌中的表达。随后在秦川牛肉用新品系背最长肌中分离SMSCs,通过生长曲线、免疫荧光和RT-qPCR技术验证SMSCs的增殖和成肌分化功能,使用RT-qPCR检测m6A甲基化酶相关基因在SMSCs增殖期24、36、48、60、72 h和分化第0、2、4、6、8天中的时序表达谱。最后利用LC-MS/MS和Dot blot技术检测SMSCs分化过程中m6A甲基化水平的变化。【】、和等m6A甲基化转移酶基因在成年牛背最长肌、前腿肌和后腿肌中的表达量均显著低于新生牛(<0.01)。和等m6A去甲基化酶基因在成年牛后腿肌中的表达更高(<0.01),在成年牛背最长肌中的表达也较高(<0.01)。分离的SMSCs具有良好的生长状态且可正常成肌分化。在SMSCs增殖期,表达逐渐下降,但在增殖后期时明显提高。在增殖期的表达变化差异不明显,则在增殖48 h后表达逐渐降低。而和在增殖期的时序表达类似,60 h之前变化不显著,但在72 h时显著提高。在SMSCs成肌分化过程中,、和的表达模式基本一致,分化前期上升,随后下降,在分化末期表达增加。而的表达随分化进行逐渐增加,则在分化前4天表达上升,随后不断下降。此外,在SMSCs分化过程中,mRNA的整体m6A水平下降(<0.01)。【】m6A甲基转移酶和去甲基化酶在新生牛和成年牛骨骼肌中的表达变化存在较为明显的差异,表明m6A修饰可能对秦川牛骨骼肌的发育具有重要作用。同时,这些m6A相关甲基化酶可能参与调控牛骨骼肌卫星细胞的增殖和分化。这一发现为研究m6A甲基化修饰调控骨骼肌生成的作用及机制提供理论依据。
m6A;m6A甲基化酶;牛;骨骼肌卫星细胞;细胞增殖;成肌分化
0 引言
【研究意义】畜禽的产肉量和肉品质离不开骨骼肌的生长发育及其遗传特性。骨骼肌也是机体重要的运动和能量代谢组织,对于维持机体代谢平衡和稳态起到重要作用。因此,研究骨骼肌的生长发育规律对于提高肉用动物生产性能和开展肌肉生理病理学研究十分重要。此外,利用分子育种技术改良产肉性能是培育优良肉牛品种的重要途径,挖掘更多关键的分子标记对肉牛的定向选育也具有重要意义。【前人研究进展】骨骼肌生成是一个非常复杂的生物学过程,从肌卫星细胞激活到成肌细胞增殖最终到终末分化阶段,这一过程除了受到关键的转录因子调控外,一些表观遗传如DNA甲基化、组蛋白修饰等也发挥着重要的作用[1]。而m6A(N-甲基腺嘌呤,N-methyladenosine)甲基化修饰作为近几年的研究热点,其在牛骨骼肌生长发育中的作用及分子机制尚不清楚。作为mRNA中最常见的甲基化修饰,m6A主要富集在mRNA的启动子区、终止密码子区以及特定motif内。m6A甲基化修饰被证明具有可逆性,由包括甲基转移酶样蛋白3(methyltransferase 3, METTL3)、甲基转移酶样蛋白14(methyltransferase 14, METTL14)和肾细胞瘤1-结合蛋白(Wilms’ tumor 1-associating protein, WTAP)等组成甲基转移酶复合物催化RNA上腺苷酸发生m6A修饰,同时脂肪量与肥胖相关蛋白(fat mass and obesity-associated protein, FTO)和Alk B同源蛋白5(AlkB homolog 5, ALKBH5)等去甲基化酶可以对已发生m6A修饰的碱基进行去甲基化修饰[2-5]。越来越多的证据表明m6A修饰通过在转录后水平调控RNA的稳定性、定位、运输、剪切和翻译进而在调控细胞命运、细胞周期、胚胎干细胞重编程、个体发育等方面发挥着重要的生物学功能[6-9]。近年来,m6A在肌生成过程中的重要调控作用也逐渐被揭开。研究发现FTO通过发挥去m6A甲基化作用正向调控mTOR-PGC-1α信号通路调节线粒体的合成进而促进肌生成[10]。METTL3可以通过催化下游mRNA发生m6A修饰,进而促进小鼠原代成肌细胞和C2C12细胞的分化[11]。此外,已有研究报道了猪、牛、鹅等畜禽动物肌肉组织发育及成肌细胞分化中的转录组m6A甲基化修饰图谱[12-15],揭示m6A在畜禽肌肉生长发育中的潜在调控作用。【本研究切入点】但m6A甲基化修饰在牛肌肉发育中的试验研究鲜见报道,同时其在体外调控肌细胞增殖与分化的功能和机制仍不明确。【拟解决的关键问题】秦川牛是我国良种黄牛的代表性品种,具有耐粗饲、抗逆性强、肉质细嫩、大理石花纹明显、遗传性能稳定等优点[16],但也存在生长速度较慢、后躯发育不充分、产肉性能有待提高等缺点。本研究即以秦川肉牛骨骼肌组织和骨骼肌卫星细胞(SMSCs)为研究对象,探究、、、和等m6A甲基化基因在秦川肉牛不同部位骨骼肌以及体外SMSCs增殖和分化过程中的表达情况,同时检测SMSCs成肌分化过程中的m6A甲基化水平。一方面为秦川肉牛的遗传改良和分子育种提供理论依据,另一方面从RNA甲基化这一新的表观遗传修饰角度研究其对骨骼肌生成的潜在作用。
1 材料与方法
1.1 试验时间与地点
试验于2019年11月至2021年8月在西北农林科技大学国家肉牛改良中心平台实验室完成。
1.2 组织采集和细胞分离、培养与诱导分化
试验所用牛只为西北农林科技大学国家肉牛改良中心良种繁育场培育的秦川牛肉用新品系(以下简称“秦川肉牛”),分别选取3头身体健康、状态良好的新生和成年秦川肉牛(36月龄,均为母牛),分别采集其背最长肌、前腿肌和后腿肌组织样品,置于-80℃保存待用。骨骼肌卫星细胞分离于上述新生秦川肉牛的背最长肌[17]。取2 g肌肉组织剪碎,在含有20 mmol·L-1中性蛋白酶、1X胶原蛋白酶II和5 mmol·L-1MgCl2的HEPES缓冲液中37℃消化30 min,加入含有10%FBS的DMEM/F12培养基(完全培养基)终止消化,依次过100和40 μm的细胞筛,滤液在300×、4℃下离心10 min,收集沉淀且重悬于完全培养基中。细胞生长至80%—100%密度时,进行传代培养,每两天进行一次换液。待细胞生长至90%密度时,将含有20%FBS和1%双抗的DMEM/F12培养基换成含有2%马血清和1%双抗的DMEM/F12培养基,诱导成肌分化。
1.3 RNA提取与cDNA合成
使用Trizol法提取组织和细胞中的总RNA,通过酶标仪检测RNA的纯度和浓度,OD 260/280比值在1.8—2.0的RNA被认为纯度良好,放于-80℃保存备用。总RNA的提取方法参考实验室之间的报道[18]。使用反转录试剂盒(RR047A,Takara,大连)将总RNA反转录为cDNA,其中去除DNA反应体系为:依次加入2.0 μL 5X gDNA Eraser Buffer、1.0 μL gDNA Eraser、1 000 ng总RNA和RNase-free dH2O补足10 μL,42℃反应2 min。反转录反应体系为:在上述反应液中依次加入4.0 μL 5X PrimeScript Buffer、4.0 μL RNase-free dH2O、1.0 μL RT Primer Mix和1.0 μL PrimeScript RT Enzyme Mix,共计20 μL,37℃反应15 min,85℃中15 s终止反应。cDNA放于-20℃保存备用。
1.4 实时荧光定量PCR(RT-qPCR)
使用TB GreenTMPremix Ex TaqTMII (Tli RNase H Plus)(RR820A,Takara,大连)荧光定量试剂盒进行RT-qPCR。15 μL的反应体系为:7.5 μL TB Green Premix Ex Taq(2X)、各0.5 μL的上下游引物、1.5 μL cDNA模板(10倍稀释)和5.0 μL RNase-free H2O,95℃预变性30 s,95℃ 3 s、60℃ 30 s、40个循环。使用为内参基因,每个样品均设置不少于3个生物学重复,采用2−ΔΔCt法计算mRNA的相对表达量。RT-qPCR所用的引物见表1。
1.5 细胞生长曲线检测
细胞在10 cm细胞培养皿中生长至90%—100%密度时,进行传代培养,将细胞接种至96孔板,在细胞生长的第12、24、36、48、60、72和84小时分别加入10 μL CCK-8(C0005,TargetMOI, 美国),每次处理后继续在培养箱中37℃反应2 h,将细胞取出,在酶标仪上检测450 nm时的吸光度(OD值),每组设置4个生物学重复。细胞培养期间,每2 d进行换液。
1.6 免疫荧光
取出细胞,PBS清洗2次后,加入4%多聚甲醛室温固定30 min,PBS清洗。加入0.2% TritonX-100通透10 min。PBS洗2遍,加入含有1%牛血清白蛋白、10% 驴血清和0.3 mol·L-1甘氨酸的PBS室温封闭1 h。然后使用特异性一抗在4℃过夜孵育,PBS再清洗3遍后,加入对应的二抗37℃孵育2 h。用PBS清洗后加入0.1% DAPI进行细胞核染色15 min。最后清洗后加入PBS保持细胞湿润,即刻在荧光显微镜(Olympus IX71,日本)下拍照。所使用的一抗为:anti-MYOD1(ab16148, Abcam)、anti-PAX7(ab187339, Abcam)和anti-MYHC(GTX20015, GeneTex),二抗为:Alexa Fluor 555-conjugated donkey anti-rabbit IgG(ab150074, Abcam)和488-conjugated goat anti-mouse IgG(ab150113, Abcam)。

表1 RT-qPCR所用引物
1.7 LC-MS/MS
按照mRNA纯化试剂盒PolyATtract mRNA Isolation Systems Kit(Z5300,Promega,美国)的操作指南纯化总RNA,得到mRNA。将100—200 ng mRNA用含有25 mmol·L-1NaCl和2.5 mmol·L-1ZnCl2的核酸酶P1在42℃消化2 h,然后加入1 mol·L-1NH4HCO3和0.5 U碱性磷酸酶37℃消化2 h,过滤后上机检测。检测平台为西北农林科技大学大型仪器设备共享平台——园艺科学研究中心,使用的仪器是Agilent 1290 Infinity II - 6470(Agilent Technology, 美国)。基于标准曲线计算浓度,进而计算N-甲基腺苷(m6A)和腺苷酸(A)的比值。
1.8 Dot blot
将纯化后的mRNA稀释至100—200 ng·μL-1,95℃下变性3 min。在Hybond-N+膜(GE Healthcare,美国)上滴加1 μL mRNA,紫外交联15 min。用5%脱脂奶粉封闭2 h后,加入m6A特异性抗体(202003,Synaptic Systems,德国)4℃过夜孵育。然后用二抗(HRP-conjugated goat anti-rabbit IgG, D110058, Sangon Biotech)室温孵育1 h,1x TBST清洗3次后,采用化学发光法显影。显影后的膜用0.02%亚甲蓝(0.3 mol·L-1醋酸钠配制)染色30 min。
1.9 统计分析
使用GraphPad Prism 7.00软件进行数据统计分析并生成图片。分别用独立样本检验和单/双因素方差分析(One/Two-way ANOVA)比较两组和多组之间的差异,以<0.05为差异显著,<0.01为差异极显著,结果均以平均值±标准差来表示。
2 结果
2.1 m6A甲基化酶相关基因在秦川肉牛不同部位骨骼肌中的表达分析
为了检测m6A甲基化酶相关基因在肉牛不同部位肌肉中的表达水平,分别采集新生牛和成年牛的背最长肌、前腿肌和后腿肌组织,并提取总RNA。RT-qPCR的结果发现m6A甲基转移酶、和在成年牛不同部位骨骼肌中的表达量均显著低于新生牛(图1-A—C,<0.05),并且在新生牛背最长肌中的表达量明显高于前腿肌和后腿肌(图1-A—C,<0.05)。m6A去甲基化酶在不同月龄牛背最长肌和前腿肌中的表达无显著差异,而在成年牛后腿肌中的表达显著高于新生牛(图1-D,<0.05),同时在新生牛后腿肌中的表达最低。另一个m6A去甲基化酶在成年牛背最长肌和后腿肌中的表达均显著高于新生牛,而在前腿肌中则相反(图1-E,<0.01)。有意思的是,与新生牛相比,和在成年牛后腿肌中的表达有着上升的趋势,这个结果与上述m6A甲基化转移酶、和的结果相反,说明这5个m6A甲基化酶相关基因可能参与后腿肌的生长发育调控,且与它们发挥的m6A甲基化修饰作用一致。
2.2 秦川肉牛骨骼肌卫星细胞(SMSCs)的增殖状态检测
为了进一步研究m6A甲基化酶相关基因在体外骨骼肌细胞中的表达模式,在新生牛背最长肌中分离了骨骼肌卫星细胞(SMSCs)。从图2-A中可以看到,将SMSCs接种到6孔板培养后,细胞可以正常增殖,生长状态良好,细胞密度随时间逐渐增加。SMSCs的生长曲线也基本呈现“S”型,从前期缓慢生长到中期快速增长,在72 h时细胞基本长满且达到生长平台期(图2-B)。配对盒基因7(paired box 7,PAX7)和成肌分化因子1(myogenic differentiation 1,MYOD1)是SMSCs的标记基因,常被用来鉴定SMSCs[19-20]。因此,为了鉴定本研究分离的细胞为骨骼肌卫星细胞,在细胞生长至48 h时,使用免疫荧光检测细胞增殖期MYOD1和PAX7的表达。如图2-C所示,MYOD1(绿色荧光)和PAX7(红色荧光)均有表达,而且可以明显看出MYOD1的荧光较弱,表达较低。这些结果可以初步确定本研究分离的细胞为骨骼肌卫星细胞,且具有正常的增殖能力。
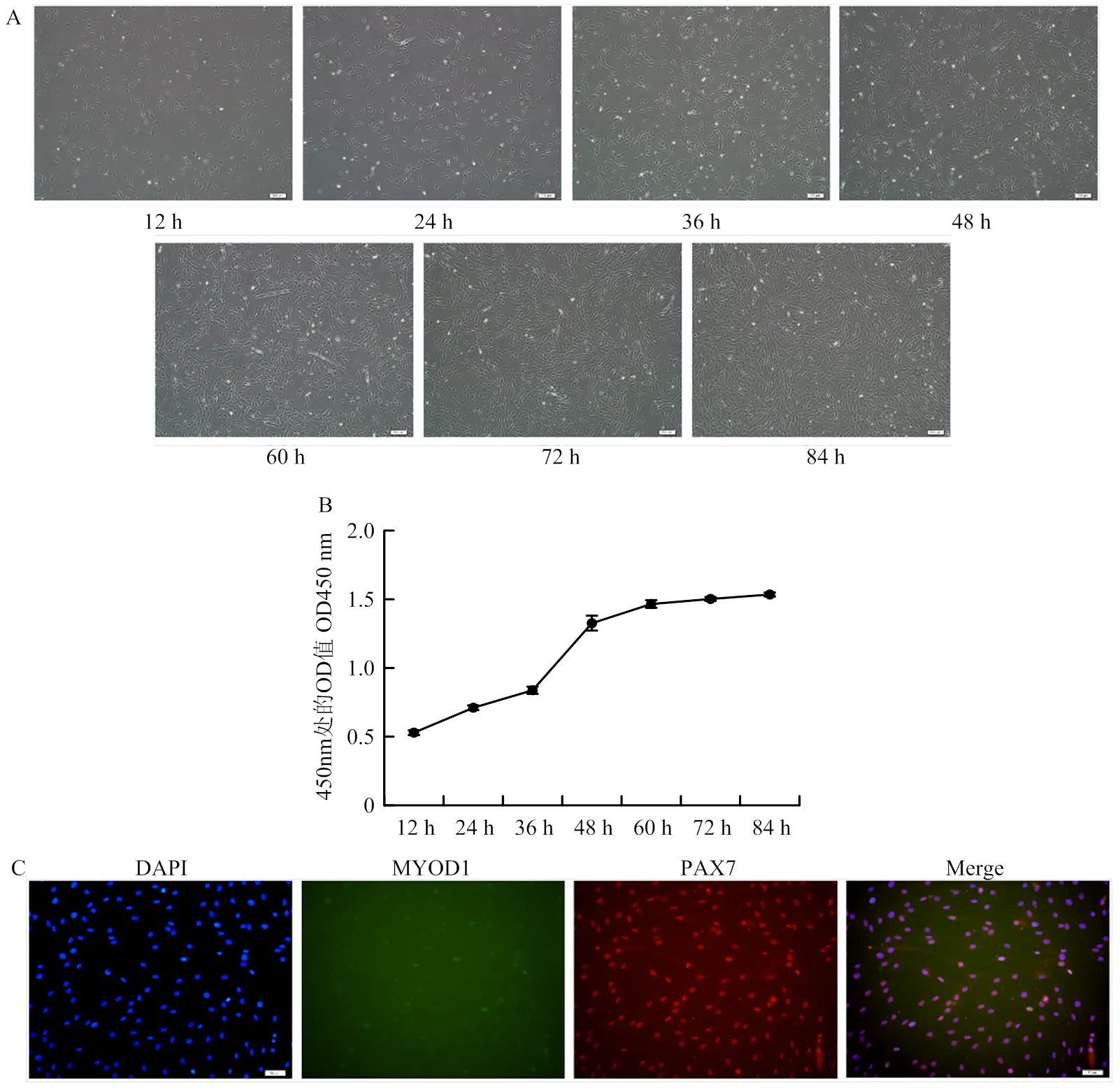
A:秦川肉牛SMSCs增殖期不同生长时间点的表型观察;B:秦川肉牛SMSCs的生长曲线;C:秦川肉牛SMSCs生长48 h时PAX7和MYOD1的免疫荧光检测
2.3 秦川肉牛骨骼肌卫星细胞(SMSCs)的成肌分化鉴定
骨骼肌的生长发育关键在于肌细胞的分化,即成肌细胞融合形成多核肌管,进而形成肌纤维的能力。为了验证本研究分离的SMSCs具有成肌分化的特性,细胞密度至90%—100%时进行诱导成肌分化,记为第0天(D0)。诱导分化的结果如图3-A所示,细胞长满后逐渐融合形成肌管,分化第2天已有较短的肌管开始出现,呈长条状。随着分化时间的延长,肌管的长度和亮度也随之增加。分化D4和D6肌管明显增多;但在分化晚期第8天,细胞逐渐停止融合,与D6相比,肌管数量和长度并没有明显增加。多核肌管会特异性表达肌球重链蛋白(myosin heavy chain,MYHC),笔者通过免疫荧光检测了SMSCs分化过程中肌管标志基因MYHC的表达。如图3-B所示,分化第2天,MYHC的荧光微弱,表达水平低,肌管形成较少;到分化第4天,MYHC蛋白荧光明显增强,肌管大量出现;在分化第6天,可以明显看到肌管变长。随后分别提取了SMSCs分化第0、2、4、6、8天的总RNA,对、、和等与骨骼肌成肌分化密切相关的特异性转录因子和成肌基因进行了相对表达量检测。结果发现和的表达在D4达到最高,随后逐渐下降;的表达随分化的进行不断增加,而的表达在分化前6 d不断上升,在第8天的表达有所下降,这些基因的时序表达趋势与骨骼肌成肌分化的规律基本相符(图3-C)。这些结果表明本试验成功分离出了牛骨骼肌卫星细胞,且SMSCs具有正常的增殖和成肌分化能力,可以用于后续试验。
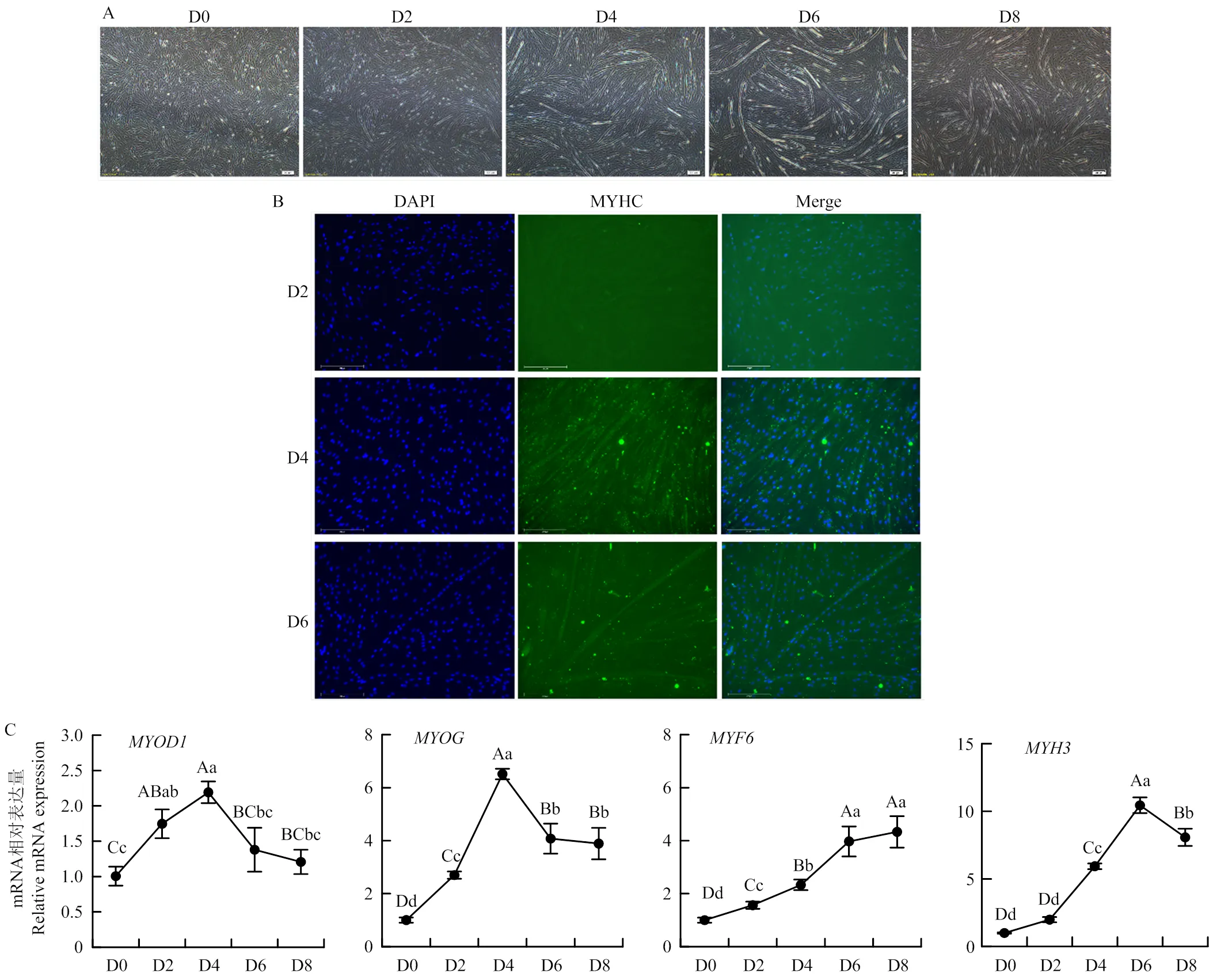
A:秦川肉牛SMSCs成肌分化第0、2、4、6、8天的表型观察;B:秦川肉牛SMSCs成肌分化过程中MYHC的荧光检测;C:骨骼肌生成特异性基因(MYOD1、MYOG、MYF6和MYH3)在秦川肉牛SMSCs成肌分化过程中的表达量检测。不同的大写字母表示差异极显著(P<0.01),不同的小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。下同
2.4 m6A甲基化酶相关基因在SMSCs增殖过程中的时序表达谱
为了研究m6A甲基化修饰对骨骼肌生长发育的潜在影响,首先对上述5个m6A甲基化酶相关基因在SMSCs增殖期的不同时间点(24、36、48、60和72 h)进行了时序表达检测,结果如图4所示。甲基转移酶的表达量在增殖过程中不断降低,但在72 h细胞接近长满时显著升高(图4-A),说明与SMSCs的增殖负相关,可能发挥负调控的作用。和则是在48 h前表达有所上升,而后降低,与不同的是,在72 h时表达再次上升(图4-B和C)。去甲基化酶和在SMSCs增殖期的表达模式基本一致,前期保持稳定表达,表达水平基本不变,而在72 h高表达(<0.01,图4-D和E)。结果中发现、、和均在细胞接近长满时的表达明显上升,表明m6A修饰可能主要在SMSCs增殖末期发挥作用。
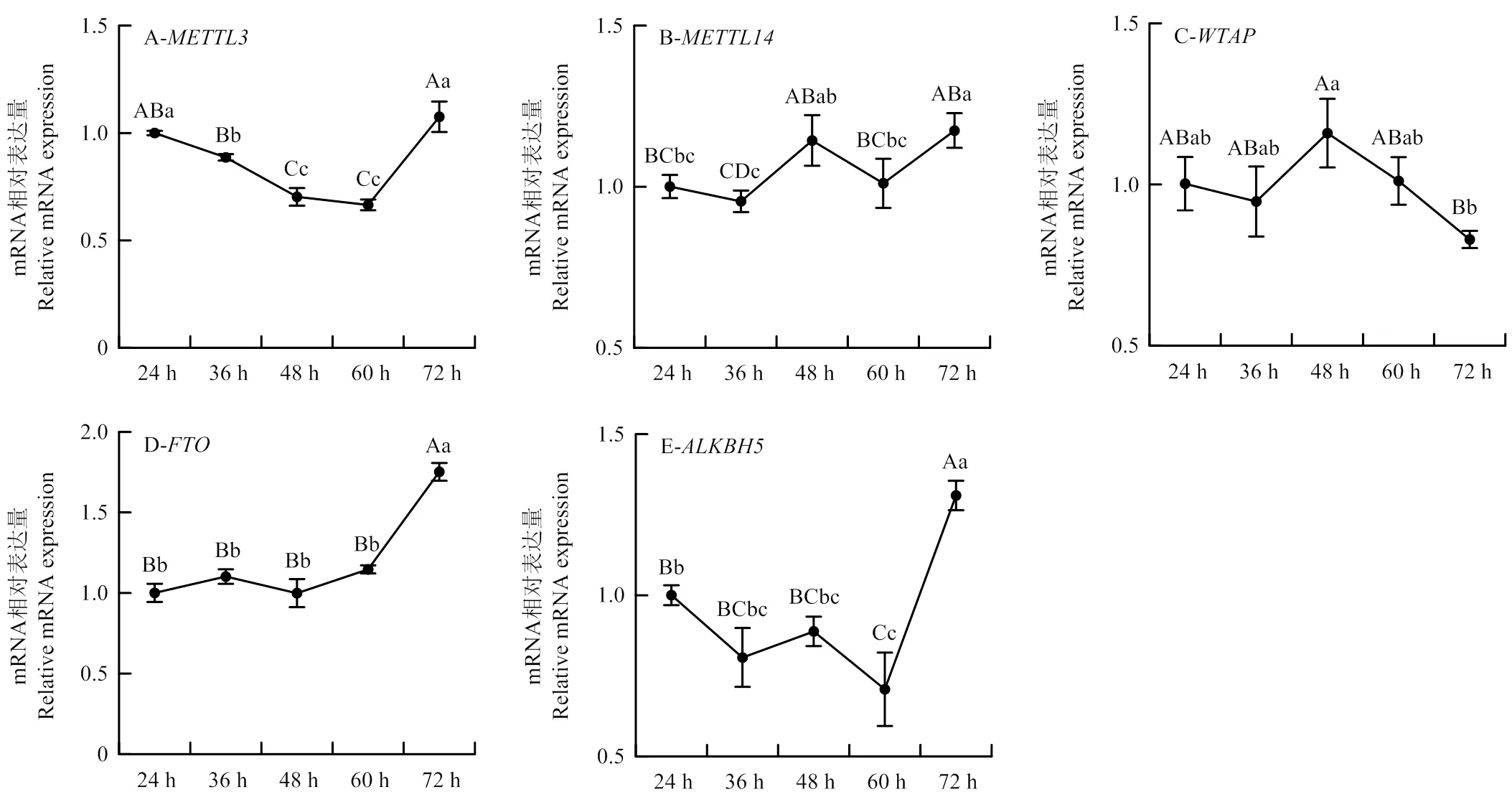
A:METTL3在SMSCs增殖中的时序表达谱;B:METTL14;C:WTAP;D:FTO;E:ALKBH5
2.5 m6A甲基化酶相关基因在SMSCs成肌分化过程中的时序表达谱
使用RT-qPCR检测了上述5个m6A相关酶基因在SMSCs成肌分化不同时间点(D0、D2、D4、D6、D8)的时序表达谱。结果发现,甲基转移酶、和的表达趋势一致,均在分化开始后表达升高,第2天后表达降低,到分化晚期D8时又显著增加达到最高表达水平(图5-A—C)。但其中的表达量变化较为不明显(图5-C)。去甲基化酶FTO则是在分化前中期维持稳定的表达量(>0.05),在分化晚期D8高表达(<0.01)(图5-D)。有趣的是,在SMSCs增殖和分化过程中的表达模式非常相似(图4-D和图5-D)。而的表达在分化前期不断增加,在D4达到高表达,随后逐渐下降,但均较D0的水平高(图5-E)。不管是m6A甲基转移酶还是m6A去甲基化酶均在分化前期表达增加,但m6A甲基转移酶在分化中期的表达明显降低,m6A去甲基化酶则基本维持了高表达,这很可能说明了m6A甲基转移酶和m6A去甲基化酶对SMSCs的分化具有重要且相反的调控作用。
2.6 SMSCs分化过程中m6A水平分析
从以上结果可以发现,m6A甲基化酶相关基因在SMSCs增殖和分化过程中存在显著变化的表达模式,表明它们可能调控骨骼肌生成。基于这些结果,笔者进一步分析了SMSCs分化过程中(D0、D2、D4)m6A甲基化修饰水平的变化。LC-MS/MS和Dot blot的结果均显示分化第4天的m6A水平显著低于D0和D2(图6)。结合m6A甲基化酶相关基因在分化过程中的时序表达模式,可以推测分化后m6A水平降低可能与m6A甲基转移酶和在分化D4表达下降,以及m6A去甲基化酶和表达不断增加的趋势有关。同时也表明了m6A甲基化修饰可能负调控SMSCs的成肌分化。
3 讨论
3.1 m6A甲基化研究进展及其在骨骼肌发育中的研究意义
虽然m6A甲基化修饰早在20世纪70年代就被发现[21],但由于检测仪器和方法学的限制,其具体的分子功能和作用机制却一直处于未知阶段。而随着m6A甲基化修饰动态可逆模式的发现[4]和m6A-seq技术的开发[22-23],m6A修饰发挥的生物学功能不断被揭示,RNA甲基化修饰也成为近十年的研究热点。近年来,m6A在多种生物学过程中的功能不断被发现,包括在猪、羊、鸡、鹅等畜禽动物肌肉和脂肪生长发育中的重要作用也逐渐被揭开[12-14, 24],但其在牛体内和体外的研究仍鲜少报道。而由于我国肉牛业起步较晚,本土的地方黄牛品种一直饱受生长速度慢、产肉性能较国外优良肉牛品种差距较大等因素的困扰,因此,如何提高地方黄牛的产肉量和肉品质是国内肉牛育种工作者亟待解决的共同问题。本研究选用国内良种黄牛——秦川肉牛为研究对象,成功建立了秦川牛骨骼肌卫星细胞(SMSCs)体外培养和成肌分化的模型。研究m6A甲基化酶、、和m6A去甲基化酶、在秦川牛骨骼肌组织以及SMSCs增殖和分化中的表达情况,发现它们在不同时期的骨骼肌组织以及体外细胞肌生成过程中的表达表现出不同程度的差异,暗示参与m6A修饰的这些基因可能调控牛骨骼肌生成。通过分析SMSCs成肌分化前后的m6A水平变化,进一步表明m6A甲基化修饰可能在肌肉生长发育中发挥潜在的调控作用。
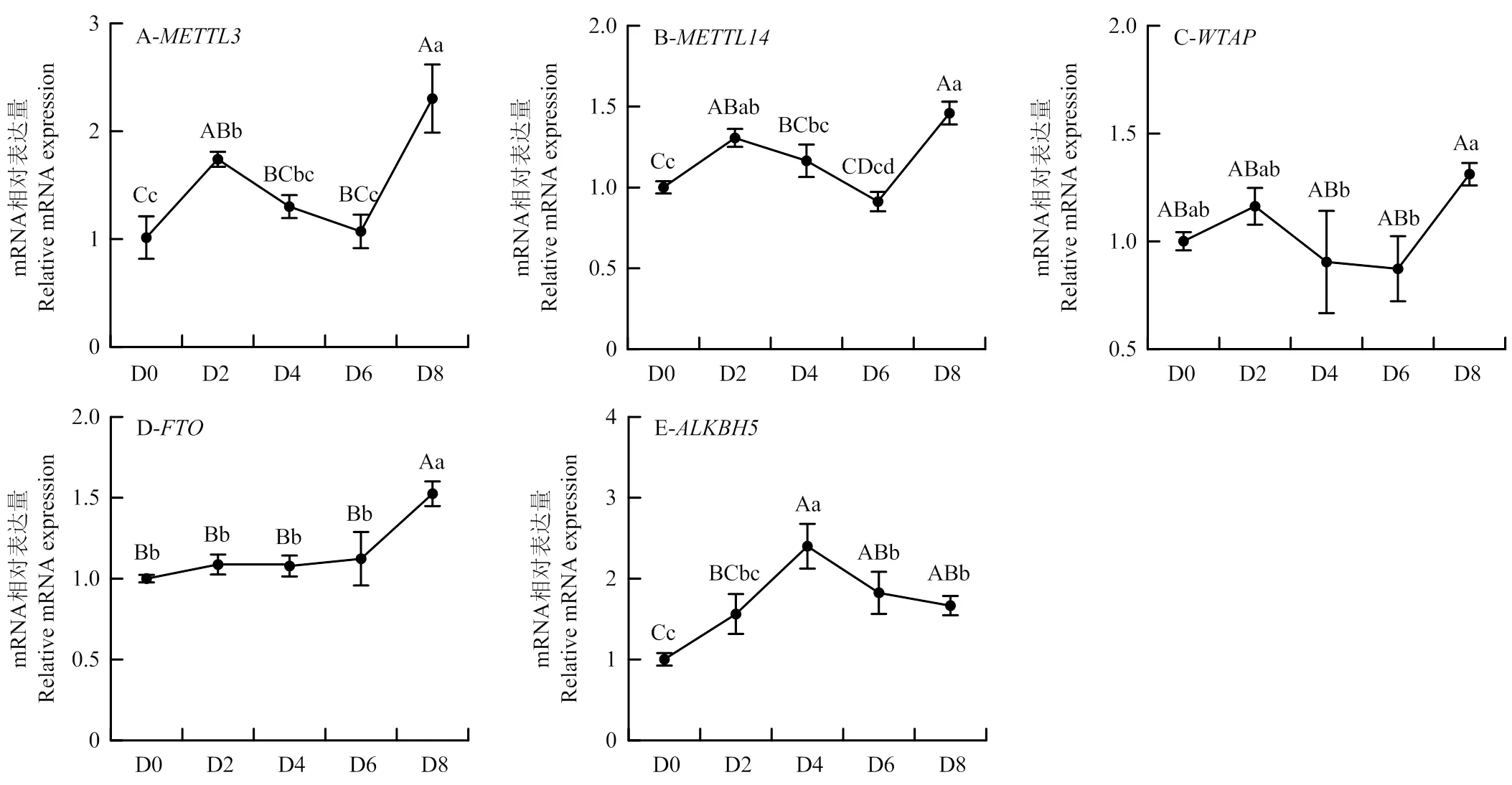
A:在SMSCs成肌分化中的时序表达谱;B:;C:;D:;E:
A: Temporal mRNA expression profile ofduring SMSCs myogenic differentiation; B:; C:; D:; E:
图5 m6A甲基化酶相关基因在SMSCs成肌分化过程中的时序表达谱
Fig. 5 Temporal expression profile of m6A methylation-related genes during SMSCs myogenic differentiation
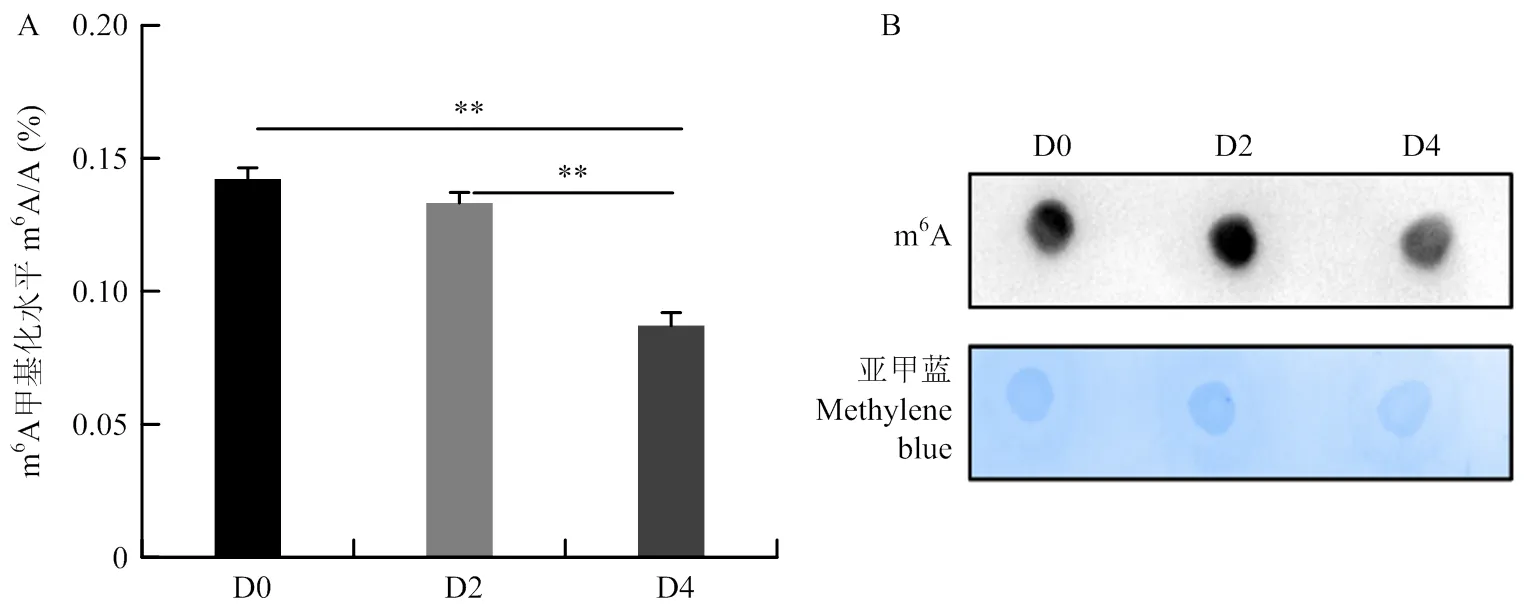
A:使用LC-MS/MS检测SMSCs成肌分化过程中m6A水平;**表示P<0.01、差异极显著。B:使用Dot blot技术检测SMSCs分化过程中的m6A修饰水平,亚甲蓝用于显示mRNA的上样量
3.2 骨骼肌组织中m6A甲基化酶相关基因的表达
为了研究m6A甲基化酶相关基因在牛骨骼肌中的表达水平,笔者检测了其在背最长肌、前腿肌和后腿肌中的表达量。可以很明显地发现甲基化酶和去甲基化酶在骨骼肌中表达模式的不同,与新生牛相比,甲基化酶、和在成年牛骨骼肌中的表达明显降低,而去甲基化酶和的表达则表现出上升的结果,这很好地说明这些基因是通过其对m6A甲基化修饰的作用来影响骨骼肌发育。最新的研究发现、、和在鸡的胸肌和腿肌中表达均随发育时期而逐渐上升,而则是在胚胎中期高表达,到胚胎后期至出壳后表达降低[25]。另一项在猪脂肪组织中的研究表明,METTL3在瘦肉型长白猪脂肪组织中的表达高于肥胖型金华猪,而FTO则相反[26]。这些不同的结果说明m6A甲基化酶相关基因的表达可能具有品种和种间差异,但都能体现出这些基因具有参与调控肌肉发育的合理可能性,并且甲基化酶与去甲基化酶基因表达模式的差异结果在很大程度上反映了m6A修饰调控肌肉发育的潜在作用。
3.3 SMSCs增殖过程中m6A甲基化酶相关基因的表达
骨骼肌的发育离不开肌细胞的增殖、分化与再生,为了更好地探究m6A相关基因可能的作用,笔者成功分离了牛骨骼肌卫星细胞并鉴定其具有成肌分化的能力,进而在体外研究这5个基因在SMSCs增殖和分化中的表达,探究m6A修饰对肌生成的功能。已有研究发现METTL3能够促进心肌细胞、平滑肌细胞的增殖[27-28],同时促进多种癌细胞的增殖[29-31];METTL14同样可以促进胰腺癌细胞的增殖[32];WTAP更是被发现可以通过影响BCL-2、CCNA2、CDK2等基因表达进而调控血管平滑肌细胞等细胞的增殖和凋亡[33-35],且与本研究中在牛SMSCs增殖中后期表达下降的结果一致的是,WTAP在平滑肌细胞增殖过程中表达也逐渐降低[36];但丁浩等[25]的研究发现在鸡原代成肌细胞增殖后期表达上升。产生这些不同表达趋势的原因可能与品种差异和细胞种类、来源有关。而FTO被发现可以抑制白血病细胞的增殖[37];ALKBH5可抑制干细胞以及肿瘤细胞的增殖[38-39]。这些研究都说明了这5个m6A相关基因均具有调控细胞增殖的能力,其都是通过发挥它们的m6A甲基化调控功能来实现。本研究发现在SMSCs增殖期中先降低再升高,在细胞增殖期不同时间点的表达趋势不明显,而和基本保持着上升的增长趋势,这些结果都与鸡原代成肌细胞中的研究一致[25]。这些基因在SMSCs增殖期中表达水平的显著变化说明了m6A甲基化可能也参与调控SMSCs的增殖,其中具体的作用机制还需进一步研究。
3.4 SMSCs分化过程中m6A甲基化酶相关基因的表达和m6A甲基化水平的变化
在胚胎期,肌细胞的增殖决定了骨骼肌的发育;而出生后骨骼肌的发育则主要依赖于成肌分化形成的肌纤维的增多增大。因此,研究m6A修饰在成肌分化中的作用也尤为重要。研究发现,METTL3对骨骼肌分化具有重要的作用,但不同的研究者却发现了不同的结果,KUDOU[11]发现siMETTL3抑制C2C12细胞成肌分化,而GHELLER[40]发现敲低METTL3促进C2C12细胞的分化。本研究表明METTL3在SMSCs成肌分化过程中维持稳定表达且在分化后期达到高表达,提示了METTL3可能促进牛骨骼肌卫星细胞的成肌分化。唐中林课题组发现干扰METTL14后,促进C2C12细胞的增殖,抑制C2C12分化[13],并且最后表明了m6A修饰参与猪的骨骼肌发育调控。而笔者的结果发现在牛SMSCs成肌分化中的表达先上升再下降最后又上升至高表达水平的差异表达模式。本研究中和的结果与其鸡原代成肌细胞分化中的结果一致,但是在鸡成肌细胞分化中后期低表达则与本研究中维持稳定表达的结果不同[25]。FTO最早被发现是与肥胖密切相关的基因[41-42],中科院杨运桂课题组最早揭示FTO的m6A去甲基化作用是脂肪生成必需的,并且在其中发现了一个有趣且重要的现象,敲除FTO在抑制小鼠脂肪沉积的同时,降低了小鼠的肌肉重量[43]。随后在小鼠体内和体外的实验验证了FTO可通过其m6A去甲基化酶的作用促进成肌分化[10],另外其中与本研究的结果一致的是,FTO在小鼠原代成肌细胞和C2C12细胞成肌分化过程中的表达增加[10]。通过这些研究,可以推测FTO促进牛SMSCs的成肌分化。另一个m6A去甲基化酶ALKBH5被发现参与调控心肌细胞的增殖与心肌再生[44],多个研究也发现了ALKBH5可以与METTL3形成相互作用的机制去调控心肌细胞命运和成骨分化[45-46]。此外,在鸡成肌细胞分化过程中和的表达趋势与其在牛SMSCs中表达逐渐增加的结果基本一致[25],进一步表明这2个m6A去甲基化酶可能具有促进牛骨骼肌分化的功能。m6A水平在成肌分化后显著降低,这个结果也与小鼠原代成肌细胞和C2C12细胞中的研究结果一致[40],表明m6A修饰可能负调控成肌分化。再综合以上的研究结果,推测成肌分化中m6A水平的变化可能与、和的表达模式相关。本研究初步探究了m6A甲基化修饰在骨骼肌卫星细胞中的表达模式,其结果为后续进一步探究m6A修饰以及甲基化酶基因对牛骨骼肌生成的作用和分子机制研究提供数据支撑。
4 结论
本研究通过检测5个经典的m6A甲基化酶基因在新生和成年秦川肉牛不同部位骨骼肌中的表达,发现m6A甲基化酶、、和m6A去甲基化酶、在牛骨骼肌中的表达模式呈现较为明显的差异,在成年牛骨骼肌中m6A甲基化酶表达下降,而去甲基化酶表达上升。此外,在SMSCs增殖和分化过程中的时序表达谱表明m6A甲基化酶相关基因均有着明显的差异表达模式,同时结合笔者发现的SMSCs成肌分化后m6A整体水平降低的结果,共同提示了、、和在调控牛骨骼肌卫星细胞增殖、分化中具有潜在重要作用。
[1] BRAUN T, GAUTEL M. Transcriptional mechanisms regulating skeletal muscle differentiation, growth and homeostasis. Nature Reviews Molecular Cell Biology, 2011, 12(6): 349-361. doi:10.1038/ nrm3118.
[2] LIU J, YUE Y, HAN D, WANG X, FU Y, ZHANG L, JIA G, YU M, LU Z, DENG X, DAI Q, CHEN W, HE C. A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation. Nature Chemical Biology, 2014, 10 (2): 93-95. doi:10.1038/nchembio. 1432.
[3] PING X L, SUN B F, WANG L, XIAO W, YANG X, WANG W J, ADHIKARI S, SHI Y, LV Y, CHEN Y S, ZHAO X, LI A, YANG Y, DAHAL U, LOU X M, LIU X, HUANG J, YUAN W P, ZHU X F, CHENG T, ZHAO Y L, WANG X, DANIELSEN J M R, LIU F, YANG Y G. Mammalian WTAP is a regulatory subunit of the RNA N6-methyladenosine methyltransferase. Cell Research, 2014, 24(2): 177-189. doi:10.1038/cr.2014.3">.
[4] JIA G, FU Y, ZHAO X, DAI Q, ZHENG G, YANG Y, YI C, LINDAHL T, PAN T, YANG Y G, HE C. N6-Methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO">. Nature Chemical Biology, 2011, 7(12): 885-887. doi:10.1038/ nchembio.687.
[5] ZHENG G Q, DAHL J A, NIU Y M, FEDORCSAK P, HUANG C M, LI C J, VÅGBØ C B, SHI Y, WANG W L, SONG S H, LU Z K, BOSMANS R P G, DAI Q, HAO Y J, YANG X, ZHAO W M, TONG W M, WANG X J, HE C. ALKBH5is a mammalian RNA demethylase that impacts RNA metabolism and mouse fertility. Molecular Cell, 2013, 49(1): 18-29. doi:10.1016/j.molcel.2012.10.015.
[6] WANG X, LU Z, GOMEZ A, HON G C, YUE Y, HAN D, FU Y, PARISIEN M, DAI Q, JIA G, REN B, PAN T, HE C. N6- methyladenosine-dependent regulation of messenger RNA stability. Nature, 2014, 505(7481): 117-120. doi:10.1038/nature12730.
[7] FU Y, DOMINISSINI D, RECHAVI G, HE C. Gene expression regulation mediated through reversible m6A RNA methylation">. Nature Reviews Genetics, 2014, 15(5): 293-306. doi:10.1038/ nrg3724.
[8] WANG X, ZHAO B S, ROUNDTREE I A, LU Z K, HAN D L, MA H H, WENG X C, CHEN K, SHI H L, HE C. N6-methyladenosine modulates messenger RNA translation efficiency. Cell, 2015, 161(6): 1388-1399. doi:10.1016/j.cell.2015.05.014.
[9] SHI H L, WEI J B, HE C. Where, when, and how: context-dependent functions of RNA methylation writers, readers, and erasers. Molecular Cell, 2019, 74(4): 640-650. doi:10.1016/j.molcel.2019.04.025.
[10] WANG X, HUANG N, YANG M, WEI D, TAI H, HAN X, GONG H, ZHOU J, QIN J, WEI X, CHEN H, FANG T, XIAO H. FTO is required for myogenesis by positively regulating mTOR-PGC-1α pathway-mediated mitochondria biogenesis. Cell Death & Disease, 2017, 8(3): e2702. doi:10.1038/cddis.2017.122.
[11] KUDOU K, KOMATSU T, NOGAMI J, MAEHARA K, HARADA A, SAEKI H, OKI E, MAEHARA Y, OHKAWA Y. The requirement of Mettl3-promotedmRNA maintenance in proliferative myoblasts for skeletal muscle differentiation. Open Biology, 2017, 7(9):170119. doi:10.1098/rsob.170119.
[12] TAO X L, CHEN J N, JIANG Y Z, WEI Y Y, CHEN Y, XU H M, ZHU L, TANG G Q, LI M Z, JIANG A N, SHUAI S R, BAI L, LIU H F, MA J D, JIN L, WEN A X, WANG Q, ZHU G X, XIE M, WU J Y, HE T, HUANG C Y, GAO X, LI X W. Transcriptome-wide N6-methyladenosine methylome profiling of porcine muscle and adipose tissues reveals a potential mechanism for transcriptional regulation and differential methylation pattern. BMC Genomics, 2017, 18: 336. doi:10.1186/s12864-017-3719-1.
[13] ZHANG X X, YAO Y L, HAN J H, YANG Y L, CHEN Y, TANG Z L, GAO F. Longitudinal epitranscriptome profiling reveals the crucial role of N6-methyladenosine methylation in porcine prenatal skeletal muscle development. Journal of Genetics and Genomics (Yi Chuan Xue Bao), 2020, 47(8): 466-476. doi:10.1016/j.jgg.2020.07.003.
[14] XU T S, XU Z J, LU L Z, ZENG T, GU L H, HUANG Y Z, ZHANG S J, YANG P, WEN Y F, LIN D J, XING M P, HUANG L L, LIU G J, CHAO Z, SUN W P. Transcriptome-wide study revealed m6A regulation of embryonic muscle development in Dingan goose (orientalis). BMC Genomics, 2021, 22(1): 270. doi:10.1186/ s12864-021-07556-8.
[15] YANG X R, WANG J F, MA X H, DU J W, MEI C G, ZAN L S. Transcriptome-wide N6-methyladenosine methylome profiling reveals m 6 A regulation of skeletal myoblast differentiation in cattle (). Frontiers in Cell and Developmental Biology, 2021, 9: 785380. doi:10.3389/fcell.2021.785380.
[16] 昝林森, 王洪程, 梅楚刚. 秦川牛肉用选育改良及产业化开发. 农业生物技术学报, 2015, 23(1): 135-140. doi:10.3969/j.issn.1674- 7968.2015.01.015.
ZAN L S, WANG H C, MEI C G. Breeding and improvement of Qinchuan cattle and its beef industrialization. Journal of Agricultural Biotechnology, 2015, 23(1): 135-140. doi:10.3969/j.issn.1674-7968. 2015.01.015. (in Chinese)
[17] 杜嘉伟, 杜鑫泽, 杨昕冉, 宋贵兵, 赵慧, 昝林森, 王洪宝. 干扰TP53INP2抑制牛成肌细胞分化. 中国农业科学, 2021, 54(21): 4685-4693. doi:10.3864/j.issn.0578-1752.2021.21.017.
DU J W, DU X Z, YANG X R, SONG G B, ZHAO H, ZAN L S, WANG H B. Interference ingene inhibits the differentiation of bovine myoblasts. Scientia Agricultura Sinica, 2021, 54(21): 4685-4693. doi:10.3864/j.issn.0578-1752.2021.21.017. (in Chinese)
[18] 宁越, 米雪, 陈星伊, 邵建航, 昝林森. SMAD1基因的沉默和过表达及对秦川牛原代成肌细胞生肌的影响. 中国农业科学, 2019, 52(10): 1818-1829. doi:10.3864/j.issn.0578-1752.2019.10.014.
NING Y, MI X, CHEN X Y, SHAO J H, ZAN L S. Silencing and overexpressing SMAD family member 1 () gene and its effect on myogenesis in primary myoblast of Qinchuan cattle (). Scientia Agricultura Sinica, 2019, 52(10): 1818-1829. doi:10.3864/ j.issn.0578-1752.2019.10.014. (in Chinese)
[19] BENTZINGER C F, WANG Y X, RUDNICKI M A. Building muscle: molecular regulation of myogenesis. Cold Spring Harbor Perspectives in Biology, 2012, 4(2): a008342. doi:10.1101/cshperspect.a008342.
[20] YAMAKAWA H, KUSUMOTO D, HASHIMOTO H, YUASA S. Stem cell aging in skeletal muscle regeneration and disease. International Journal of Molecular Sciences, 2020, 21(5): 1830. doi:10.3390/ijms21051830.
[21] WEI C M, GERSHOWITZ A, MOSS B. Methylated nucleotides block 5' terminus of HeLa cell messenger RNA. Cell, 1975, 4(4): 379-386. doi:10.1016/0092-8674(75)90158-0.
[22] DOMINISSINI D, MOSHITCH-MOSHKOVITZ S, SCHWARTZ S, SALMON-DIVON M, UNGAR L, OSENBERG S, CESARKAS K, JACOB-HIRSCH J, AMARIGLIO N, KUPIEC M, SOREK R, RECHAVI G. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature, 2012, 485(7397): 201-206. doi:10.1038/nature11112.
[23] MEYER K D, SALETORE Y, ZUMBO P, ELEMENTO O, MASON C E, JAFFREY S R. Comprehensive analysis of mRNA methylation reveals enrichment in 3' UTRs and near stop codons. Cell, 2012, 149(7): 1635-1646. doi:10.1016/j.cell.2012.05.003.
[24] DENG K P, FAN Y X, LIANG Y X, CAI Y, ZHANG G M, DENG M T, WANG Z B, LU J W, SHI J F, WANG F, ZHANG Y L. FTO-mediated demethylation of GADD45B promotes myogenesis through the activation of p38 MAPK pathway. Molecular Therapy - Nucleic Acids, 2021, 26: 34-48. doi:10.1016/j.omtn.2021.06.013.
[25] 丁浩, 林月月, 张涛, 张闪闪, 吴玉麟, 段严军, 巩用双, 谢恺舟, 王金玉, 戴国俊, 张跟喜. m6A甲基化在鸡肌肉生长发育中的表达研究. 中国畜牧兽医, 2021, 48(5): 1525-1534. doi:10.16431/j.cnki. 1671-7236.2021.05.003.
DING H, LIN Y Y, ZHANG T, ZHANG S S, WU Y L, DUAN Y J, GONG Y S, XIE K Z, WANG J Y, DAI G J, ZHANG G X. Study on the expression of m6A methylation in chicken muscle growth and development. China Animal Husbandry & Veterinary Medicine, 2021, 48(5): 1525-1534. doi:10.16431/j.cnki.1671-7236.2021.05.003. (in Chinese)
[26] 朱琳娜. FTO、METTL3基因表达对猪脂肪细胞mRNA N6-甲基腺苷水平及脂肪沉积的影响研究[D]. 杭州: 浙江大学, 2014.
ZHU L N. Effectof, METTL3Gene expression on mRNAm6Amathylation and lipid metabolism in porcine subcutaneous adipocytes[D]. Hangzhou: Zhejiang University, 2014. (in Chinese)
[27] 陈悦, 唐竞桐, 罗仕蓉. METTL3-m6A途径抑制肺动脉平滑肌细胞增殖的实验研究. 海南医学, 2021, 32(8): 953-956. doi:10.3969/ j.issn.1003-6350.2021.08.001.
CHEN Y, TANG J T, LUO S R. Role of METTL3-dependent m6A in inhibiting proliferation of pulmonary artery smooth muscle cells. Journal of Hainan Medical University, 2021, 32(8): 953-956. doi:10. 3969/j.issn.1003-6350.2021.08.001. (in Chinese)
[28] 刘钟颖. 甲基转移酶METTL3在心肌细胞中的作用研究[D]. 武汉: 武汉科技大学, 2020.
LIU Z Y. The role of methyltransferase METTL3 in cardiomyocytes[D]. Wuhan: Wuhan University of Science and Technology, 2020. (in Chinese)
[29] XIA T F, WU X Q, CAO M, ZHANG P B, SHI G D, ZHANG J J, LU Z P, WU P F, CAI B B, MIAO Y, JIANG K R. The RNA m6A methyltransferase METTL3 promotes pancreatic cancer cell proliferation and invasion. Pathology - Research and Practice, 2019, 215(11): 152666. doi:10.1016/j.prp.2019.152666.
[30] HAN J, WANG J Z, YANG X, YU H, ZHOU R, LU H C, YUAN W B, LU J C, ZHOU Z J, LU Q, WEI J F, YANG H W. METTL3 promote tumor proliferation of bladder cancer by accelerating pri-miR221/222 maturation in m6A-dependent manner. Molecular Cancer, 2019, 18(1): 110. doi:10.1186/s12943-019-1036-9.
[31] LIU J, ECKERT M A, HARADA B T, LIU S M, LU Z K, YU K K, TIENDA S M, CHRYPLEWICZ A, ZHU A C, YANG Y, HUANG J T, CHEN S M, XU Z G, LENG X H, YU X C, CAO J, ZHANG Z Z, LIU J Z, LENGYEL E, HE C. M 6 A mRNA methylation regulates AKT activity to promote the proliferation and tumorigenicity of endometrial cancer. Nature Cell Biology, 2018, 20(9): 1074-1083. doi:10.1038/s41556-018-0174-4.
[32] 徐晓东. N6-甲基嘌呤(m6A)甲基转移酶METTL14对胰腺癌增殖和侵袭转移的影响及其机制研究[D]. 武汉: 华中科技大学, 2017.
XU X D. The effect METTL14 on prolifetation and metastasis of pancreatic cancer cells and its mechanisms[D]. Wuhan: Huazhong University of Science and Technology, 2017. (in Chinese)
[33] SMALL T W, BOLENDER Z, BUENO C, O'NEIL C, NONG Z X, RUSHLOW W, RAJAKUMAR N, KANDEL C, STRONG J, MADRENAS J, PICKERING J G. Wilms' tumor 1-associating protein regulates the proliferation of vascular smooth muscle cells. Circulation Research, 2006, 99(12): 1338-1346. doi:10.1161/01.RES. 0000252289.79841.d3.
[34] HORIUCHI K, UMETANI M, MINAMI T, OKAYAMA H, TAKADA S, YAMAMOTO M, ABURATANI H, REID P C, HOUSMAN D E, HAMAKUBO T, KODAMA T. Wilms' tumor 1-associating protein regulates G2/M transition through stabilization of cyclin A2 mRNA. PNAS, 2006, 103(46): 17278-17283. doi:10.1073/pnas.0608357103.
[35] KONG Y, WU R F, ZHANG S H, ZHAO M, WU H J, LU Q J, FU S Q, SU Y W. Wilms' tumor 1-associating protein contributes to psoriasis by promoting keratinocytes proliferation via regulating cyclinA2 and CDK2. International Immunopharmacology, 2020, 88: 106918. doi:10.1016/j.intimp.2020.106918.
[36] SMALL T W, PICKERING J G. Nuclear degradation of wilms tumor 1-associating protein and survivin splice variant switching underlie IGF-1-mediated survival. Journal of Biological Chemistry, 2009, 284(37): 24684-24695. doi:10.1074/jbc.M109.034629.
[37] SU R, DONG L, LI C Y, NACHTERGAELE S, WUNDERLICH M, QING Y, DENG X L, WANG Y G, WENG X C, HU C, YU M X, SKIBBE J, DAI Q, ZOU D L, WU T, YU K K, WENG H Y, HUANG H L, CHEN J J. R-2HG exhibits anti-tumor activity by targeting FTO/m6a/MYC/CEBPA signaling. Cell, 2018, 172(1/2): 90-105.e23. doi:10.1016/j.cell.2017.11.031.
[38] ZHANG S C, ZHAO B S, ZHOU A D, LIN K Y, ZHENG S P, LU Z K, CHEN Y H, SULMAN E P, XIE K P, BÖGLER O, MAJUMDER S, HE C, HUANG S Y. m6A demethylase ALKBH5maintains tumorigenicity of glioblastoma stem-like cells by sustaining FOXM1 expression and cell proliferation program. Cancer Cell, 2017, 31(4): 591-606.e6. doi:10.1016/j.ccell.2017.02.013.
[39] 方婷晓. m6A去甲基化酶ALKBH5抑制食管鳞癌的增殖、侵袭和迁移[D]. 广州: 南方医科大学, 2019.
FANG T X. M6A demethylase ALKBH5inhibits proliferation, migration and invasion of esophageal squamous cell carcinoma[D]. Guangzhou: Southern Medical University, 2019. (in Chinese)
[40] GHELLER B J, BLUM J E, FONG E H H, MALYSHEVA O V, COSGROVE B D, THALACKER-MERCER A E. A defined N6- methyladenosine (m6A) profile conferred by METTL3 regulates muscle stem cell/myoblast state transitions. Cell Death Discovery, 2020, 6: 95. doi:10.1038/s41420-020-00328-5.
[41] CHURCH C, MOIR L, MCMURRAY F, GIRARD C, BANKS G T, TEBOUL L, WELLS S, BRÜNING J C, NOLAN P M, ASHCROFT F M, COX R D. Overexpression of Fto leads to increased food intake and results in obesity. Nature Genetics, 2010, 42(12): 1086-1092. doi:10.1038/ng.713.
[42] FISCHER J, KOCH L, EMMERLING C, VIERKOTTEN J, PETERS T, BRÜNING J C, RÜTHER U. Inactivation of the Fto gene protects from obesity. Nature, 2009, 458(7240): 894-898. doi:10.1038/ nature07848.
[43] ZHAO X, YANG Y, SUN B F, SHI Y, YANG X, XIAO W, HAO Y J, PING X L, CHEN Y S, WANG W J, JIN K X, WANG X, HUANG C M, FU Y, GE X M, SONG S H, JEONG H S, YANAGISAWA H, NIU Y, JIA G F, WU W, TONG W M, OKAMOTO A, HE C, DANIELSEN J M R, WANG X J, YANG Y G. FTO-dependent demethylation of N6-methyladenosine regulates mRNA splicing and is required for adipogenesis. Cell Research, 2014, 24(12): 1403-1419. doi:10.1038/ cr.2014.151.
[44] HAN Z B, WANG X X, XU Z H, CAO Y, GONG R, YU Y, YU Y, GUO X F, LIU S Z, YU M X, MA W Y, ZHAO Y M, XU J, LI X D, LI S N, XU Y, SONG R J, XU B B, YANG F, BAMBA D, SUKHAREVA N, LEI H, GAO M Q, ZHANG W W, ZAGIDULLIN N, ZHANG Y, YANG B F, PAN Z W, CAI B Z. ALKBH5regulates cardiomyocyte proliferation and heart regeneration by demethylating the mRNA of YTHDF1. Theranostics, 2021, 11(6): 3000-3016. doi:10.7150/thno.47354.
[45] SONG H W, FENG X, ZHANG H, LUO Y M, HUANG J, LIN M H, JIN J F, DING X, WU S J, HUANG H, YU T, ZHANG M K, HONG H O, YAO S H, ZHAO Y X, ZHANG Z Y. METTL3 and ALKBH5oppositely regulate m6A modification of TFEB mRNA, which dictates the fate of hypoxia/reoxygenation-treated cardiomyocytes. Autophagy, 2019, 15(8): 1419-1437. doi:10.1080/15548627.2019. 1586246.
[46] YU J J, SHEN L J, LIU Y L, MING H, ZHU X X, CHU M P, LIN J T. The m6A methyltransferase METTL3 cooperates with demethylase ALKBH5to regulate osteogenic differentiation through NF-κB signaling. Molecular and Cellular Biochemistry, 2020, 463(1/2): 203-210. doi:10.1007/s11010-019-03641-5.
Expression Pattern of m6A Methylase-Related Genes in Bovine Skeletal Muscle Myogenesis
YANG XinRan1, MA XinHao1, DU JiaWei1, ZAN LinSen1, 2
1College of Animal Science and Technology, Northwest A&F University, Yangling 712100, Shaanxi;2National Beef Cattle Improvement Center, Yangling 712100, Shaanxi
【】 The role of RNA m6A methylation modification in muscle development has been continuously discovered in recent years. The aim of this study was to explore the mRNA expression of m6A methylases, including,,,, and, in bovine muscle tissue and in the proliferation and differentiation of skeletal muscle satellite cells (SMSCs). Meanwhile, the changes of m6A level during SMSCs myogenic differentiation in vitro were analyzed. This study could provide a reference for clarifying the role and mechanism of m6A modification in skeletal muscle development.【】 The expression of m6A methylases in skeletal muscle of newborn and adult cattle was detected by real-time quantitative PCR (RT-qPCR). Then, SMSCs were isolated from the Longissimus dorsi muscle of Qinchuan beef cattle. The proliferation and myogenic differentiation of SMSCs were verified by cell growth curve, immunofluorescence and RT-qPCR, and the temporal expression profiles of m6A methylases in proliferation (24 h, 36 h, 48 h, 60 h, and 72 h) and differentiation (Day 0, 2, 4, 6, and 8) of SMSCs were detected by RT-qPCR. Finally, the m6A levels during SMSCs differentiation were detected using LC-MS/MS and dot blot assays.【】 The mRNA expression levels of m6A methyltransferases, including,, and, in the Longissimus dorsi muscle, forelegs muscle and hind legs muscle of adult cattle were significantly lower than those of newborn cattle (<0.01). The mRNA expression of demethylases such asand<0.01), andwas higher in the Longissimus dorsi muscle of adult cattle (<0.01).The isolated SMSCs had the functions of normal growth, proliferation and myogenic differentiation. The expression ofdecreased gradually in SMSCs proliferation, but increased significantly at 72 h. The expression ofdid not change significantly, whilereached the highest level at 48 h, and then decreased gradually. The temporal expression profiles ofandwere similar in the proliferative phase. They did not change obviously before 60 h and increased significantly at 72 h. The expression patterns of,andwere consistent during SMSCs differentiation, with an increase in the early stage of differentiation, followed by a decrease, and an increase in the late stage of differentiation. The expression ofincreased gradually with differentiation.The expression ofincreased during the first 4 days of differentiation and then continuously decreased. Furthermore, the overall m6A level of mRNA declined during the myogenic differentiation in SMSCs (<0.01). 【】The expression changes of m6A methyltransferases and demethylases in skeletal muscle of newborn and adult cattle were significantly different, suggesting that m6A modification might have an important role in the development of skeletal muscle in Qinchuan cattle. Meanwhile, these m6A methylases might regulate the proliferation and differentiation of bovine SMSCs. These results provide a theoretical basis for the study of the role and molecular mechanism of m6A methylation modifications in regulating skeletal myogenesis.
N-methyladenosine (m6A); m6A methylase; cattle; skeletal muscle satellite cells; cell proliferation; myogenic differentiation

2021-09-30;
2022-04-12
国家重点研发计划(2018YFD0501700)、国家自然科学基金(31972994)、国家肉牛牦牛产业技术体系(CARS-37)
杨昕冉,E-mail:yangxinran93@nwafu.edu.cn。通信作者昝林森,E-mail:zanlinsen@163.com
(责任编辑 林鉴非)
