多主棒孢SdhB-H278Y突变位点real-time PCR 检测体系的建立与应用
2023-01-31朱广雪阎昱韬孙炳学周荣佳岳圆圆谢学文柴阿丽李宝聚石延霞
朱广雪 阎昱韬 孙炳学 周荣佳 岳圆圆 谢学文 柴阿丽 李 磊 李宝聚* 石延霞*
(1 青岛农业大学园艺学院,山东青岛 266109;2 中国农业科学院蔬菜花卉研究所,北京 100081)
由多主棒孢(Corynespora cassiicola)引起的黄瓜棒孢叶斑病是危害黄瓜较重的叶部病害之一(杨洁,2016),在我国的北京、山东、辽宁、河北等多个省(市)及日本、韩国、美国等地均有发生(李长松 等,2009;高苇 等,2011;杨苗,2013)。用于防治该病害的杀菌剂主要有琥珀酸脱氢酶抑制剂类(SDHIs)杀菌剂、甲氧基丙烯酸酯类(QoIs)杀菌剂等,但目前该病菌对大部分杀菌剂产生了抗性(Duan et al.,2019;Zhu et al.,2019)。啶酰菌胺作为SDHIs 杀菌剂中的一个广谱性杀菌剂(颜范勇 等,2008;陈莉 等,2009),其通过阻断琥珀酸脱氢酶(succinate dehydrogenase,SDH)铁硫簇与泛醌结合区域的电子传递来阻碍病原菌的能量代谢,抑制病菌正常生长,从而达到防治病害的目的(李良孔 等,2011)。
2004 年啶酰菌胺正式登记(亦冰,2006),多用于作物灰霉病的防治,但在施用过程中对多主棒孢间接产生了选择压力,导致多主棒孢对啶酰菌胺产生了抗性。药靶基因突变是多主棒孢产生抗药性的一种重要机制,日本学者Miyamoto 等(2009,2010)报道了由不同抗性突变导致的对啶酰菌胺的抗性水平差异,SdhB-H278Y 突变株对啶酰菌胺超高抗,SdhB-H278R 和SdhC-S73P 突变株为高抗,SdhD-G109V、SdhD-S89P 和SdhD-G109V 突变株为中抗。引起我国多主棒孢对啶酰菌胺产生抗性的突变类型主要有SdhB-H278R/Y/L、SdhBI280V、SdhC-S73P、SdhD-D95E、SdhD-H105R、SdhD-G109V 等,其中SdhB-H278Y 突变可导致对啶酰菌胺高水平抗性(朱发娣,2018;Sun et al.,2022)。传统的抗药性检测方法如菌丝生长速率法、孢子萌发法、抑菌圈法等存在周期长、工作量大且无法进行定量研究的问题(金恭玺 等,2015;李卓等,2017),因此建立一种高效、灵敏、定量的多主棒孢SdhB-H278Y 突变检测方法,对于该病害的预防具有重要意义。随着分子生物技术的发展,近年来多种分子检测手段广泛应用于植物病原菌的检测和定量研究,如普通PCR(allele specific PCR,AS-PCR)、实时荧光定量PCR(real-time PCR)、环介导等温扩增技术(loop mediated isothermal amplification method,LAMP)和多重等位基因PCR(multiplex allele specific PCR,MAS-PCR)等。real-time PCR 是美国应用生物系统公司(Applied Biosystems,ABI)推出的通过检测荧光信号变化进行核酸定量的技术(王季秋 等,2016),目前在病原菌抗药性检测上也广泛应用,先后建立了核盘菌(Sclerotinia sclerotiorum)抗多菌灵β-微管蛋白E198A 突变位点real-time PCR 检测体系、多主棒孢抗啶酰菌胺SdhB-H278R 突变位点real-time PCR 检测体系、灰葡萄孢抗啶酰菌胺的运输体基因及琥珀酸脱氢酶基因表达量的real-time PCR 检测体系等(赵伟,2005;孙炳学 等,2018;金宇杰,2021)。
中国农业科学院蔬菜花卉研究所蔬菜病害防控创新团队前期发现的多主棒孢SdhB-H278Y 突变株对啶酰菌胺表现为超高水平抗性,增加了黄瓜棒孢叶斑病的防治难度。本试验根据黄瓜多主棒孢SdhB基因序列差异设计特异性引物,构建realtime PCR 分子检测体系,并对该体系进行特异性、灵敏度等评价,以期建立高效、灵敏、定量检测黄瓜多主棒孢SdhB-H278Y 抗性突变的real-time PCR体系,为黄瓜棒孢叶斑病抗性治理提供技术支持。
1 材料与方法
1.1 试验材料
供试菌株:20 株多主棒孢及其他8 种常见病原菌(表1)均由中国农业科学院蔬菜花卉研究所蔬菜病害防控创新团队提供,其中多主棒孢HG15050740-4、SD1 已知SdhB基因序列(图1)。HG15050740-4 携带SdhB-H278Y 突变,作为阳性对照;SD1 为野生型敏感菌株,作为阴性对照。
供试试剂和培养基:96%啶酰菌胺原药,购自陕西美邦农药有限公司;植物基因组DNA 提取试剂盒、SuperReal PreMix Plus(SYBR Green),购自天根生化科技(北京)有限公司;2×TaqMaster Mix(Dye Plus),购自南京诺唯赞生物科技股份有限公司;PDA 培养基(马铃薯200 g、葡萄糖20 g、琼脂粉20 g、蒸馏水定容至1 L)。
主要仪器设备:NanoDrop 2000c 超微量分光光度计(Thermo Fisher Scientific Inc,美国)、3-18K 型离心机(Sigma,德国)、7500 荧光定量PCR 仪(ABI,美国)、S1000 Thermal Cycle PCR仪(BIORAD,美国)、Jel Doc 2001 型凝胶成像系统(BIO-RAD,美国)。
1.2 引物合成及测序
real-time PCR 和AS-PCR 所用引物及基因序列均由北京博迈德基因技术有限公司合成和测序。
1.3 DNA 提取
分别将供试菌株接菌至PDA 培养基,28 ℃培养5 d,刮取菌丝作为提取样本。利用植物基因组DNA 提取试剂盒,根据试剂盒中的说明书提取菌丝基因组DNA,利用NanoDrop 2000c 测定DNA浓度;使用ddH2O稀释至100 ng·μL-1,-20 ℃保存。
1.4 SdhB 序列测定
参考孙炳学等(2018)的方法,以表1 中序号2~17 的多主棒孢DNA 为模板,使用引物Cc-SdhB-F 和Cc-SdhB-R(表2)扩增SdhB基因片段,对PCR 产物进行测序。

表1 供试菌株信息
AS-PCR 反应体系(50 μL):2×TaqMaster Mix 25 μL,引物Cc-SdhB-F 和Cc-SdhB-R 终浓度为0.4 μmol·L-1,模板DNA 1 μL,ddH2O 补足至50 μL。反应程序:95 ℃ 3 min;95 ℃ 15 s,58 ℃15 s,72 ℃ 90 s,循环30 次;72 ℃ 5 min。
1.5 SdhB-H278Y 突变株对啶酰菌胺敏感性测定
采用菌丝生长速率法(Miyamoto et al.,2009)测定携带SdhB-H278Y 突变的多主棒孢及野生型敏感菌株SD1 对啶酰菌胺的敏感性。使用打孔器在培养好的菌落边缘打取直径5 mm 的菌饼,接种于含啶酰菌胺浓度梯度(0.1、0.5、1.0、10.0、30.0 μg·mL-1)的PDA 平板上,以不加药剂为空白对照,每处理3 次重复。28 ℃黑暗培养5 d,采用十字交叉法测量菌落直径,利用Excel 软件计算EC50值、毒力回归方程和相关系数。
1.6 引物设计
根据GenBank 中多主棒孢SdhB基因序列(登录号:MG729603、MG729607),利用Primer Premier 5.0 软件分别设计特异性引物及内参引物。针对SdhB-H278Y 突变位点设计特异性引物B-H278Y-Fc/R3e,并将包含SdhB-H278Y 突变位点的部分SdhB基因作为内参基因设计内参引物B-H278Y-NC-F/R。基于碱基错配原则,将下游特异性引物3′末端与突变的碱基胸腺嘧啶(T)配对,靠近3′端第3 位的位置引入错配碱基,以增加引物特异性(朱发娣,2018)(表2)。
1.7 引物特异性检验
以携带SdhB-H278Y突变的菌株HG15050740-4、SDH 其他点突变的多主棒孢及其他常见8 种病原菌(表1)DNA 为模板,以ddH2O 为阴性对照,使用引物B-H278Y-Fc、B-H278Y-R3e 进行PCR扩增,检验引物特异性。
AS-PCR 反应体系(20 μL):2×TaqMaster Mix 10 μL,引物B-H278Y-Fc 和B-H278Y-R3e 终浓度为0.4 μmol·L-1,模板DNA 1 μL,ddH2O 补足至20 μL。反应程序:95 ℃ 3 min;95 ℃ 15 s,66.5 ℃ 15 s,72 ℃ 30 s,循环35 次;72 ℃ 5 min。PCR 产物经1%琼脂糖凝胶电泳检测后,采用凝胶成像系统分析结果。
real-time PCR 反应体系(20 μL):2×SuperReal PreMix Plus 10 μL,50×ROX Reference Dye 0.4 μL,上、下游引物终浓度均为0.4 μmol·L-1,模板DNA 1 μL,RNase-free ddH2O 补足至20 μL。反应程序:95 ℃ 15 min;95 ℃ 15 s,66.5 ℃ 15 s,72 ℃(荧光信号接受区)30 s,循环40 次;95 ℃15 s,60 ℃(每次循环增加0.35 ℃)1 min,60 ℃15 s,循环100 次。以熔解曲线是否有单一特异的吸收峰作为引物特异性的判断标准。
1.8 标准曲线的建立
以SdhB-H278Y 突变株HG15050740-4 和野生型敏感菌株SD1 的混合DNA 作为模板,调整SdhBH278Y 突变株DNA 摩尔质量分别占DNA 总量的5%、10%、20%、40%、80%和100%,使用特异性引物B-H278Y-Fc/R3e 和内参引物B-H278Y-NCF/R 进行real-time PCR 扩增。计算ΔCt 值(ΔCt=Ct特异性引物-Ct内参引物),以ΔCt 值为纵坐标,以SdhB-H278Y 突变株DNA 所占比例的对数为横坐标,制作标准曲线(孙炳学 等,2018),3 次重复。real-time PCR 扩增体系及反应程序同1.7。
1.9 灵敏度检测
将定量SdhB-H278Y 基因组DNA 进行10 倍浓度梯度稀释,至终浓度分别为3.6、3.6×10-1、3.6×10-2、3.6×10-3、3.6×10-4、3.6×10-5、3.6×10-6、3.6×10-7ng·μL-1,分别采用AS-PCR 和realtime PCR 的扩增方法进行检测,根据扩增片段的有无、大小和荧光值的大小,评价引物的灵敏度。ASPCR、real-time PCR 扩增体系及反应程序同1.7。
1.10 real-time PCR 检测体系的验证与应用
菌株DNA 验证:以SdhB-H278Y 突变株HG15051740-4 和野生型敏感菌株SD1 的混合DNA作为模板,调整SdhB-H278Y 突变株DNA 摩尔质量分别占DNA总量的90%、60%、30%、15%和7.5%,3 次重复,验证标准曲线的可靠性。利用Excel 软件计算标准差及预期值与试验值的相关系数。
田间SdhB-H278Y 突变株定量检测:从山东地区黄瓜种植大棚内随机采集黄瓜棒孢叶斑病病样12 份,采用75%乙醇消毒叶片表面3 次,随后用无菌水清洗3 次;使用无菌刀片切取病斑组织,然后用植物基因组DNA 提取试剂盒提取病斑组织DNA,利用引物B-H278Y-Fc/R3e、B-H278Y-NCF/R 进行real-time PCR 扩增,以SdhB-H278Y 突变株HG15051740-4 基因组DNA 为阳性对照,以野生型敏感菌株SD1 基因组DNA 为阴性对照,应用已构建的标准曲线计算病斑中SdhB-H278Y 突变株DNA 占病斑总DNA 的比例,3 次重复,验证检测体系是否可直接用于黄瓜棒孢叶斑病病斑中SdhBH278Y 突变株占比的检测。
2 结果与分析
2.1 多主棒孢SdhB 核酸序列和氨基酸序列分析
以16 株多主棒孢DNA 为模板,使用引物Cc-SdhB-F/R 扩增SdhB基因并测序。结果显示:多主棒孢SdhB基因在832、838 位发生碱基突变(C→T、A→G),导致278 位密码子由组氨酸(CAC,H)突变成酪氨酸(TAC,Y),即SdhB-H278Y;280 位密码子由异亮氨酸(ATT,I)突变成缬氨酸(GTT,V),即SdhB-I280V(图1)。16 株多主棒孢中有5 株携带SdhB-H278Y 突变,5 株携带SdhB-I280V 突变(表1)。

图1 部分多主棒孢SdhB 核酸序列和氨基酸序列信息
2.2 SdhB-H278Y 突变株对啶酰菌胺的敏感性测定
采用菌丝生长速率法测定SdhB-H278Y 突变株及SD1 对啶酰菌胺的敏感性,结果表明(表3):SD1 对啶酰菌胺的EC50值为0.09 μg·mL-1,SdhB-H278Y 突变株中仅1 株EC50值为21.47 μg·mL-1,其余5 株EC50值均大于30 μg·mL-1。

表3 SdhB-H278Y 突变株对啶酰菌胺的敏感性测定结果
2.3 引物特异性检验
以携带SdhB-H278Y 突变的菌株HG15050740-4、SDH 其他点突变的多主棒孢及其他常见8 种病原菌DNA 为模板进行AS-PCR 扩增,评价B-H278Y-Fc/R3e 引物的特异性。结果表明(图2):携带SdhBH278Y 突变的菌株能扩增出明亮且单一的条带,大小为171 bp,而SDH 其他点突变的菌株、8 种常见病原菌DNA 及阴性对照ddH2O 均未扩增出条带,证明该引物可用于多主棒孢SdhB-H278Y 突变特异性检测。

图2 引物特异性检测结果
应用特异性引物B-H278Y-Fc/R3e 及内参引物B-H278Y-NC-F/R 进行real-time PCR 检测,结果显示:在熔解温度为88.66 ℃时,B-H278Y-Fc/R3e 的扩增产物出现单一的特异性峰(图3-a);在88.18 ℃时,B-H278Y-NC-F/R 的扩增产物出现单一的特异性峰(图3-b)。
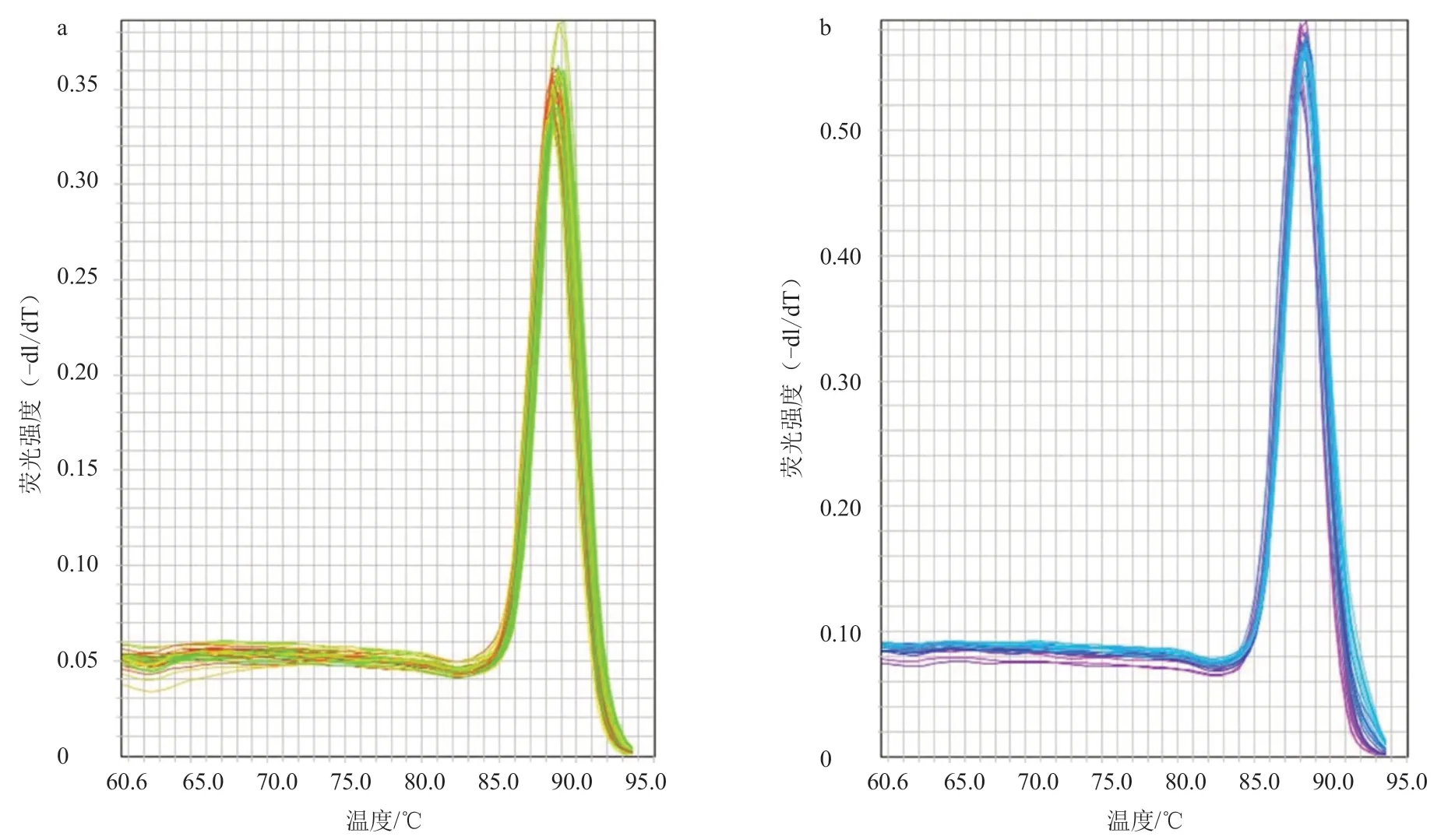
图3 real-time PCR 熔解曲线分析结果
2.4 特异性引物灵敏度检测
以10 倍梯度稀释的SdhB-H278Y 突变株HG15050740-4 基因组DNA 为模板,对引物B-H278Y-Fc/R3e 进行AS-PCR 和real-time PCR灵敏度测定。结果表明:AS-PCR 检测的灵敏度为3.6×10-3ng·μL-1(图4-a),real-time PCR 检测的灵敏度为3.6×10-4ng·μL-1(图4-b),即real-time PCR 的灵敏度为AS-PCR 的10 倍。

图4 AS-PCR 和real-time PCR 检测体系的灵敏度比较
2.5 real-time PCR 标准曲线的建立
以SdhB-H278Y 突变株HG15050740-4 和野生型敏感菌株SD1 的混合DNA 作为模板,使用引物B-H278Y-Fc/R3e、B-H278Y-NC-F/R 进行real-time PCR 扩增,建立了标准曲线y=-3.016 6x+6.603 8,斜率为-3.016 6,截距为6.603 8,相关系数R2=0.992 9,呈现出良好的线性关系(图5)。

图5 real-time PCR 检测SdhB-H278Y 突变的标准曲线
2.6 real-time PCR 检测体系的验证与应用
以SdhB-H278Y 突变株HG15051740-4 和野生型敏感菌株SD1 的混合DNA 作为模板,使用引物B-H278Y-Fc/R3e、B-H278Y-NC-F/R 进行real-time PCR 扩增。结果显示:DNA 检测值依次为(84.35±3.88)%、(54.89±9.60)%、(23.59±3.85)%、(10.20±2.36)%、(3.67 ± 0.06)%,与对应的预期值90%、60%、30%、15%、7.5%具有很高的相关性,R2=0.999 7,表明该检测体系具有可靠性,可定量检测总DNA 中SdhB-H278Y 突变株DNA 所占比例。
田间多主棒孢SdhB-H278Y 定量检测结果表明(表4):12 份田间病样的DNA 检测结果为0.12%~2.69%,平均值为0.69%,与阴性对照无显著差异,而与阳性对照差异显著,表明该检测体系可用于黄瓜棒孢叶斑病病斑中SdhB-H278Y 突变株所占比例的检测。

表4 田间黄瓜多主棒孢SdhB-H278Y 定量检测结果
3 结论与讨论
近年来,由多主棒孢引起的黄瓜棒孢叶斑病给我国黄瓜生产造成了严重的危害,且番茄、茄子等蔬菜的棒孢叶斑病也在我国大面积发生,造成严重的经济损失(李宝聚 等,2012)。多主棒孢SdhBH278Y 突变在我国山东、河北等地黄瓜主产区发生频率高,导致病菌对啶酰菌胺产生超高水平抗性(朱发娣,2018),且与吡噻菌胺、氟吡菌酰胺、萎锈灵存在正交互抗性(阎昱韬 等,2020)。为了及时、有效检测该突变在田间的频率变化,建立一种高效real-time PCR 检测技术是十分必要的,将为该病害的风险评估、防治策略提供理论依据。
本试验通过对黄瓜多主棒孢SdhB序列的测定,发现供试多主棒孢携带SdhB-H278Y 和SdhBI280V 突变。SdhB-H278Y 突变株对啶酰菌胺的EC50值为21.47 μg·mL-1或>30 μg·mL-1。也有报道多主棒孢SdhB-H278Y 突变株对啶酰菌胺的EC50值均大于30 μg·mL-1,且对其他SDHIs 杀菌剂也有较高的抗性水平,推测可能与同类型药剂选择压力有关(Shi et al.,2021)。此外,在茄链格孢(Alternaria solani)中也发现了SdhB-H278Y突变,且在啶酰菌胺浓度为100 μg·mL-1时SdhB-H278Y突变株仍能继续生长,而野生型敏感菌株在啶酰菌胺浓度为0.1~10 μg·mL-1时菌丝生长受到明显抑制(Mostafanezhad et al.,2022),这表明SdhBH278Y 突变株对啶酰菌胺有较高水平抗性,应尽快选择有效药剂进行抗SDHIs 多主棒孢的抗性治理。
本试验建立的real-time PCR 检测体系具有良好的线性关系(R2=0.992 9),可以快速定量检测田间SdhB-H278Y 突变株。经多主棒孢菌株DNA验证,试验值与预期值具有极高的相关性(R2=0.999 7),可用于黄瓜棒孢叶斑病病斑中SdhBH278Y 突变株所占比例的检测。该检测体系熔解曲线在88.66 ℃有唯一的产物吸收峰,灵敏度达到3.6×10-4ng·μL-1,是AS-PCR 的10 倍。用于核盘菌β-微管蛋白E198A 突变位点real-time PCR检测体系的灵敏度也是AS-PCR 的10~100 倍(赵伟,2005),与本试验结果基本一致。利用LAMP技术对多主棒孢Cytb基因G143A 突变也可进行有效检测(Li et al.,2021),但与real-time PCR 相比,LAMP 需要设计多对引物(Prida et al.,2008),在反应过程中产生大量的扩增产物,极易造成交叉污染,定量研究时还需使用特殊仪器(如浊度仪),且易产生假阳性(Shi et al.,2020)。而real-time PCR 具有灵敏度高、特异性和可靠性强等特点,还能实现多重反应,自动化程度高,无污染,在定量检测中发挥着重要的作用(Mori et al.,2001;欧阳松应 等,2014;李文学 等,2019)。
综上,本试验建立的real-time PCR 检测技术体系能够高效、灵敏、定量检测多主棒孢SdhBH278Y 突变株在田间的发生,为黄瓜多主棒孢抗性治理提供科学的技术手段,以便及时有效开展黄瓜棒孢叶斑病抗药性治理。
