奇异值分解滤波对超声造影超微血管成像图像质量的影响
2023-01-31胡海曼雷炳松叶华容
程 慧,胡海曼,雷炳松,王 琦,李 楠,叶华容*
(1.武汉科技大学附属华润武钢总医院,湖北 武汉 430080;2.武汉科技大学医学院,湖北 武汉 430081;3.湖北工业大学电气与电子工程学院,湖北 武汉 430068)
肝脏病变、尤其肿瘤性病变的血管分布可为诊断疾病提供重要信息[1]。超声造影(contrast enhanced ultrasound,CEUS)可显示病灶与正常组织血流灌注模式及形态结构的差异,现已用于诊断肝脏疾病[2],而诊断准确率与图像质量密切相关[3]。信噪比(signal-to-noise ratio,SNR)、对比组织比(contrast-to-tissue ratio,CTR)及分辨率是评价CEUS图像质量的重要参数,对以上参数进行优化有利于提高CEUS的临床应用价值。肝脏受呼吸运动影响较大,导致SNR提升空间有限[4]。超微血管成像(superb microvascular imaging,SMI)为新型超声成像技术,基于可自适应算法显著消除杂波。奇异值分解(singular value decomposition,SVD)是基于已采集数据的图像后处理技术[4],可根据声学响应的空间和时间特征分离造影信号和组织信号,通过将获取图像数据的空间和时间信息放入Casorati矩阵并进行组合,使每帧图像均被矢量化并添加为一列。SVD滤波器在去除组织和杂波信号抑制方面表现优异[5],近年来亦已用于血流成像[6]及SMI[7]。本研究观察SVD滤波处理对肝脏CEUS SMI图像质量的影响。
1 资料与方法
1.1 数据来源 图像数据来源于2021年11月于武汉科技大学附属华润武钢总医院接受CEUS检查的1例疑诊肝血管瘤患者,男,32岁;检查前患者签署知情同意书。
1.2 仪器与方法 嘱患者检查前禁食6 h。采用Mindray Resona R9超声诊断仪,配备频率1.2~6.0 MHz的SC6-1U凸阵探头。嘱患者仰卧,保持安静状态,充分暴露腹部,根据检查要求配合呼吸。由1名具有20年以上工作经验的超声科医师首先以二维超声扫查肝脏,成像深度10 cm,记录病灶的灰阶超声特征(如大小、位置、回声等);选取显示病灶最佳切面,切换至CEUS模式,经肘静脉注入2.4 ml声诺维造影剂,嘱患者屏气,以双幅模式及高帧率造影功能(造影图像帧率41 帧/秒)、机械指数0.1[8]行CEUS,观察肝脏造影表现。以DICOM格式存储灰阶及CEUS图像。
1.3 图像处理选取 250帧动脉期不受呼吸运动干扰的图像,以SVD进行滤波处理,具体流程见图1。将Casorati矩阵记为S,并通过SVD进行分解,见公式(1):
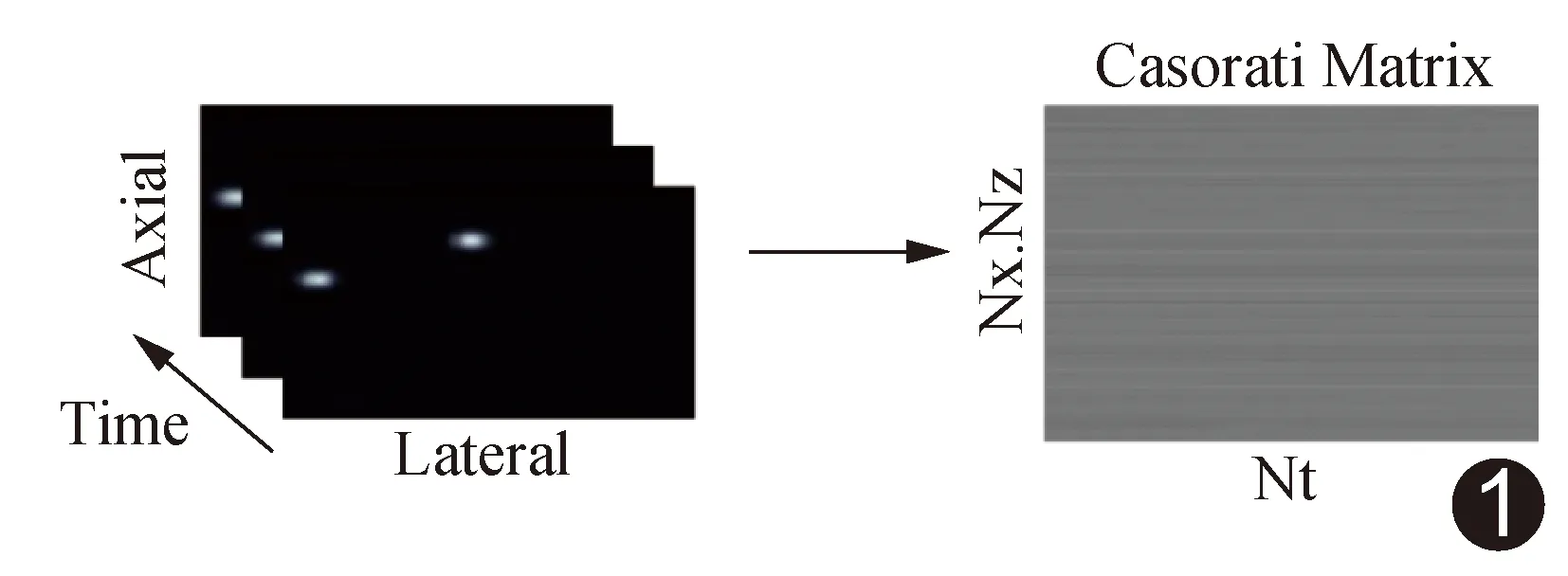
图1 SVD滤波处理流程图 Casorati矩阵形成过程中,每帧的空间信息被重组成为Casorati矩阵的列向量
S=UDV*
(1)
其中,U表示空间奇异向量;V表示对应的时间向量;D为1个对角矩阵,包含作为奇异值的元素,奇异值元素表示对每个奇异向量对的整体信号;*代表转置矩阵。
可将被重新排序为Nz行及Nx列的空间奇异向量视为1帧从数据中提取的虚拟图片,所对应的时间奇异矢量控制每个像素点大小随时间推移而变化。对于检测组织的背景信号,选择相对较低的奇异值阈值,以滤除不需要的组织背景;对于噪声信号,选择相对较高的奇异值阈值,以滤除杂乱的背景噪声信号。
矩阵SVD滤波由Matlab函数“svd(.)”提供数值解。可供调整的SVD滤波系数包括组织阈值T1及噪声阈值T2,其定义如下:默认奇异值以降序排列,舍弃小于组织阈值T1的奇异值以去除背景组织信号,舍弃大于噪声阈值T2的奇异值以去除系统噪声信号;最终保留T1与T2间的奇异值,以保留最佳造影信号。采用奇异值曲线拐点作为选取T1的优化策略,设定组织残留阈值T1为50(奇异值曲线拐点处),见图2。
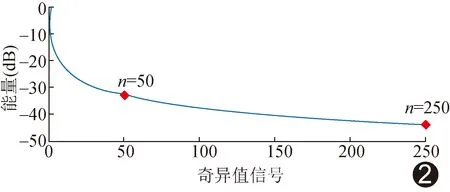
图2 奇异值随奇异值索引变化的曲线
1.4 评估图像质量指标 以SNR、CTR及半高全宽测量所得的分辨率作为评价指标,评估SVD对图像质量的影响:SNR越高代表穿透力越好、检测造影剂的敏感度越高[9];CTR可衡量本底残留,CTR越大代表残留组织信号越低、造影信号越强[10];分辨率越高,代表分辨2条相邻微血管的能力越强[4]。分别采用公式(2)和(3)计算本例250帧造影图像在SVD滤波处理前后的SNR、CTR。半高全宽为函数的某个峰在峰值之半时两点之间的距离;对平面内的数值进行投影并计算函数时,将2个峰值之间的距离视为2条血管的距离。

(2)
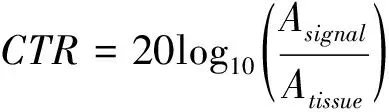
(3)
式中,Asignal、Anoise和Atissue分别表示微泡、噪声和组织残留对应的信号区域。
2 结果
2.1 可视化 相比二维声像图及CEUS图像,SVD滤波处理后,SMI的近场组织残留被显著抑制,微泡造影剂信号获得增强,肝脏区域可见更多微血管网络,见图3。

图3 各种图像显示肝脏
2.2 血管之间的距离 二维超声无法观测微血管;CEUS可显示直径较大的血管,但无法显示直径较小者。CEUS SMI可清晰显示微血管分支,并支持测量血管间的距离,见图4。

图4 局部放大图像显示肝脏微血管 A.二维声像图;B.CEUS;C.CEUS SMI;D.对A~C图中的白线处进行投影,基于CEUS的SMI可见2个波峰,其间距为0.79 mm,代表图C中白线横跨的2支微血管中心间距为0.79 mm,而图A、B中的微血管及对应波均难以分辨
2.3 SNR与CTR 二维声像图、CEUS及CEUS SMI的SNR分别为7.56、17.65及22.43 dB,CTR分别为1.12、7.56及16.34 dB,见图5。
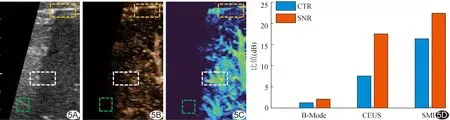
图5 不同成像模式SNR与CTR比较 A.二维声像图;B.CEUS;C.CEUS SMI;D.SNR与CTR柱状图 (黄框:组织残留;白框:造影信号;绿框:噪声)
3 讨论
CEUS可通过观察病灶血流灌注模式而诊断疾病[2],但对于细微及深层血管的价值有限[11]。SMI虽可提示CEUS无法检测的微血管血流信号,但不能表达肿瘤增强模式的洗脱信息[12]。CEUS联合SMI用于诊断疾病具有更高的临床价值[13]。CEUS中,在超声激励下,临床所用造影剂会发生收缩及膨胀,形成频率较为丰富的非线性信号[14-15];组织运动亦可产生非线性信号,并对设备产生干扰,使非造影剂信号被检出,且系统噪声影响图像质量提升[13]。SMI不仅可消除杂波,还能检出缓慢低速的造影剂信号,在提高检测微血管能力的同时提升图像质量;但同样不能免于组织运动的影响。
既往研究[16]表明,经SVD处理后的图像可显示更多传统CEUS不能显示的血流信号,以及单一SMI难以检出的速度较慢的血流信号[17]。本研究发现,对基于肝脏CEUS的SMI行SVD滤波处理可显示更多微血管网络、甚至检出2条相距0.79 mm的微血管,而其CTR及SNR也相比原始CEUS图像分别提升8.78 dB及4.78 dB,提示采用上述方法可有效避免组织运动及杂波信号对图像质量的影响,弥补造影剂及单纯SMI的不足。
根据既往文献[17]报道,本研究采取奇异值曲线拐点这一普适性优化策略选取组织残留阈值T1。相对而言,选取噪声阈值T2更应谨慎,降低噪声阈值虽可有效抑制噪声,但同时一些微弱的微泡信号也将被抑制而导致图像丢失细节信息。
综上所述,基于肝脏CEUS SMI图像行SVD滤波处理可在提高图像SNR和CTR的同时提升其分辨率。但本研究仅为针对单例患者的初步探索,有待累积样本进一步观察。
