深度学习重建算法优化能谱CT低单能量图像质量及检测肝脏低对比度小病灶能力
2023-02-01吕培杰刘娜娜王落桐FrancescaRigiroliDanieleMarin高剑波
吕培杰,刘娜娜,王落桐,Francesca Rigiroli,Daniele Marin,高剑波*
(1.郑州大学第一附属医院放射科,河南 郑州 450052;2.通用电气医疗集团CT影像研究中心,北京 100176;3.哈佛大学医学院贝斯以色列女执事医疗中心放射科,美国 马萨诸塞 22015;4.杜克大学医学中心放射科,美国 北卡罗来纳 27708)
随着碘X射线衰减能力变强,能谱CT低单能量成像(<70 keV)对比度逐渐增加[1],但所伴随的高噪声可致图像质量降低,影响检测与诊断肝脏低对比度小病灶(如肝转移灶);而常规重建算法,包括滤波反投影(filtered back projection,FBP)和基于混合模型的自适应统计迭代重建(adaptive statistical iterative reconstruction V,ASIR-V)等均无法有效解决低能级图像的噪声问题[2]。近期有研究[2-4]表明深度学习图像重建(deep learning imaging reconstruction,DLIR)可显著减低腹部CT图像噪声、提高对比度并保持图像纹理不变,进而改善图像质量。以往DLIR技术多用于常规混合能量CT图像,少见用于单能量CT图像的研究[5-7]。本研究观察以DLIR算法优化能谱CT低单能量图像质量、提高检测肝脏低对比度小病灶能力的可行性。
1 资料与方法
1.1 研究对象 纳入2020年3月—2021年3月30例于郑州大学第一附属医院接受上腹部增强CT扫描的肝脏疾病患者,男16例、女14例,年龄21~72岁、平均(55.6±14.2)岁;体质量指数20.10~35.45 kg/m2,平均(25.81±3.72)kg/m2;共58个病灶,包括肝囊肿30个、肝脏转移瘤28个,均经病理或临床及6个月以上影像学随访证实,直径0.51~3.00 cm,平均(2.13±0.81)cm。纳入标准:①年龄≥18岁;②病灶门脉期呈局灶性低对比度,即病灶与周围肝实质CT值比值<1,且0.5 cm<直径≤3 cm。排除标准:图像资料不完整或质量差而影响诊断。本研究经院伦理委员会批准(批号:2017-KY-02)。
1.2 仪器与方法 采用GE Revolution 256排CT机,嘱患者仰卧,行上腹部双期CT增强扫描,以双筒高压注射器经肘静脉以3.0 ml/s流率注射非离子型对比剂碘海醇(350 mgI/ml,1.3~1.5 ml/kg体质量),采用Smart Prep技术触发监测腹主动脉,达到阈值(100 HU)后延迟12 s开始动脉期扫描,完成30 s后行门脉期扫描。扫描参数:动脉期,管电压120 kVp,自动管电流100~700 mA,螺距1.375;门脉期,管电压80 kVp和140 kVp,管电流350~570 mA,螺距1.375,转速0.5秒/周,噪声指数10 HU,FOV 50 cm×50 cm。分别采用DLIR算法(重建强度为高水平)和基于混合模型的ASIR-V算法(重建百分比为60%)重建层厚和层间距均为1.25 mm的40、50、60及70 keV的门脉期单能量图像。
1.3 图像分析 将所有图像传输至GE AW4.7影像工作站,由1名具有3年以上工作经验的放射科医师于门脉期肝门层面的肝脏、门静脉主干、背部肌肉和肝脏病灶内放置类圆形ROI,测量CT值及标准差(standard deviation,SD);于前腹壁皮下脂肪内获取图像噪声值(像素平均值的SD)[8]。保证同一能级不同算法之间、同一算法不同能级图像间ROI一致,对各参数均测量3次,取平均值,分别计算肝脏和门静脉相对于背部肌肉及肝脏病灶相对于周围正常肝实质的对比噪声比(contrast-to-noise ratio,CNR):CNR肝脏/门静脉=(CT肝脏/门静脉-CT背景肌肉)/SD,CNR肝脏病灶=(CT肝脏病灶-CT周围肝实质)/SD周围肝实质。
由另2名具有14年以上工作经验、且不知晓患者及图像信息的放射科医师共同评估CT图像,预设窗宽和窗位分别为400 HU和40 HU,可根据需要适当调整,采用5分法对图像总体质量、病灶显著性和诊断信心进行主观评分(表1)[9-10],≥3分为满足诊断标准。

表1 肝脏CT图像质量主观评分标准
1.4 统计学分析 采用Graphpad Prism 8.0.2统计软件进行数据分析。以±s表示符合正态分布的计量资料;主观评分结果为等级资料,以中位数(上下四分位数)表示。采用配对t检验或配对Wilcoxon秩和检验比较相同能级不同算法图像之间各指标;以单因素方差分析或Friedman检验比较相同算法不同能级图像(Geisser-Greenhouse校正,两两比较Turkey法)。P<0.05为差异有统计学意义。
2 结果
2.1 客观评估 40~70 keV能级下,相比ASIR-V图像,DLIR图像的CNR肝脏、CNR门静脉及CNR肝脏病灶分别增加36.33%~44.45%、36.00%~42.96%及13.15%~16.91%(P均<0.05);DLIR图像噪声均显著减少(P均<0.05),减少幅度约26.71%~29.23%。不同能级下,2种算法间各指标变化率差异均无统计学意义(P均>0.05),见表2及3。DLIR图像噪声最大值位于40 keV,与ASIR-V图像50 keV能级下噪声相当(t=1.05,P=0.320)。除CNR肝脏外,不同能级间DLIR图像各指标两两比较差异均有统计学意义(P均<0.05);所有能级图像中,40 keV能级下DLIR图像的CNR门静脉与CNR肝脏病灶最高(P均<0.05),噪声亦高于其他能级图像(P均<0.05),见图1。

图1 不同能级DLIR图像的CNR门静脉、CNR肝脏病灶及噪声变化趋势 图2 不同能级DLIR图像总体质量、病灶显著性及诊断信心评分变化趋势
2.2 主观评估 40~70 keV条件下,DLIR图像质量均可满足临床诊断标准,但20.00%(8/40)40 keV ASIR-V图像无法满足标准;40~60 keV能级下,相比ASIR-V图像,DLIR图像总体质量、病灶显著性及诊断信心评分分别增加14.58%~34.26%、10.89%~14.46%及18.18%~21.89%(P均<0.05)。不同能级下,2种算法病灶显著性评分变化率差异无统计学意义(P>0.05),见表2、4。不同能级DLIR图像间各评分总体比较差异均有统计学意义(P均<0.05),40 keV DLIR图像总体质量和诊断信心评分与50、60 keV图像比较差异均无统计学意义(P均>0.05),而病灶显著性评分高于50~70 keV图像(P均<0.05),见图2、3。

表2 不同重建算法各能级上腹部CT图像客观及主观质量评价结果

表3 相比ASIR-V重建图像,各能级上腹部CT DLIR重建图像CNR和噪声变化率

图3 患者男,72岁,肝转移癌(直径0.55 cm) 相同能级下,相比ASIR-V图像,DLIR图像噪声、图像纹理及图像总体质量均显著改善,40 keV DLIR图像噪声高于其他能级,但CNR亦高,且病灶解剖细节清晰(箭)
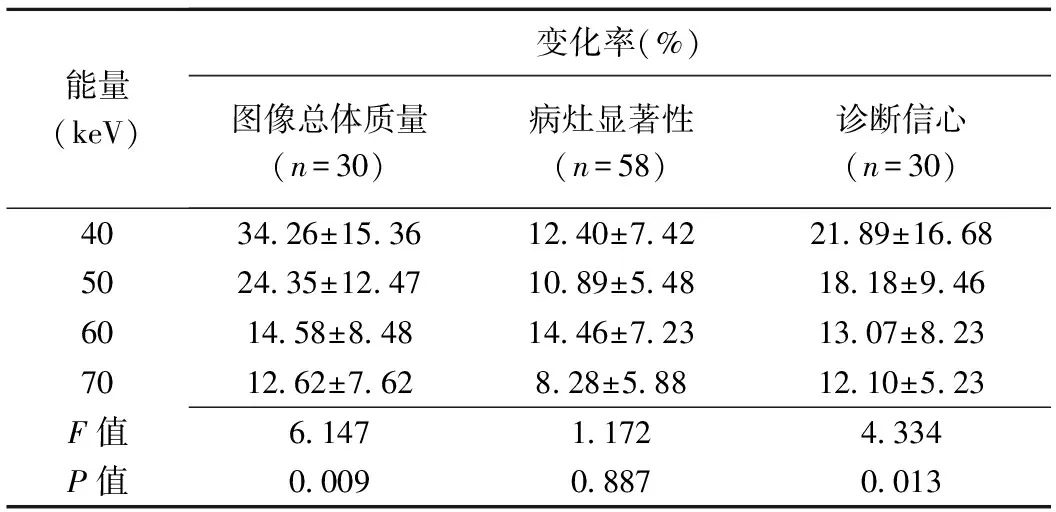
表4 相比ASIR-V重建图像,各能级上腹部CT DLIR重建图像主观评分变化率
3 讨论
新一代基于深度学习算法的DLIR图像重建技术可获得与高辐射剂量FBP图像相匹配的噪声纹理和空间分辨率特征,且降噪能力与现有常规迭代技术相当或更高[11-12]。本研究中,与ASIR-V图像相比,各单能量DLIR图像水平降噪效果更明显、图像对比度更佳,与既往临床研究[13]结果相符。另外,本研究进一步发现,不同单能量之间,DLIR相对ASIR-V的降噪比例及CNR提升比例无显著差异,表明DLIR客观优化效果未受单一能级变化的影响;虽然DLIR图像总体质量评分均显著高于ASIR-V图像[7,13],但各能级图像表现不尽相同,40 keV能级下,DLIR相对于ASIR-V单能量图像的优化率显著高于其他能级,可能与原40 keV噪声高于其他能级有关;在不改变图像纹理的条件下,DLIR降噪优化效果更佳。
各能级DLIR单能量图像的CNR肝脏病灶均显著高于ASIR-V图像,提升幅度为13.15%~16.91%,尤以40 keV DLIR图像的CNR肝脏病灶最高;分析原因,一方面与40 keV碘汇聚能力最大有关,另一方面,40 keV联合DLIR降噪后,噪声已降至临床可接受的50 keV ASIR-V图像的水平[14]。本研究中40 keV DLIR图像总体质量、病灶显著性及诊断信心评分均大于或相当于其他能级图像,提示40 keV可视为平衡肝脏病灶对比度和总体图像质量的最佳能级水平。
综上所述,DLIR技术可显著减少低能量图像噪声,提高检测肝脏低对比度小病灶的能力及诊断信心,提升图像总体质量,其中40 keV为最佳单能量水平。但本研究样本量小,且来自单一中心,仅采用60% ASIR-V和高强度水平DLIR,未纳入其他重建水平,亦未评估诊断病灶的准确性,有待扩大样本量进一步观察。
