病毒蛋白调控逆转录元件Ⅰ型长弥散核元件活性的影响及其意义
2023-01-30赵梓含王宇综述赵一霏赵可审校
赵梓含,王宇 综述,赵一霏,赵可 审校
吉林大学白求恩第一医院转化医学研究院艾滋病与病毒研究所,吉林 长春 130061
逆转录元件(retroelements)又称逆转录转座子(retrotransposons),是一类非常特殊的 DNA 元件[1]。这些元件可以经由DNA 到RNA 再到DNA 的方式实现自身的复制,以扩增基因组DNA 上的拷贝数。这些逆转录元件在细胞内的拷贝数非常巨大,以一个人二倍体细胞为例,各种逆转录元件占据基因组DNA全部长度的40%以上。这些逆转录元件得以拥有大量拷贝数的一个原因是其在细胞中长期存在。一方面,逆转录元件被发现在动物、植物、甚至原核细胞中广泛存在[2⁃3]。考虑到真核、原核细胞之间在细胞膜组成、细胞内容物、基因组DNA 所在空间及形式方面均存在巨大差异,暗示可能早在寒武纪之前,地球上的细胞中可能就已经存在逆转录元件了。另一方面,基于核酸序列的进化分析表明,其中多数逆转录元件的进化史均达到几千万年以上,某些甚至超过6 亿年,真正达到了前寒武纪时期[4]。可以说,逆转录元件的进化与地球上整个生物圈的进化息息相关;而更重要的是,逆转录元件的复制活性通过改变染色质结构、重排基因组序列、沉默乃至断裂旧基因、生成新基因等手段,为生物进化提供了重要的源动力[1]。因此,逆转录元件是细胞中重要的组成部分。
近年来,越来越多的证据则表明,逆转录元件的复制过程与细胞内天然免疫系统的活化水平存在紧密关联,后者则在抵御病毒入侵时发挥重要功能。因此,参与调控细胞内逆转录元件活性可能会成为某些病毒间接调控干扰素表达的方式。本文首先介绍了Ⅰ型长弥散核元件(long interspersed element⁃1,LINE⁃1),一种唯一已知可在人体细胞中自主完成复制的逆转录元件,综述了几种病毒蛋白对LINE⁃1 活性的影响及其相关机制,并探讨了病毒调控LINE⁃1活性可能产生的生理学意义,以期为针对相关感染和疾病的药物研发提供支持。
1 逆转录元件的介绍
1.1 逆转录元件LINE⁃1 转座是遗传重组的一种特殊形式,将某些遗传元件从一个DNA 位点移动至另一个DNA 位点,这些可移动的遗传元件称为转座子[5]。根据转座机制和结构特征对转座子进行分类,可分为 DNA 和 RNA 转座子[6⁃7]。其中 RNA 转座子又被称为逆转录转座子或逆转录元件,其转座过程是通过一种特殊的“复制⁃粘贴”模式,即先将DNA转录成RNA,再反转录成cDNA,然后插入基因组中的某一新位点,且原位置不被剪切[8]。逆转录元件又根据其是否带有长末端重复序列,进一步细分为长末端重复序列(long terminal repeat,LTR)逆转录元件和非LTR逆转录元件。
LINE⁃1是人体细胞中已知唯一一类具有复制活性的、可自主转座的非LTR 逆转录元件。LINE⁃1 的插入主要发生在基因组的非编码区[9⁃10]。在人类基因组上,LINE⁃1 的拷贝数约50 万个,占整个基因组的16.9%[11]。但其中绝大部分在基因组中均已失去复制活性,可能是LINE⁃1 在复制过程中仅能以较低的效率合成出全长的LINE⁃1 序列,大部分的复制序列均不完整,失去了再次逆转座的功能。就结果而言,目前单一人体细胞中仅有80 ~ 150 个拷贝是全长且能够自我复制的 LINE⁃1[12]。
1.2 LINE⁃1 的结构功能及其逆转座机制 LINE⁃1拷贝全长约6 000 bp,中间包含2 个开放读框ORF1和ORF2,两侧则分别为具有启动子功能的5'非编码区(5'UTR),以及 1 个带有 polyA 尾的 3'UTR[13](图1A)。ORF1编码1个大小约40 kD的蛋白,被命名为ORF1p。ORF1p 作为核酸伴侣,可稳定新转录的LINE⁃1 RNA[14⁃15];ORF2编码ORF2p,大小约150 kD,提供逆转录转座过程所需的DNA 内切酶和逆转录酶活性[16]。ORF1p 和 ORF2p 是 LINE⁃1 逆转座所必需的两种蛋白质,在翻译后会与LINE⁃1 RNA 发生相互作用,并在其他细胞因子的参与下形成LINE⁃1 核糖核蛋白复合物(ribonucleoprotein particle,RNP)。LINE⁃1 RNP 是 LINE⁃1 发挥逆转座活性的基本功能单位[13]。在最近的一项研究中,还发现LINE⁃1 RNP可作为内源性触发器,通过RNA 传感途径激活天然免疫系统[17]。
LINE⁃1 通过靶点介导的逆转录过程(target⁃site primed reverse transcription,TPRT)在基因组中进行复制[18](图1 B)。ORF1p保护LINE⁃1 RNP中的LINE⁃1 mRNA 免被降解、促进 LINE⁃1 mRNA 从核糖体上脱离以及辅助 LINE⁃1 RNP 进入细胞核[14⁃15]。随后,LINE⁃1 RNP 进入细胞核并到达基因组DNA,识别基因组 DNA 中的 TTTTAA 或相似序列,ORF2p 通过其核酸内切酶活性识别切割位点5'⁃TTTT/AA⁃3',在A 与T 之间进行剪切,从而产生单链DNA 断裂,暴露出游离的TTTT 序列。这段序列可以与LINE⁃1⁃mRNA 上的polyA 序列通过碱基互补的方式结合,然后ORF2p 会利用切口处的TTTT 为引物,以LINE⁃1 mRNA为模板,逆转录产生LINE⁃1 cDNA。最后以目前尚不清楚的机制整合至基因组,完成逆转座过程,该过程就是TPRT过程[19⁃20]。
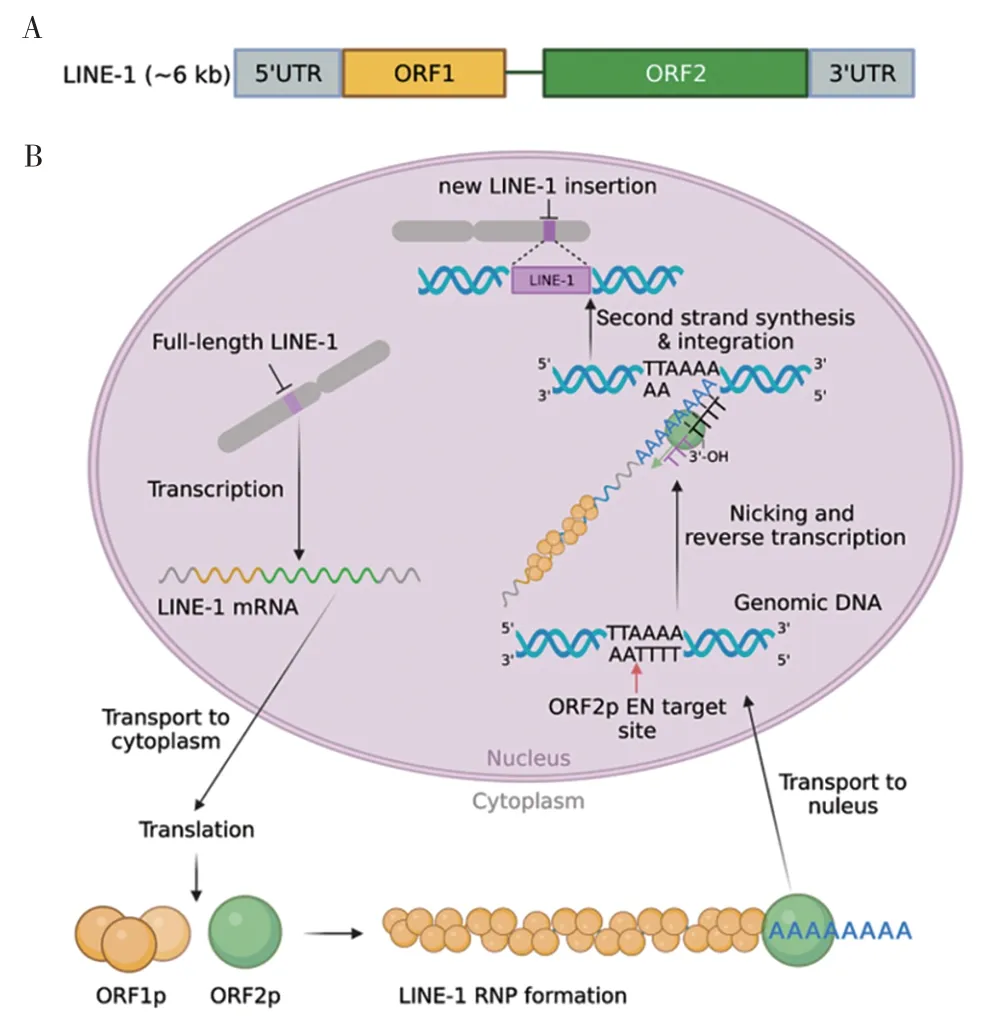
图1 LINE⁃1结构(A)和LINE⁃1逆转座复制(B)的示意图Fig.1 SchematicdiagramofLINE⁃1structure(A)andLINE⁃1 retrotransposition cycle(B)
1.3 LINE⁃1的生物学意义 LINE⁃1作为人体细胞中唯一具有自主转座活性的逆转录元件,是基因组改变和进化的主要参与者。从LINE⁃1 的复制过程中对AATTTT 基序的识别可知,在任意单侧DNA 链上,平均每4 096 个碱基就会包含1 个LINE⁃1 可识别的位点;且LINE⁃1 还允许该基序的碱基可以在一定程度上存在变化。相当于LINE⁃1 在剪切和插入时无论在染色质、正反义链、还是具体位点的选择上均是高度随机的。其可能产生的后果至少包括:①改变基因组结构,如因正反义链剪切位置的相近引发的染色质断裂以及后续可能产生的重排;②突变基因,如插入蛋白编码区从而改变基因的开放阅读框;③调节基因表达,如插入基因上游从而改变相应启动子的结构和功能。这些结果均可为基因组带来新的遗传信息,提供进化的基本动力,在生物进化中具有重要意义。
与此同时,LINE⁃1 的异常活化也会导致基因组的不稳定性,最终引发多种疾病。1988年的1 例A型血友病是第一个被证实与LINE⁃1 有关的基因疾病,是由于LINE⁃1 插入患者X 染色体从而导致血友病发生[21]。另外,LINE⁃1 的自主转座还与癌症的发生和发展密不可分。研究显示,在多种肿瘤和癌变组织中均发现了LINE⁃1表达上调的证据,认为LINE⁃1可能是促进癌症产生的一个潜在因素[22⁃23]。通常仅在恶性化程度较高的肿瘤组织中才能检测出ORF1p的表达,因此,LINE⁃1 ORF1p 有潜力成为肿瘤恶性程度检测的分子标志物[24⁃25]。
LINE⁃1对免疫系统也具有重要调控作用。一方面,LINE⁃1与自身免疫性疾病的发病相关,会导致系统性红斑狼疮、Aicardi⁃Goutières综合征(Aicardi⁃Gou⁃tières syndrome,AGS)等自身免疫疾病的发生[26⁃27];另一方面,LINE⁃1 也通过多种途径引发细胞的抗病毒天然免疫,由于逆转录步骤的存在,LINE⁃1在复制过程中会同时产生RNA 和DNA,后两者则会进一步活化细胞内的各种RNA 和DNA 感受通路,在调控固有免疫与适应性免疫中均起到重要作用[28]。LINE⁃1作为抗病毒免疫反应的内源性激活剂,通过环状磷酸鸟苷⁃磷酸腺苷合成酶⁃干扰素刺激因子(cyc⁃lic GMP⁃AMP synthase⁃stimulator of interferon genes,cGAS⁃STING)或维甲酸诱导基因蛋白Ⅰ/黑色素瘤分化相关蛋白5⁃线粒体抗病毒信号蛋白(retinoic acid⁃inducible protein I/melanoma differentiation⁃asso⁃ciated protein 5⁃mitochondrial antiviral signaling pro⁃tein,RIG⁃I/MDA5⁃MAVS)通路诱导Ⅰ型 IFN 的产生,LINE⁃1 RNA 激活了IFNβ 介导的固有免疫反应,而后者反过来可以抑制LINE⁃1[17]。
综上所述,从最初发现至今,已有多种人类疾病被归因于LINE⁃1介导的逆转座,因此对于调控LINE⁃1活性的研究十分关键[29⁃30]。已经有一系列针对宿主抗病毒因子调控LINE⁃1活性的研究,如在3'⁃修复核酸外切酶 1(three⁃prime repair exonuclease 1,TREX1)基因敲除细胞中,LINE⁃1活性明显上调[31];一种包含SAM 和HD 结构域的磷酸水解酶蛋白1(SAM and HD domain⁃containing protein 1,SAMHD1)可通过抑制 LINE⁃1 ORF2p 的表达来抑制 LINE⁃1 逆转座[32]。LINE⁃1 可激活和调控细胞的抗病毒天然免疫水平,随着对LINE⁃1 活性和细胞IFN 水平的进一步研究,不仅抗病毒因子抑制LINE⁃1 活性,许多病毒表达的蛋白也参与LINE⁃1活性的调控。
2 人类免疫缺陷病毒(human immunodeficiency virus,HIV)蛋白对LINE⁃1逆转座活性的影响
艾滋病(获得性免疫缺陷综合征,AIDS)被世界卫生组织定义为严重威胁人类健康的重要疾病之一,是由 HIV 感染导致[33]。HIV 由 2 条长约 9 800 bp完全相同的正义RNA 单链构成,其结构除了位于5'和 3'⁃末端的 LTR 和编码结构蛋白的gag、pol、env基因外,还包含几个重叠的读码框,分别为tat、rev、nef、vif、vpr、vpu(HIV⁃2 中的vpx)。这些基因编码的蛋白对于HIV 在体内的感染均是必不可少的,在对抗宿主天然免疫防御的过程中发挥重要作用[34⁃35]。而LINE⁃1 的逆转座却会激活天然免疫调节,以支持宿主的抗病毒机制。最近的研究发现,病毒感染会调节宿主细胞内源性LINE⁃1的逆转座水平[36⁃37]。考虑到LINE⁃1的复制可激活细胞内IFN 及后续抗病毒因子的表达,如果HIV 编码的蛋白具有抑制LINE⁃1 活性的功能,将是非常合理的。事实上,已经有不止一种HIV蛋白被证明是LINE⁃1调控因子。
2.1 HIV⁃1 Nef对LINE⁃1逆转座活性的抑制作用
2.1.1 HIV⁃1 Nef 蛋白的功能 Nef 作为 HIV 蛋白之一,是大小约27 kD 的豆蔻酰化的多功能蛋白,存在于细胞质和细胞膜上。此前,人们已知Nef蛋白至少可发挥4 种功能:①下调细胞表面CD4 蛋白水平;②下调细胞表面Ⅰ型组织相容复合物(major histoco⁃mpatibility class I,MHC⁃I)水平;③调控细胞信号传导及活化[38];④介导一种抗病毒丝氨酸整合因子(se⁃rine incorporator,SERINC)家族蛋白的降解[39]。通过这些功能,Nef可显著提高HIV 子代病毒的产量及对靶细胞的感染性[40]。
2.1.2 HIV⁃1 Nef通过两种机制间接抑制LINE⁃1活性最新研究表明,Nef 还是一种有效的LINE⁃1 逆转座的抑制因子[41]。且 Nef 介导的 LINE⁃1 调控似乎与上述 4 种功能无关。首先,Nef可抑制 LINE⁃1 5'UTR 启动子的活性,降低了LINE⁃1 RNA逆转录和随后LINE⁃1蛋白表达的效率。但Nef 并不与LINE⁃1 5'UTR 发生直接的接触。其次,Nef的存在可显著影响ORF1p与LINE⁃1 RNA 间的相互作用,从而破坏 LINE⁃1 RNP的形成或完整性,达到抑制LINE⁃1 活性的目的。然而,Nef 与 ORF1p 或 LINE⁃1 RNA 之间同样不存在结合的现象。表明Nef 对启动子活性以及RNP 稳定性的影响很可能并非特异性的靶向LINE⁃1,而是具有更广谱的作用。
研究还发现,Nef 蛋白序列上第二位的甘氨酸(G2)是其调控LINE⁃1 活性所必须的氨基酸残基[41]。G2 是Nef 蛋白形成豆蔻酰化的必要残基,而豆蔻酰化则可以将Nef蛋白插入细胞内的各种膜结构上,改变Nef 在细胞内的定位。值得注意的是,Nef 调控LINE⁃1 活性的两种机制均需要Nef 形成豆蔻酰化;与之相符的是,G2A突变可严重削弱Nef抑制LINE⁃1复制的能力,同时Nef G2A 突变体也不再能够有效抑制LINE⁃1 刺激IFN 产生的现象。结合上述结果,Nef 通过发生豆蔻酰化将自身定位在细胞内的膜结构上,并通过间接机制抑制LINE⁃1 5'UTR 的启动子活性并破坏ORF1p与LINE⁃1 RNA之间的相互作用,最终实现调控 LINE⁃1 活性及 LINE⁃1 介导的固有免疫活化水平。
2.2 HIV⁃1 Vpr对LINE⁃1逆转座活性的抑制作用
2.2.1 HIV⁃1 Vpr 蛋白功能 Vpr 是 HIV⁃1 中一种大小约14 kD 的蛋白,通过与HIV 结构蛋白Gag 相互作用被主动包装进病毒粒子。Vpr 通过不同途径作用来支持HIV⁃1 的复制:诱导共济失调毛细血管扩张突变基因 Rad3 相关激酶(ataxia⁃telangiectasia and rRad3⁃related,ATR)的 DNA 损伤反应(DNA damage response,DDR),从而导致细胞周期停滞在G2 期,进而促进病毒复制;在HIV⁃1 感染单核细胞衍生的树突状细胞(monocyte⁃derived dendritic cells,MDDC)和巨噬细胞的过程中,如缺乏Vpr,HIV⁃1 的复制则会减弱[42]。
2.2.2 HIV⁃1 Vpr抑制LINE⁃1逆转座 在之前的报道中,观察到滞留于G1、S、G2 或 M 期的细胞中LINE⁃1逆转座活性被抑制,表明LINE⁃1 逆转座需要在正常分裂的细胞中进行。在受阻细胞中,LINE⁃1 转录本的水平普遍显著减少,转录抑制是LINE⁃1 逆转座活性减小的主要原因[43]。HIV⁃1 Vpr 会影响宿主细胞分裂,使宿主细胞周期滞留在G2 或M 期。这似乎与观察到的Vpr抑制LINE⁃1复制的现象相吻合。研究发现,HIV⁃1 Vpr 并不抑制 LINE⁃1 的转录过程,证明Vpr是在LINE⁃1完成转录后才抑制其活性。表明虽然在停滞的细胞中LINE⁃1 也可完成转录过程,但完整的LINE⁃1 逆转座需要在正常分裂的细胞中进行。该研究还发现,独立于上述机制之外,Vpr 还可与LINE⁃1 ORF2p 发生相互作用并抑制ORF2p 的逆转录酶活性。与此同时,与ORF2p的结合还使得Vpr借此附着在LINE⁃1 RNP上,显著抑制LINE⁃1 RNP的功能,进一步抑制LINE⁃1的逆转座活性[44]。
2.3 HIV⁃2 Vpx 对逆转录元件 LINE⁃1 活性的促进作用
2.3.1 HIV⁃2 Vpx 蛋白功能 Vpx 最早发现发现于1988年,是 HIV⁃2 和某些猴免疫缺陷病毒(simian immunodeficiency virus,SIV)所独有的[45]。Vpx 通过拮抗宿主限制因子SAMHD1 促进HIV⁃2 在巨噬细胞、原代CD4+T 细胞和树突状细胞等免疫细胞中的复制,并通过不断增加HIV⁃2逆转录产物cDNA 的积累,突破免疫细胞内专有的抗病毒防线[46]。Vpx还是一种天然免疫激活的抑制因子。STING 信号小体通过激活干扰素调节因子3(interferon regulatory factor 3,IRF3)或核因子活化 B 细胞 κ 轻链增强子(nuclear factor kappa⁃light⁃chain⁃enhancer of activated B cells,NF⁃κB)来诱导各种天然免疫基因的表达,而Vpx 则可在多种类型的细胞中选择性地抑制cGAS⁃STING诱导的NF⁃κB信号来抑制天然免疫水平[47]。
2.3.2 HIV⁃2 Vpx 促进 LINE⁃1 逆转座活性 目前已有报道认为,Vpx 蛋白可促进LINE⁃1 的逆转座活性[48]。此前曾提到,Vpx 通过下调宿主 SAMHD1 蛋白的表达水平来协助HIV⁃2 或SIV 感染巨噬细胞等免疫细胞。作为抗病毒因子的SAMHD1同样具有调控 LINE⁃1 活性的能力。研究证实,SAMHD1 可通过下调LINE⁃1 ORF2p 蛋白的表达水平,破坏LINE⁃1 RNP 的稳定性,从而阻断LINE⁃1 对基因组的剪切及逆转录过程[32]。而通过介导SAMHD1 蛋白的降解,Vpx 也消除了 SAMHD1 对 LINE⁃1 的抑制,因此间接实现了对LINE⁃1活性的促进[32]。
近期的研究表明,Vpx 还可能会通过破坏人类中心沉默复合物(the human silencing hub,HUSH)来促进LINE⁃1 的逆转座。HUSH 复合物可选择性地与位于常染色质区域内具有复制活性的、全拷贝LINE⁃1相结合。随后,HUSH 可通过促进组蛋白H3 发生K9 位的三甲基化(histone H3K9 trimethylation,H3K9⁃me3)来沉默LINE⁃1的转录过程,以此限制LINE⁃1的表达[29]。与此同时,HUSH 还可抑制灵长类免疫缺陷病毒(如HIV⁃1、HIV⁃2 和SIV)的逆转录。而为了支持病毒的复制,HIV⁃2 或 SIV 的 Vpx 作为接头蛋白通过与DDB1和CUL4相关因子1⁃cullin4A/B(DDB1 and CUL4 associated factor 1⁃cullin4A/B,DCAF1⁃CU⁃L4A/B)E3泛素连接酶相结合的方式,来降解HUSH复合物以增强病毒感染[49⁃50]。表明对 HUSH 复合物的破坏很可能是Vpx 促进LINE⁃1 活性的另一种途径。已有研究显示,Vpx的表达会导致内源性LINE⁃1 ORF1p表达增强[48]。综上所述,HIV⁃2 Vpx确实会促进LINE⁃1的活性。
3 HBV蛋白对LINE⁃1活性的影响
3.1 乙型肝炎病毒(hepatitis B virus,HBV)与LINE⁃1 HBV 感染是引起人类肝细胞癌(hepatocellular carci⁃noma,HCC)最常见的病因[51]。有研究显示,LINE⁃1在肝细胞癌中是一个重要的突变源,可降低体细胞的肿瘤抑制能力[52]。在此基础上可以推测,如果HBV 可改变LINE⁃1 的生物学特性,就可能会促进HBV感染的肝细胞病变发展为肝细胞癌[53]。
有研究发现,HBV 聚合酶(polymerase,Pol)在调节LINE⁃1 逆转座方面具有新的功能与活性。HBV Pol 通过与 LINE⁃1 ORF1p 的相互作用和抑制 LINE⁃1 5'UTR区域,来显著抑制LINE⁃1逆转座[54]。另外,还有报道发现,多种HBV 蛋白均可参与调节LINE⁃1活性,表明LINE⁃1在HBV 介导的肝细胞癌发生中起到关键作用[52,55]。
3.2 HBx⁃L1 嵌合转录本 HBV 感染的一个关键点是将HBV 序列整合至宿主基因组中,这与肝细胞癌的发生、发展有直接关系。HBx 是HBV 最重要的整合蛋白[55],同时与多种宿主因子在肿瘤相关的生物学途径中密切相关[52]。流行病学研究表明,HBx 是HBV 发挥作用的核心功能蛋白,其在HBV 感染的肝细胞病变发展成肝细胞癌的过程中起重要作用[56⁃57]。最近的测序结果表明,HBV 对于人类基因组的插入并非随机,其插入位点多位于LINE⁃1 的重复非编码序列附近,因此,除直接调控LINE⁃1 活性外,HBV 可能还会在其他方面与LINE⁃1 存在某种关联,而HBx极可能是形成这种关联的桥梁[53]。
目前有报道发现,HBx 与 LINE⁃1 可在基因水平上发生融合。在HBV 感染过程中,其可将编码HBx的基因插入至染色体8p11上的LINE⁃1序列中,产生的HBx⁃LINE⁃1 嵌合转录本具有致癌性。在对HBV阳性的肝细胞癌细胞株测序时发现,23.3%的肝细胞癌细胞株中均可检测到HBx⁃LINE⁃1 嵌合转录本[52]。Wnt/β⁃Catenin 信号通路与肝细胞癌的发生相关[58]。HBx⁃LINE⁃1 嵌合转录本作为一种长非编码 RNA 发挥作用,通过激活 Wnt/β⁃Catenin 信号通路来促进肝细胞癌的发展[52]。
4 总结与展望
LINE⁃1 作为人体细胞中唯一已知具有复制活性,可自主转座的逆转录元件,不仅为基因组提供了进化的动力,同时也由于其造成了基因组的不稳定性导致多种疾病的产生。LINE⁃1对于免疫系统也具有重要意义,其中对细胞的抗病毒天然免疫起到关键的激活、调控作用。本文主要阐述了3 种HIV 蛋白 Nef、Vpr 和 Vpx 对 LINE⁃1 逆转座活性的影响,以及 LINE⁃1 与 HBV 蛋白 HBx 形成的特殊的 HBx⁃L1 嵌合转录本。
HIV⁃1 Nef 和 Vpr 对 LINE⁃1 逆转座活性起抑制作用。Nef 通过抑制LINE⁃1 5'UTR 启动子的活性和影响ORF1p 与LINE⁃1 RNA 间的相互作用来达到抑制LINE⁃1 活性的目的;Vpr 则通过诱导细胞周期停滞和抑制ORF2p 介导的逆转录酶活性来抑制LINE⁃1 逆转座。一方面,LINE⁃1 是激活宿主天然免疫的最基本单位,IFN介导的抗病毒反应又是宿主抵抗病毒感染的核心[59]。IFN 能够诱导干扰素刺激基因(interferon⁃stimulated genes,ISGs)的表达,产生多种有效的抗病毒限制因子抑制HIV 复制。表明抑制LINE⁃1 逆转座活性即为对细胞内IFN 水平的抑制,可以一定程度上帮助HIV 逃避宿主天然免疫的防御。另一方面,如果LINE⁃1 将新的拷贝插入至整合在宿主基因组的HIV⁃1 基因中或感染细胞生存所必需的基因中,则可能导致HIV⁃1 无法产生子代病毒或感染细胞被破坏。因此还可推测,抑制LINE⁃1 的逆转座活性相当于限制LINE⁃1 新拷贝的插入,以保护自己的基因组和感染细胞的基因组免受突变。综上所述,抑制 LINE⁃1 逆转座活性对HIV⁃1 的复制与传播起促进作用。
然而HIV的感染过程对LINE⁃1的活性并非是一个抑制的过程。相反,此前有研究认为,HIV 的感染在总体上对LINE⁃1 的逆转座是一个促进的作用[60]。表明HIV对LINE⁃1活性的影响极可能是一种动态的过程,同时存在促进和抑制的调控机制。Vpx 促进LINE⁃1活性的现象正是这一推论的具体体现。HIV⁃2 Vpx 通过下调病毒限制性因子SAMHD1 和HUSH复合物来促进LINE⁃1逆转座。推测HIV的某个感染或复制步骤需要LINE⁃1的参与,或者可以受到LINE⁃1的促进作用。对这一步骤及相关机制的解析有望提供新的抗HIV 药物的靶点,对于HIV 的预防及治疗具有重要意义。
另外,本文还阐述了HBV 抑制LINE⁃1逆转座活性,和 LINE⁃1 与 HBV 蛋白 HBx 相互作用的形式,即形成了特殊的HBx⁃LINE⁃1 嵌合转录本。需要特别强调的是,HBx⁃LINE⁃1 无需被翻译成蛋白,仅以长非编码RNA的形式即可促进癌症的发展。虽然HBx⁃LINE⁃1 嵌合转录本在肝细胞癌发生、发展中的确切作用方式尚需更详细的探究,但LINE⁃1 的转录调控可能成为治疗HBV 相关肝细胞癌的新突破口,为新的治疗方法开辟道路。
综上所述,病毒蛋白与LINE⁃1 间的相互作用展现出了多种多样的生物学活性,其中有些会保护宿主抵御病毒的进一步感染,有些则会引起更严重的疾病。未来需要以对病毒蛋白调控LINE⁃1 活性的机制进行更多更深入的研究,以消除其中的负面作用并增强正面的保护效果为目标,为针对相关感染和疾病的药物研发提供新的分子基础和作用靶点。
志谢感谢BioRender.com提供的作图平台
