核糖体展示技术筛选抗呋喃唑酮单链抗体
2023-01-30陈荫楠罗彩林郑晨娜石贤爱刘震
陈荫楠,罗彩林,郑晨娜,石贤爱,刘震
1.泉州医学高等专科学校,福建 泉州 362000;2.福州大学生物科学与工程学院,福建 福州 350108
硝基呋喃类化合物是一类由人工合成的广谱抗生素,曾被作为治疗药物与饲料添加剂用于水产养殖业中,具有较好的抑菌及杀菌功效[1]。但长期研究发现,若食用含呋喃唑酮(furazolidone,FZD)残留的水产品,会对人体产生严重的毒害作用[2]。我国在2002年将FZD列为禁用药[3]。
目前水产品中FZD 残留量主要通过仪器或ELISA 试剂盒检测。仪器法检测FZD 存在检测设备价格昂贵、样品需进行复杂的前处理步骤以及对操作人员要求较高等问题,不适合大批量检测[4]。与仪器法相比,ELISA 试剂盒检测FZD 具有快速、操作简便、灵敏度高、成本低等优点,更适用于农兽药残留的快速检测。传统ELISA 法需先获得相应的多抗血清或单抗。多抗存在抗体不均一、特异性较差的特点,无法实现稳定的大批量生产[5],单抗的特异性虽然较高,但其制备过程复杂。随着基因工程的快速发展,单链抗体由于其相对分子质量小、组织穿透力强、免疫性低等特点,已成为研究热点,但用于水产品中残留药物检测方面的研究较少。
核糖体展示技术通过重叠延伸(splicing by over⁃lap extension,SOE)⁃PCR 技术构建单链抗体文库,直接在体外进行转录和翻译,形成蛋白质⁃核糖体⁃mRNA复合物[6]。利用核糖体表面表达的抗体和包被抗原的特异性可直接在体外进行筛选[7⁃8],无需转化即可进行大容量库的构建及筛选,不受宿主细胞限制,弥补了细胞内展示技术的不足[9]。因此,本研究通过核糖体展示技术筛选获得抗FZD 单链抗体株,并对其特异性进行检测,在大批量生产后进一步应用于后续的ELISA检测。
1 材料与方法
1.1 细胞、菌株及载体 小鼠杂交瘤细胞、E.coliDH5α、E.coliBL21(DE3)、E.coli Rosetta(DE3)、pET⁃28a(+)vector、pET⁃27b(+)vector、pMD⁃18T 均由福州大学生物科学与工程学院实验室保存。
1.2 主要试剂及仪器 HRP标记的抗His⁃tag标签抗体购自美国Abcam 公司;HRP 标记的羊抗小鼠IgG(H + L)购自美国Thermo 公司;FZD 标准品溶液、呋喃妥因、呋喃它酮、FZD 代谢物、呋喃西林及其衍生物5 种结构类似物标准液购自德国Dr.Ehrenstorfer公司;卵清白蛋白(OVA)、牛血清白蛋白(BSA)购自美国 Worthington 公司;TNT T7 Quick for PCR DNA 试剂盒购自美国Promega 公司;四甲基联苯胺(tetrame⁃thylbenzidine,TMB)购自天根生化科技(北京)有限公司;First Strand cDNA Synthesis Kit 购自美国 Ther⁃moFisher Scientific 公司;各种DNA 限制性内切酶购自日本 TaKaRa 公司;Ni⁃NTA 亲和层析柱购自德国QIAGEN公司。
1.3 人工抗原合成 由福州大学生物科学与工程学院实验室前期利用重氮法成功制备FZD 的人工抗原FZD⁃OVA,具体步骤参考文献[10]。
1.4 单链抗体文库构建 Trizol法提取小鼠杂交瘤细胞总RNA,逆转录为第一链cDNA,以其为模板,设计重链VH和轻链VL可变区简并引物,扩增抗体的重链和轻链[11]。引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。

表1 PCR扩增引物Tab.1 Primers for PCR amplification
扩增后的VL⁃linker分别与VH⁃linker进行 SOE⁃PCR,组装成 VH⁃linker⁃VL单链抗体文库。第一轮为无引物PCR,反应体系为:Taq PCR master mix 20 μL,VH⁃linker和VL⁃linker各4 μL,ddH2O 12 μL。反应条件为:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸 1 min,共 15 个循环。第二轮 PCR 反应体系为:Taq PCR master mix 5 μL,VH⁃linker/back和Ck/for 各2 μL,ddH2O 1 μL。反应条件为:94 ℃预变性2 min;94 ℃变性 30 s,52 ℃退火30 s,最后72 ℃延伸1 min,共25 个循环。1%琼脂糖凝胶电泳鉴定扩增产物并纯化回收。通过蓝白斑筛选,挑取阳性克隆子送生工生物工程(上海)股份有限公司测序,验证抗体文库的多样性。
1.5 体外转录及翻译 用TNT T7 Quick for PCR DNA试剂盒对单链抗体文库进行转录和翻译[12]。反应体系为:TNT T7 PCR Master Mix 40 μL,1 mmol/L Methi⁃onine 1 μL,PCR DNA 8 μL,dd H2O 1 μL,共 50 μL,于30 ℃水浴条件下反应90 min。
1.6 亲和筛选 将检测抗原FZD⁃OVA稀释至40μg/mL,包被酶标板,4 ℃包被过夜;弃包被液,缓冲液洗涤3次,加入5%脱脂奶37 ℃封闭3 h;弃封闭液,PBSM缓冲液洗涤2 次,扣干后置冰上预冷;将翻译后的混合产物加至150 μL 冰冷脱脂奶中混匀后,加至预冷孔板中,50 μL/孔,置冰上继续反应2 h;PBSTM 缓冲液洗涤3 次,每次5 min,PBSM 缓冲液按同样方法再次洗涤 2 次,加入含 20 mmol/L EDTA 的 1 × PBS缓冲液,冰上放置10 min 进行解离;吸取上清,以其mRNA 为模板,进行 RT⁃PCR,具体步骤同 1.4 项,重复下一轮筛选。同时,设无抗原对照组和无TNT T7 PCR Master Mix的对照组[13⁃14]。
1.7 单链抗体的原核表达 经三轮筛选后,产物经NcoⅠ和HindⅢ双酶切,与经同样酶酶切的线性质粒pET⁃28a(+)进行酶连反应;将重组质粒转化至E.coli Rosetta(DE3)感受态细胞中,涂布含50 μg/mL卡那霉素的LB平板,筛选转化子。同时,将未筛选的原始抗体基因片段也进行转化筛选。随机挑取100 个筛选基因表达的阳性重组子和50个原始基因文库表达的阳性重组子接种至含50 μg/mL卡那霉素的LB液体培养基中,A600值达 0.6 时,加入0.2 mmol/L IPTG,30 ℃诱导 8 h。用 Ni⁃NTA 亲和层析柱进行纯化,具体操作参考说明书进行。
1.8 单链抗体筛选 采用ELISA法检测抗体蛋白。设抗原组、空白对照组和阴性对照组[15],每组均设5 个平行试验。用10 μg/mL FZD⁃OVA包被酶标板,4 ℃反应过夜,空白对照组包被PBS 缓冲液,阴性对照组包被OVA溶液;PBST洗涤3次,200 μL/孔,5 min/次,加入5%脱脂奶,200 μL/孔,室温封闭2 h;加入抗体蛋白(1∶2 000 稀释),100 μL/孔,37 ℃反应2 h;PBST 洗涤 3 次,加入 HRP 标记的抗 His⁃tag 标签抗体(1∶2 000稀释),100 μL/孔,37 ℃反应1 h;PBST洗涤3次,5 min/次,加入底物TMB,100 μL/孔,37 ℃避光反应30 min;加入终止液,100 μL/孔,酶标仪测定A450值。对获得的高亲和力阳性克隆子进行大量诱导表达及纯化,并进行5%SDS⁃PAGE鉴定。
1.9 单链抗体亲和力分析 以FZD⁃OVA 作为包被抗原,采用间接竞争 ELISA 法检测抗体亲和力[16⁃17]。用10 μg/mL FZD⁃OVA 包被酶标板,4 ℃反应过夜;加入5%脱脂奶,200 μL/孔,室温封闭2 h;将FZD标准品溶液从100 ~ 1 ng/mL 进行倍比稀释[10],与单链抗体(1∶50稀释)等体积混合,每孔加入100 μL混合液,37 ℃反应2 h;弃混合液,洗涤3 次,加入HRP标记的抗His⁃tag 抗体(1∶2 000稀释),100 μL/孔,37 ℃反应1 h;加入底物TMB,100 μL/孔,37 ℃避光反应30 min;加入终止液,200 μL/孔,酶标仪测定A450值[18⁃19]。结果判定:以标准溶液质量浓度的对数值作为横坐标,结合率为纵坐标绘制竞争曲线,按下式计算抑制率为50%时混合液中FZD的标准浓度即为竞争抑制率IC50,以此判断抗体特异性。
结合率(%)=(A-A空白)/(A0-A空白)×100%;
抑制率(%)=100-结合率(%)
式中A为不同抗原浓度的吸光值;A0为不加抗原的吸光值;A空白为不加抗原、不加单链抗体的吸光值。
1.10 单链抗体的交叉反应性分析 采用间接竞争ELISA 法测定单链抗体与竞争物的交叉反应性。分别将呋喃妥因、呋喃它酮、FZD 代谢物、呋喃西林及其衍生物5 种结构类似物标准液从100 ~ 1 ng/mL进行倍比稀释后作为被检抗原[20],绘制各自的标准曲线得出IC50值,步骤同1.9 项。5 种结构类似物的IC50与FZD的比值即为交叉反应率(%)。
1.11 统计学分析 采用SPSS 16.0 软件进行统计学分析,空白组和实验组间的亲和力比较采用F检验,以P<0.05为差异有统计学意义。
2 结果
2.1 单链抗体文库的鉴定 扩增产物经1%琼脂糖凝胶电泳分析,可见约600 bp 的轻链可变区基因片段VL⁃linker和约400 bp 的重链可变区基因片段VH⁃linker,见图1。
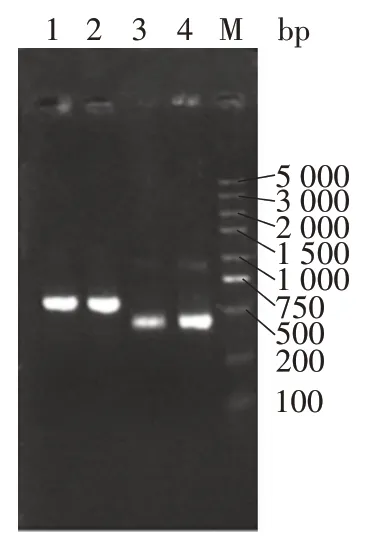
图1 抗体重链和轻链可变区扩增后产物电泳图Fig.1 Electrophoretic map of amplified products of variable regions of VH and VL of antibody
等浓度的VH⁃linker和VL⁃linker进行 SOE⁃PCR 拼接反应,扩增完整的单链抗体片段,连接后的完整片段大小约1 000 bp,见图2。
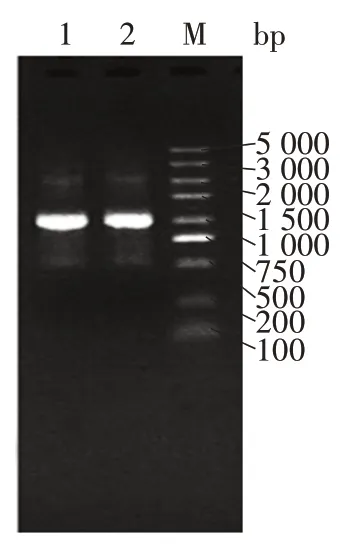
图2 单链抗体基因PCR扩增产物电泳图Fig.2 Electrophoretic map of PCR amplification products of single chain antibody gene
2.2 测序分析 随机挑取10 个克隆子,PCR 产物经1%琼脂糖凝胶电泳分析,在约1 000 bp 处可见单一条带,大小与目的条带一致,初步推断为插入了单链抗体DNA的阳性克隆子,见图3。
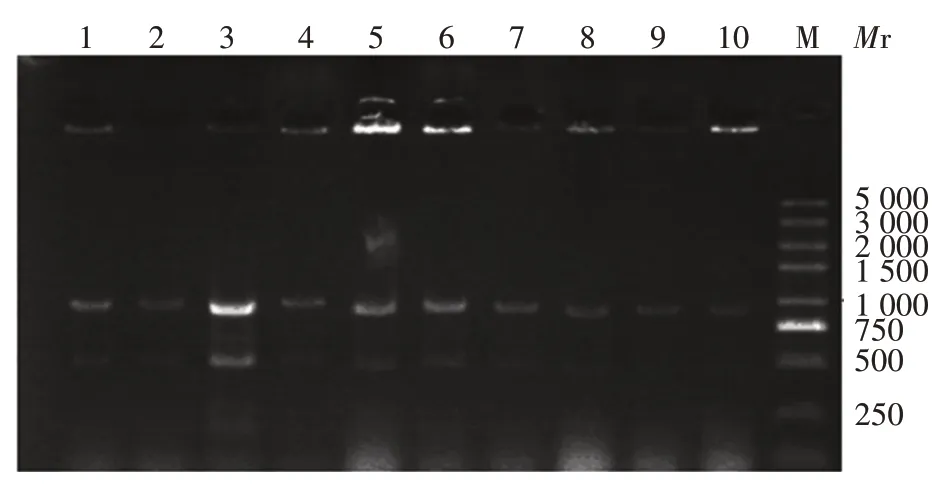
图3 单链抗体克隆子的菌落PCR电泳图Fig.3 Colony PCR electrophoretic map of single chain antibody clones
测序结果显示,10 条单链抗体序列包含了T7 启动子、Linker 片段、VH和VL可变区,且内部无终止密码子,具有较好的完整性。其中,不同单链抗体的重链互补决定区(complementarity⁃determining regions,CDRs)包含的氨基酸数目和种类差异较大,该区域决定抗体与抗原的特异性结合,表明该单链抗体文库有不同的抗体特异性,具备多样性。
2.3 核糖体展示筛选抗体基因 以FZD⁃OVA为筛选抗原,每轮回收mRNA 进行下一轮扩增筛选,经三轮筛选,约1 000 bp 处目的条带逐渐变亮,空白对照组和阴性对照组均未扩增出目的条带,见图4。表明在逐轮筛选过程中,针对抗原FZD⁃OVA 的目的基因得到了有效富集。
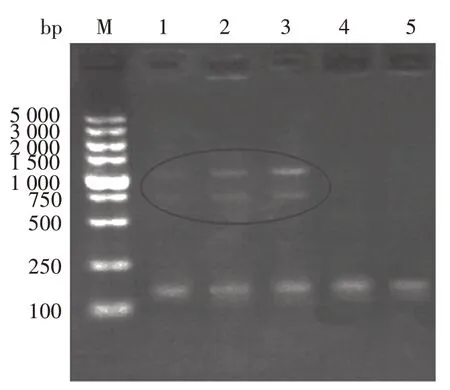
图4 每轮核糖体展示筛选后目的基因扩增产物电泳图Fig.4 Electrophoretic map of amplified products of target genes after each round of ribosome display screening
2.4 ELISA 法筛选阳性克隆子 原始文库中随机挑取的克隆子A450值较低,表明表达的蛋白特异性较低,很难获得高亲和力菌株。经核糖体展示重复筛选后,约1/5 的克隆子表达产物A450值较高,显示与抗原FZD⁃OVA 具有较好的特异性,其中3 株抗体FZD⁃ScFv1、FZD⁃ScFv2和FZD⁃ScFv3均具有较高的A450值。见图5 和图6。空白对照组和阴性对照组A450值均低于0.2,而3 株单链抗体的A450均高于空白对照组,且差异有统计学意义(F=17.682,P<0.05),表明3株单链抗体对抗原FZD具有一定的亲和力。
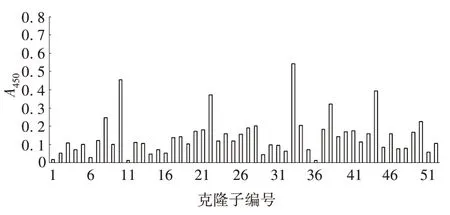
图5 ELISA法检测原始文库的单链抗体活性Fig.5 Detection of single chain antibody activity in original library by ELISA
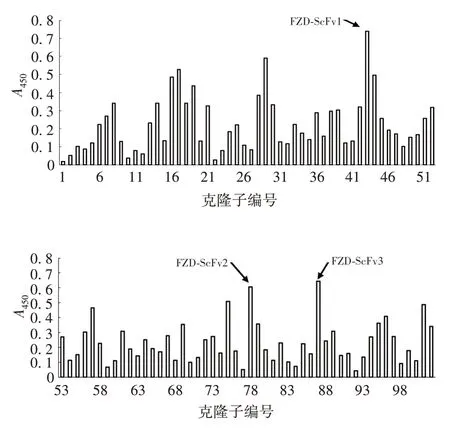
图6 ELISA 法检测核糖体展示筛选基因表达的单链抗体活性Fig.6 Detection of single chain antibody activity of ribo⁃somal display screening gene by ELISA
2.5 表达及纯化的FZD⁃ScFv1的鉴定 对特异性最高的单链抗体株FZD⁃ScFv1 进行大量诱导表达及纯化后,经5%SDS⁃PAGE分析,在相对分子质量约35 000处可见单一目的条带,大小与预期相符,见图7。

图7 单链抗体株FZD⁃ScFv1的SDS⁃PAGE分析Fig.7 SDS⁃PAGE analysis of single chain antibody strain FZD⁃ScFv1
2.6 单链抗体FZD⁃ScFv1 的亲和力分析 ELISA 标准曲线方程为:y=42.24x+2.930 2(R2=0.990 2),当抑制率为50%时,IC50值为13.01 ng/mL。
2.7 单链抗体FZD⁃ScFv1 的交叉反应性分析 单链抗体FZD⁃ScFv1 与呋喃它酮、呋喃妥因、氨基脲、呋喃西林及其衍生物之间的交叉反应率分别为0.03、0.16、0.08、0.1和0.22,均小于1%,表明获得的单链抗体FZD⁃ScFv1与FZD具有较好的特异性。
3 讨论
抗体工程的发展主要经历了多抗、单抗和基因重组抗体3 个阶段。单链抗体就是利用基因工程重组技术通过连接肽将抗体的重链和轻链可变区进行拼接的重组蛋白,其具有相对分子质量小、穿透力强、可在多种宿主中表达的特点,可满足生产成本低的大规模生产,因此被广泛应用于医学领域[21⁃22]。但其应用于动植物病害的诊断、预防及农兽药残留检测方面的报道较少。
本研究利用核糖体展示技术筛选抗FZD 单链抗体基因片段,对其进行诱导表达,并对表达产物的有效性进行了探索,结果显示,小鼠重链可变区VH大小约 400 bp,轻链可变区VL大小约 600 bp,经linker拼接后目的基因约1 000 bp。测序结果表明,抗体文库容量大,具备多样性,可用于进一步的筛选。通过TNT T7 Quick for PCR DNA 无细胞系统进行转录和翻译,产生单链抗体⁃核糖体⁃mRNA 三元复合体。以FZD⁃OVA 为抗原进行亲和筛选,回收 mRNA 用于下一轮筛选。经三轮筛选后,目的基因片段条带逐渐变亮,得到了富集。
将原始基因片段与经过筛选的基因片段双酶切后,分别与载体pET⁃28a(+)连接并转化E.coli Rosetta(DE3)进行诱导表达,间接ELISA法测定表达产物与FZD 的特异性。结果表明,经过筛选后挑取的克隆子,约20%表达出的目的蛋白与抗原有较好的结合能力,选择其中亲和力最高的单链抗体FZD⁃ScFv1进行下一步鉴定。
对FZD⁃ScFv1 菌株的表达条件进行探索,并进行大量表达及纯化。表达产物经SDS⁃PAGE 分析,在相对分子质量约35 000处可见目的条带。
间接竞争ELISA法检测FZD⁃ScFv1的亲和力,得出IC50值为13.01 ng/mL。同样基于间接ELISA 法测定FZD⁃ScFv1的特异性,选择5种硝基呋喃类抗生素作为竞争物,结果显示,交叉反应率均小于1%。
综上所述,与之前制备的单克隆抗体(交叉反应率均低于0.01%)相比[10],本研究制备的单链抗体的IC50和交叉反应率稍低,但足以满足检测需求,且利用核糖体展示技术构建及筛选的单链抗体均在体外完成,操作简单,制备所需时间较短。因此,可进一步建立基于抗FZD 单链抗体的间接竞争ELISA 法,从稳定性、检测限等方面与基于单克隆抗体的检测法进行比较,为单链重组抗体应用于检测农兽药残留奠定基础。
