Bi2WO6的制备及其光催化性能研究
2023-01-30杨水金单明清
杨水金,陈 飘,单明清
(湖北师范大学 化学化工学院,湖北 黄石 435002)
快速的工业发展和人口增长给人类生活带来了严重的环境问题[1-3].光催化被认为是一种有前途且高效、简便的环境修复技术,该技术能够借助清洁的太阳能来驱动催化剂降解污染物,对环境十分友好[4-6].为了有效地利用太阳能进行光催化环境修复,人们努力地开发各种可见光响应的光催化材料.截止目前已经被发现的用于光催化降解污染物或者抗生素的催化剂比比皆是,例如传统的TiO2和ZnO等.但是这些催化剂的带隙值都比较大,根据经验公式可以得出,他们只能在能量较高、波长较短的紫外光下被激发.然而,太阳光中紫外光的含量仅仅占有5%,这就表明了他们对太阳光的利用率很低.相反,较小的带隙值虽然可以广泛利用太阳光,但是根据光催化的基本原理来看,当电荷被激发跃迁到导带上之后,由于静电作用力又会回到原来的位置,这也不利于光催化的进行.所以,如何在提高对可见光利用的同时还能降低电荷的分离成为了工作者一直以来努力的方向.
Bi2WO6是 Aurivilius 家族中最简单的成员之一.他是一种窄带隙半导体(2.6~2.8 eV),可以捕获420~470 nm范围内的可见光.他的晶体结构显示出重叠的(Bi2O2)2+和(WO4)2-层[7-8].Bi2WO6以其独特的物理化学性质和热稳定性,被广泛应用于有机污染降解中.在选择性氧化和光催化还原中,Bi2WO6被认为是一种理想的光催化剂.他的合成方法很多,如水热法、溶剂热法和溶胶-凝胶法.根据之前的报道,Chen等[9]采用水热法合成Bi2WO6,并将其作为催化剂在可见光条件下降解溶液中的苯酚.Ma等[10]采用水热法合成了Bi2WO6,并将其应用于光催化还原Cr(VI).He等[11]采用溶剂热法合成Bi2WO6并将其用于可见光照射下降解罗丹明B(RhB).Bi2WO6虽然具有诸多优势,但在光催化领域仍有一定的局限性,例如具有很大的光生电子和空穴复合概率,并在有限的光反应区域内表现出吸收.因此,人们采用了一系列方法来扩大Bi2WO6的光催化活性,例如掺杂贵金属(Ag、Pt 等);用NaBH4还原形成Bi/Bi2WO6体系;与其他半导体耦合,例如 TiO2、CeO2、BiVO4和 BiOX(X为Cl、Br、I).这些方法有助于光生电子和空穴的分离,从而提高Bi2WO6的光催化活性.此外,催化剂的性能还受到形貌的严重影响[12].
本文则是采用简单的一步水热法,通过加入不同含量的醋酸调节反应过程中溶液的酸度,制得了具备不同形貌结构的Bi2WO6;通过XRD、SEM、FT-IR和PL、UV-Dis等手段对样品进行结构和光学性质的表征证明了催化剂制备成功;最后,以罗丹明B为目标污染物,探究了不同制备条件下Bi2WO6的光催化性能差异.通过自由基的捕获实验,发现空穴在其中起着重要的作用,其次是超氧自由基,最后才是羟基自由基.基于以上讨论,推测出Bi2WO6降解罗丹明B光催化性能提升的可能原因.
1 实验部分
1.1 实验试剂与仪器
所有试剂均为分析纯试剂,Bi(NO3)3·5H2O、Na2WO4·2H2O来自阿拉丁试剂有限公司;冰醋酸、无水乙醇、抗坏血酸、异丙醇、乙二胺四乙酸二钠、罗丹明B,均采用国药集团化学试剂有限公司生产的药品.
UV722S型紫外-可见吸光光度计,上海仪电分析仪器有限公司;5700型红外拉曼光谱仪,美国Nicolet 公司;X-线衍射仪,德国Bruker 公司;S-4800扫描电子显微镜,日立公司;PHS-25 pH计,上海仪电科学仪器有限公司.
1.2 光催化剂Bi2WO6的制备
将2 mmoL Bi(NO3)3·5H2O溶于35 mL不同体积比的冰醋酸水溶液中(V酸∶V水为0∶35、5∶30、10∶25、15∶20),搅拌30 min后,向其中加入1 mmoL的Na2WO4·2H2O,继续搅拌30 min,最后将溶液转移至45 mL反应釜,160 ℃下反应12 h,待反应自然降温到室温后,经离心收集产物,用水和无水乙醇分别洗涤3次,60 ℃下烘干后得到不同的Bi2WO6样品.根据加入的醋酸体积的不同,将产物标记为X-BWO,不加醋酸的产物则标记为BWO.
1.3 光催化性能测试
用300 W氙灯作为光源(CEL-HXF300,中教金源),将0.02 g光催化剂加至体积为50 mL、质量浓度为10 mg/L的RhB溶液中,磁力搅拌30 min,进行暗处理,达到催化剂和污染物的吸附-脱附平衡,之后开灯进行光降解实验,每隔10 min取样一次,高速离心2次后取出上层清液,利用紫外可见分光光度计在554 nm处测量吸光度的变化,整个实验在20~25 ℃条件下进行.
1.4 自由基捕获实验
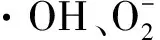
2 结果与讨论
2.1 XRD分析
图1显示的是不同制备条件下钨酸铋的XRD图,结果表明,对于只利用水做溶剂生成的 Bi2WO6,与标准卡片对比,没有新的峰出现,且峰都比较尖锐,这表明所制备的Bi2WO6具有很好的纯度和结晶度.逐渐加入醋酸后,生成的X-BWO的出峰位置也能很好地对应到标准卡片,且从图中可以明显地看出当醋酸体积为10 mL时,10-BWO的峰强度最大,推测该体积的BWO具有最佳的结晶度和纯度,这也是10-BWO具有最佳催化性能的原因之一.

图1 BWO、5-BWO、10-BWO和15-BWO的XRD图
2.2 FT-IR分析
为进一步对催化剂的结构进行分析,对BWO和10-BWO进行了红外光谱的测试如图2所示.波数为500~1 000 cm-1左右的峰可以归属于Bi—O、W—O和W—O—W.而出现在3 500 cm-1左右的峰归属于吸附在催化剂表面的H2O分子中O—H的峰.结合XRD和FT-IR分析,初步判断所制备的材料的确是纯的钨酸铋[13].

图2 BWO和10-BWO的红外光谱图
2.3 光学性质分析
光学性质是光催化剂一个重要的性质.图3是BWO和10-BWO的固体紫外曲线图,经醋酸调节后,BWO的光吸收波长从449 nm提升到10-BWO的469 nm,产生了红移的现象.由Eg=1 240/λ可知,样品的带隙值大概从BWO的2.8 eV降低到10-BWO的2.6 eV,这可能是由于形貌改变引起的.由此可知,10-BWO较BWO对可见光的利用率有所提高.

图3 BWO和10-BWO的固体紫外图
2.4 荧光性质分析
根据荧光产生的原因,可以判断光生电荷的分离效率,较强的荧光强度则表明光生载流子易复合,相反,较弱的荧光强度则证明了光生载流子的复合几率降低[14].本研究对BWO和10-BWO的荧光性质进行了分析.如图4所示,相比于纯水溶液状态下制备的BWO,加入醋酸后的10-BWO具有较低的荧光强度,由此可以判断,10-BWO的光生载流子复合几率更低.结合SEM分析的结果推测,这可能是加入醋酸以后,产物的形貌从之前密闭的结构转变为现在松散的结构,且纳米片变得很薄,导致载流子更快向催化剂的表面转移[15-19].

图4 BWO和10-BWO的荧光光谱图
2.5 形貌分析
通过扫描电子显微镜(SEM)对材料的形貌进行表征得到如图5所示的结果.从图5(a)和图5(b)中可以看出,在不加醋酸的情况下生成的BWO由许多纳米片自组装成紧密的鸟巢状结构,这样的形貌并不利于对光的吸收与利用.从图5(c)和图5(d)中可以发现,加入醋酸以后生成的10-BWO是由纳米片自组装成的花状微球结构.该结构具有很大的表面积,这不仅能提高对污染物分子的吸附能力,还能加速对光的反射活动,进而提高对光的利用率;该结构纳米片非常薄,有利于电荷的转移,这些结构特征都可以提高光催化性能.而结构改变的原因,推测是由于加入了醋酸,对反应体系整体的酸碱度产生了一定的影响,在弱碱性条件下,三价铋离子易水解,当加入酸后,抑制了三价铋的水解,所以在水热的条件下,团聚现象减弱,片与片的间隙变大,片状在自组装时趋向于生成更加松散的花状结构.

图5 BWO和10-BWO的SEM图
2.6 比表面积分析
光催化剂的颗粒大小和比表面积对光催化活性有相当大的影响.为了确定光催化性能改善的原因,首先通过测量BWO和10-BWO的N2吸附-脱附曲线来研究表面积,如图 6(a)所示.加入醋酸之后的10-BWO拥有比BWO更加大的比表面积,表明该材料能为RhB分子的吸附提供较大的面积,从而加速光催化反应的进程.且样品对RhB的吸附中出现了H3磁滞回线,判断该过程属于IV型等温吸附,且从粒径分布图6(b)来看,材料的孔径大多分布在10 nm左右,根据孔径的大小可以知道,该材料属于介孔材料.

图6 BWO和10-BWO的N2吸附-脱附曲线和粒径分布曲线图
2.7 光催化性能分析
为了进一步研究材料的光催化活性,选择有色染料RhB为光催化降解物.如图7(a)所示,进行了有色染料RhB的降解实验.由降解有色染料RhB的紫外可见吸收光谱图可以得出,各组催化剂都有很不错的降解效果,其中10-BWO的降解能力最好.可见光作用50 min,基本能将50 mL 10 mg/L的RhB完全降解.这表明用10-BWO具有良好的光催化性能.图7(b)是降解RhB的模拟动力学模型图,从图中可以看出该反应符合一级动力学模型,且10-BWO的降解速率是最快的.从图7(a)中还可以看出,10-BWO在暗处理阶段对污染物分子的吸附力度是很大的,这与之前所测试的扫描电镜图和BET分析的情况十分吻合.而开灯前的浓度较低,则更加有助于后续罗丹明B分子的降解.此外,从图中还可以发现,随着加入的醋酸含量增多,光催化性能反而降低,这可能是由于体系的酸性太强,不利于钨酸铋的生长,还可能破坏钨酸铋某些晶面上的原子排列情况,导致一些有利于光催化的晶面生长状况不好,从而降低了光催化性能,与XRD图中看到的情况十分接近.

图7 BWO、5-BWO、10-BWO和15-BWO降解RhB实验
2.8 液体紫外分析
图8(a)和8(b)分别是BWO和10-BWO降解RhB的液体紫外图,从图中可以看出10-BWO材料对RhB具有很强的吸附效果,这与之前测试的SEM和BET情况相吻合,经50 min的光照处理之后,10-BWO几乎可以100%降解RhB,降解效果相较于BWO更好,这也能够说明其光催化性能是有提升的.

图8 BWO和10-BWO降解RhB的液体紫外图
2.9 光催化剂稳定性
光催化剂的可重复使用性是工业应用的一个重要特征.因此,对其进行光催化稳定性测试.图9是5次循环实验的降解效率对比,通过循环使用实验验证了其稳定性和可重复使用性.在相同条件下对RhB进行降解,即使在5次循环运行之后10-BWO的催化性能活性损失率在10%以内,没有明显的活性损失.由此可见,材料10-BWO拥有良好的稳定性,有进一步参与工业应用的前景,可以循环回收继续使用.

图9 10-BWO经5次循环后的光催化效率图
2.10 自由基捕获实验

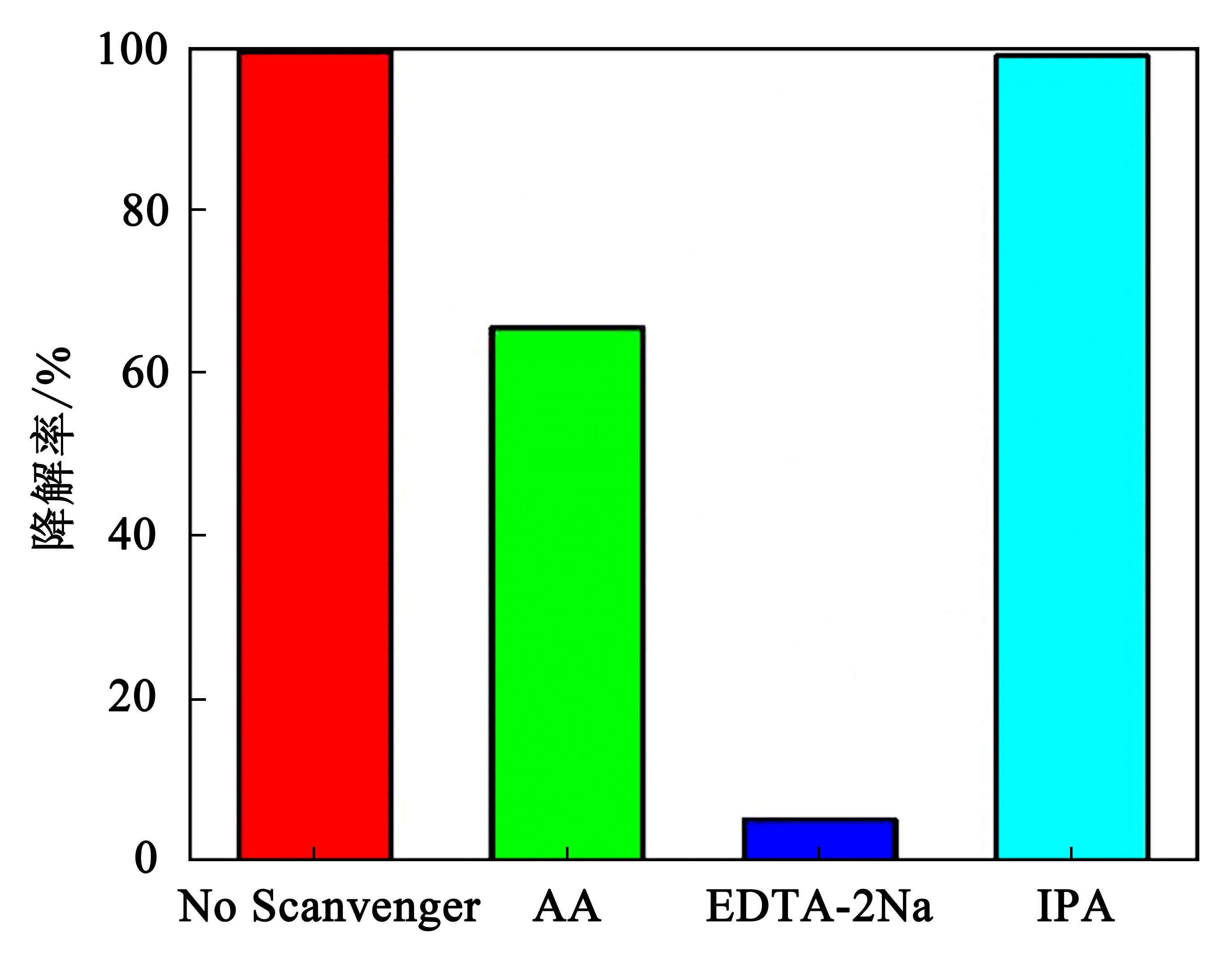
图10 10-BWO在可见光下加入不同捕获剂降解RhB的光催化活性
2.11 光催化机理
结合以上的测试分析,对10-BWO降解RhB的机理如图11所示.在模拟的太阳光照射下,10-BWO的电子接收能量,从价带(VB)被激发到导带(CB)上,空穴(h+)在价带上累积.跃迁到导带上的电子与吸附在催化剂表面的氧气发生反应,生成超氧自由基,进而氧化污染物分子.而由于价带电位不够正,所以空穴无法将OH-氧化为·OH,因为在自由基的捕获实验中,发现羟基自由基并非主要的活性物.但空穴可以直接与污染物分子发生反应,进而将其分解成小分子的H2O和CO2.
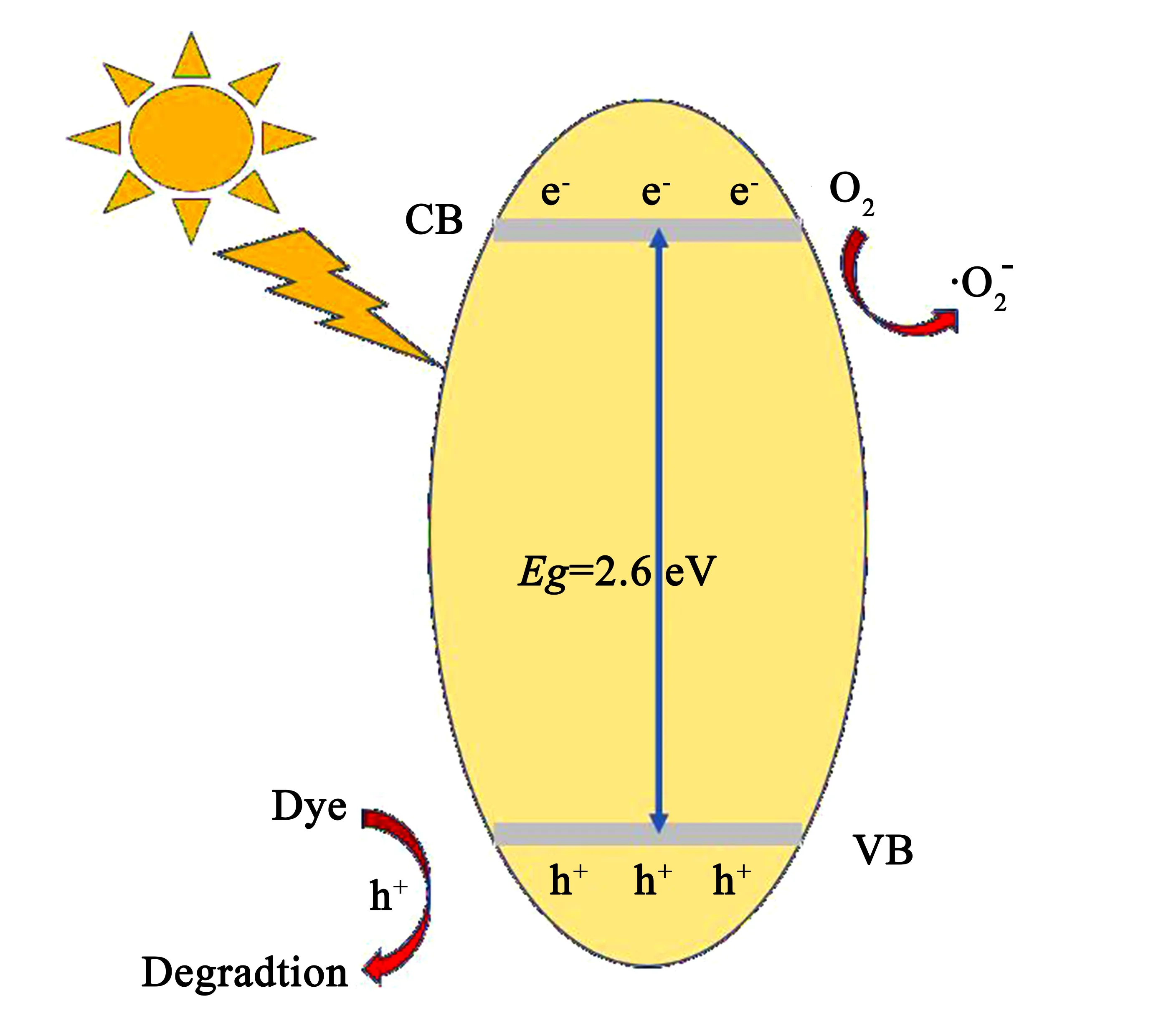
图11 10-BWO的降解机理图
3 结论
采用一步水热法,在不同醋酸含量的条件下制备了具有不同形貌的钨酸铋光催化材料,经XRD测试证明了晶体的结晶度很好,纯度很高.并结合红外测试,进一步确定了样品的结构.经SEM表征证明了材料的微观形貌,与只利用水作为溶剂制备的钨酸铋相比较,加入醋酸后的钨酸铋具有更松散的结构,这有利于提高对污染物分子的吸附能力,同时也有助于对光的利用率.通过荧光光谱图得出,相比于纯水溶液状态下制备的BWO,加入醋酸后的10-BWO具有较低的荧光强度,由此可以判断,10-BWO的光生载流子复合几率更低.固体紫外光谱图可以看出,样品的光吸收范围增大,对可见光利用率提高.BET测试证明了加入醋酸以后制备的材料拥有更大的表面积,这有利于对污染物分子进行吸附.在50 min的光照后,0.02 g 10-BWO可以完全降解50 mL 10 mg/L的RhB,与其他的材料相比较,10-BWO拥有最佳的性能.经拟合后发现,10-BWO对罗丹明B的降解符合一级动力学.
通过改变反应体系的pH值来改善产物很容易团聚的现象,最终得到的材料具有更好的形貌和更优异的催化性能,这为改变钨酸铋形貌和改善钨酸铋制备条件提供了一种可借鉴的方法.
