噬菌体在水产养殖中治疗细菌感染的研究进展和挑战
2023-01-30龚梦馨李明源
龚梦馨, 李明源
噬菌体在水产养殖中治疗细菌感染的研究进展和挑战
龚梦馨, 李明源
(喀什大学 生命与地理科学学院, 新疆 喀什 844000)
高密度、集约化水产养殖业的发展导致疾病不断发生并呈现日趋严重之势, 同时, 由于细菌对传统抗生素产生耐药性而使抗生素的使用受到越来越多的限制, 世界各国科学家都在致力于研究替代抗生素的新疗法。噬菌体因为可以特异性地杀死某些细菌, 对动、植物以及环境都没有副作用, 因此, 在水产养殖病害防治中呈现良好的应用前景。本文从噬菌体的特异性、安全性、赋形方法以及对环境的影响等方面对国内外水产养殖中的噬菌体治疗研究现状和存在的主要问题进行了简要论述, 为了解学科进展, 促进噬菌体在治疗中的成功使用提供了理论依据。
水产养殖; 噬菌体疗法; 噬菌体; 抗生素耐药性
作为优质蛋白重要来源的水产品, 人们对其需求正日渐增长。据《2022年世界渔业和水产养殖状况》[1]报告, 2020年世界渔业和水产养殖总产量上升至历史最高水平, 亚洲国家渔业和水产养殖动物产量约占全球总量的70%。随着水产养殖业的扩大发展, 特别是高密度、集约化养殖的发展, 导致疾病经常爆发, 引起养殖动物大量死亡, 给产业带来巨大损失, 致使生产效益下降、成本提高。水生动物病原体主要包括细菌、病毒、原生动物和真菌等。其中, 细菌给水生动物造成的危害最大。据统计, 水生动物约34%的疾病是由细菌引起[2]。抗击水生动物的疾病对公众健康可能产生巨大影响, 因为某些人畜共患病原体可通过与患病动物或动物源性食品的直接接触传播, 存在导致人类疾病或导致公共卫生风险[3]。水生养殖动物发病后, 往往使用抗生素治疗。然而, 抗生素治疗不但容易造成环境污染, 而且会导致产生耐药性细菌, 所以抗生素的使用正受到越来越多限制。目前, 世界各国科学家都在致力于研究替代抗生素的新疗法。噬菌体由于可以特异性地杀死某些细菌, 对动、植物以及环境都没有副作用, 因此, 在水产养殖病害防治中呈现良好的应用前景。下面, 我们对水产养殖中的噬菌体治疗研究现状和存在主要问题, 作简要概述。
1 噬菌体概述
噬菌体是指可以感染细菌的病毒, 发现于20世纪初, 是由一层蛋白质或脂蛋白组成的衣壳包裹着核酸(单链或双链DNA或RNA)组成的生物实体(图1)。它的衣壳可以保护噬菌体遗传物质, 而尾部可以通过位于尾部纤维上的特定受体识别宿主细菌[4-5]。噬菌体是地球上最丰富、最多样化的微生物, 其数量大约是细菌的10倍。目前, 大多数已知的噬菌体都属于有尾病毒目(Caudovirales)的有尾噬菌体。
噬菌体表现出两个不同的复制循环(周期): 裂解性循环和溶原性循环。只表现出裂解循环的噬菌体为烈性噬菌体, 而同时表现出裂解循环和溶原循环的噬菌体为温和噬菌体。无论是裂解性循环还是溶原性循环, 噬菌体都是从被动地黏附到细菌细胞(宿主菌)表面特异性受体(或转运蛋白)后将基因组注入宿主细胞开始进行裂解循环。在裂解循环中, 噬菌体基因组在宿主菌细胞内诱导自身组分合成, 包括基因组复制, 从而致使宿主菌细胞直接裂解。溶原性循环中, 噬菌体基因组整合到宿主菌基因组中, 并与宿主基因组一起复制形成原噬菌体。
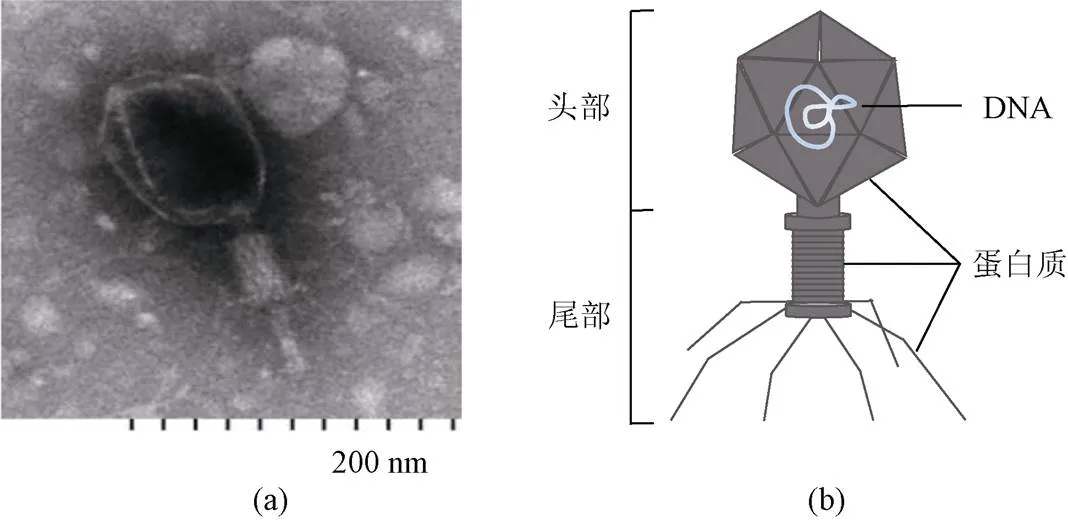
图1 噬菌体照片(a)和模式图(b)
原噬菌体可以以质粒的形式存在于宿主菌中, 这一状态称为溶原性。溶原性可以持续很多代, 直到由于环境因素(如抗生素治疗、DNA 损伤等)出现而诱导裂解循环发生为止[4-5]。原噬菌体和宿主菌双方都从溶原性中获益。一方面, 宿主菌为噬菌体提供生存之所, 另一方面, 原噬菌体可以影响宿主菌代谢特性, 使之获得对超级感染的免疫力和诸如抗生素抗性、毒力因子等新的表型, 有利于其拓展生存环境。
表现出溶原性循环的噬菌体即温和噬菌体被认为是参与细菌细胞之间基因水平转移的噬菌体。它们可以转移毒力因子或抗生素抗性基因。因此, 温和噬菌体不适合用于疾病防治。相反, 只表现出裂解循环的烈性噬菌体, 可以直接裂解宿主菌, 其参与基因转移的可能性有限, 从而使它们可以用于疾病治疗[4, 6]。
2 水产养殖中噬菌体治疗研究现状
2.1 噬菌体的发展简史
噬菌体应用研究由来已久。早在1919年, 噬菌体的发现和命名者之一Felix d’Herelle就开始尝试利用噬菌体治疗人类细菌感染疾病。1921年Richard Bruynoghe和Joseph Maisin发表了有关噬菌体治疗由金黄色葡萄球菌()引起的皮肤病的论文, 这是第一篇关于噬菌体治疗人类细菌感染性疾病的研究报告[7]。但是, 随着磺胺类药()和青霉素()分别于1930和1940年代相继投入使用, 人类对细菌感染疾病的治疗进入抗生素化学治疗时代, 这极大削弱了对噬菌体治疗的研究热情, 只在少数国家包括前苏联、波兰和印度仍然进行噬菌体治疗研究。有趣的是, 自20世纪80年代, 利用噬菌体治疗动物细菌感染[8-12]和治疗人类多重耐药性细菌感染获得成功以来, 人们又开始重视噬菌体治疗这一方法。
2.2 噬菌体的研究进展
利用噬菌体治疗水产养殖动物细菌性疾病, 始于20世纪90年代。NAKAI等[13]把分离到的格氏乳球菌()噬菌体PLgY, 通过皮下注射到格氏乳球菌感染的黄尾鱼()的体内, 发现可以显著降低感染黄狮鱼的死亡率。变形假单胞菌()是鱼类养殖中常见的一种致病性很强的细菌, 能导致不同时期的香鱼()发病。PARK等[14]发现让变形假单胞菌感染鱼苗, 口服分离到的变形假单胞菌的两株噬菌体PPpW-3和PPpW-4, 不但可以显著降低病鱼死亡率, 而且可以显著减少池塘中的变形假单胞菌数, 特别值得注意的是, 治疗变形假单胞菌感染的香鱼所用的噬菌体PPpW-3和PPpW-4, 不会在香鱼体内长期存在, 也不会诱导香鱼产生中和抗体[15]。中国学者在水产养殖动物疾病的噬菌体防治方面开展了大量研究。弧菌Ⅱ(Ⅱ)可以感染皱纹盘鲍(Ino)诱发脓疱病, 李太武等[16]分离到的河流弧菌Ⅱ的噬菌体, 可以有效地治疗或推迟脓疱病引起的鲍死亡, 把鲍成活率提高50%以上。目前, 噬菌体用于治疗鲍哈维氏弧菌()感染[17]、牡蛎()副溶血弧菌(s)感染[18]和刺参()鳗弧菌()感染[19]都有报道(表1)。
2.3 噬菌体的特异性
噬菌体具有很强特异性, 作用一般仅限于少数或几种细菌菌株。噬菌体可以特异识别目标细菌表面受体, 具有高度特异性, 仅感染一种细菌属甚至某些特定菌株。噬菌体不会损害环境或宿主的天然微生物群落, 特别是益生菌群落[4]。另外, 噬菌体不会与真核细菌相互作用, 仅作用于原核生物细菌, 因此, 利用噬菌体治疗副作用很小[5, 20]。应用噬菌体治疗感染杀鲑气单胞菌()的比目鱼()实验表明, 噬菌体不但有效降低了气单胞菌(sp.)的感染, 而且对养殖水体的天然细菌群落没有影响[21], 这与使用抗生素治疗结果形成反差。用抗生素特别是具有广谱活性的抗生素治疗鱼类疾病, 会改变环境和宿主正常的微生物群落, 并可能导致继发感染和耐药性的出现[22]。

表1 水产养殖中主要的噬菌体治疗实验研究总结
水生动物病原体范围广泛, 而噬菌体作用具有特异性, 所以, 分离广谱噬菌体成为一个主要研究领域[23]。VINOD等[24]分离出对50株对哈维氏弧菌()具有活性的噬菌体, 以保护虾幼虫; ZHANG等[25]发现了一种对副溶血性弧菌()具有广泛宿主范围的噬菌体。新近, 刘莉等[26]鉴定到一株广谱噬菌体, 发现分离自中华鳖()、南美白对虾()、鲈鱼()等养殖动物的嗜水气单胞菌()、迟缓爱德华氏菌()、副溶血弧菌和黄杆菌()等10多种致病株都对该噬菌体敏感, 而枯草芽孢杆菌()、酵母菌()等益生菌对其不敏感, 显示出该噬菌体在水产动物疾病防治中具有良好应用前景。
鉴于已发现的广谱噬菌体十分有限, 克服噬菌体宿主范围狭窄这一挑战的方法还可以使用具有不同特异性的噬菌体混合物来实现, 这种方法也称为噬菌体鸡尾酒疗法。混合物中的噬菌体各自都有特定的靶细菌, 它们共同作用, 实现广谱杀菌的同时, 又不影响益生菌群落。随着越来越多的噬菌体被发现和鉴定, 使得利用混合噬菌体同时治疗不同的细菌疾病成为可能[27-28]。目前, 已经报道有混合噬菌体制剂成功应用于医学治疗[29]。中国已有一种有噬菌体性质的制剂神克隆菌应用于水产养殖动物疾病防治, 其对水产养殖动物的主要致病菌如弧菌()、假单胞菌、气单胞菌、耶尔森氏菌()、爱德华氏菌()等都较好治疗作用。研究还发现, 重复或连续使用噬菌体治疗比单次使用噬菌体治疗效果更好[30]。
3 水产养殖中噬菌体治疗存在问题
噬菌体疗法在水产动物养殖上的应用虽然前景光明, 但仍有些理论和应用问题有待解决, 特别是噬菌体基因转移的风险亟待探索[40, 41]。烈性噬菌体具有高度特异性, 一般不会破坏有益细菌, 也不会影响环境[42], 人们担心的是噬菌体根除病原体可能会导致空出的生态位被其他细菌重新入侵[43], 通过调节宿主菌的数量改变群落比例, 从而破坏微生物组对环境产生负面影响。噬菌体还通过裂解细菌细胞释放有机物, 也可能对生物圈中有机物循环产生重要影响[44]。这些因素在水生环境中可以快速传播, 其作用尤为明显[45]。使用最小的噬菌体剂量, 可能有助于降低破坏环境细菌群落的可能性。但是, 有关噬菌体的繁殖研究尚不充分, 少量噬菌体在治疗期间可能低于阈值且效率低下。因此, 在规模化应用之前, 亟需对每种噬菌体对微生物群落的影响进行研究[41, 46, 47]。
3.1 噬菌体的基因转移
使用噬菌体治疗时要考虑的一个重要安全因素是基因水平转移的风险。据报道细菌对噬菌体比对抗生素产生耐药性的速率大约慢10倍, 并且耐噬菌体细菌对具有相似靶标范围的其他噬菌体没有耐药性[48], 但这仍然是需要重视的问题。众所周知, 选择压力和环境中抗生素的持续存在会导致细菌产生抗药性。细菌在结合和转导过程中可以通过基因水平转移获得抗生素抗性基因。结合指供体细菌和受体细菌通过细胞间的暂时沟通, 将遗传物质自供体菌转入受体菌, 使受体菌获得供体菌部分遗传性状[49]。转导是指外源DNA被引入细菌细胞, 这个过程不需要细菌细胞的直接接触, 温和的噬菌体可能会在这个过程中发挥作用。因此, 水产养殖动物疾病防治中, 应将具有转导可能的温和噬菌体排除在外, 仅选择烈性的噬菌体用于噬菌体鸡尾酒疗法[50]。有证据证明, 应用噬菌体鸡尾酒疗法可能是避免细菌对噬菌体产生耐药性的有效方法。MATEUS等[51]发现一种由3种噬菌体组成的混合物不但可以防治水产养殖动物疾病, 而且可能会延缓细菌对噬菌体抗性的发展, 这是因为对一种以上的噬菌体产生耐药性意味着细菌的适应成本更高[40, 52]。
3.2 噬菌体赋形
每个生物系统都是不同的, 因此, 应用噬菌体疗法进行治疗或者作为预防性治疗时, 正确的使用方法包括噬菌体的选择、递送方式和稳定性等因素, 必需独立考虑。噬菌体疗法成功的第一步是选择合适的噬菌体, 一般而言, 选择具有烈性且裂解周期短的噬菌体可以提高治疗效率[53]。噬菌体在自然界中非常丰富, 据报道每毫升水中含有多达 104~108个噬菌体[42], 分离能够有效应用于治疗的新型烈性噬菌体仍然是一项重要工作[54-55]。
在水产养殖中, 噬菌体递送方式包括浸泡、注射、饲喂和局部施用。当疾病是外部的或当噬菌体穿过一些天然屏障可以到达感染的内部部位时, 浸泡是一种有效的治疗方法[56-57]。噬菌体递送方式遇到的挑战之一是噬菌体有时难以到达体内的细菌感染部位。噬菌体疗法成功的关键是有足够数量的噬菌体可以到达并攻击目标。只有当噬菌体被有效地运送到感染部位并且它们不被动物的免疫系统清除时, 才能实现有效治疗。KALATZIS等[40]报道鱼类的噬菌体疗法可以引起其自身免疫系统反应, 从而清除噬菌体并阻止其到达感染部位, YUN等[58]验证了噬菌体裂解物可能具有免疫调节作用并诱导细胞和体液免疫反应的事实, 他们使用嗜水气单胞菌的噬菌体裂解物来刺激鲤鱼, 发现用噬菌体裂解物的存活率高于用灭活细菌细胞疫苗免疫的鱼。这与PARK 等[56, 59]的黄尾鱼()进行噬菌体治疗后没有发现产生中和抗体的报告相矛盾, 因此这个问题尚需深入研究。解决阻碍噬菌体抵达体内细菌感染部位的可能方法, 一是将噬菌体微胶囊化进行保护[48], 二是筛选噬菌体突变体, 旨在减弱表面蛋白的免疫原性, 使噬菌体不易被动物的免疫系统清除[60]。
耐pH和耐热性对噬菌体的存活至关重要。pH可以影响噬菌体的感染性, 低于5 或超过10时, 感染细菌效率较低, 大多数噬菌体在pH为6~8时活性最佳[61]。当鱼类胃中pH值较低, 会影响噬菌体的胞内复制和增殖。解决这一问题的方法, 可以在含有噬菌体的鱼饲料上用乳清蛋白涂层[62], 既能控制噬菌体的释放并保护它们到达目的地[41, 60]。温度对噬菌体的活力、储存和发生关系密切, 高温可能会降解构成衣壳的蛋白质。水产养殖用水温度通常适中, 不影响噬菌体活性。需要注意的是在生产过程中, 有时需要在低温或高温下加工产品, 因此, 这时最好选择对温度敏感性较低的噬菌体。另外, 水产养殖动物疾病治疗和预防治疗中, 使用噬菌体的剂量和递送时间, 也会影响治疗和预防效果。
终上所述, 噬菌体由于其对动、植物以及环境没有副作用, 在水产养殖病害防治中具有非常良好的应用前景。然而, 目前对水产养殖中的噬菌体治疗仍有一些问题, 如适用的噬菌体数量有限及其对基因水平转移的风险, 都需要深入研究。
[1] FAO. The state of world fisheries and aqua culture[R]. Italy: Food and Agriculture Organization of the United Nations, 2022: 10-25.
[2] LAFFERTY K D, HARVELL C D, CONRAD J M, et al. Infectious diseases affect marine fisheries and aquaculture economics[J]. Annual Review of Marine Science, 2015, 7(1): 471-496.
[3] VIAUD-MARTINEZ K A, BROWNELL R L, KOMN ENOU A, et al. Genetic isolation and morphological divergence of Black Sea bottlenose dolphins[J]. Biological Conservation, 2008, 141(6): 1600-1611.
[4] VENGADESH L, CHAN K G, PRIYIA P, et al. Insights into bacteriophage application in controllingspecies[J]. Frontiers in Microbiology, 2016, 7(232): 1114.
[5] JANIS D, KAYLA C, DELILAH H, et al. A Review of phage therapy against bacterial pathogens of aquatic and terrestrial organisms[J]. Viruses, 2017, 9(3): 50.
[6] JASSIM S, LIMOGES R G. Natural solution to antibiotic resistance: bacteriophages ‘The Living Drugs’[J]. World Journal of Microbiology & Biotechnology, 2014, 30(8): 2153-2170.
[7] WITTEBOLE X, DE ROOCK S, OPAL S M. A historical overview of bacteriophage therapy as an alternative to antibiotics for the treatment of bacterial pathogens[J]. Virulence, 2014, 5: 209-218.
[8] SMITH H W, HUGGINS M B. Successful treatment of experimentalinfections in mice using phage: its general superiority over antibiotics[J]. Journal of General Microbiology, 1982, 128(2): 307-318.
[9] SMITH H W, HUGGINS M B. Effectiveness of phages in treating experimentaldiarrhoea in calves by means of bacteriophages[J]. Gen Microbiol, 1983, 129: 2659-2675.
[10] SOOTHILL J S. Bacteriophages prevents destruction of skin grafts by[J]. Burns, 1994, 20: 209-211.
[11] MERRIL C R, BISWAS B, CARLTON R, et al. Long- circulating bacteriophage as antibacterial agents[J]. Proc Natl Acad Sci USA, 1996, 93: 3188-3192.
[12] BARROW P, LOVELL M, BERCHIERI A J R. Use of lytic bacteriophage for control of experimentalsepticemia and meningitis in chickens and calves[J]. Clin Diagn Lab Immunol, 1998, 5: 294- 298.
[13] NAKAI T, SUGIMOTO R, PARK K, et al. Protective effects of bacteriophage on experimentalinfection in yellowtail[J]. Diseases of Aquatic Organisms, 1999, 37(1): 33-41.
[14] PARK S C, SHIMAMURA I, FUKUNAGA M, et al. Isolation of bacteriophages specific to a fish pathogen,, as a candidate for disease control[J]. Applied and Environmental Microbiology, 2000, 66(4): 1416-1422.
[15] PARK S C, NAKAI T. Bacteriophage control ofinfection in ayu[J]. Diseases of Aquatic Organisms, 2003, 53(1): 33-39.
[16] 李太武, 相建海, 刘瑞玉, 等. 噬菌体防治皱纹盘鲍脓疱病的研究[J]. 海洋与湖沼, 1999, 30(4): 374-380.
LI Taiwu, XIANG Janhai, LIU Ruiyu, et al. Studies on bacteriophage control pustule disease of abalone[J]. Oceanologia et Limnologia Sinica, 1999, 30(4): 374-380.
[17] WANG Y, BARTON M, ELLIOTT L, et al. Bacteriophage therapy for the control ofin greenlip abalone ()[J]. Aquaculture, 2017, 473: 251-258.
[18] ZHANG H, YANG Z, ZHOU Y, et al. Application of a phage in decontaminatingin oysters[J]. International Journal of Food Microbiology, 2018, 275: 24-31.
[19] LI Z, ZHANG J, LI X, et al. Efficiency of a bacteriophage in controllinginfection in the juvenile sea cucumber[J]. Aquaculture, 2016, 451: 345-352.
[20] WITTEBOLE X, ROOCK S D, OPAL S M. A historical overview of bacteriophage therapy as an alternative to antibiotics for the treatment of bacterial pathogens[J]. Virulence, 2014, 5(1): 226-235.
[21] SILVA Y J, MOREIRINHA C, PEREIRA C, et al. Biological control ofinfection in juvenile senegalese sole () with Phage AS-A[J]. Aquaculture, 2016: 225-233.
[22] WELEDJI E P, WELEDJI E K, ASSOB J C, et al. Pros, cons and future of antibiotics[J]. New Horizons in Translational Medicine, 2017, 4: 9-1.
[23] DEFOIRDT T, BOON N, SORGELOOS P, et al. Alternatives to antibiotics to control bacterial infections: luminescent vibriosis in aquaculture as an example[J]. Trends in Biotechnology, 2007, 25(10): 472-479.
[24] VINOD M G, SHIVU M M, UMESHA K R, et al. Isolation ofbacteriophage with a potential for biocontrol of luminous vibriosis in hatchery environments[J]. Aquaculture, 2006, 255(1/4): 117-124.
[25] ZHANG H, YANG Z, ZHOU Y, et al. Application of a phage in decontaminatingin oysters[J]. International Journal of Food Microbiology, 2018(275): 24-31.
[26] 刘莉, 卢淑娟, 吕孙建, 等. 噬菌体作为替代抗生素在水产养殖中的应用与示范[R]. 湖州: 浙江省淡水水产研究所, 2018.
LIU Li, LU Shujuan, LV Sunjian, et al. Application and demonstration of phages as alternative antibiotics in aquaculture[R]. Huzhou: Zhejiang Freshwater Fisheries Research Institute, 2018.
[27] WEBER-DABROWSKA B, JO´NCZYK-MATYSIAK E, ZACZEK M, et al. Bacteriophage procurement for therapeutic purposes[J]. Frontiers in Microbiology, 2016, 7: 1-14.
[28] COOPER C J, KHAN M, NILSSON A S. Adapting drug approval pathways for bacteriophage-based therapeutics[J]. Frontiers in Microbiology, 2016, 7(7): 1209.
[29] 陈培芬, 孔英君, 文思, 等. 噬菌体治疗耐碳青霉烯鲍曼不动杆菌合并铜绿假单胞菌肺部感染的病例报道[J]. 新发传染病电子杂志, 2022, 7(2): 71-75.
CHEN Peifen, KONG Yingjun, WEN Si, et al. A case report of phage therapy against lung infection caused by carbapenem-resistantand carbapenem-resistant[J]. Electronic Journal of Emerging Infectious Diseases, 2022, 7(2): 71-75.
[30] RICHARDS G P. Bacteriophage remediation of bacterial pathogens in aquaculture: a review of the technology[J]. Bacteriophage, 2014, 4(4): e975540-1-14.
[31] VINOD M G, SHIVU M M, UMESHA K R, et al. Isolation ofbacteriophage with a potential for biocontrol of luminous vibriosis in hatchery environments[J]. Aquaculture, 2006, 255: 117-124.
[32] KHAIRNAR K, RAUT M P, CHANDEKAR R H, et al. Novel bacteriophage therapy for controlling metallo- beta-lactamase producinginfection in catfish[J]. BMC Vet Res, 2013, 9: 264.
[33] 龚婷. 对虾养殖环境中TCBS类群细菌多样性分析及虾源气单胞菌噬菌体生物学特性研究[D]. 北京: 国家海洋局, 2014.
GONG Ting. Analysis of bacterial diversity of TCBS group in shrimp culture environment and study on biological characteristics ofphage from shrimp[D]. Beijing: State Oceanic Administration, 2014.
[34] SILVA Y J, MOREIRINHA C, PEREIRA C, et al. Biological control ofinfection in juvenile senegalese sole () with Phage AS-A[J]. Aquaculture, 2016, 450: 225-233.
[35] KALATZIS P G, BASTIAS R, KOKKARI C, et al. Isolation and characterization of two lytic bacteriophages, ϕst2 and ϕgrn1; Phage therapy application for biological control ofin aquaculture live feeds[J]. PLoS ONE, 2016, 11: e0151101.
[36] STALIN N, SRINIVASAN P. Efficacy of potential phage cocktails againstand closely relatedspecies isolated from shrimp aquaculture environment in the south east coast of India. Vet[J]. Microbiol, 2017, 207: 83-96.
[37] 李振. 噬菌体防控苗期刺参弧菌感染的研究[D]. 大连: 大连理工大学, 2018.
LI Zhen. Study on the usage of phage in controlling vibrio infection in the juvenile sea cucumber[D]Dalian: Dalian University Of Technology, 2018.
[38] YUN S, JUN J W, GIRI S S, et al. Immunostimulation ofusing phage lysate of[J]. Fish Shellfish Immunol, 2019, 86: 680- 687.
[39] SCHULZ P, ROBAK S, DASTYCH J, et al. Influence of bacteriophages cocktail on European eel () immunity and survival after experimental challenge[J]. Fish Shellfish Immunol, 2019, 84: 28-37.
[40] KALATZIS P G, CASTILLO D, KATHARIOS P, et al. Bacteriophage interactions with marine pathogenic: implications for phage hherapy[J]. Antibiotics, 2018, 7(1): 1-23.
[41] CULOT A, GROSSET N, GAUTIER M. Overcoming the challenges of phage therapy for industrial aquaculture: a review[J]. Aquaculture, 2019, 513: 734423.
[42] PAL S. Phage therapy an alternate disease control in aquaculture: a review on recent advancements[J]. IOSR Journal of Agriculture and Veterinary Science, 2015, 8: 68-81.
[43] LLOYD-SMITH J O. Vacated niches, competitive release and the community ecology of pathogen eradication[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2013, 368: 20120150.
[44] MUNIESA M, COLOMER LUC M. Potential impact of environmental bacteriophages in spreading antibiotic resistance genes[J]. Future microbiology, 2013, 8: 739- 751.
[45] PARK S C, SHIMAMURA I, FUKUNAGA M, et al. Isolation of bacteriophages specific to a fish pathogen,, as a candidate for disease control[J]. Applied and Environmental Microbiology, 2000, 66(4): 1416-1422.
[46] MEADEN S, KOSKELLA B. Exploring the risks of phage application in the environment[J]. Front Microbiol, 2013, 4: 1-8.
[47] PAYNE R J H, JANSEN V A A. Pharmacokinetic principles of bacteriophage therapy[J]. Clin Pharmacokinet, 2003, 10: 5-11.
[48] LY-CHATAIN M H, HUONG M. The factors affecting effectiveness of treatment in phages therapy[J]. Frontiers in Microbiology, 2014, 5: 1-7.
[49] SULTAN I, RAHMAN S, JAN A T, et al. Antibiotics, resistome and resistance mechanisms: A bacterial perspective[J]. Frontiers in Microbiology, 2018, 9: 2066.
[50] MATILLA M A, FANG X, SALMOND G P. Viunalikeviruses are environmentally common agents of horizontal gene transfer in pathogens and biocontrol bacteria[J]. Isme Journal, 2014, 8(10): 2143-2147.
[51] MATEUS L, COSTA L, SILVA Y J, et al. Efficiency of phage cocktails in the inactivation ofin aquaculture[J]. Aquaculture, 2014, 424: 167-173.
[52] SARHAN W A, AZZAZY H M. Phage approved in food, why not as a therapeutic? [J]. Expert Review of Anti-infective Therapy, 2015, 13: 91-101.
[53] STALIN N, SRINIVASAN P. Efficacy of potential phage cocktails againstand closely relatedspecies isolated from shrimp aquaculture environment in the south east coast of India[J]. Veterinary Microbiology, 2017, 207(17): 83-96.
[54] ALMEIDA ADELAIDE, CUNHA, ÂNGELA, et al. Phage therapy and photodynamic therapy: low environmental impact approaches to inactivate microorganisms in fish farming plants[J]. Marine Drugs, 7(3): 268- 313.
[55] MUSHEGIAN A R. Are there 1031virus particles on earth, or more, or fewer?[J]. Journal of Bacteriology, 2020, 202: e00052-20.
[56] PARK S C, SHIMAMURA I, FUKUNAGA M, et al. Isolation of bacteriophages specific to a fish pathogen,, as a candidate for disease control[J]. Applied and Environmental Microbiology, 2000, 66(4): 1416-1422.
[57] SCHULZ P, PAJDAK-CZAUS J, ROBAK S, et al. Bacteriophage-based cocktail modulates selected immunological parameters and post-challenge survival of rainbow trout ()[J]. Journal of Fish Diseases, 2019, 42: 1151-1160.
[58] YUN S, JUN J W, GIRI S S, et al. Immunostimulation ofusing phage lysate of[J]. Fish Shellfish Immunol, 2019, 86: 680- 687.
[59] NAKAI T, PARK S C. Bacteriophage therapy of infectious diseases in aquaculture[J]. Research in microbiology, 2002, 153: 13-18.
[60] MERRIL C R, BISWAS B, CARLTON R. Long- circulating bacteriophage as antibacterial agents[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(8): 3188-3192.
[61] HUANG K, NITIN N. Edible bacteriophage based antimicrobial coating on fish feed for enhanced treatment of bacterial infections in aquaculture industry[J]. Aquaculture, 2019, 502: 18-25.
[62] VONASEK E, LE P, NITIN N. Encapsulation of bacteriophages in whey protein films for extended storage and release[J]. Food Hydrocoll, 2014, 37: 7-13.
Research progress and challenges of bacteriophage in the treatment of bacterial infections in aquaculture
GONG Meng-xin, LI Ming-yuan
(School of Life and Geographical Sciences, Kashi University, Kashi 844000, China)
With the rising frequency of diseases in aquaculture as a result of high-density and intensive farming, as well as antibiotics limits, biologists all over the world are investigating alternatives to antibiotics for the treatment of bacterial infection. Bacteriophages can precisely kill some bacteria while having a little detrimental impact on animals, plants, and the environment; they are thus emerging as a promising option for non-antibiotic therapy to treat bacterial diseases. This study briefly examines the research status and major challenges of phage therapy in aquaculture at home and abroad in terms of specificity, safety, shaping method, and environmental impact. The successful application provides a theoretical foundation.
aquaculture; bacteriophage; phage therapy; antibiotic resistance
Jul. 25, 2022
Q939.48
A
1000-3096(2022)11-0160-07
10.11759/hykx20220725001
2022-07-25;
2022-09-13
新疆维吾尔自治区自然科学基金面上项目(2021D01A18)
[The Natural Science Foundation of Xinjiang Uygur Autonomous Region, No. 2021D01A18]
龚梦馨(1994—), 女, 新疆喀什人, 助教, 硕士, 主要从事噬菌体研究, E-mail: mercyxin@163.com; 李明源,通信作者(1984—), E-mail: mingyuan_lee@163.com
(本文编辑: 谭雪静)
