江蓠属不同种质资源中藻胆蛋白和琼胶含量差异及综合提取工艺研究
2023-01-30王旭雷牛建峰闫舒恒张玉红宋玉龄王广策宫相忠王立军
羌 玺, 王旭雷, 牛建峰, 闫舒恒, 张玉红, 宋玉龄, 王广策, 宫相忠, 王立军, 4
江蓠属不同种质资源中藻胆蛋白和琼胶含量差异及综合提取工艺研究
羌 玺1, 2, 4, 王旭雷2, 3, 牛建峰2, 3, 闫舒恒2, 3, 张玉红5, 宋玉龄2, 王广策2, 3, 宫相忠1, 王立军2, 3, 4
(1. 中国海洋大学 海洋生命学院, 山东 青岛 266003; 2. 中国科学院 海洋研究所 中国科学院实验海洋生物学重点实验室 海洋大科学研究中心, 山东 青岛 266071; 3. 青岛海洋科学与技术试点国家实验室 海洋生物学和生物技术功能实验室, 山东 青岛 266237; 4. 南通中科海洋科学与技术研究发展中心, 江苏 南通 226334; 5. 青岛市市南区疾病预防控制中心, 山东 青岛 266072)
藻胆蛋白和琼胶是来源于藻类的重要活性物质, 随着藻胆蛋白和琼胶需求量的日益提升, 寻找合适的提取原料尤为重要。本研究比较了中国8种常见江蓠()的藻胆蛋白和琼胶含量, 建立了一种环保的综合提取工艺并进一步优化了琼胶提取条件。研究结果显示不同品种江蓠的藻胆蛋白和琼胶含量有显著差异, 张氏江蓠()的藻胆蛋白和琼胶含量相对较高。以张氏江蓠为综合提取藻源, 藻蓝蛋白的得率为0.073 mg/g, 藻红蛋白得率为0.088 mg/g, 通过单因素实验和正交模型优化琼胶提取工艺, 最佳提取工艺为碱浓度4%, 碱处理时间2 h, 碱处理温度65 ℃, 琼胶得率为43.51%。结果表明, 张氏江蓠有较高生物资源利用率, 综合提取藻胆蛋白和琼胶可以提高张氏江蓠的应用价值, 研究为张氏江蓠的综合开发提供理论依据。
江蓠(); 琼胶; 藻胆蛋白; 综合提取; 高值化利用
红藻中富含蛋白质、多酚、膳食纤维等活性物质。藻胆蛋白是一种水溶性荧光活性蛋白, 包括藻红蛋白、藻蓝蛋白、别藻蓝蛋白和藻红蓝蛋白[1]。藻胆蛋白具有抗氧化、增强免疫力、抗肿瘤、荧光活性等多种生物活性[2]。藻胆蛋白具有很高的经济价值, 不仅可作为安全无毒的天然染料, 还可作为食品添加剂、肿瘤治疗光敏剂、荧光检验试剂等用于保健食品、生物医学、环境科学等领域[3-4]。
琼胶也是红藻中重要的活性物质, 是红藻细胞壁的重要组成成分之一, 其分子式为(C12H18O9)n。琼胶是由1,3连接的β-D-半乳糖和1,4连接的α-3, 6-内醚-L-半乳糖组成的琼脂糖与琼脂胶构成的长链线性结构[5]。琼胶具有较好的亲水性、凝胶性、可逆性、稳定性, 是重要的工业原料, 可作为增稠剂、稳定剂和澄清絮凝剂用于食品、日用化工、生物、医药等行业[6]。随着对琼胶深入研究, 琼胶还可用于生物培养基、电泳层析介质, 保健功能食品及新型纳米材料[7-8]。近年来, 随着琼胶应用范围的扩大, 琼胶的需求量远高于生产量, 使得琼胶的价格逐年上升, 因此扩大琼胶产量是琼胶工业发展的当务之急。
江蓠属海藻种类丰富, 在中国分布范围广、生长周期短、人工养殖技术成熟, 是中国重要的经济藻类[9]。江蓠属海藻是中国琼胶的主要提取来源之一[10]。随着琼胶需求量的扩大, 提取藻源不足限制了琼胶产量, 从而阻碍琼胶工业的发展。另外, 不同江蓠之间的琼胶含量差异较大, 需要筛选含胶量高、藻胆蛋白量多的江蓠作为藻源, 以便提高琼胶的产量, 增加江蓠经济价值。目前, 中国尚未有报道多种江蓠的藻胆蛋白和琼胶含量比较, 因此对中国常见江蓠的藻胆蛋白和琼胶含量展开详细研究, 这对中国江蓠属海藻种质资源及琼胶工业的发展十分重要。
传统提取琼胶的方法为常温浓碱法或者高温稀碱法[11], 使用碱处理的目的是为了去除藻中的硫酸基、色素和可溶性蛋白质, 来提高琼胶质量。目前琼胶工艺优化研究大多在传统碱提法的基础上加入超声[12]、微波[13]工艺, 造成可溶性蛋白、色素、含氮物质流入碱处理废水中, 不仅使得活性物质被浪费, 还增加废液处理成本和环境保护压力[14]。如何改善传统琼胶提取工艺的缺陷、降低生产成本、进一步提高海藻的经济价值, 成为一个亟需解决的问题。
本研究选取中国常见的8种江蓠, 比较分析不同品种江蓠中藻胆蛋白和琼胶含量, 选取藻胆蛋白和琼胶相对含量较高的江蓠为综合提取藻源, 并建立一种综合提取两种活性物质藻胆蛋白和琼胶的方法-先提取江蓠中藻胆蛋白再提取琼胶, 通过单因素和正交模型实验, 进一步优化琼胶提取的工艺。本研究不仅筛选合适江蓠品种为琼胶藻源, 还建立了综合提取藻胆蛋白和琼胶的方法, 减轻了琼胶提取工业的环保压力, 并提高了本土养殖江蓠的利用率, 降低对原料进口依赖, 为中国相关藻业的发展提供参考。
1 材料与方法
1.1 材料
缢江蓠()、异枝江蓠()WC-150采集于海南省文昌市。细基江蓠繁枝变种()、异枝江蓠()HSK18、张氏江蓠()采集于海南省海口市。帚状江蓠()采集于海南省乐东市。凤尾菜()采集于海南省三亚市。龙须菜()采集于山东省威海市。脆江蓠()购于青岛胶南利群市场。氢氧化钠、盐酸、次氯酸钠均为分析纯。
1.2 方法
1.2.1 江蓠藻胆蛋白含量
采后的江蓠洗净、去除杂藻。称取200 g江蓠, 按1∶1.5(g∶mL)料液比加入去离子水, 用沙冰机破碎,放入–20 ℃冰箱中, 反复冻融, 筛绢过滤, 6 000 r/min离心10 min, 去除杂质, 得藻胆蛋白粗提液, 反复冻融3次[15]。合并3次提取液, 用紫外分光光度计(UV-1900, 日本岛津公司)对稀释一定倍数的藻胆蛋白粗提液在250~700 nm波长进行全波长扫描, 并记录A652、A617、A565、A557、A280 nm, 藻胆蛋白浓度和纯度计算公式如下[16]。
1.2.2 江蓠琼胶含量
琼胶提取参照纪明侯的方法[17], 具体如下: 取50 g洗净的江蓠藻渣, 加入NaOH, 65 ℃水浴加热2 h, 随后用去离子水洗至中性, 加入NaClO漂白5 min, 洗净后用盐酸软化藻体5 min, 然后洗涤至中性, 酸化后的江蓠加入去离子水, 95 ℃水浴加热3 h, 趁热过滤凝固, 真空冷冻干燥, 得到干燥的琼胶。琼胶得率计算公式如下。
琼胶得率/%=(琼胶干燥后质量/江蓠干质量)×100%
1.2.3 琼胶提取单因素实验
影响琼胶得率的因素有碱浓度、料液比、碱处理时间、碱处理温度, 通过单因素实验优化琼胶提取合适条件。
1.2.3.1 碱浓度对琼胶提取的影响
取10 g江蓠, 分别加入2%、4%、6%、8%、10%、12%的NaOH溶液, 料液比1∶1, 碱处理温度65 ℃, 碱处理时间2 h, 比较琼胶得率。
1.2.3.2 料液比对琼胶提取的影响
取10 g江蓠, 分别按1∶0.5、1∶1、1∶2、1∶3、1∶4料液比(g∶mL), 加入6%NaOH, 碱处理温度65 ℃, 碱处理时间2 h, 比较琼胶得率。
1.2.3.3 碱处理时间对琼胶提取的影响
取10 g江蓠, 加入6%NaOH, 分别碱处理1、2、3、4、5 h, 料液比1∶2, 碱处理温度65 ℃, 比较琼胶得率。
1.2.3.4 碱处理温度对琼胶提取的影响
取10 g江蓠, 加入6%NaOH, 分别碱处理温度55 ℃、65 ℃、75 ℃、85 ℃、95 ℃, 料液比1∶2, 碱处理时间2 h, 比较琼胶得率。
1.2.4 江蓠琼胶提取正交实验
通过单因素实验, 确定碱浓度、碱处理时间、碱处理温度为影响琼胶得率的3个因素。采用3因素3水平L9(33)正交实验确定琼胶最佳提取工艺, 实验设计见表1。
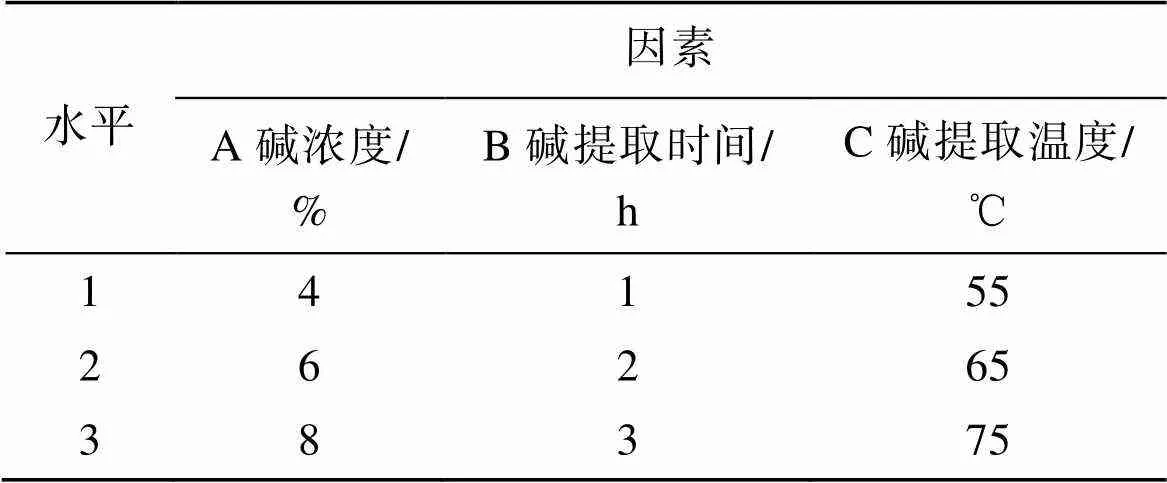
表1 因素及水平
1.2.5 琼胶表征
1.2.5.1 琼胶硫酸根含量
琼胶硫酸根含量测定采用BaCl2-明胶比浊法[18]。将100 mg 琼胶样品加入试管中, 加入10 mL 1 mol/L HCl于100 ℃水浴3.5 h。随后将反应液4 ℃ 6 000 r/min 离心10 min, 取上清液于360 nm处测定的吸光度OD值, 带入标准曲线, 计算出硫酸根浓度。琼胶中硫酸根含量计算公式如下。
=[(×)×100%]/,
式中,为样品中硫酸盐的百分比(%);为硫酸盐质量浓度(mg/mL);为样品体积(mL);为样品质量(mg)。
1.2.5.2 琼胶傅里叶变换红外光谱
使用傅里叶变换红外(FTIR)光谱仪(Nicolet iS 10, Thermo Fisher, USA)在4 000 cm–1~500 cm–1的波长下分析琼胶粉末, 分辨率4 cm–1, 扫描次数16次。
1.2.5.3 琼胶分子量
使用GPC测定提取的琼胶的分子量。琼胶溶解在去离子水(5 mg/mL)中, 柱温为40 ℃, 进样量为40 μL, 流速为0.8 mL/min, 流动相为去离子水。
1.2.5.4 琼胶凝固和融化温度
取1.5%琼胶水浴融化, 测定凝固和融化温度[19]。
1.2.6 数据处理
采用Microsoft Excel和SPSS 13.0对实验数据进行统计分析, 采用Origin 2018绘制图像。
2 结果与分析
2.1 江蓠藻胆蛋白含量比较
异枝江蓠WC-150、缢江蓠、帚状江蓠、细基江蓠繁枝变种、凤尾菜、张氏江蓠、异枝江蓠HSK18、脆江蓠、龙须菜经过反复冻融后, 提取的藻胆蛋白粗提液在652、617、565、540和498 nm具有别藻蓝蛋白、藻蓝蛋白和藻红蛋白特征吸收峰。实验结果显示8种江蓠中藻蓝蛋白、别藻蓝蛋白、藻红蛋白的含量有显著差异(表2)。采自不同海域的异枝江蓠藻胆蛋白含量具有差异, 可能是环境温度、盐度、营养盐差异造成江蓠藻胆蛋白含量不同。8种江蓠的别藻蓝蛋白含量相对较少, 藻红蛋白含量相对较多。其中脆江蓠、龙须菜、异枝江蓠HSK18、张氏江蓠藻红蛋白得率较高, 张氏江蓠、异枝江蓠HSK18、细基江蓠繁枝变种的藻蓝蛋白得率较高。综合比较, 脆江蓠、异枝江蓠HSK18、张氏江蓠、龙须菜的藻胆蛋白得率较高, 可作为藻胆蛋白提取来源, 提高江蓠的经济价值。
2.2 江蓠琼胶含量比较
比较异枝江蓠WC-150, 缢江蓠、帚状江蓠、细基江蓠繁枝变种、凤尾菜、张氏江蓠、异枝江蓠HSK18、脆江蓠、龙须菜琼胶含量(表3)。采自不同海域的异枝江篱琼胶含量略有差异。8种江蓠的琼胶含量有显著差异。凤尾菜、细基江蓠繁枝变种、张氏江蓠、帚状江蓠的琼胶得率较高(得率大于35%), 可作为琼胶提取原料。8种江蓠提取的琼胶的硫酸根含量没有显著差异, 表明其琼胶质量没有显著差异。综合比较8种常见的江蓠, 张氏江蓠的藻胆蛋白总含量和琼胶的得率相对较高、经济价值高, 所以选择张氏江蓠作为后续优化琼胶得率的江蓠品种。
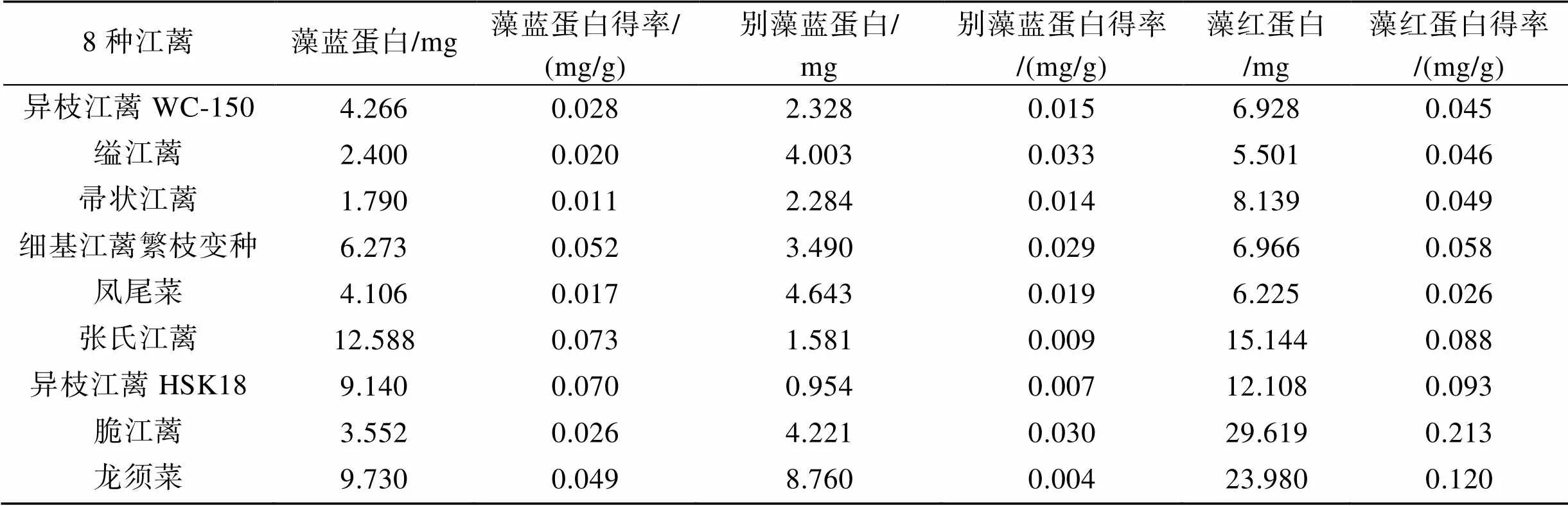
表2 8种江蓠藻蓝蛋白、别藻蓝蛋白、藻红蛋白含量与得率
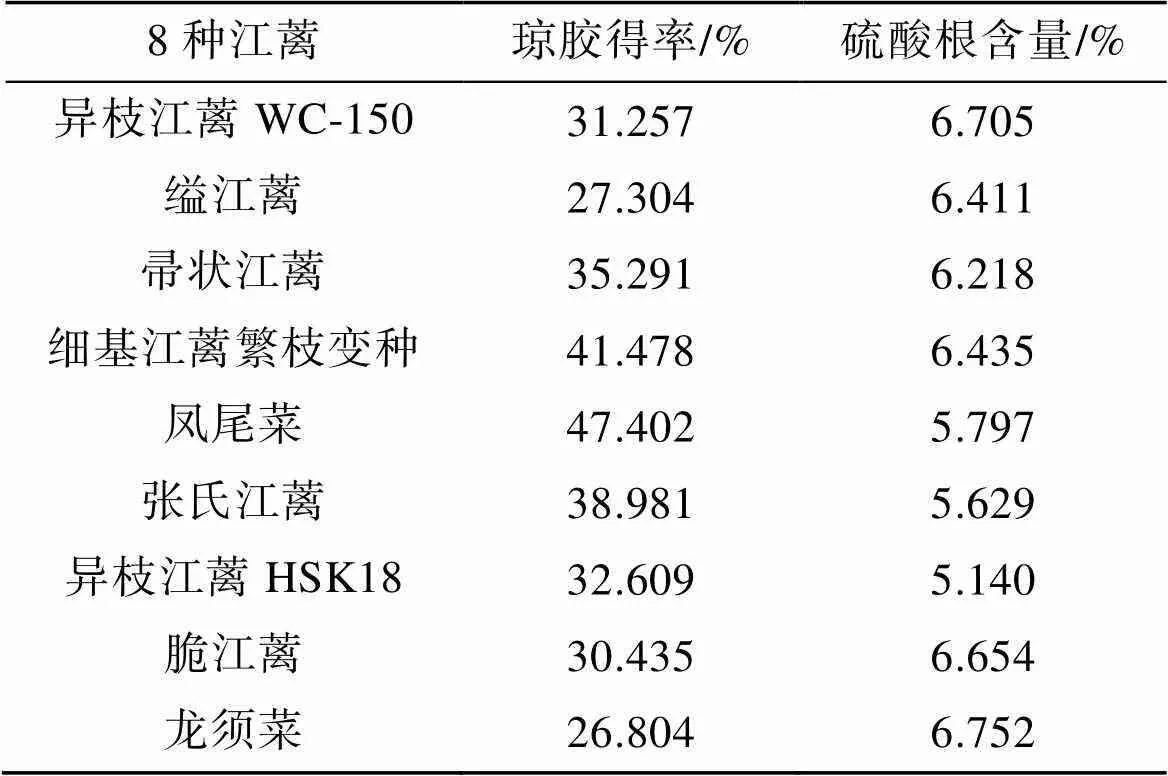
表3 8种江蓠琼胶得率和琼胶硫酸根含量
2.3 琼胶提取单因素实验结果
2.3.1 碱浓度对琼胶得率影响
NaOH碱浓度对琼胶得率的影响如图1a所示。随着碱浓度的增加, 琼胶的得率呈现先增大后减小的趋势, 当NaOH浓度达到8%时, 琼胶得率达到最大值为42.93%, 随后琼胶得率下降。碱处理可减少琼胶的硫酸根含量, 提高琼胶的凝胶强度, 但是碱浓度过高, 也可能将琼胶分解成小分子物质, 降低琼胶得率, 同时增加了琼胶的生产成本和污水处理的难度。因此, 最佳的NaOH浓度为6%。
2.3.2 料液比对琼胶得率影响
料液比对琼胶得率的影响见图1b。随着料液比的增加, 琼胶的得率呈现先增加后不变的趋势, 当料液比从1∶0.5增加到1∶2(g∶mL)时, 琼胶的得率从35.20%缓慢上升到39.50%, 随后随着料液比增加略有下降。料液比的增加对琼胶得率没有显著影响, 且料液比过高, 碱处理时NaOH使用量提高, 增加琼胶生产成本。因此, 最佳料液比为1∶2(g∶mL)。
2.3.3 碱处理时间对琼胶得率影响
碱处理时间对琼胶得率的影响见图1c。琼胶得率随着碱处理时间的增加先增加后减少。碱处理2 h内琼胶得率上升, 碱处理2 h得率最高为42.93%。随着碱处理时间增加, 江蓠细胞壁被破坏, 琼胶溶出量增加, 降低后续琼胶提取得率。因此, 最佳碱处理时间为2 h。
2.3.4 碱处理温度对琼胶得率影响
碱处理温度对琼胶得率的影响见图1d。琼胶得率先随着碱处理温度的升高而增加, 在65 ℃时达到最高, 其得率为42.93%。随后碱处理温度提高使得琼胶得率迅速下降, 可能是在高温条件下江蓠细胞更易破裂, 使得琼胶溶出, 降低琼胶得率。过高温度还可能破坏琼胶结构, 使琼胶失去凝胶性。因此, 最佳碱处理温度为65 ℃。
2.4 琼胶提取正交实验结果
综合单因素实验结果进行分析, 选定了碱浓度(A)(4%、6%、8%)、碱处理时间(B)(1、2、3 h)、碱处理温度(C)(55 ℃、65 ℃、75 ℃)作为正交实验因素和水平, 以琼胶得率为参考指标, 根据3因素3水平进行正交设计, 正交实验结果如表4所示。对正交实验结果进行分析, 碱处理温度极差最大, 碱处理时间极差最小, 琼胶提取得率的因素影响程度为: 碱处理温度> 碱浓度> 碱处理时间, 其中碱处理温度对琼胶提取得率影响最显著。得到张氏江蓠提取琼胶最佳工艺条件为A1B2C2, 即碱浓度4%NaOH, 碱处理时间2 h, 碱处理温度65 ℃。按照最佳工艺条件进行验证实验, 琼胶的得率为43.51%, 与正交实验结果相符, 验证了正交实验结果的可行性。

图1 单因素实验结果
a. 碱浓度; b. 料液比; c. 碱处理时间; d. 碱处理温度
a. alkali concentration; b. solid-liquid ratio; c. alkali treatment time; d. alkali treatment temperature
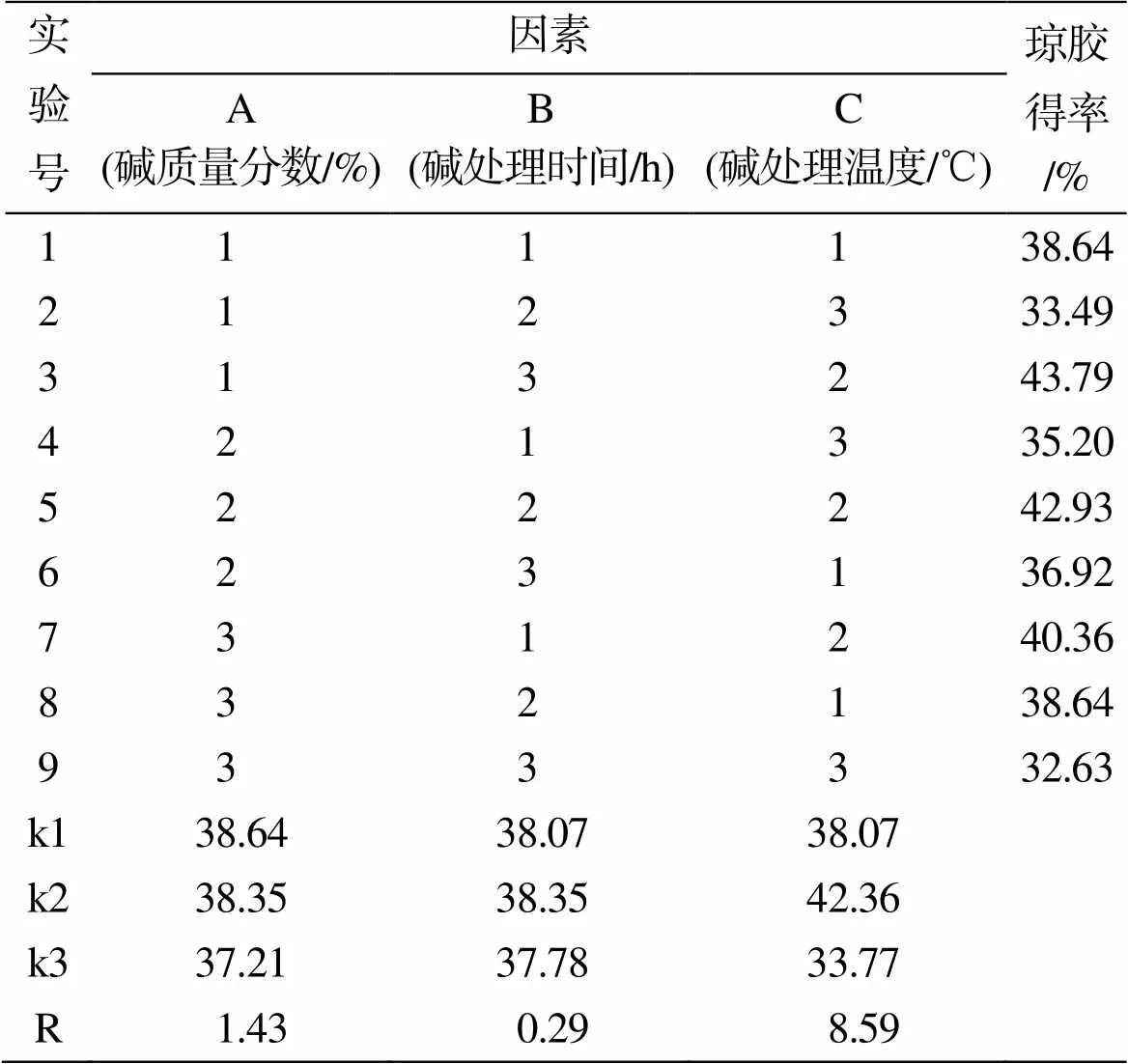
表4 正交实验结果
2.5 琼胶表征
从张氏江蓠提取出的琼胶理化性质测定结果如下。硫酸盐浓度标准曲线:= 1.989 1+ 0.006 8, 其中为吸光度OD值,为硫酸盐浓度, 经计算提取的琼胶硫酸根含量为5.67%, 表明碱处理工艺可以去除大部分硫酸根。琼胶的凝固温度和融化温度分别为38.7 ℃和77.5 ℃。GPC结果表明, 提取的琼胶分子量主要为0.593、0.836、1.474和290 kDa(图2), 95%的琼胶分子量为290 kDa, 与文献报道的分子量较为一致[20], 部分低分子量琼胶可能是由于提取过程中高温使部分琼胶降解。FTIR光谱结果表明, 提取的琼胶在3 350、1 358、1 030、932、892和860~820 cm–1处显示琼胶特征峰, 即-OH、-SO42–、CH2OH的C-O、3, 6-AG、琼脂糖和半乳糖硫酸基的特征吸收峰(图3)[21]。
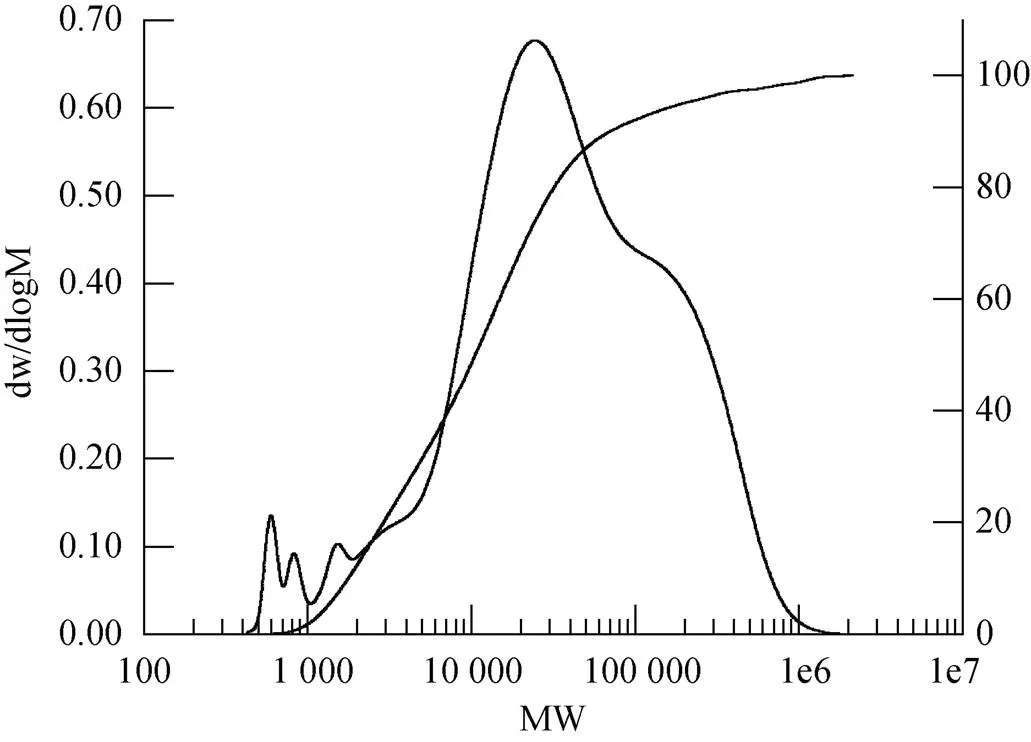
图2 琼胶GPC曲线
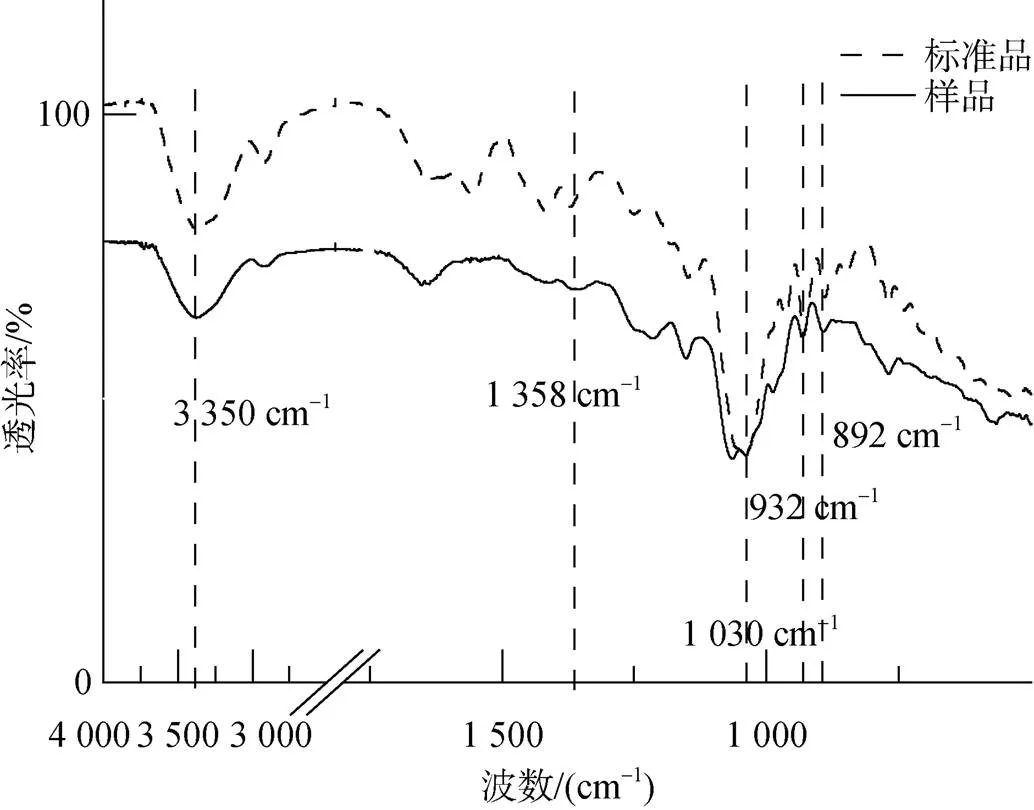
图3 琼胶红外光谱图
3 讨论
中国琼胶产业发展迅速, 据调查中国年产琼胶超过2万吨, 占世界琼胶产量的65%, 并呈现逐年上升趋势。不同品种江蓠琼胶含量相差较大, ZHAO等[22]以细基江蓠为原料, 得到琼胶得率为21.3%; 史升耀等[23]以北海江蓠为藻源, 碱处理后琼胶得率为48.4%; SAHU等[24]以真江蓠为原料, 琼胶得率超过50%; LEE等[25]比较了马来西亚3种江蓠的琼胶含量, 发现帚状江蓠、缢江蓠和张氏江蓠的琼胶含量差异较大。可见, 合适的江蓠品种对琼胶工业十分重要。中国江蓠资源丰富, 需要系统研究比较不同江蓠的琼胶含量, 为琼胶工业筛选合适藻源。本研究比较中国8种常见江蓠的琼胶含量, 不同品种江蓠琼胶含量差异显著, 凤尾菜中琼胶含量与龙须菜中琼胶含量相差高达20%, 本研究相关结果将为中国江蓠养殖品种的选择提供重要参考。本研究显示采自不同海域的异枝江蓠的琼胶含量也存在差异, 后续可研究江蓠生长环境对江蓠琼胶的影响。
碱处理是琼胶生产中的最关键步骤, 研究表明, 碱处理能使江蓠琼胶中的硫酸基去除, 使得琼胶酯转换成琼胶, 提高琼胶的凝胶强度和得率[26]。本实验研究结果表明碱浓度、碱处理温度、碱处理时间对琼胶得率有显著影响, 且碱处理温度对琼胶得率的影响最为显著, 这与KUMAR[27]研究结果相类似。本实验采用高温低碱法提取琼胶, 与低温高碱法相比, 高温低碱法使用碱量低, 并且避免了低温高碱法中过低的温度会使硫酸基去除不彻底、处理时间长和成本高等缺点。不过, 提取过程中的高温会造成部分琼胶结构(小于5%)的破坏降解, 使得琼胶得率略微降低, 这与史升耀[23]研究结果相似。
琼胶生产会产生大量高碱高盐的废水, 朱宁连[14]用膜过滤装置处理制胶过程中产生废水, 处理前后的废水中蛋白浓度差额为0.132 mg/mL, 表明废水中含有大量可溶性蛋白。本研究运用综合提取工艺, 将江蓠中的可溶性藻胆蛋白优先提取, 降低后续琼胶提取过程中废水中的可溶性蛋白和含氮量, 降低了废水处理成本并且提高了海藻的经济价值。目前有部分文献报道龙须菜[28]和细基江蓠藻胆蛋白含量, 其余品种江蓠尚未有文献报道藻胆蛋白含量, 本文测定了中国8种常见的江蓠的藻胆蛋白含量, 为江蓠作为藻胆蛋白提取藻源提供参考。
4 结论
本研究系统比较了中国常见8种江蓠的藻胆蛋白含量和琼胶含量, 以藻胆蛋白和琼胶含量较高的张氏江蓠为藻源, 建立了藻胆蛋白和琼胶的综合提取工艺。综合提取的藻蓝蛋白得率0.073 mg/g, 藻红蛋白得率0.088 mg/g, 并通过单因素实验和正交模型优化琼胶提取工艺, 得出提取琼胶的最佳工艺为碱浓度4%, 碱处理时间2 h, 碱处理温度65 ℃, 琼胶得率为43.51%。相关研究结果为张氏江蓠等海藻资源的高值化利用奠定了基础, 并为琼胶工业相关的发展和研究提供了重要参考。
[1] CHANG L, LIU X, LI Y, et al. Structural organization of an intact phycobilisome and its association with photosystem II[J]. Cell Res, 2015, 25(6): 726-737.
[2] 羌玺, 王立军, 牛建峰, 等. 海藻来源藻胆蛋白研究进展[J]. 食品工业科技, 2022, 43(16): 442-451.
QIANG Xi, WANG Lijun, NIU Jianfeng, et al. Research progress of phycobiliproteins from seaweed[J]. Science and Technology of Food Industry, 2022, 43(16): 442-451.
[3] QIANG X, WANG L J, NIU J F, et al. Phycobiliprotein as fluorescent probe and photosensitizer: A systematic review[J]. International Journal of Biological Macromolecules, 2021, 193: 1910-1917.
[4] 吴昌义. 藻胆蛋白荧光探针在动物疫病检测中的应用展望[J]. 当代畜牧, 2017, 5z: 50-51.
WU Changyi. Application prospect of phycobiliprotein fluorescent probe in the detection of animal diseases[J]. Contemporary Animal Husbandry, 2017, 5z: 50-51.
[5] DUCKWORTH M, YAPHE W. The structure of agar: Part I. Fractionation of a complex mixture of polysaccharides[J]. Carbohydrate Research, 1971, 16(1): 189- 197.
[6] ABDUL KHALIL H P S, LAI T K, TYE Y Y et al.A review of extractions of seaweed hydrocolloids: Properties and applications[J]. Express Polymer Letter, 2018, 12(4): 296-317.
[7] SOUSA A M M, SOUZA H, UKNALIS J, et al. Electrospinning of agar/PVA aqueous solutions and its relation with rheological properties[J]. Carbohydrate Polymers, 2015, 115(22): 348-355.
[8] 刘名求, 杨贤庆, 戚勃, 等. 江蓠活性多糖与藻胆蛋白的研究现状与展望[J]. 食品工业科技, 2013, 34(13): 338-341.
LIU Mingqiu, YANG Xianqing, QI Bo, et al. Present situation and prospect of polysaccharide and phycobiliprotein from[J]. Science and Technology of Food Industry, 2013, 34(13): 338-341.
[9] 刘思俭. 我国江蓠的种类和人工栽培[J]. 湛江海洋大学学报, 2001, 21(3): 71-79.
LIU Sijian. Species and artificial cultivation ofin China[J]. Journal of Guangdong Ocean University, 2001, 21(3): 71-79.
[10] MARTíNEZ-SANZ M, GOMEZ L, ZHAO M, et al. Alternative protocols for the production of more sustainable agar-based extracts from[J]. Algal Research, 2021, 55: 102254.
[11] 史升耀, 张燕霞, 范晓, 等. 碱处理对中国江蓠属海藻所含琼胶的作用[J]. 水产学报, 1988, 12(2): 145-155.
SHI Shengyao, ZHANG Yanxia, FAN Xiao, et al. Effect of alkali treatment on agar contained inin China[J]. Journal of Fisheries of China, 1988, 12(2): 145-155.
[12] 徐卓越. 超声高温一步法提取琼脂及对品质的影响[J]. 饮料工业, 2019, 22(2): 10-13.
XU Zhuoyue. Extraction of agar by ultrasonic with high temperature and its effect on quality[J]. Beverage Industry, 2019, 22(2): 10-13.
[13] 沈照鹏, 穆惠敏, 崔欣, 等. 微波法提取龙须菜琼胶及其理化性质的研究[J]. 水产学报, 2017, 41(6): 854- 860.
SHEN Zhaopeng, MU Huimin, CUI Xin, et al. Study on the extraction ofagar by microwave and its physicochemical properties[J]. Journal of Fisheries of China, 2017, 41(6): 854-860.
[14] 朱宁连. 膜分离法用于分离红藻藻红蛋白及废碱液处理[D]. 福州: 福建农林大学, 2009.
ZHU Ninglian. Separation of phycoerythrin from red algae by membrane separation and treatment of waste lye[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009.
[15] 牛建峰. 海洋藻类功能性蛋白质的纯化、鉴定及其应用的研究[D]. 青岛: 中国科学院海洋研究所, 2007.
NIU Jianfeng. Study on purification, identification and application of functional proteins from marine algae[D]. Qingdao: Institute of Oceanography Chinese Academy of Sciences, 2007.
[16] 张文怡. 红藻中藻胆蛋白的分离纯化及应用[D]. 福州: 福州大学, 2018.
ZHANG Wenyi. Isolation, purification and application of phycobiliproteins from red algae[D].Fuzhou: Fuzhou University, 2018.
[17] 纪明侯. 海藻化学[M]. 北京: 科学出版社, 1997: 104-105.
JI Minghou. Seaweed chemistry[M]. Beijing: Science Press, 1997: 104-105.
[18] 陈乾, 马天翔, 郭宏举, 等. 硫酸钡-比浊法测定褐藻糖胶中硫酸根的含量[J]. 药学实践杂志, 2012, 30(2): 118-120.
CHEN Qian, MA Tianxiang, GUO Hongju, et al. Determination of the sulfate content in sulfated fucans by barium sulfate turbidity[J]. Journal of Pharmaceutical Practice, 2012, 30(2): 118-120.
[19] FREILE-PELEGRíN Y, ROBLEDO D. Effects of season on the agar content and chemical characteristics offrom Yucatán, México[J]. Botanica Marina, 1997, 40: 285-290.
[20] MARTíNEZ-SANZ M, GóMEZ-MASCARAQUE L G, BALLESTER A R, et al. Production of unpurified agar-based extracts from red seaweedby means of simplified extraction protocols[J]. Algal Research, 2019, 38: 101420.
[21] 赵谋明. 江篱加工高强度琼胶机理及其应用研究[J]. 广州: 华南理工大学, 1995.
ZHAO Mouming. Study on the mechanism and application of high strength agar in[D]. Guangzhou: South China University of Technology, 1995.
[22] ZHAO P, WANG X L, NIU J F, et al. Agar extraction and purification of R-phycoerythrin from, and subsequent wastewater treatment by Ulva prolifera[J]. Algal Research, 2020, 47: 101862.
[23] 史升耀, 唐湛祥. 江蓠琼胶的研究——Ⅱ.碱处理对琼胶质和量的影响[J]. 水产学报, 1982, 6(1): 51-58.
SHI Shengyao, TANG Zhanxiang. Studies agar fromⅡ. Effect of alkali treatment on agar gum and quantity[J]. Journal of Fisheries of China, 1982, 6(1): 51-58.
[24] SAHU N, SAHOO D. Study of morphology and agar contents in some importantspecies of Indian coasts[J]. American Journal of Plant Sciences, 2013, 4(12): 52-59.
[25] LEE W, LIM P, PHANG S, et al. Agar properties ofspecies () collected from different natural habitats in Malaysia[J]. Regional Studies in Marine Science, 2016, 7: 123- 128.
[26] ARVIZU-HIGUERA D L, RODRíGUEZ-MONTESINOS Y E, MURILLO-áLVAREZ J I, et al. Effect of alkali treatment time and extraction time on agar from[J]. Journal of Applied Phycology, 2008, 20(5): 515-519.
[27] KUMAR V, FOTEDAR R. Agar extraction process for(Withell, Miller and Kraft, 1994)[J]. Carbohydrate Polymers, 2009, 78(4): 813-819.
[28] 陈美珍, 余杰, 钟秋玲, 等. 龙须菜藻胆蛋白免疫功能和抗氧化作用的研究[J]. 食品科学, 2005, 26(9): 456-459.
CHEN Meizhen, YU Jie, ZHONG Qiuling, et al. Studies on the immune function and antioxidation of phycobiliprotein in[J]. Food Science, 2005, 26(9): 456-459.
Optimization of content and comprehensive extraction of phycobiliprotein and carrageenan from
QIANG Xi1, 2, 4, WANG Xu-lei2, 3, NIU Jian-feng2, 3, YAN Shu-heng2, 3, ZHANG Yu-hong5, SONG Yu-ling2, WANG Guang-ce2, 3, GONG Xiang-zhong1, WANG Li-jun2, 3, 4
(1. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China; 2. CAS and Shandong Province Key Laboratory of Experimental Marine Biology, Center for Ocean Mega-Science, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 3. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 4. Nantong Zhong Ke Marine Science and Technology R & D Center, Nantong 226334, China; 5. Qingdao Shinan District Center for Disease Control & Prevention, Qingdao 266072, China)
Phycobiliproteins and agar are active compounds isolated from algae, which have widespread applications in various fields. It is vital to select suitableas the raw material for agar extraction, considering the increasing demand and consumption of phycobiliproteins and agar. In this study, phycobiliproteins and agar were extracted fromin China for a comparative analysis of the differences in their contents. Additionally, an environmentally friendly comprehensive method for extraction of phycobiliprotein and agar was established. The results demonstrated the differences in contents of phycobiliproteins and agar from eight species of.had higher contents of phycobiliproteins and agar. The yields of phycocyanin and phycoerythrin fromwere 0.073 mg/g and 0.088 mg/g, respectively. The extraction conditions of agar were optimized by single factor experiments and an orthogonal model. The yield of agar was 19.60% at 4% alkali concentration, 2 h alkali treatment time, and extraction at 62 ℃. Therefore, this study showed thathad a higher utilization rate than other seven species. It also showed that the comprehensive extraction method can make better use of, which improved its application value. Thus this study provides valuable information required for the development of.
; agar; phycobiliprotein; comprehensive extraction; high-value utilization
Sep. 7, 2022
P745
A
1000-3096(2022)11-0107-09
10.11759/hykx20220907001
2022-09-07;
2022-09-19
国家重点研发计划项目(2018YFD0901500); 山东省重大科技创新工程项目(2019JZZY010815); 国家现代农业产业技术体系(CARS-50); 南通市科技计划项目(MS22021017); 山东省“泰山学者”工程专项经费资助项目(tspd20210316)
[National Key R&D Program of China, No. 2018YFD0901500; Major Scientific and Technological Innovation Projects of Shandong Province, No. 2019JZZY010815; Ministry of Agriculture and Rural Affairs of the People's Republic of China, No. CARS-50; Nantong Municipal Science and Technology Planning Project, No. MS22021017; Research Fund for the Taishan Scholar Project of Shandong Province, No. tspd 20210316]
羌玺(1997—), 女, 江苏南通人, 硕士研究生, 主要从事海洋生物学研究, E-mail: qx1123@stu.ouc.edu.cn; 宫相忠(1963—),通信作者, E-mail: gxzhw@163.com; 王立军(1974—), 通信作者, E-mail: wanglijun@qdio.ac.cn
(本文编辑: 谭雪静)
