海南黎安港海草床碳储量评估
2023-01-30杨熙,余威,何静,黄盛
杨 熙, 余 威, 何 静, 黄 盛
海南黎安港海草床碳储量评估
杨 熙1, 2, 3, 余 威1, 2, 3, 何 静1, 2, 3, 黄 盛1, 2, 3
(1. 国家海洋局 南海环境监测中心, 广东 广州 510300; 2. 自然资源部 海洋环境探测技术与应用重点实验室, 广东 广州 510300; 3. 海南南沙珊瑚礁生态系统国家野外科学观测研究站, 广东 广州 510300)
本研究对海南黎安港海草床碳储量进行了评估, 并对我国南海区近岸现存海草床总碳储量进行了估算。结果显示, 黎安港海草床中海草植物碳储量、100 cm深度沉积物碳储量和总碳储量分别为(179.75±102.28) Mg C、(7795.86±2923.75)Mg C和(7975.61±2907.15) Mg C; 南海区近岸现存海草床总储碳量约为357 008.86 Mg C。研究发现, 黎安港沉积物有机碳含量平均值为0.56%±0.25%, 海草植物储碳密度为(1.60±0.91)Mg C·ha–1, 100 cm深度沉积物储碳密度为(69.61±26.11)Mg C·ha–1, 均明显低于全球平均值(分别为2.50%、2.52 Mg C·ha–1和139.70 Mg C·ha–1)。黎安港有些裸滩区域沉积物有机碳含量和储碳密度要高于相邻的海草生长区, 鉴于海草生长区与其周边一些裸滩区域存在有机碳的交换转移, 建议将海草生长区周边的一些裸滩区沉积物碳储量也纳入海草床总碳储量。
海草床; 碳储量; 裸滩; 黎安港; 南海
海草床具有重要的生态功能, 其能净化水体、稳定底质、维持高的海洋生物多样性, 是海洋动物觅食、繁殖和生长的重要海底栖息地。海草床生态系统是海岸带“蓝碳”的重要组成部分, 具有较强的储碳能力, 研究显示, 全球海草生长区占海洋总面积不到0.2%, 但每年海草床生态系统封存的碳占全球海洋碳封存总量的10%~15%[1]。近年来随着“蓝碳”的关注度越来越高, 海岸带“蓝碳”逐渐受到重视。
虽然国内外已开展了一些海草床生态系统碳储量调查评估研究[2-6], 由于涉及的种类和区域非常有限, 目前世界上的大多数海草种类及海草床区域的储碳量的相关调查数据依然十分匮乏[7], 一些评估研究中由于缺乏区域海草种类、以及区域环境状况、沉积物特征等详细信息, 其评估结果的准确性存疑[6]。现有研究中对区域海草床碳储量的估算大部分都是基于地中海大洋波喜荡草植物体和沉积物的有机碳含量进行[8-9]。然而大洋波喜荡草植物体和沉积物的储碳密度远高于其他海草种类[10-12], 这样会导致评估结果远高于实际值。我国有着较大面积的海草床分布, 但由于海草床生态系统储碳方面研究不足, 相关调查数据极为缺乏, 在全球海草床生态系统碳储量的估算中我国海草床碳储量相关情况经常缺失, 如Fourqurean等[1]对全球946个不同的海草床区域的统计中未包含我国的海草床区域。因此, 亟需加强我国海草床分布区碳储量调查研究工作。
海南黎安港是我国热带一个近封闭的潟湖生态系统, 里面分布有较大面积的海草, 主要种类为海菖蒲(), 此外还有较小面积的泰来草()和圆叶丝粉草()等种类分布。本研究通过对黎安港海草床生态系统碳储量进行调查评估, 包括海草(包括地上部分和地下部分)碳储量、附生生物碳储量和沉积物碳储量。此外, 还利用国内外已有的一些海草床碳储量调查结果, 结合南海区海草种类和面积分布情况, 对我国南海区海草床生态系统总碳储量进行估算, 以填补我国目前海草床碳储量研究的不足, 为我国海岸带“蓝碳”管理提供数据支撑。
1 材料和方法
1.1 站位和样方布设
黎安港区域海草床总面积约为112 ha, 主要由3个大斑块组成(图1), 其中西北部斑块面积约为25 ha, 正南部斑块面积约为24 ha, 东南部斑块面积约为63 ha。调查站位依据该区域海草床分布状况共布设22个调查站位, 其中4个站位(A1′、A4′、B1′和B4′)为裸滩对照站位(图1)。在每个海草调查站位设置1条平行于岸线方向的50 m长样带, 宽度为3 m左右, 在样带中随机布设3个0.5 m×0.5 m的样方, 用于海草生物量和附生生物量测算的样品采集。本次调查于2021年8月在海南陵水黎安港进行。

图1 黎安港海草床调查站位分布示意图
1.2 样品的采集和分析
样方调查中, 采集样方内的所有海草植株, 冲洗去除海草根系上的沉积物后装入做好标记的样品袋, 在室内使用剪子或刀片将海草植株分离为地上生物量(叶片和叶鞘)、地下生物量(根状茎和根)两部分, 使用刀片刮取叶片表面的附生生物; 将地上生物量和地下生物量两部分分别装入样品袋, 将附生生物装入称重好的离心管。利用单人手持式土壤取样钻机(SD-1, Australia)在每个站位采集一个深度为1 m的沉积物柱样。对于采集的每个沉积物柱状样, 现场进行分割装袋, 其中0~50 cm深度的沉积物, 以10 cm为间距分层, 50~100 cm深度的沉积物分为一层, 共计6个样品。所有样品均于–20 ℃条件下保存, 并带至实验室进行分析处理。
海草生物量样品于真空冷冻干燥器中干燥至恒重, 记录干重, 然后用碾磨机将干燥后的样品粉碎, 过100目标准筛, 置于小型密封袋中密封, 放入干燥器中待测。将沉积物样品置于干燥箱60 ℃中烘干至恒重, 记录干重, 用陶瓷质研钵将干燥后的样品粉碎, 过100目标准筛, 置于密封袋中, 放入干燥器中待测。海草植物总有机碳含量分析采用非色散红外吸收法; 沉积物有机碳含量分析采用重铬酸钾氧化-还原容量法。
1.3 数据处理方法
黎安港海草床生态系统碳储量计算时包括植物碳储量(包括地上部分生物量、地下部分生物量和附生生物的碳储量)和沉积物碳储量两部分。利用SPSS 13.0统计软件对调查数据进行分析处理。碳储量相关计算方法如下:
(1) 植物碳储量
植物碳储量计算公式如下:
Cstock=Ca+Cb+Ce, (1)
式中,Cstock为植物碳储量,Ca为地上部分生物量碳储量,Cb为地下部分生物量碳储量,Ce为附生生物的碳储量, 单位均为兆克碳(Mg C)。
地上部分、地下部分和附生生物的碳储量计算公式如下:
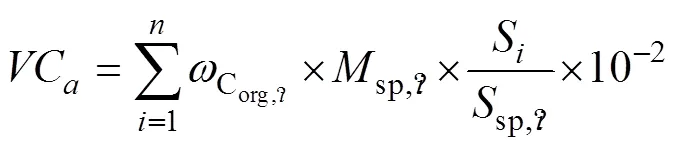


(2) 沉积物碳储量
沉积物碳储量计算公式如下:
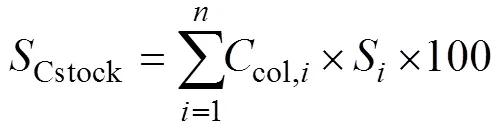
其中,
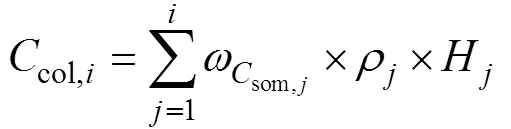
(3) 总碳储量
海草床生态系统总碳储量计算公式如下:
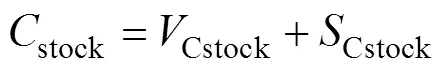
2 结果
2.1 黎安港海草植物生物量和有机碳含量
黎安港区域发现有海菖蒲、泰来草和圆叶丝粉草三种海草, 海菖蒲占绝对优势。所有调查站位中除C2站位未发现海草, 其他站位均有海草出现, 其中海菖蒲在除C2站位之外的其他站位均有发现, 圆叶丝粉草仅在A4站位有发现、泰来草仅在A5站位有发现。由表1可见, 黎安港区域海草地下生物量明显高于地上生物量, 海草附生生物量较低。有机碳含量方面, 该区域海草地下部分有机碳含量为32.49%± 1.37%, 明显高于地上部分(24.43%±2.56%), 附生生物有机碳含量仅为7.27%±2.18%。
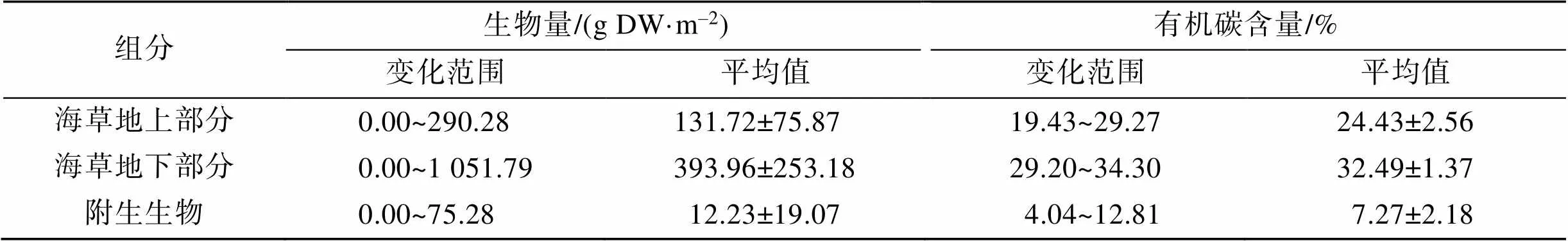
表1 黎安港海草植物生物量和有机碳含量
对比各调查站位海草地上部分有机碳含量(图2)、地下部分有机碳含量(图3)和附生生物有机碳含量(图4)。各站位间海草地上部分有机碳含量存在一定差异, 位于潟湖开口处的几个站位(B5、B6和C3)的海草地上部分有机碳含量明显要低于潟湖内部的其他站位; 各站位间海草地下部分有机碳含量差异不明显; 各站位间附生生物有机碳含量差异较大, 但无明显规律。
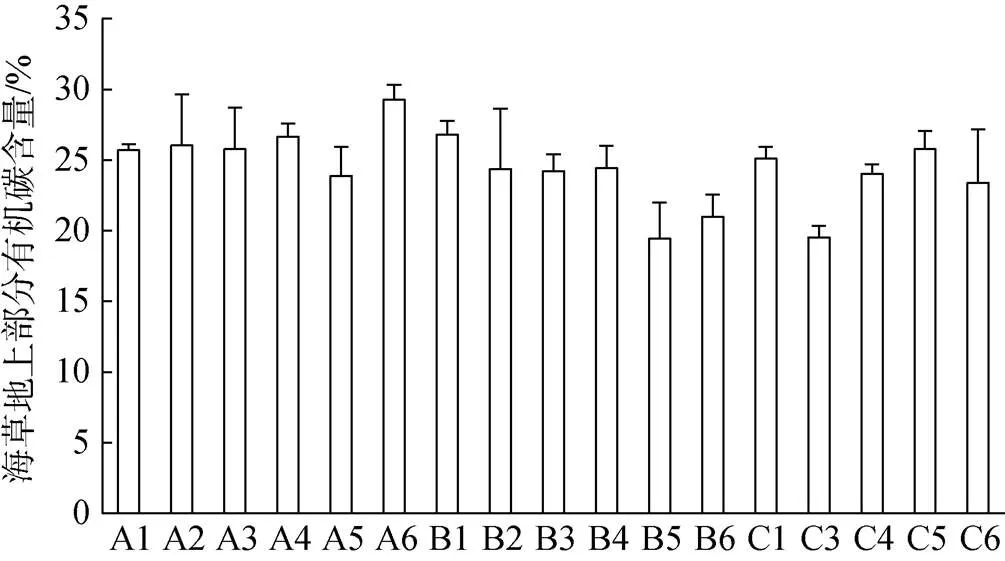
图2 各调查站位海草地上部分有机碳含量
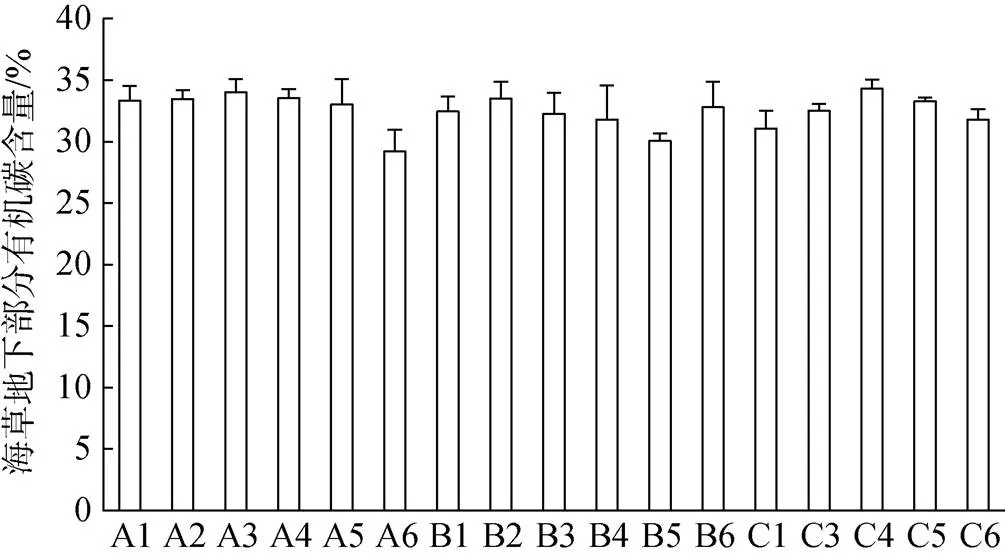
图3 各调查站位海草地下部分有机碳含量
2.2 黎安港沉积物容重和有机碳含量
黎安港区域各调查站位沉积物容重变化范围为1.18 g·cm–3~1.52 g·cm–3, 总平均值为(1.27±0.18) g·cm–3; 各调查站位沉积物有机碳含量变化范围为0.21%~ 1.17%, 总平均值为0.56%±0.25%。各调查站位间沉积物容重差异不明显(图5a), 而各调查站位间沉积物有机碳含量存在较大差异, 其中A1、B1′和B4′站位的沉积物有机碳含量明显高于其他站位。C1~C6站位沉积物有机碳含量分布规律显示, 该区域海草床分布区域内由近岸至远岸沉积物有机碳含量呈现增加的趋势(图5b)。不同土层沉积物密度和有机碳含量情况见表2, 沉积物密度呈现出由浅至深递增的趋势; 而沉积物有机碳含量在各土层间差异不明显, 其中最高值出现在0~10 cm和30~40 cm土层。
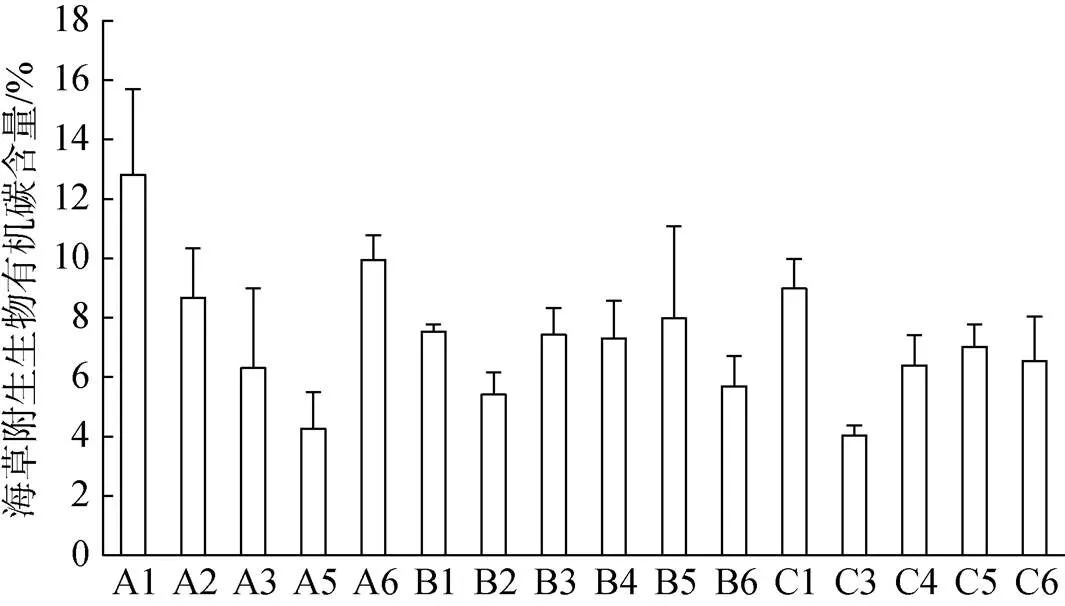
图4 各调查站位海草附生生物有机碳含量
沉积物有机碳含量垂直分布情况见图6, 结果显示, 大多数站位的沉积物有机碳含量在垂直分布上差异较小, 有些呈现波动状态, 其中呈现相似规律的有A1、A3、B1、C3和C4站位, 沉积物有机碳含量由表至底呈现先升高后降低的趋势, 其中最大值基本出现在20~30 cm土层。C5、C6站位沉积物有机碳含量由表至底呈现出先降低后升高的趋势, 最低值出现在20~30 cm土层, 最高值出现在表层和30 cm以下土层。裸滩对照站位沉积物有机碳含量垂直分布上, A1′站位呈波动状态, 总体差异不大; A4′站位各土层之间差异不明显; B1′站位呈现先上升后下降的趋势, 最高值出现在30~40 cm土层; B4′站位各土层之间差异不明显。海草生长站位与裸滩站位对比可见, A4′断面处的裸滩沉积物有机碳含量明显低于海草生长区, B1′断面和B4′断面处裸滩沉积物有机碳含量却明显高于于海草生长区。
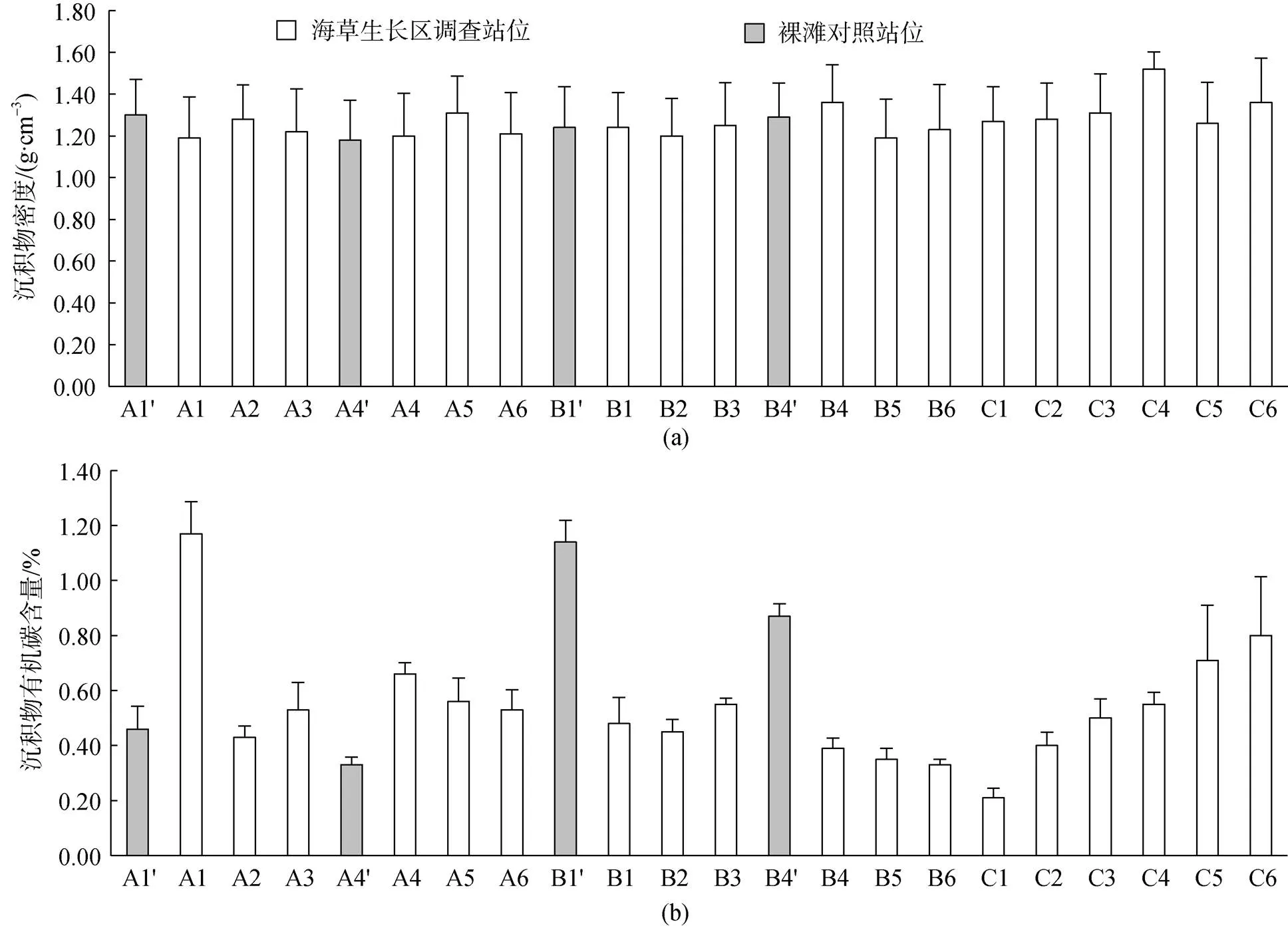
图5 各调查站位沉积物密度(a)和有机碳含量(b)
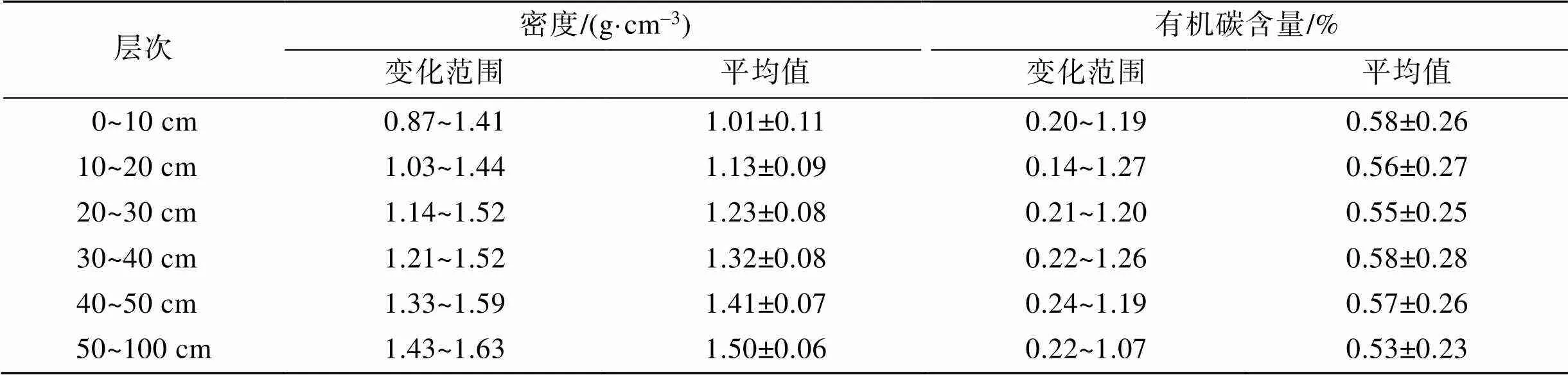
表2 黎安港不同层次沉积物密度和有机碳含量
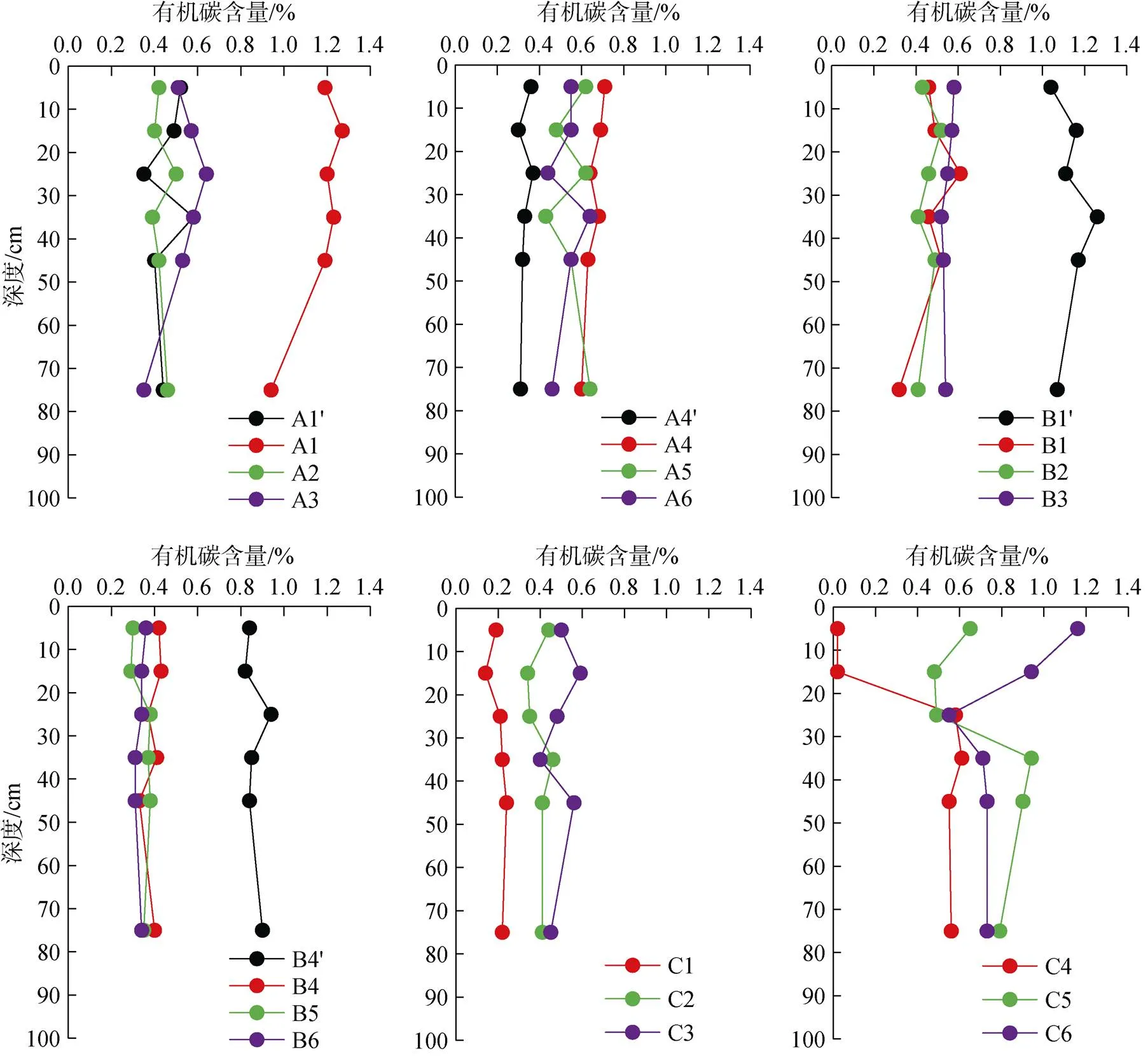
图6 各调查站位沉积物有机碳含量的垂直分布图
2.3 黎安港储碳密度和碳储量估算
根据海草植物生物量和有机碳含量, 以及柱状沉积物容重和有机碳含量, 计算得出了区域海草植物储碳密度、100 cm深度沉积物储碳密度和总储碳密度, 结果见表3。区域总储碳密度为(71.21± 25.96)Mg C·ha–1, 其中100 cm深度沉积物储碳密度占绝大部分, 为(69.61±26.11)Mg C·ha–1, 占比97.75%。海草植物储碳密度为(1.60±0.91)Mg C·ha–1, 在总储碳密度中占比2.25%, 其中海草地下部分储碳密度最高, 为(1.27±0.78)Mg C·ha–1, 其次为海草地上部分, 为(0.33±0.21)Mg C·ha–1, 而海草附生生物储碳密度很低。通过将各站位100 cm深度沉积物储碳密度情况进行对比(其中包括裸滩区和海草生长区的对比)(图7), 结果显示, 邻近潟湖开口处的站位(如B4—B6、C1—C3等站位)储碳密度要低于潟湖靠内部区域的站位(如A1—A6、C4—C6等站位)。海草生长区域站位与临近的裸滩站位对比显示, 黎安港西部区裸滩(A1′和A4′)储碳密度明显低于海草生长区(A1—A6), 而在黎安港开口处的裸滩(B1′和B4′)储碳密度明显高于相邻的海草生长区(B1—B6)。
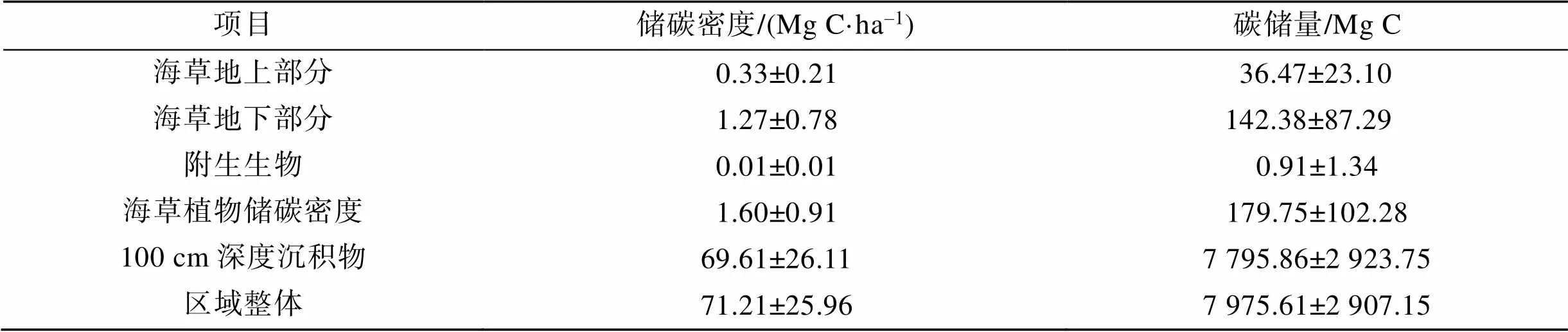
表3 黎安港海草床储碳密度和碳储量
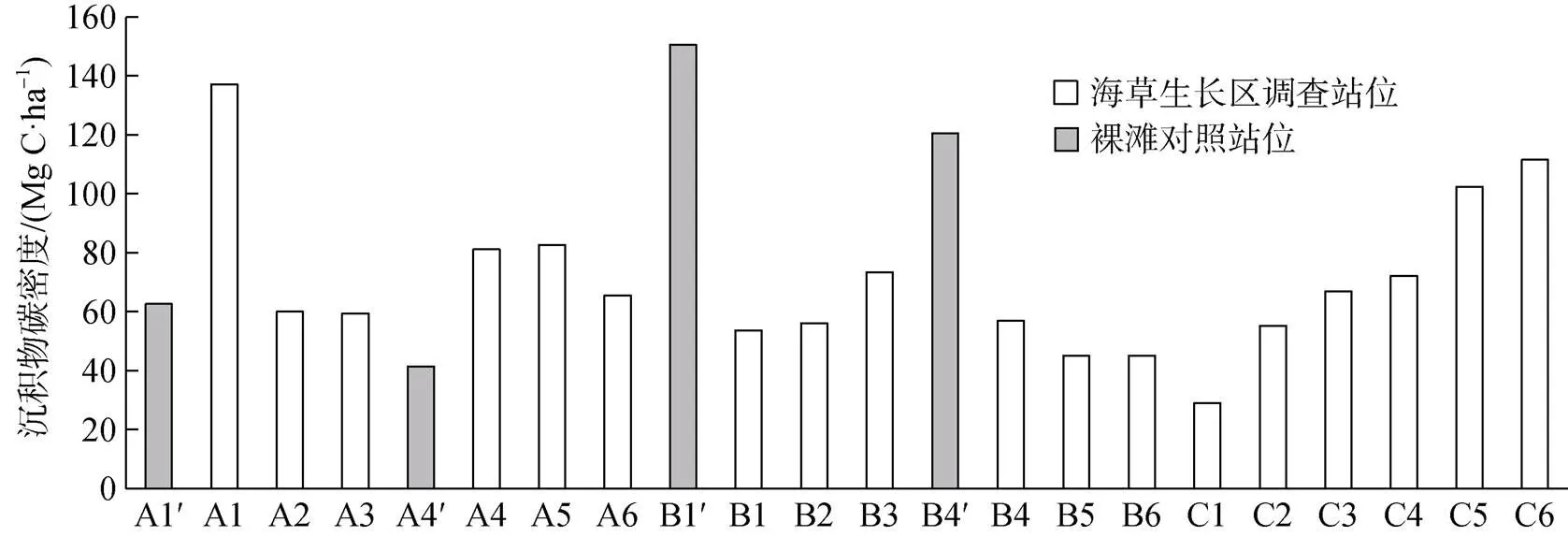
图7 各调查站位100 cm深度沉积物储碳密度
根据储碳密度计算结果, 结合黎安港区域海草床面积情况, 可估算出该区域的碳储量情况(表3)。结果显示, 黎安港海草床分布区总碳储量为(7975.61± 2907.15) Mg C, 其中100 cm深度沉积物碳储量为(7795.86±2923.75)Mg C, 占比97.75%, 海草植物(包括海草地上部分、地下部分和附生生物)碳储量为(179.75±102.28) Mg C, 占比2.25%。
3 讨论
黎安港海草床沉积物有机碳含量区域总平均值为0.56%±0.25%, 远低于全球海草床沉积物有机碳含量平均值(2.50%)[1]。在沉积物有机碳的垂直分布上, 以往研究表明, 沉积物有机碳含量一般表现为表层含量最高[14], 而本研究中大多数站位的沉积物有机碳含量在垂直分布上无明显差异, 且有些站位沉积物有机碳含量最大值出现在20~ 30 cm土层。海草床沉积物有机碳含量存在很大区域差异, 如Kennedy等[15]对全球包含20个海草种类的219个海草床区域沉积物有机碳含量进行分析, 结果显示这些区域沉积物有机碳含量的变化范围在0.1%~11.0%之间。海草床沉积物有机碳含量与多种因素有关, 其中水动力情况和底质类型是影响沉积物有机碳含量的重要因素[16], 黎安港虽然是较封闭性潟湖, 但也受较强的潮汐作用影响, 由于黎安港底质类型为粗砂, 混有大量珊瑚和贝壳碎屑, 在潮汐等水流的冲刷作用下很容易造成沉积物有机碳的流失, 而表层沉积物有机碳的流失则会更加明显, 这造成了黎安港海草床沉积物有机碳含量总体偏低, 以及一些站位沉积物有机碳含量表现出表层低, 高值出现在20~30 cm土层的现象。沉积物有机碳含量决定着沉积物碳密度的高低, 黎安港海草床100 cm深度沉积物储碳密度变化范围为28.94~137.07 Mg C·ha–1, 区域平均值为69.61 Mg C·ha–1, 远低于全球平均值(约为139.70 Mg C·ha–1)[1]。Miyajima 等[17]对东亚、东南亚区域海草床沉积物储碳密度进行了调查, 发现我国海草床沉积物储碳密度的变化范围为38~120 Mg C·ha–1, 这与本研究结果较为一致。Lavery等[6]对澳大利亚海草床沉积物储碳密度的调查结果也远低于全球平均值。出现上述情况主要是由于全球统计结果中大部分为大洋波喜荡草海草床的调查结果, 而研究显示, 大洋波喜荡草含有抑制细菌生长物质, 其凋落物的腐败过程非常缓慢, 可达2000多年以上[18-19], 国外一些大洋波喜荡草海草床区域由于其凋落物的长期堆积而形成了几米甚至十几米沉积物有机碎屑层, 沉积物有机碳含量很高, 100 cm深度沉积物储碳密度高达(372.40±74.50)Mg C·ha–1, 远高于其他种类海草床[1], 这也在一定程度上导致全球海草床沉积物储碳密度被高估。不同种类海草床其沉积物储碳密度存在差异, 如Lavery等[6]发现澳大利亚沿岸8种海草沉积物碳储密度存在显著差异, 其分析认为不同海草的细胞壁和其它保护性物质的生化组成不同, 以及不同海草的形态对悬浮颗粒物的捕获能力不同造成了这种差异。即使同种类海草床, 在不同地区其沉积物储碳密度也会存在很大差异, 如澳大利亚的Tanzania区域和肯尼亚的Gazi Bay都生长有泰来草和海菖蒲, Tanzania区域泰来草和海菖蒲生长区100 cm深度沉积物储碳密度分别约为34.09和47.73 Mg C·ha–1, 而Gazi Bay泰来草和海菖蒲生长区100 cm深度沉积物储碳密度分别约为205和293.75 Mg C·ha–1[4-5], 显著高于Tanzania区域。
海草植物体储碳密度方面, 全球有70多种海草[20], 不同种类海草由于形态大小、植物组织中有机碳含量存在显著差异, 它们在碳捕获和碳储存方面存在很大差异[21]。研究显示, 小型海草如贝克喜盐草, 其植物体储碳密度约为0.14 Mg C·ha–1, 卵叶喜盐草约为0.28 Mg C·ha–1[2]; 中型海草如泰来草, 其植物体储碳密度约为0.60 Mg C·ha–1[2]; 而大型海草如大洋波喜荡草(), 其植物体储碳密度约为7.92 Mg C·ha–1[1]。黎安港海菖蒲属于大型海草, 本研究中黎安港区域海草植物储碳密度为1.60 Mg C·ha–1虽高于一些小型海草, 但明显低于大洋波喜荡草, 这是因为大洋波喜荡草具有其他海草所不具备的一些特征, 其主要分布于地中海沿岸区域, 生长密度非常大, 其叶片长度能超过1m, 根部能深入地下1 m多深并能长期存在, 这些特性使其植物体储碳密度要明显高于其他海草种类[22]。由于全球统计结果中有大部分源自地中海大洋波喜荡草海草床的调查结果, 因此, 本研究中黎安港海草植物储碳密度也低于全球海草植物体储碳密度平均值(约为2.52 Mg C·ha–1)[1]。
关于海草生长区与裸滩区沉积物储碳密度的差异, 以往研究显示, 由于海草具有较强的碳捕获和碳封存能力, 一般海草生长区沉积物储碳密度要明显高于相邻的裸滩区, 如Githaiga等[5]对肯尼亚的Gazi Bay海草床储碳情况调查中发现所有海草生长区站位沉积物储碳密度都显著高于裸滩对照站位, 且高出4~6倍。Gullström等[4]在印度洋西部热带海草床区域碳储量的调查中也发现海草生长区沉积物有机碳含量和储碳密度都明显高于裸滩区域。美国弗吉尼亚州一项海草床修复项目显示, 该区域海草床修复9年后, 海草生长区内的0~20 cm层的沉积物储碳密度是裸滩对照区的3倍[23]。本研究中在黎安港靠内部的裸滩沉积物储碳密度明显低于海草生长区, 这与以往研究结果较为一致。而本研究还发现在黎安港开口处的裸滩沉积物储碳密度却要显著高于海草生长区。开口处海草生长区沉积物储碳密度较低可能与潮汐等水流因素影响有关, 潮汐等水流冲刷作用会导致海草生长区沉积物中有机碳的流失。海草床生态系统是一个开放的系统, 海草生长区与其周边一些裸滩区域具有连通性, 存在有机碳的转移[21], 海草凋落物可由海浪冲刷堆积至裸滩, 长期积累导致一些裸滩区域沉积物碳密度超过了海草生长区。因此, 建议在海草床生态系统碳储量进行评估时, 除了评估海草生长区的碳储量外, 也应将与海草生长区存在连通性的裸滩区沉积物碳储量纳入进来, 否则会造成区域海草床生态系统总碳储量被低估。
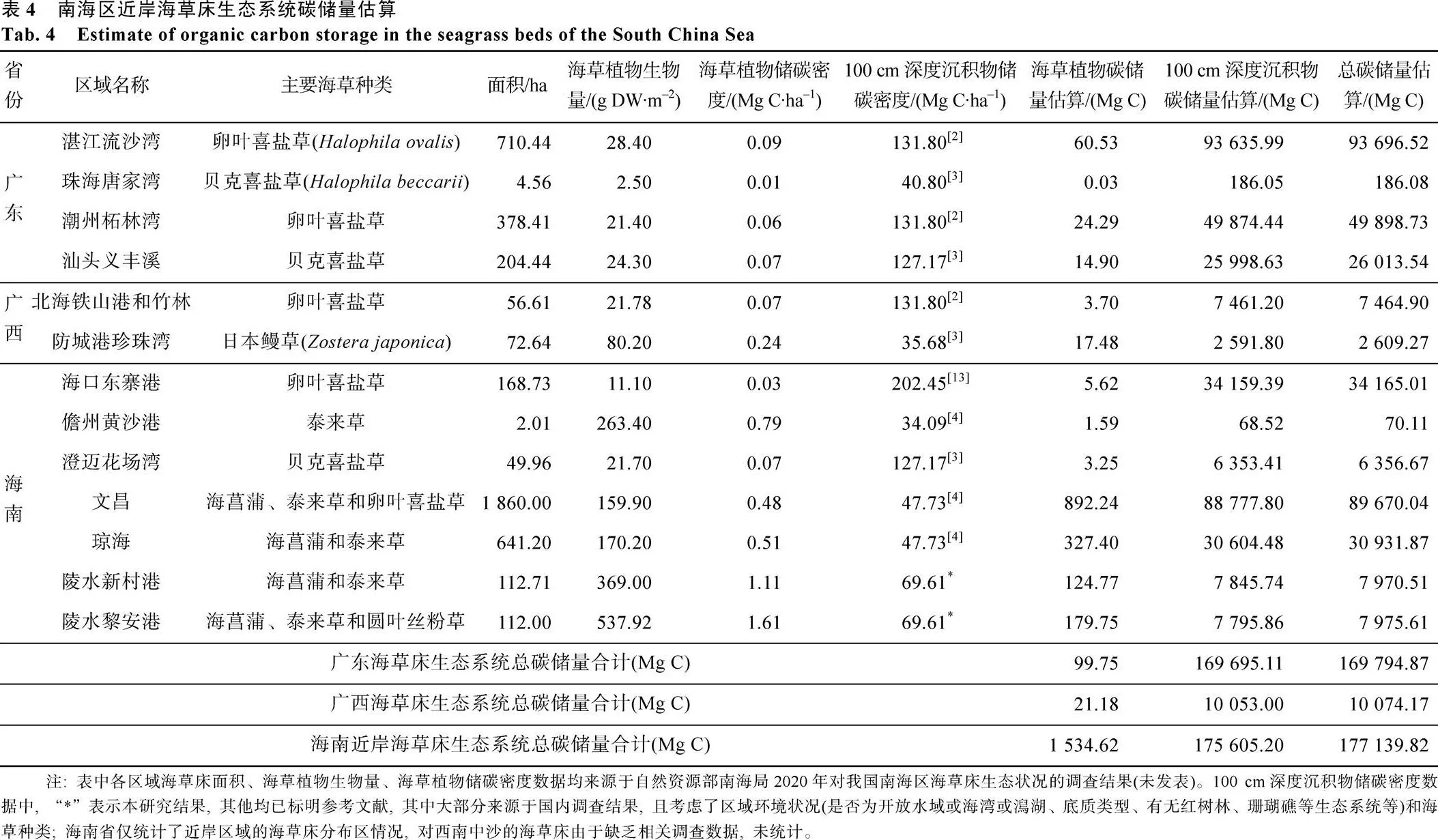
目前我国关于海草床碳储量的研究仅有一些零星报道, 如李梦[3]2017年夏季对广西不同种类海草床沉积物储碳情况进行了调查研究, 发现广西海草床沉积物储碳密度平均值为48.32 Mg C·ha–1, 估算出广西海草床生态系统100 cm深度沉积物总碳储量约为26 721.62 Mg C。Jiang等[2]对海南8个新发现的海草床区域(海草床总面积为203.64 ha)的碳储量进行了调查, 发现这8个区域海草植物体碳储量为33.50 Mg C, 表层沉积物(5 cm深度)总碳储量为1 306.45 Mg C。本研究对海南陵水黎安港海草床生态系统总碳储量进行了计算, 结果为(7 975.61± 2 907.15)Mg C。通过收集国内外不同区域不同种类海草床沉积物储碳密度的研究结果, 并结合自然资源部南海局对我国南海区海草资源面积分布的最新调查结果, 对南海区近岸现存海草床总碳储量进行了估算(表4), 结果显示, 我国南海区海草床总储碳量约为357 008.86 Mg C。Wu 等[24]利用全国海草床总面积和全球海草床储碳密度平均值对我国海草床生态系统总碳储量进行了估算, 结果为330 000~ 1 060 000 Mg C, 本研究估算结果与该结果处于同一数量级水平, 且本研究在估算中考虑到了南海各海草床分布区的区域状况、海草种类等差异, 结果更为准确。
致谢: 向国家海洋局南海环境监测中心所有参与过航次样品采集和分析的工作人员致以衷心的感谢!
[1] FOURQUREAN J W, DUARTE C M, KENNEDY H, et al. Seagrass ecosystems as a globally significant carbon stock[J]. Nature Geoscience, 2012, 1(7): 297-315.
[2] JIANG Z, LIU S, ZHANG J, et al. Newly discovered seagrass beds and their potential for blue carbon in the coastal seas of Hainan Island, South China Sea[J]. Marine Pollution Bulletin, 2017, 125(1/2): 513-521.
[3] 李梦. 广西海草床沉积物碳储量研究[D]. 南宁: 广西师范学院, 2018.
LI Meng. Carbon storage in the seagrass sediments of Guangxi, China[D]. Nanning: Guangxi Teachers Education University, 2018.
[4] GULLSTRÖM M, LYIMO L D, DAHL M, et al. Blue carbon storage in tropical seagrass meadows relates to ccarbonate stock dynamics, plant–sediment processes, and landscape context: Insights from the Western Indian Ocean[J]. Ecosystems, 2018, 21(3): 551-566.
[5] GITHAIGA M N, KAIRO J G, GILPIN L, et al. Carbon storage in the seagrass meadows of Gazi Bay, Kenya[J]. PLoS ONE, 2017, 12(5): e0177001.
[6] LAVERY P S, MATEO M-Á, SERRANO O, et al. Variability in the carbon storage of seagrass habitats and its implications for global estimates of blue carbon ecosystem service[J]. PLoS ONE, 2013, 8(9): e73748.
[7] DUARTE C M, MARBA N, GACIA E, et al. Seagrass community metabolism: Assessing the carbon sink capacity of seagrass meadows[J]. Global Biogeochemical Cycles, 2010, 24: 1-8.
[8] NELLEMANN C, CORCORAN E, DUARTE C M, et al. Blue carbon - The role of healthy oceans in binding carbon[M]. UNEP/FAO/UNESCO/IUCN/CSIC, 2008.
[9] DUARTE C M, MIDDELBURG J J, CARACO N. Major role of marine vegetation on the oceanic carbon cycle[J]. Biogeosciences, 2005, 2(1): 1-8.
[10] MATEO M, ROMERO J, PĖREZ M, et al. Dynamics of millenary organic deposits resulting from the growth of the Mediterranean seagrass[J]. Estuarine Coastal & Shelf Science, 1997, 44(1): 103-110.
[11] IACONO C L, MATEO M A, E GRÀCIA, et al. Very high-resolution seismo-acoustic imaging of seagrass meadows (Mediterranean Sea): Implications for carbon sink estimates[J]. Geophysical Research Letters, 2008, 35(18): 102-102.
[12] Gérard P, BAZARRI H, BIANCHI C N, et al. Mediterranean seagrass meadows: resilience and contribution to climate change mitigation. A short summary[J]. Transplantation Proceedings, 2012, 22(4): 1547-1548.
[13] 邱广龙, 林幸助, 李宗善, 等. 海草生态系统的固碳机理及贡献[J]. 应用生态学报, 2014, 25(6): 1825-1832.
QIU Guanglong, LIN Xingzhu, LI Zongshan, et al. Seagrass ecosystems: Contributions to and mechanisms of carbon sequestration[J]. Chinese Journal of Applied Ecology, 2014, 25(6): 1825-1832.
[14] 辛琨, 颜葵, 李真, 等. 海南岛红树林湿地土壤有机碳分布规律及影响因素研究[J]. 土壤学报, 2014, 5: 1078-1086.
XIN Kun, YAN Kui, LI Zhen, et al. Distribution of soil organic carbon in mangrove wetlands of hainan island and its influencing factors[J]. Acta Pedologica Sinica, 2014, 5: 1078-1086.
[15] KENNEDY H, BEGGINS J, DUARTE C M, et al. Seagrass sediments as a global carbon sink: Isotopic constraints[J]. Global Biogeochemical Cycles, 2010, 24: 1-9.
[16] MAZARRASA I, SAMPER-VILLARREAL J, SERRANO O, et al. Habitat characteristics provide insights of carbon storage in seagrass meadows[J]. Marine Pollution Bulletin, 2018, 134(SEP.): 106-117.
[17] MIYAJIMA T, HORI M, HAMAGUCHII M, et al. Geographic variability in organic carbon stock and accumulation rate in sediments of East and Southeast Asian seagrass meadows[J]. Glob Biogeochem Cycle, 2015, 29: 397-415.
[18] MATEO M, ROMERO J. Detritus dynamics in the seagrass Posidonia oceanica: Elements for an ecosystem carbon and nutrient budget[J]. Mar Ecol Prog Ser, 1997, 151: 43-53.
[19] MATTEO M, RENOM P, JULIA R, et al. An unexploredsedimentary record for the study of environmental change inMediterranean coastal environments:(L.)Delile peats[J]. Int At Energy Agency CS Papers Ser, 2002, 13: 163-173.
[20] HARTOG C D, KUO J. Taxonomy and biogeography of seagrasses[J]. Seagrasses Biology Ecologyand Conservation, 2006: 1-23.
[21] MAREOM, CEBRIÁN J, DUNTON K, et al. Carbon flux in seagrass ecosystems[M]. AIP Publishing, 2006.
[22] MARBÀ N, DUARTE C, CEBRIÁN J, et al. Growth and population dynamics ofon the Spanish Mediterranean coast: elucidating seagrass decline[J]. Marine Ecology Progress, 1996, 137(1/3): 203-213.
[23] SERRANO O, RUHON R, LAVERY P S, et al. Impact of mooring activities on carbon stocks in seagrass meadows[J]. Scientific Reports, 2016, 6: 23193.
[24] WU J, ZHANG H, PAN Y, et al. Opportunities for blue carbon strategies in China[J]. Ocean & Coastal Management, 2020, 194(1): 105241.
Carbon storage in the seagrass beds of Li’an Bay, Hainan
YANG Xi1, 2, 3*, YU Wei1, 2, 3, HE Jing1, 2, 3, HUANG Sheng1, 2, 3
(1. South China Sea Environmental Monitoring Center, State Oceanic Administration, Guangzhou 510300, China; 2. Key Laboratory of Marine Environmental Survey Technology and Application, Ministry of Natural Resources, Guangzhou 510300, China; 3. Nansha Islands Coral Reef Ecosystem National Observation and Research Station, Hainan, Guangzhou 510300, China)
This study evaluated the organic carbon (Corg) storage in Li’an Bay (Hainan) seagrass beds and estimated the total Corgstorage in the seagrass beds of the South China Sea. The results showed that the seagrass biomass Corgstorage, the top meter sediment Corgstorage, and the total Corgstorage in the Li’an Bay seagrass beds were (179.75±102.28) Mg C, (7, 795.86±2, 923.75) Mg C and (7, 975.61±2, 907.15) Mg C, respectively. The total Corgstorage in the seagrass beds was about 357, 008.86 Mg C. The mean sediment Corgcontent was 0.56%±0.25%, the mean seagrass biomass Corgdensity was 1.60±0.91 Mg C·ha−1, and the mean Corgdensity of the top meter sediment was 69.61±26.11 Mg C·ha−1in Li’an Bay. All of these values were lower than the global averages (2.50%, 2.52 Mg C·ha−1, and 139.70 Mg C·ha−1, respectively). The Corgcontent and Corgdensity of the sediments in some barren tidal flats (unvegetated) were higher than those in vegetated areas of Li’an Bay, as Corgexchange occurred between the vegetated areas and the adjacent barren tidal flat. These results recommend including the sediment Corgstorage of the barren tidal flat in the total Corgstorage of seagrass beds.
seagrass bed; carbon storage; barren tidal flat; Li’an Bay; South China Sea
Jan. 6, 2022
P76
A
1000-3096(2022)11-0116-10
10.11759/hykx20220106005
2022-01-06;
2022-05-28
自然资源部海洋环境探测技术与应用重点实验室2020年度自主设立课题(MESTA-2020-C006); 广东省平台基地及科技基础条件建设项目(2021B1212050025); 中国海洋发展基金会项目(CODF-002- ZX-2021); 2019年省级促进经济高质量发展(海洋经济发展)海洋六大产业专项重点项目(GDOE[2019]A46); 2022年省级促进经济高质量发展(海洋经济发展)海洋六大产业专项重点项目(GDNRC[2022]48)
[2020 Annual Project of the Key Laboratory of Marine Environmental Survey Technology and Application, Ministry of Natural Resources, No.MESTA-2020-C006; Science and Technology Plan Projects of Guangdong Province, No. 2021B1212050025; China Ocean Development Foundation, No. CODF-002-ZX-2021; Key Program of Marine Economy Development (Six Marine Industries) Special Foundation of Department of Natural Resources of Guangdong Province, No. GDOE[2019]A46; Key Program of Marine Economy Development (Six Marine Industries) Special Foundation of Department of Natural Resources of Guangdong Province, No. GDNRC[2022]48]
杨熙(1989—), 男, 湖北监利人, 博士, 工程师, 主要从事海草生态学、海洋浮游生物生态学研究, E-mail: yang1209xi@163.com
(本文编辑: 康亦兼)
