SH-6联合LY294002对胶质瘤细胞增殖、凋亡的影响及机制探究
2023-01-30邹有瑞李嘉麟
邹有瑞,李嘉麟,黄 灵,马 悦,马 辉
脑胶质瘤是中枢神经系统肿瘤中最常见的肿瘤之一[1],约占脑部中枢神经系统肿瘤的80%[2]。主要治疗方式是手术治疗及辅助放化疗。高级别胶质瘤患者的平均生存时间只有15个月[3],其发病机制需要进一步明确。近年来,磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/AKT)信号在肿瘤发病机制中的作用逐渐被深入研究,生长因子受体RAS、肌醇5′-磷酸酶、C末端调节蛋白、AKT的表达水平在大多数实体瘤中都有不同程度的改变[4],这种信号级联上下游效应器及相关的调控被认为是有吸引力的研究靶点。本研究通过使用新型PI3K/AKT信号通路抑制剂SH-6和LY294002处理胶质瘤细胞,分析PI3K/AKT通路中重要蛋白表达的变化,观察胶质瘤细胞的生物学功能的变化,并探讨其可能的致病机制。
1 资料与方法
1.1 一般资料:本实验于2020年7月至2021年6月在宁夏医科大学宁夏医学科学技术研究中心开展。U251 MG细胞系(人脑星形胶质母细胞瘤细胞),形态为上皮细胞样,培养特性为贴壁生长,购自中国科学院上海细胞库;DMEM、胎牛血清(Fetal bovine serum,FBS)购自美国Gibco公司;兔抗人p-PI3K、PI3K、p-AKT、AKT、GAPDH抗体购自英国艾博抗公司;辣根过氧化物酶(Horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗购自北京中桥生物科技公司;胰蛋白酶和青霉素、链霉素购自上海碧云天有限公司;二幸可宁酸(Bicinchoinic acid,BCA)法蛋白质定量试剂盒购自江苏凯基公司;TranswellTM小室、基质胶(Matrigel)购自美国康宁公司;CCK-8试剂盒购自上海东仁化学科技有限公司;Mil-lex-HV PVDF 膜(孔径0.45 μm)、增强化学发光试剂盒购自美国默克密理博公司;4%多聚甲醛购自上海索莱宝公司;倒置显微镜购自日本奥林巴斯公司;Multiskan GO型酶标仪购自美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 细胞培养:将U251细胞从液氮中取出,迅速复苏后置于37 ℃、5% CO2恒温培养箱中,隔1 d更换培养基,待细胞生长至80%左右进行传代,传3到5代后,取处在对数生长期的细胞进行后续实验。
1.2.2 药物处理:按照药物使用说明书将处在对数生长期的U251细胞按3×105个/孔接种于6孔板内,待细胞贴壁后,对不同组细胞分别进行处理。对照组细胞不做任何处理;在DMSO组中加入与SH-6和LY294002混合液相同体积的DMSO溶液;在联合组细胞中加入SH-6和LY294002混合液。继续细胞培养后进行后续实验。
1.2.3 Western-Blot法检测各组胶质瘤细胞中PI3K/AKT信号通路关键蛋白的表达:收集各组U251细胞并提取全蛋白,用BCA试剂盒对蛋白浓度进行定量,以20 μg/孔的上样量用10% SDS-PAGE进行电泳分离总蛋白,电泳结束后,在电流270 mA、功率30~35 W条件下转至PVDF膜上。PVDF膜置于50 g/L脱脂牛奶中封闭2 h。分别按照Marker上的分子量标记将PVDF膜剪下,之后分别加入p-PI3K、PI3K、p-AKT、AKT(稀释度都为1∶2 000)一抗在4 ℃过夜孵育。PBST 洗膜后加入辣根过氧化物酶标记的羊抗兔IgG二抗(稀释度为1∶5 000),室温孵育1 h,洗膜,用增强化学发光试剂盒曝光显影,并分析条带灰度值。
1.2.4 流式细胞术
1.2.4.1 检测细胞凋亡:将各组贴壁的胶质瘤细胞消化脱壁,使其成为单细胞悬液并等分为两份,其中一份用PBS离心洗涤2遍弃上清液,向每组中加入500 μL的1×Binding Buffer工作液重悬后,在避光的条件下向每组细胞中加入5 μL Annexin V-PE 和10 μL 7-AAD,轻柔混匀后孵育5 min,最后上机检测并分析。
1.2.4.2 检测细胞周期:向各组细胞中加入约0.5 mL预冷染色缓冲液,重悬细胞并重复一次。1 000 r/min左右离心3~5 min。弃上清液,加入0.5 mL培养基重悬细胞。用1 mL的枪头反复吸取混匀细胞避免成团。最后向各组细胞中加入4 μL的RedNucleus I染色液,缓慢并充分混匀,在避光常温条件下孵育20 min后上机分析。
1.2.5 细胞侵袭试验:将无菌Transwell小室放于24孔板中,Transwell小室为上室,下室为24孔板。上下室均含有培养液,以聚碳酸酯膜相隔。Matrigel基质胶按1∶9比例稀释后,取50 μL加入Transwell小室,放于4 ℃冰箱中风干过夜。第2 d用枪头吸干析出水化培养基。用不含血清的DMEM培养基将各组细胞稀释到2×105个/mL。取200 μL细胞悬液于上室,下层培养基加入培养基,培养24 h。之后用棉签擦去小室上层细胞,用30 g/L的多聚甲醛固定30 min,1%结晶紫溶液染色10 min,待风干后,显微镜观察不同视野下的细胞数,拍照并统计穿过基质胶的细胞个数。穿过基质胶的结晶紫染色阳性细胞被认为是侵袭的细胞。
1.2.6 划痕实验:将各组U251细胞按照5×105/孔的密度种植到6孔板内。培养24 h后用1 mL枪头垂直于6孔板的底部划线并用PBS洗掉脱落的细胞。用倒置显微镜在0、24 h时观察划痕的宽度,并统计在24 h内划痕向内迁移的距离(μm)。
1.2.7 CCK-8实验:将每组U251细胞稀释至密度为2×104个/mL,吸取100 mL细胞悬液于96孔板中,在37 ℃、5% CO2恒温恒湿培养箱内培养,分别在0、24、48、72 h向96孔板中加入10 μL CCK-8试剂,继续培养2 h;用酶标仪检测不同时间点波长450 nm处的吸光度值,利用吸光度值反应细胞增殖能力并进行数据统计分析。
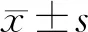
2 结果
2.1 SH-6和LY294002联合处理抑制PI3K/AKT信号通路中相关蛋白的表达:Western-blot检测结果显示,与对照组、DMSO组比较,联合组中p-PI3K/PI3K及p-AKT/AKT的比例显著降低(t=26.0,P<0.05);对照组、DMSO组之间差异无统计学意义(t=0.42,P>0.05),见图1(封二)。
2.2 SH-6和LY294002联合处理抑制细胞的侵袭能力:每个视野Transwell检测结果表明,联合组的侵袭细胞数量为(549.3±17.50)个,明显弱于对照组的(1 462±29.70)个及DMSO组的(1 653±35.44)个,2组比较差异有统计学意义(P<0.05),见图2(封二)。
2.3 SH-6和LY294002联合处理后细胞迁移能力明显降低:计算后得知,24 h时对照组、DMSO组、联合组细胞迁移的距离分别为(42.87±6.03)μm、(43.20±6.25)μm 、(81.67±6.51)μm,联合组细胞系的迁移能力距离明显低于其他2组。
2.4 SH-6和LY294002联合处理促进胶质瘤细胞凋亡:使用Annexin V-PE/7-ADD对细胞进行双染并用流式分析后可以看得出,对照组U251细胞凋亡率为(1.06±0.12)%,DMSO组为(2.15±0.05)%,联合组为(8.27±0.15)%,联合组U251细胞凋亡率明显增加(P<0.05)。
2.5 SH-6和LY294002联合处理对U251细胞周期的影响:流式细胞仪检测各组胶质瘤细胞周期的结果为在24 h后,对照组细胞在G0/G1期的比例为(4.41±0.19)%,DMSO组为(9.37±0.07)%,联合组为(27.45±0.08)%,联合组G0/G1期细胞比率增加(P<0.05),结果表明SH-6和LY294002联合处理阻滞U251细胞周期在G0/G1期,见图3(封二)。
2.6 SH-6和LY294002联合处理抑制胶质瘤细胞增殖能力:随着细胞培养时间的增加,各组细胞的增殖能力均呈增长趋势,但联合组细胞在72小时的吸光度值为0.86±0.67,明显低于对照组的1.57±1.2、DMSO组的1.37±1.16,差异具有统计学意义(P<0.05),见图4(封二),显示联合组U251细胞在24、48、72 h时相对于对照组和DMSO组增殖能力下降。
3 讨论
尽管医疗技术发展十分迅速,胶质瘤相关诊疗技术已取得进步,但是胶质瘤患者预后并没有得到根本性的提高[5-6]。PI3K/AKT信号通路在调节细胞的增殖及凋亡方面有着重要作用[7-8]。PI3K/AKT的激活受到严格把控,受细胞外生长因子、氨基酸及葡萄糖的可用性的影响[9]。PI3K/AKT信号通路由有磷酸化磷脂酰肌醇3羟基的脂类激酶活性的PI3K及下游AKT组成,分为Ι、Ⅱ、Ⅲ型[9],PI3K在细胞中激活磷脂酰肌醇激酶,同时也能调控AkT分子的活性。PI3K磷酸化后也可激活后影响细胞内相关生物学信号转导,调控细胞的增殖、凋亡等[10-12]。众所周知,肿瘤细胞内部的代谢错综复杂,并非完全由一条通路代谢失调所引起。基于此,当我们同时使用两种抑制剂后,该信号通路中的蛋白表达将会发生哪些变化呢?PI3K/AKT信号发生变化后该肿瘤细胞的细胞周期是怎么变化的呢?PI3K/AKT信号通路与细胞周期、细胞增殖等关系究竟如何呢?他们之间的相互作用关系如何?至今在国内外尚未见相关文献报道。本文使用了该通路抑制剂LY294002及最新的磷脂酰肌醇磷酸类似物SH-6。SH-6在肌醇环的第三位缺失羟基,并且有能够修饰的脂肪族侧链,具有更高的代谢稳定性[13]。本研究采用Western-Blolt检测PI3K/AKT信号通路中关键蛋白分子的表达水平。研究发现,相对于对照组及DMSO组,SH-6联合LY294002可显著抑制PI3K/AKT信号通路中p-AKT、p-PI3K的表达,AKT、PI3K的表达却无明显变化,p-AKT/AKT、p-PI3K/PI3K的比例降低。由此推测,联合使用SH-6和LY294002可抑制胶质瘤细胞中PI3K/AKT信号通路的表达,能有效抑制PI3K/AKT信号通路中关键蛋白磷酸化。最后我们通过细胞划痕实验、Transwell、流式分析实验,CCK-8实验进一步检测SH-6和LY294002联合处理对细胞增殖、侵袭及迁移能力的作用,结果显示联合组细胞增殖、迁移、侵袭能力均弱于对照组及DMSO组,而凋亡率明显高于对照组及DMSO组(P<0.05),表明SH-6和LY294002联合处理可抑制PI3K/AKT信号通路,从而明显抑制胶质瘤细胞增殖、迁移、侵袭等生物学能力[14]。其原因可能是蛋白经过磷酸化修饰后在PI3K/AKT信号通路中处于关键环节,蛋白的磷酸化修饰被抑制后,下游相关信号分子被进一步抑制,对肿瘤细胞生物学功能产生重要调控作用[15]。
综上所述,同时抑制PI3K/AKT信号通路中的情况下能够影响AKT/PI3K通路上相关蛋白磷酸化表达量的变化,从而进一步影响人脑胶质瘤细胞的侵袭及迁移。本研究揭示了联合使用SH-6和LY294002在抑制胶质瘤细胞恶性表型中的重要作用,为今后胶质瘤临床治疗提供新的治疗靶点。
