子宫内膜癌组织DBC1与SIRT1蛋白表达及意义
2023-01-30赵舸邹存华宋冬冬赵淑萍
赵舸,邹存华,宋冬冬,赵淑萍
(青岛大学附属青岛市妇女儿童医院,山东 青岛 266034 1 妇科中心; 2 普通外科)
子宫内膜癌(EC)在女性生殖系统恶性肿瘤中占比20%~30%[1-4]。近年来EC发病率呈明显上升和年轻化趋势[5-8]。目前EC治疗以手术为主,辅助放疗和化疗的综合治疗方式可获得较高的存活率,但化疗毒副作用大,严重影响病人的生活质量。EC发病机制目前仍不十分明确,探索肿瘤发生的分子机制,寻求新的治疗靶点具有重要的临床意义。已有研究发现,沉默信息调节因子1(SIRT1)在白血病、结直肠癌、前列腺癌等多种癌细胞中高表达,且与基因调控、细胞凋亡和增殖及肿瘤发生密切相关[9-12]。同时,SIRT1的关键内源性抑制剂乳癌缺失因子1(DBC1)可通过特异性抑制SIRT1来促进P53介导的细胞凋亡[13]。近年来已有多项研究表明,DBC1及SIRT1与多种恶性肿瘤的发生发展相关,同时与P53介导的凋亡途径密切相关。但有关DBC1及SIRT1与EC的相关研究较少,具体调控机制尚不明确。本研究拟通过免疫组织化学方法,检测EC组织、不典型增生子宫内膜组织及对照组子宫内膜组织DBC1及SIRT1的表达情况,并分析二者在EC中的关联性。现将结果报告如下。
1 资料与方法
1.1 一般资料
收集青岛大学附属青岛市妇女儿童医院2019年10月—2020年12月手术切除的EC组织标本60例,不典型增生子宫内膜40例。另选取同时期子宫肌瘤子宫全切术且术后病理诊断为正常子宫内膜组织40例作为对照组。病人年龄为35~66岁,平均(48.00±0.02)岁。EC根据国际妇产科联盟(FIGO)2009年分期标准进行分期:ⅠA~ⅠB期36例,Ⅱ~Ⅳ期24例;高分化25例,中/低分化35例;肌层浸润深度<1/2为23例,≥1/2为37例。所有病人均未行放化疗等。
1.2 免疫组织化学方法检测各组织中DBC1和SIRT1蛋白的表达
组织标本石蜡包埋,切片,烤片。将组织切片依次在二甲苯Ⅰ、Ⅱ、Ⅲ溶液中各浸泡15 min后,在无水及体积分数0.95、0.85、0.70乙醇中各浸泡5 min,以使切片脱蜡、脱水。冲洗10 min,用PBS冲洗4次,每次2 min。室温下用体积分数0.03过氧化氢孵育15 min,双蒸水冲洗3次,PBS冲洗4次,每次3 min。在煮沸的柠檬酸抗原修复液(pH 6.0)中放入组织切片,继续加热2 min,室温冷却,双蒸水冲洗3次,PBS冲洗4次,每次2 min,以使抗原修复。切片滴加一抗(DBC1兔抗人单克隆抗体(abcam公司,ab215852),滴度1∶200;SIRT1兔抗人单克隆抗体(abcam公司,ab189494),滴度1∶200),4 ℃孵育过夜,PBS冲洗4次,每次2 min。在组织切片上滴加过氧化物酶标记的抗兔聚合物,孵育30 min,PBS冲洗4次,每次2 min。切片滴加DAB辣根法显色液,显微镜下观察显色反应以便及时中止显色。苏木精复染,脱水,封片。PBS代替抗体作为阴性对照,已知的EC SIRT1和DBC1阳性表达组织作为阳性对照。
1.3 结果判定
细胞胞浆或胞膜中出现棕黄色颗粒为阳性表达。高倍镜(100倍)下随机选择10个视野,根据阳性细胞所占百分比及染色强度进行评分。①染色强度评分标准:无着色0分,染色浅黄色1分,染色黄色2分,染色棕黄色3分;②阳性细胞所占百分比评分:阳性细胞<5%为0分,阳性细胞5%~25%为1分,阳性细胞26%~50%为2分,阳性细胞51%~75%为3分,阳性细胞76%~100%为4分。将①和②的评分结果相加,根据总分判定结果:≤3分为阴性表达,≥4分为阳性表达。
1.4 统计学分析
采用SPSS 22.0软件进行统计学处理。计数资料比较采用χ2检验,相关性分析采用Spearman等级相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同子宫内膜组织中DBC1和SIRT1蛋白表达比较
DBC1蛋白阳性表达位于子宫内膜组织细胞核或胞质中,SIRT1蛋白阳性表达位于子宫内膜组织的细胞浆或胞膜中。DBC1蛋白在EC组织中的阳性表达率(70.0%)明显高于不典型增生子宫内膜(65.0%)及对照组子宫内膜(37.5%),差异均有统计学意义(χ2=11.260,P<0.05)。其中EC组与对照组比较、不典型增生组与对照组比较,差异均有统计学意义(χ2=10.343、6.054,P<0.05)。
SIRT1蛋白在EC中的阳性表达率(65.0%)高于不典型增生子宫内膜(62.5%)及对照组子宫内膜(30.0%),差异具有统计学意义(χ2=13.370,P<0.05)。其中EC组与对照组比较、不典型增生组与对照组比较,差异均具有统计学意义(χ2=11.765、6.599,P<0.05)。见图1。

A~C为DBC1蛋白表达,D~F为SIRT1蛋白表达。A、D:正常子宫内膜组织;B、E:不典型增生子宫内膜组织;C、F:EC组织。免疫组化SP染色,100倍。图1 EC、不典型增生子宫内膜及正常子宫内膜组织DBC1和SIRT1蛋白表达
2.2 EC组织DBC1和SIRT1蛋白表达与临床病理参数的关系
DBC1蛋白表达与EC组织临床分期(χ2=5.833,P<0.05)、手术病理分级(χ2=9.878,P<0.05)、肌层浸润深度(χ2=8.733,P<0.05)及淋巴结转移有关(χ2=5.945,P<0.05),而与病人年龄分布无关(χ2=1.837,P>0.05)。
SIRT1蛋白表达与EC组织恶性程度(χ2=5.910,P<0.05)、手术病理分级(χ2=8.308,P<0.05)、肌层浸润深度(χ2=10.972,P<0.05)及淋巴结转移有关(χ2=5.918,P<0.05),而与病人年龄分布无关(χ2=0.188,P>0.05)。见表1。
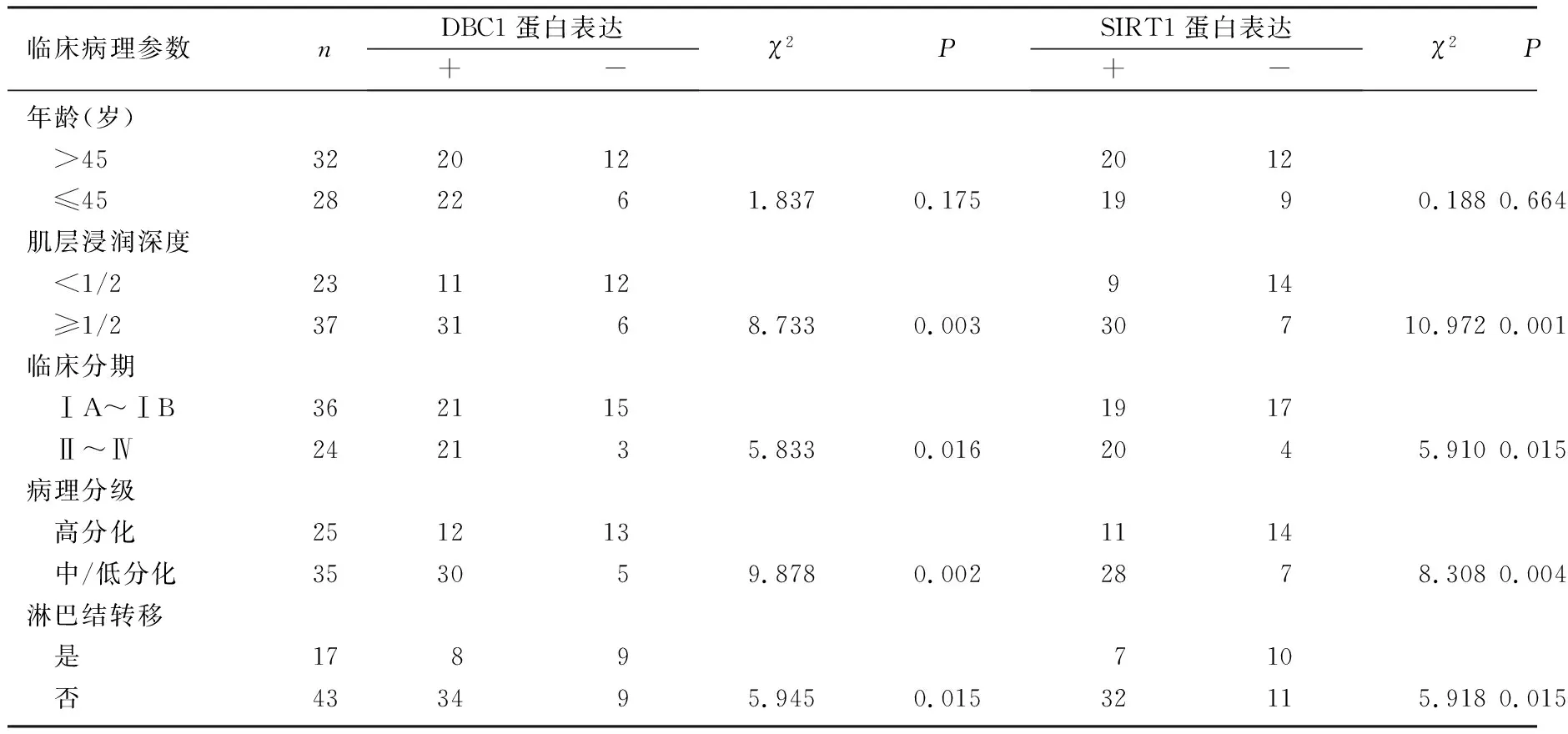
表1 EC组织DBC1蛋白及SIRT1蛋白的表达与临床病理参数的关系(例)
2.3 EC组织DBC1蛋白和SIRT1蛋白表达的相关性
Spearman等级相关分析结果表明,EC组织DBC1和SIRT1蛋白表达呈正相关(r=0.358,P<0.05)。见表2。不典型增生子宫内膜及正常子宫内膜组织DBC1和SIRT1蛋白表达无相关性(P>0.05)。
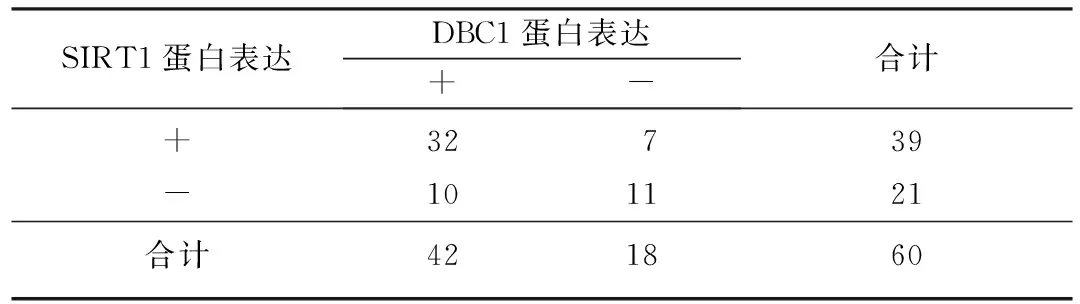
表2 EC中DBC1蛋白及SIRT1蛋白表达的关系(例)
3 讨 论
针对EC分子靶点的研究对于改善病人预后以及指导药物治疗等具有重要的意义。SIRT1是一种Ⅲ型组蛋白去乙酰化酶,属于组蛋白去乙酰化酶(HDACs)家族。已有研究显示,HDAC3与宫颈癌发生、发展过程密切相关;同时SIRT1在人宫颈癌组织中高表达,且与淋巴结转移程度、临床病理分期密切相关[14-18]。有研究发现,SIRT1在人EC中的表达明显高于正常子宫内膜组织,敲除SIRT1可明显抑制肿瘤细胞生长[16]。此外,SIRT1高表达与肿瘤细胞顺铂类以及紫杉醇化疗耐药有关,SIRT1抑制剂能有效逆转这种耐药抵抗[17]。SIRT1抑制剂已被应用于乳癌、前列腺癌、慢性髓性白血病、肝癌等肿瘤的临床研究中[18]。已有研究表明,SIRT1通过靶向作用于P53的赖氨酸382位点使其去乙酰化并降低其基因转录活性等机制导致肿瘤形成[19]。在肿瘤细胞中存在着SIRT1/P53通路的激活,其可以抑制肿瘤细胞凋亡过程,促进肿瘤细胞存活。目前,SIRT1已成为有效的抗癌靶点[20-23]。本研究结果显示,SIRT1蛋白在EC组织表达部位为细胞核,其阳性表达率明显高于不典型增生子宫内膜及对照组子宫内膜,提示SIRT1蛋白的表达与EC的发生发展密切相关。
DBC1 最早被发现位于乳癌病人染色体8p21缺失区域[24]。已有研究表明,DBC1是SIRT1的内生抑制剂[25]。最近的研究结果表明,DBC1可与SIRT1催化活性中心结合,从而抑制SIRT1去乙酰化酶活性,竞争性抑制SIRT1与底物P53结合[24]。DBC1与SIRT1的相互作用受磷酸化、SUMO化等翻译后修饰的调节,去SUMO化酶SENP1可使DBC1去SUMO化,抑制DBC1与SIRT1的相互作用[26-27]。关于DBC1与肿瘤发病机制的关系尚存在争议,DBC1的缺失与肿瘤发生的因果关系尚未确定。多项研究结果表明,DBC1在多种恶性肿瘤如乳癌、肝癌、结直肠癌中过表达,并且与不良预后有关[28-30]。然而也有研究表明,胃腺癌中DBC1的表达与较低的肿瘤学分期、较低的组织学分级以及更高的病人生存率密切相关[25]。表明SIRT1蛋白及DBC1蛋白在恶性肿瘤的发生发展过程中发挥着重要作用。但有关DBC1在EC中的表达情况报道较少。本文研究结果显示,DBC1蛋白表达部位多数位于细胞核,其在EC组织中的阳性表达率明显高于不典型增生子宫内膜及对照组子宫内膜,表明DBC1蛋白的表达对EC的发生发展起到一定的促进作用。
本文研究了EC组织中DBC1及SIRT1蛋白表达与临床病理参数的关系,结果表明,SIRT1、DBC1蛋白的表达与FIGO分期、淋巴结转移、肌层浸润程度以及肿瘤分化程度有关,SIRT1蛋白及DBC1蛋白在淋巴结转移的EC组织中的阳性表达率明显高于非淋巴结转移组织,病理分级中/低分化EC组织的阳性表达率明显高于高分化组织,而与病人年龄无关。表明DBC1及SIRT1蛋白的过表达能够促进EC的侵袭及转移。本实验结果还显示,EC组织DBC1蛋白及SIRT1蛋白表达存在正相关关系,提示DBC1/SIRT1信号通路可能在EC的发生发展、侵袭及转移过程中发挥重要作用。结合EC术后病理P53的检测结果,推测EC 中DBC1及SIRT1可能受磷酸化及SUMO化调节,从而影响了DBC1-SIRT1间的相互作用,导致其相互作用减弱,释放其中的SIRT1,进而影响P53的表达,导致细胞凋亡作用减弱,癌细胞存活,从而促进了癌症的发生发展过程。但具体的作用机制尚需进一步研究。
综上所述,DBC1及SIRT1与EC的发生发展密切相关,DBC1、SIRT1可能成为EC新的抗癌靶点。本研究尚存在不足,如样本量过少,导致结果出现偏倚以及缺乏细胞实验等。进一步研究DBC1/SIRT1信号通路的作用有望为EC的治疗开辟新的途径。
