影像学易误诊的肺原发恶性外周神经鞘膜瘤1例
2023-01-29邓虞娇
邓虞娇,伍 兵
四川大学华西医院放射科,四川 成都 610041
1 资 料
患者,男性,73岁。2020年6月出现干咳,伴背部持续性胀痛,外院影像学检查提示中央型肺癌;2020年7月咳嗽加重,咳黄脓痰,痰中带血,伴胸部持续性胀痛,活动后心累、气促,遂于2020年8月转入四川大学华西医院进一步诊治。入院查体:右下肺叩诊浊音,右下肺呼吸音低,双肺呼吸音粗,散在哮鸣音,余未见明显异常。实验室检查:血红蛋白为116 g/L(120~160 g/L),血小板为369×109/L[(100~300)×109/L],白细胞为8.71×109/L[(4~10)×109/L],中性分叶核粒细胞百分率为79.0%(50%~70%),C-反应蛋白为179.00 mg/L(0~10 mg/L),白细胞介素6为67.86 pg/mL(4.2~24.3 pg/mL),降钙素原为0.13 ng/mL(<0.1 ng/mL)。计算机体层成像(computed tomography,CT)胸部血管三维重建(图1、2):右侧肺门、右肺上叶可见最大截面积约5.6 cm×3.8 cm软组织密度肿块影,呈分叶状,边界不清,周围多发磨玻璃斑片影及网格影,增强后病灶不均匀强化,肿块累及右肺上叶,致右肺上叶部分支气管狭窄、闭塞,肿块累及纵隔内,包埋部分右肺动脉干及其分支、右上肺静脉,肿块与纵隔及右侧肺门增大淋巴结融合,部分分界不清,上腔静脉被包绕,局部可疑受侵,管腔未见明显狭窄。右肺动脉干及右上肺动脉局部充盈缺损影。诊断意见:右侧肺门、右肺上叶软组织密度肿块影,考虑肺癌可能,伴右肺上叶阻塞性炎症,纵隔及右侧肺门淋巴结转移待排除。右肺动脉干及右上肺动脉局部充盈缺损影,提示肺动脉栓塞。纤维支气管镜:右肺上叶气管黏膜肿胀,管腔变窄。经皮肺穿刺病理学检查(图3):少量梭形细胞肿瘤,诊断为肉瘤,亚型考虑恶性外周神经鞘瘤(malignant peripheral nerve sheath tumor,MPNST)。免疫组织化学检查:肿瘤细胞呈CD34(-)、STAT-6(-)、上皮膜抗原(epithelial membrane antigen,EMA,-)、TLE-1(部分+)、S-100(-)、PCK(-)、desmin(个别+)、SMA(部分+)、myogenin(-)、H3K27Me3(部分-)、WT-1(部分+)、CR(-)、ALK-1(-)、CDK4(个别+)、MDM2(个别+)、Myo D1(-)、TTF-1(-)、CK7(-)、P53(+)、CK5/6(-)、D2-40(-)、Ki-67(MIB-1)阳性率25%。荧光原位杂交技术(fluorescencein situhybridization,FISH)检测:未检出MDM2基因扩增;未检出SS18基因易位。二代基因测序(next generation sequencing,NGS):ERBB2基因扩增,组织丰度2.2倍;TP53 p.Y205D第6外显子错义突变,组织丰度28.5%;未检测到MSI-H、TMB;血浆为10.74个突变/Mb,组织为7.52个突变/Mb。PD-L1表达阴性,TPS<1%。患者已行5次右肺放疗(1 500 cGy/300 cGy/5 f),病情暂时稳定,目前临床随访中。
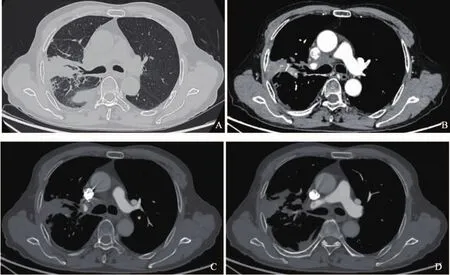
图1 肺原发恶性MPNST CT图像
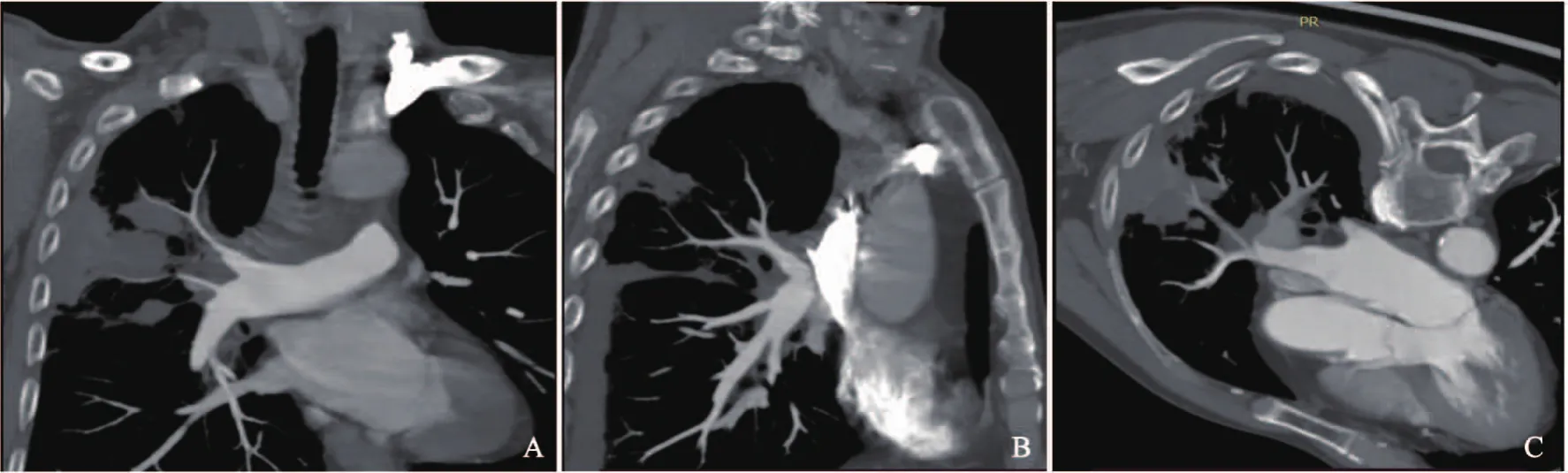
图2 肺原发恶性MPNST胸部血管三维重建图像
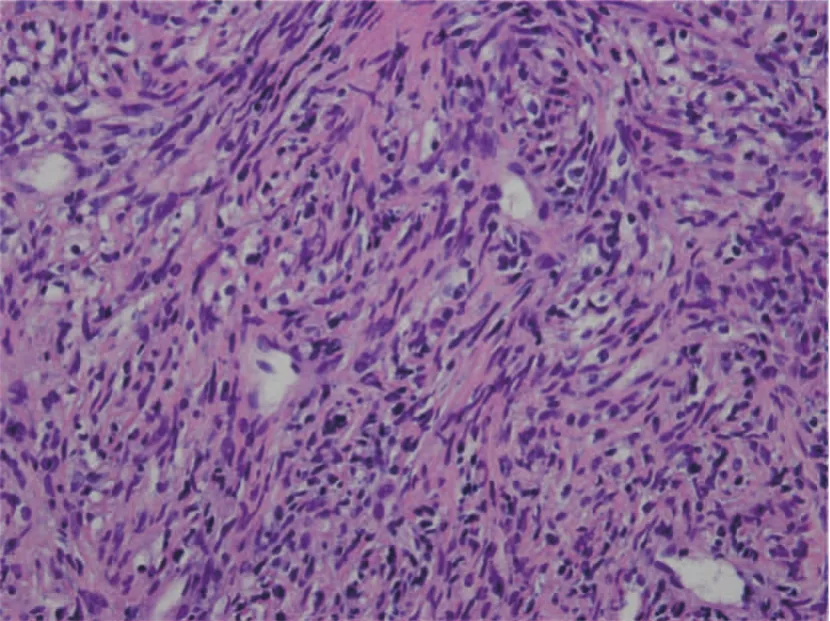
图3 MPNST病理学表现(H-E染色,×400)
2 讨 论
恶性MPNST是一种侵袭性软组织肉瘤,主要来源于施万细胞,发病率为1/3 000,多见于躯干、四肢及头颈,肺内原发罕见。MPNST发病机制尚不明确,50%继发于1型神经纤维瘤中预先存在的、组织学上良性的、不能手术的丛状神经纤维瘤,研究[1]指出,CDKN2A/B的丢失具有鉴别价值。肺MPNST多见于成年人,无明确性别差异,好发于右肺。
对比国内外已发表的肺原发MPNST案例[2-3],本研究患者特殊之处在于影像学特点酷似中央型肺癌,咳嗽、胸痛、咯血等临床表现无特异性,无神经纤维瘤病史,若无支气管镜活检与免疫组织化学检测,难以鉴别两者。肺内神经鞘膜瘤常分为支气管型和肺实质型,支气管型在CT上常表现为3种形式,分别为肿块呈哑铃状向腔外生长、肿块沿支气管纵轴生长和肿块呈带蒂状向管腔内生长,病灶内密度不均匀,强化明显,邻近支气管可受压阻塞出现阻塞性肺炎和肺不张;肺实质型在CT表现上分为肺实质良性肿块型和肺实质恶性肿块型,良性肿块一般较大,圆形或类圆形,边缘光整,包膜完整,呈网格状强化,邻近肺组织与骨组织可受压,但无受侵及远处转移表现,恶性肿块较小,形状不规则,有分叶,边缘毛糙,无完整包膜,中心可出现因缺血坏死而导致的囊性变,呈不均匀强化,邻近组织可受侵,可发生远处转移,但无论是良性还是恶性肺内神经鞘膜瘤,都无明显的纵隔、肺门淋巴结受累。本例患者还应采用超声内镜引导下的经支气管针吸活检或者其他手段对N10R、N7R淋巴结进行穿刺,以明确肿大淋巴结是否为转移所致。
大体上,MPNST病变呈白色、实性、肉质,有时可见黏液样改变,常有坏死和出血。显微镜下,MPNST通常为高度浸润性病变,表现出不同的细胞形态(包括梭形、上皮样、多形性或小圆形细胞)和结构模式。经免疫组织化学检查,未发现MPNST的诊断标志物。由于肿瘤中的施万细胞分化是高度可变的,往往是不完全的,S-100蛋白的诊断价值有限。它的表达通常是局灶性的,仅在50%~60%的MPNST核中可见染色,并且从超微结构上观察到与施万细胞分化程度相关。MPNST很少表达上皮标志物。虽然全细胞角蛋白如AE1/AE3和EMA的亚群染色,但大多数不表达细胞角蛋白7或19,有助于与单相滑膜肉瘤区分。神经上皮干细胞蛋白(nestin)是一种在神经外胚层干细胞中表达的中间丝蛋白,主要表达于胚胎发育期间的哺乳动物神经组织,在MPNST中显示出强烈的细胞质染色,呈现比其他神经标志物更广泛的模式,而在良性神经鞘瘤和其他肉瘤中表达较弱或无表达。它对MPNST比其他神经标志物更敏感,当与其他标志物联合使用时,可能有助于MPNST的诊断。与形态相似的滑膜肉瘤相比,MPNST中高活动性高迁移率族蛋白A2(high mobility group AT-Hook 2,HMGA2)优先表达,因此,HMGA2免疫组织化学可能是分离MPNST和滑膜肉瘤的有用标志物[4]。目前,良恶性MPNST的鉴别较为困难,Szymanski等[5]发现,通过超低深度全基因组测序(ultra low pass whole genome sequencing,ULP-WGS)分析血浆细胞游离脱氧核糖核酸(cell free deoxyribonucleic acid,cfDNA)片段大小和拷贝数变化得出的肿瘤片段水平与MPNST肿瘤情况显著相关,可以鉴别良恶性外周神经鞘膜瘤。有研究[6]指出,良恶性外周神经鞘膜瘤在磁共振成像(magnetic resonance imaging,MRI)和弥散加权成像(diffusion-weighted imaging,DWI)上表现不同,如肿瘤大小、边缘、病灶周围水肿等。结合表观弥散系数(apparent diffusion coefficient,ADC)和无分裂脂肪可以很好地鉴别外周神经鞘膜瘤的恶性和良性。
根治性手术是主要治疗手段,广泛的切缘阴性是影响预后的重要因素。对于无法进行手术切除的肿瘤,放疗与化疗可降低肿瘤分期,但易产生耐药性。近年来,靶向治疗成为热点,潜在靶点相关研究不断涌现。有研究[7]结果表明,MET和MEK抑制剂联合使用,通过防止信号网络适应的共同机制,有望提高MEK抑制MPNST的治疗效果,以及通过共同靶向受体来延缓或防止耐药性的出现。有研究[8]发现,虫草素可通过p53/Sp1/tubulin途径抑制MPNST肿瘤细胞生长,阻滞细胞周期在DNA合成后期/有丝分裂期(second gap/Mitosis,G2/M)和合成期(synthesis phase,S)。Guo等[9]发现,Polo样激酶1(polo-like kinase 1,PLK1)是MPNST另一治疗靶点,主要作用于细胞周期的G2/M过渡阶段。有研究[10]指出,双特异性磷酸酶(dual specificity phosphatase,DUSP)1和DUSP6在MPNST中高表达,DUSP抑制剂可通过c-Jun氨基末端蛋白激酶(c-Jun N-terminal protein kainse,JNK)(可能还有其他底物)增加丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号,减缓增殖并促进细胞死亡。
