过氧乙酸高级氧化技术机理及影响因素研究进展
2023-01-28代朝猛贾辰炎胡佳俊刘曙光张亚雷游学极
代朝猛 ,贾辰炎 ,胡佳俊 ,刘曙光 ,张亚雷 ,游学极
(1.同济大学土木工程学院,上海 200092;2.上海大学生命科学学院,上海 200444;3.同济大学环境科学与工程学院,上海 200092)
随着社会的快速发展,复杂有机污染物排放量急剧增加,且呈现出高毒性、高危害和难降解的趋势,对人体健康、经济发展和生态安全带来的危害不容忽视,研究开发一种高效实用的有机污染物处理技术意义重大〔1〕。过氧乙酸高级氧化技术(PAA−AOPs)是一种符合要求的新兴水处理技术。
过氧乙酸(PAA)是一种有机过氧酸,其氧化还原电位为1.06~1.96 V,具有杀菌能力强和污染性小等特点,因此被广泛用作漂白剂、消毒剂和氧化剂〔2−3〕。H2O2作为Fenton反应的氧化剂,已被研究多年。PAA可以看作是H2O2的衍生物,两者有相近的结构和相似的性质,这引起了研究人员将PAA代替H2O2应用于高级氧化领域的兴趣〔4〕。
PAA是小分子有机物,由C、H、O等元素组成,在使用过程中不会产生元素污染,符合我国目前大力倡导的环境友好的价值导向〔5〕。此外,PAA做AOPs的氧化剂比H2O2更有优势〔6〕。作为一种类似H2O2的过氧化物,PAA的最低空分子轨道能(−0.25 eV)低于H2O2(0.57 eV),且PAA的过氧键键能(159.1 kJ/mol)远低于H2O2(213.5 kJ/mol),这些都表明PAA更容易被活化〔7−8〕。据J. HOLLMAN等〔7〕报道,氧化剂质量浓度都为50 mg/L时,UV/PAA体系降解文拉法辛(VEN)、卡马西平(CBZ)、氟西汀(FLU)比UV/H2O2体系分别快55%、75%、33%。
随着研究的不断深入,PAA−AOPs对有机污染物的高效去除能力得到了有力证实〔9〕,并且有二次污染小、对温度和pH等因素要求宽松、能在常温常压的自然环境中进行等特点,符合经济节约和环境友好的价值导向,具有独特的优势和广阔的应用前景,是最具前途的水处理技术之一〔10〕。笔者对PAA−AOPs的反应机理、研究现状、特有性质和主要影响因素进行了综述,并在此基础上分析了该技术面临的问题,展望了该技术未来的研究方向。
1 PAA−AOPs反应机理
PAA−AOPs即通过外加能量或添加催化剂的方式使PAA反应,生成因含有未成对电子而极易发生反应的自由基和单线态氧(1O2)等活性物质,这些活性物质进而与目标污染物中的特定结构反应使其降解的水处理技术。本综述将对PAA−AOPs的反应机理、研究现状和独特性质进行总结与分析,并整理了不同PAA活化方式的优点和缺点。
1.1 活化机理
目前研究最多的活化方式有光照活化、过渡金属活化和碳质材料活化三种〔10〕。
1.1.1 光照活化
光照 活 化 中 以UV活 化 最 为 常 见〔11〕。据J. HOLLMAN等〔7〕报道,UV可以活化PAA产生羟基FLU和CBZ等药物,降解遵循准一级动力学模型,增强UV的强度会使准一级反应速率常数线性增加。UV的波长对活性物质的产率有显著影响,常用的波长为254 nm,可由紫外灯产生〔7,12−13〕。UV/PAA体系中关于活化的主要反应如式(1)~式(5)所示〔11,14〕,其作用机理如图1所示。
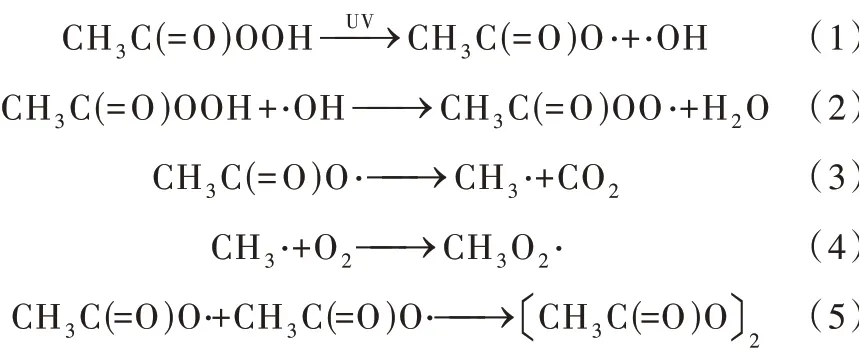
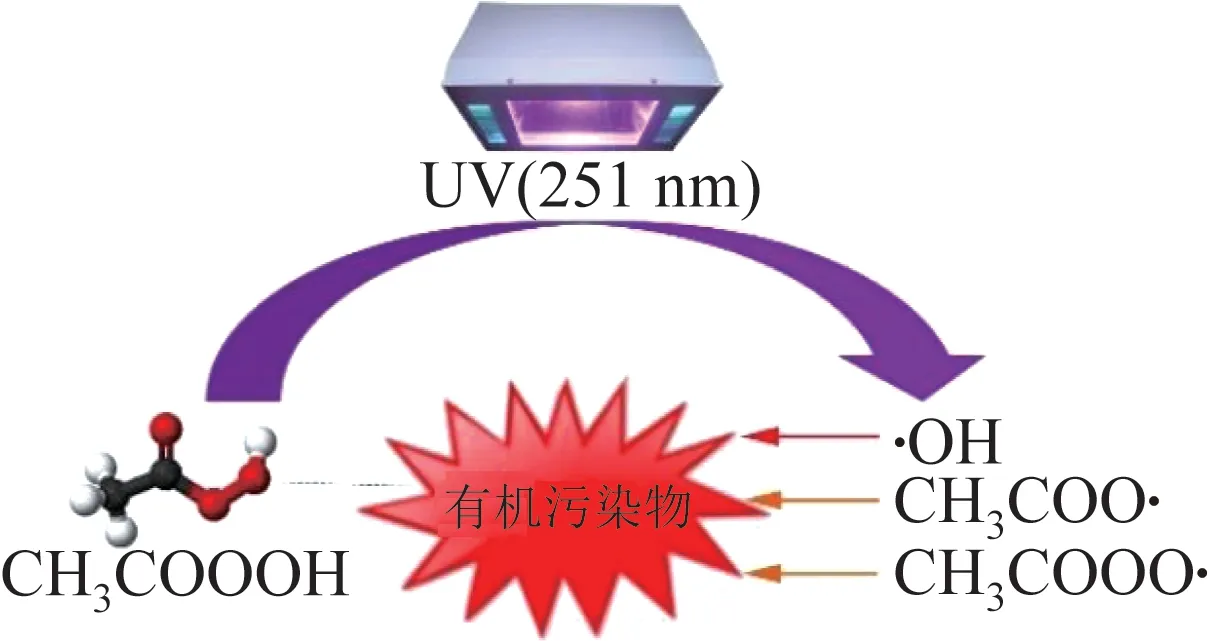
图1 UV/PAA体系反应机理Fig. 1 Reaction mechanism of UV/PAA system
1.1.2 过渡金属活化
Co〔8〕、Fe〔15〕、Mn〔16〕和Cu〔12〕等过渡金属易得失电子,可作为催化剂活化PAA。据J. KIM等〔6〕报道,Fe(Ⅱ)/PAA体系在120 min内可以完全降解亚甲基蓝(MBA)、萘普生(NAP)和双酚A(BPA)等有机污染物。Co是加速PAA分解的高效催化剂,与Fe、Mn和Cu等其他过渡金属相比,其效率更高〔4〕。但有研究发现,Co2+和Cu2+会引起人体健康问题,相比之下,Fe2+和Mn2+更为绿色环保〔17−18〕。过渡金属催化剂可分为均相催化剂〔8〕和非均相催化剂〔19〕。过渡金属非均相催化剂主要包括各类过渡金属的氧化物,其活化PAA具有反应条件易达到和催化剂易回收等特点〔19〕。相比之下,主要包括各类过渡金属离子的过渡金属均相催化剂则存在易金属浸出引起二次污染的缺点〔19−20〕。但在同等物质的量的情况下,金属均相催化剂对过氧化物的活化效果更好〔17〕。笔者以过渡金属离子活化PAA为例(以M表示过渡金属),介绍活化过程中的主要反应。如图2所示,Mn+与M(n+1)+可在体系内部自循环转换,符合绿色循环发展理念〔8,19〕。过渡金属离子/PAA体系中关于活化的主要反应如式(6)、式(7)所示。
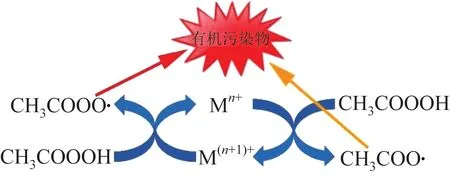
图2 过渡金属离子/PAA体系反应机理Fig. 2 Reaction mechanism of transition metal ion/PAA system
Mn++CH3C(=O)OOH—→—M(n+1)++CH3C(=O)O⋅+OH−(6)
M(n+1)++CH3C(=O)OOH—→—Mn++CH3C(=O)OO⋅+H+(7)
1.1.3 碳质材料活化
碳质材料催化剂因其具有材料来源广泛和无二次污染等特点在AOPs中的优势明显〔21〕。活性炭纤维(ACFs)〔22〕和碳纳米管〔23〕等碳质材料已被证明可以有效活化PAA降解有机污染物。并且Fengya ZHOU等〔22〕发现ACFs在活化PAA降解活性艳红X−3B的过程中表现出显著的pH耐受性、持续催化能力和良好回用效果等特点。有研究表明,羰基是碳质材料上能够有效活化过氧化物的官能团,并且羰基可以活化过氧化物产生非自由基活性物质单线态 氧(1O2)〔17〕。碳 质 材 料/PAA体 系 中 关 于 活 化 的主要反应如式(8)~式(10)所示。
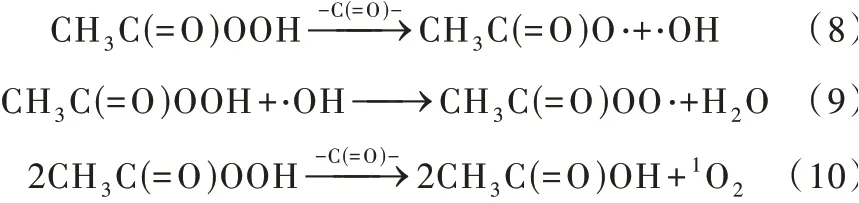

图3 碳质材料/PAA体系反应机理Fig. 3 Reaction mechanism of carbonaceous material/PAA system
综上,笔者对活化机理的分析主要集中于不同活化方式在活化PAA过程中表现出的特点,比较结果见表1。

表1 不同类型PAA−AOPs优缺点比较Table 1 Comparison of advantages and disadvantages of different types of PAA−AOPs
1.2 降解机理
对PAA−AOPs降解机理的分析集中于优势活性物质、易反应结构以及具体反应路径〔4,6,11,27〕。
1.2.1 优势活性物质
PAA−AOPs中的优势活性物质可分为·OH和有机自由基(R—C·)两大类,具体反应的优势活性物质如表2所示。一般情况下,·OH和R—C·共存于PAA−AOPs中,两者对有机污染物降解的贡献率因自由基的特性和目标污染物的结构特征不同而不同〔28〕。·OH和R—C·可以如式(2)所示相互转换。

表2 不同类型PAA−AOP的优势活性物质Table 2 The active materials of different types of advanced oxidation processes with PAA
·OH是广谱自由基,主要通过脱氢反应或加成反应使有机污染物发生降解,可降解多种有机污染物〔29〕。据Meiquan CAI等〔11〕报道,在UV/PAA体系降解CBZ和布洛芬(IBP)的实验中·OH是主要活性物质;J. HOLLMAN等〔7〕在UV/PAA体系降解SMX的实验中推导出,·OH在降解中起主导作用。
R—C·是选择性自由基,面对不同种类的污染物,发挥的作用差异较大,其在降解中的贡献率往往取决于目标污染物的分子结构〔30−32〕。有研究表明,R—C·会与萘环上的取代基发生反应,其更易降解含有萘环结构的有机污染物〔11〕。Zongping WANG等〔4〕在Co(Ⅱ)/PAA体系降解SMX的实验中发现主要是R—C·在降解中发挥作用,其中CH3COOO·起主要作用,CH3COO·起次要作用;据F. GHANBARI等〔33〕报道,在UVC−LED/Fe(Ⅱ)/PAA体系降解对乙酰氨基酚(ACT)的实验中,·OH和R—C·都是最主要的活性物质。
除·OH和R—C·外,PAA−AOPs产 生 的·O2−和1O2都有可能是优势活性物质,但目前关于PAA−AOPs的研究仍然较少,暂未发现·O2−和1O2是 优 势活性物种的研究,与PAA−AOPs相似的过硫酸盐高级氧化技术(PS−AOPs)有发现1O2是优势活性物质的研究〔34〕,可加强PAA−AOPs此方面的研究。
1.2.2 易反应结构和具体反应路径
活性物质主要通过与目标污染物中某些特定结构反应使目标污染物降解成毒性更小、更容易降解的小分子有机物,或完全矿化成CO2和H2O〔4,19〕。与其他AOPs相比,PAA−AOPs更倾向于降解含有偶氮键或萘环结构的有机污染物,其主要原因是PAA−AOPs中特有的R—C·更易与偶氮键和萘环结构反应〔11,19〕。在面对含有偶氮键或萘环结构的有机污染物 时,可 优 先 选 用PAA−AOPs。田 丹 等〔27〕发 现,Co(Ⅱ)/PAA体系中自由基主要与酸性橙(AO7)的偶氮键和萘环结构反应使AO7降解;据Wei WU等〔19〕报道,Co3O4/PAA体系中的活性物质主要与金橙G(OG)的偶氮键和萘环结构反应使OG发生降解。
在具体反应路径方面,不同结构的有机污染物由于结构的特性发生的反应不同。具体反应路径通常通过质谱分析结合有机污染物特定结构推导出,常见的反应路径包括脱氢、羟基化、氧化、脱氯、脱羧等〔4,6,15〕。Zongping WANG等〔4〕报道称,Co(Ⅱ)/PAA体系中的活性物质主要通过脱氢、氧化和偶联等反应使SMX发生降解;J. KIM等〔6〕报道称,Fe(Ⅱ)/PAA体系中的活性物质主要通过羟基化、氧化和脱羧等反应使多种抗生素降解。
2 PAA−AOPs的主要影响因素
PAA−AOPs的 主 要 影 响 因 素 包 括pH、PAA浓度、无机阴离子和天然有机质(NOM)等。为了优化PAA−AOPs,必须对这些影响因素进行深入研究,笔者将以这四个主要影响因素为重点进行讨论分析。
2.1 pH
pH对三种活化方式的影响差异较大。现有研究表明,光照活化〔25〕和碳质材料活化〔22〕对pH有较强 的 耐 受 性,而 过 渡 金属活化〔4,6,16〕则对pH有 较 高的要求,具体情况如表3所示。相对于其他氧化剂,PAA本 身 就 具 有 很 强 的pH耐 受 性〔22〕,这 是PAA−AOPs的主要优势之一。
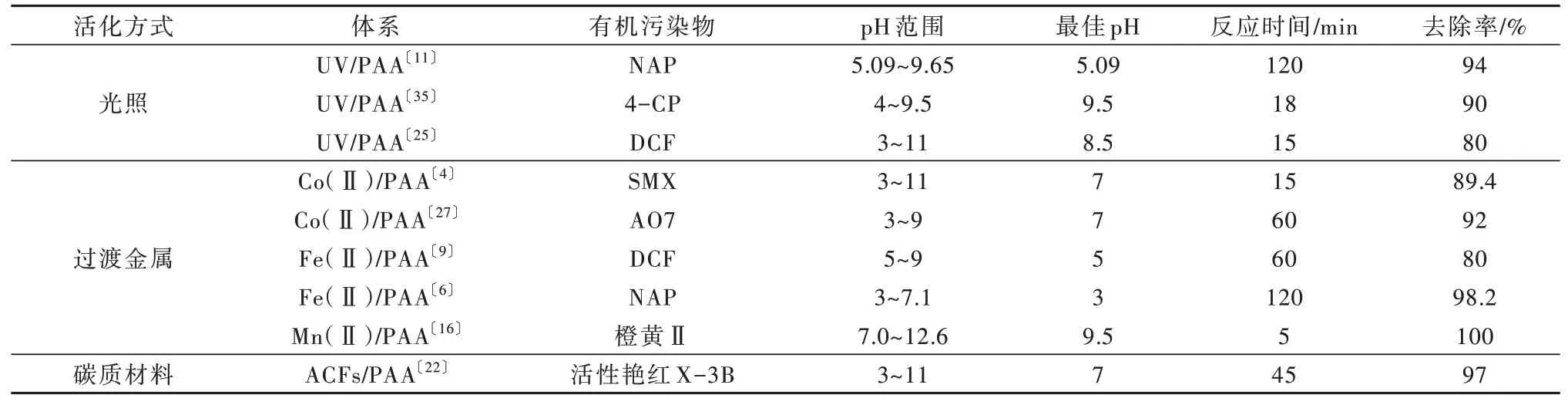
表3 不同类型PAA−AOPs的pH相关分析Table 3 The correlation analysis of pH of different types of PAA−AOPs
PAA的pKa值 为8.2,当pH小 于8.2时,PAA主要以质子形式(PAA0)存在,当pH大于8.2时,PAA主要以离子形式(PAA−)存在〔11〕。PAA0是比PAA−更强 的氧化剂,且PAA0比PAA−对·OH的清除 能 力弱〔8,11〕,这些会使得PAA−AOPs的最佳pH倾向于酸性或弱碱性。
但是PAA−在254 nm处具有比PAA0更高的摩尔吸光系数〔24,26〕,导致UV/PAA体系降解目标污染物的最佳pH偏碱性〔36−37〕。而OH−与·OH的二级反应速率常数是1.2×1010L/(mol·s),因此OH−浓度高的强碱性条件也不利于目标污染物的降解〔12〕。综上所述,弱碱性环境最适于UV/PAA体系降解目标污染物。据Li ZHANG等〔25〕报道,Cu2+强化UV/PAA体系降解DCF的最佳pH为8.5;M. MUKHOPADHYAY等〔35〕发现,在pH为9.5的环境下,UV/PAA体系对对氯苯酚(4−CP)的降解效果最好;Tianqi ZHANG等〔26〕构建了反应动力学模型,发现pH为8.0时,PAA被活化分解的效果最好。
pH对催化剂的影响在过渡金属/PAA体系中表现得更加明显〔16〕。pH会影响体系中过渡金属的存在形态:过渡金属在酸性环境中以离子形式存在,在碱性环境中会转化为氢氧化物〔9〕。此外,强酸环境不利于缺电子高价态金属离子形成,使PAA不能被过渡金属离子有效活化〔8,27〕。因此,对于过渡金属/PAA体系来讲,中性或弱酸性环境更有利于对目标污 染 物 的 降 解〔4,8,27〕。据Zhenran WANG等〔9〕报 道,Fe(Ⅱ)/PAA体系降解DCF的最佳pH为5;J. KIM等〔8〕发现Co(Ⅱ)/PAA体系降解CBZ在pH为7时降解效果最好。
碳质材料/PAA体系有较好的pH耐受性,pH并不是该体系主要的影响因素〔22〕。Fengya ZHOU等〔22〕使用ACFs活化PAA降解活性艳红X−3B时发现,当pH在3~11范围内,目标污染物的去除率都在97%以上,差距不大。
2.2 PAA浓度
将PAA−AOPs应用于实际生产中必须研究PAA浓度对降解效果的影响。PAA浓度的升高会使目标污染物的降解率随之升高,这主要归因于自由基的生成速率和积累浓度随体系中PAA浓度的升高 而 升高〔8,38〕。J. KIM等〔8〕发 现,将PAA浓 度从20µmol/L升高到200 µmol/L,CBZ在Co(Ⅱ)/PAA体系中的降解率从22%升高到90%。然而,自由基的大量产生可能会导致自由基的自猝灭,且高浓度的PAA不仅会吸收紫外光还会与污染物竞争·OH反应〔kPAA/·OH=(9.33±0.3)×108L(mol·s)〕〔4,25,39〕。因 此,升高体系中PAA浓度至过量的水平,目标污染物的降解率先快速升高后缓慢升高,甚至会出现降低的现 象〔6,22,25,28,33,40〕。张 李 等〔12〕发 现,将PAA浓 度 从10 µmol/L升 高 到200 µmol/L,Cu2+/UV/PAA体系 降解DCF的降解速率常数(kobs)在10~100 µmol/L范围内 增 长 较 快,从0.082 5 min−1增 加 到0.2 min−1,在100~200 µmol/L范围内增长 较慢,仅从0.2 min−1增加到0.255 0 min−1。
2.3 无机阴离子
无机阴离子广泛存在于天然水体中,对PAA−AOPs影响较大的无机阴离子包括Cl−、CO32−和NO3−等。笔者将以这些阴离子对PAA−AOPs的影响为重点进行总结和分析。
2.3.1 Cl−
Cl−在废水中的含量普遍较高,研究Cl−对PAA−AOPs的影响极其重要〔27〕。Cl−的影响体现在两个方面:一方面,Cl−可以直接与PAA反应生成二次氧化剂HOCl〔41〕;另一方面,Cl−可以和自由基反应生成含氯活性物质,包括Cl·、Cl2·−和HOCl·−等。有研究表明,Cl−对自由基反应途径的影响较大,对非自由基反应途径不起作用〔17〕。与Cl−相关的主要反应如式(11)~式(13)所示〔14〕。
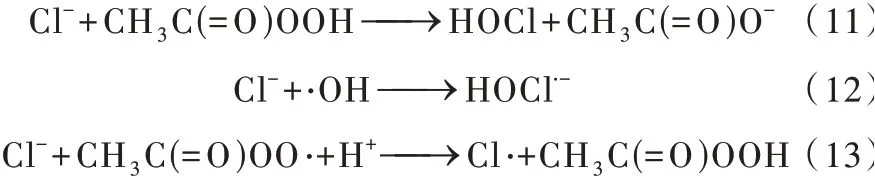
含氯活性物质对不同种类污染物的敏感性不同〔10〕。因此,Cl−对降解的影响也取决于目标污染物的种类。田丹等〔27〕发现Cl−的存在(0~500 mmol/L)不利于AO7的降解;F. GHANBARI等〔33〕在降解ACT的过程中发现0~10 mmol/L的低浓度Cl−对降解没有影响,10~20 mmol/L的高浓度Cl−对降解有轻微的抑制作用;Li ZHANG等〔25〕观测到0~10 mmol/L范围内Cl−的浓度变化对DCF降解效果的影响可忽略不计;而Fengya ZHOU等〔22〕在ACFs/PAA体系降解有机污染物的过程中发现,Cl−对降解有双重效果,0~100 mmol/L的低浓度Cl−会与活性自由基生成低活性的,对降解有抑制作用;100~300 mmol/L的高浓度Cl−可与PAA生成高活性的HOCl,对降解有促进作用。
2.3.2 CO32-
CO32−是·OH猝灭剂,对降解具有较强的负面作用〔8,42〕。Siao CHEN等〔42〕在UV/PAA体 系 降 解NAP的实验中发现,将CO32−投加量从0增加到20 mmol/L,·OH在降解反应中发挥的作用越来越小,k·OH,NAP由0.054 min−1降 低 到0.036 min−1。此 外,Zongping WANG等〔4〕发 现CO32−抑 制 降 解 的 原 因 还 可 能 是HCO3−的存在严重阻碍了PAA的分解。史鸿乐等〔38〕认为CO32−的引入提高了体系的pH,这也是不利于目标污染物降解的原因之一。J. KIM等〔8〕认为,CO32−有与Co2+络合的倾向,也不利于目标污染物的降解。与CO32−相关的主要反应如式(14)、式(15)所示〔43〕。
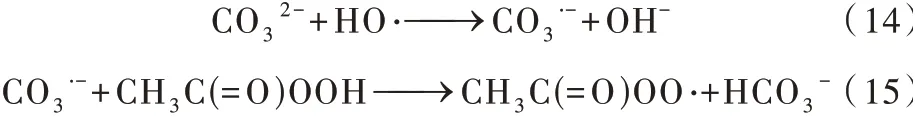
CO32−不能清除R—C·。因此,对于R—C·起主要 作 用 的 反 应,CO32−的 影 响 较 小〔11,42〕。据Siao CHEN等〔42〕报道,相比于·OH和R—C·都是优势活性物质的实验,只有R—C·是优势活性物质的NAP降解实验受到CO32−浓度变化的影响要小很多〔11〕。
张李等〔12〕发现将CO32−浓度从0增加到10 mmol/L对DCF的降解没有明显的抑制作用,他推测CO32−和·OH产生的CO3·−对DCF的降解有促进作用,抵消了·OH数量减少的影响。Tongcai LIU等〔44〕也发现体系中生成的CO3·−对目标污染物的降解有促进作用。
2.3.3 NO3−
NO3−是一种光敏剂,对PAA−AOPs的影响体现在两个方面:一方面,NO3−可以吸收UV,减少目标污染物的直接光解;另一方面,NO3−可以在UV的照射下生成·OH,增强降解效果,具体反应如式(16)所示〔10,12〕。

据文献〔9,12,33〕报道,NO3−对降解的影响不大,少部分的实验中有轻微促进作用或抑制作用。Zhen⁃ran WANG等〔9〕报道称,NO3−对Fe(Ⅱ)/PAA体系降解DCF的影响不大;F. GHANBARI等〔33〕在UVC−LED/Fe(Ⅱ)/PAA体系降解ACT的实验中发现0~10 mmol/L的低浓度NO3−对降解表现出轻微的抑制作用,其原因是生成的亚硝酸盐可以猝灭自由基,10~20 mmol/L的 高浓 度NO3−表 现 出 中性 作 用;张 李 等〔12〕在Cu2+/UV/PAA体系和UV/PAA体系降解DCF的过程中发现NO3−的存在提高了对DCF的降解效率,并且NO3−浓度越高,促进效果越明显。
2.4 NOM
NOM是水体中普遍存在的一种复杂成分,实验常以腐殖酸(HA)和黄腐酸(FA)为代表〔42〕。NOM可以与·OH和R—C·等活性物质发生反应,削弱降解效 果〔10〕。Siao CHEN等〔42〕发 现 低 至1 mg/L的HA几乎可以完全抑制NAP的降解,说明NOM对目标污染物降解的抑制作用非常强;Zongping WANG等〔4〕发现HA可以抑制Co(Ⅱ)/PAA体系中SMX的降解,其原因除了HA可以消耗反应性自由基外,还有HA的络合作用会阻碍催化剂的活性位点。PAA浓度、无机阴离子和NOM对于降解反应影响的具体案例总结见表4。

表4 共存组分对PAA-AOPs的影响Table 4 The effect of coexisting components on advanced oxidation processes with PAA
3 总结与展望
首先综述了PAA−AOPs的反应机理、研究现状和特有性质。PAA−AOPs能原位产生·OH、R—C·、·O2−和1O2等高活性物质通过脱氢、羟基化、氧化、脱氯、脱羧等反应途径高效降解有机污染物,且更倾向于降解含有偶氮键或萘环结构的污染物。然后对pH、PAA浓度、无机阴离子(Cl−、CO32−、NO3−)和NOM等因素对PAA−AOPs的影响进行了概述。pH对光照活化〔25〕和碳质材料活化〔22〕的影响较小,对过渡金属活化〔4,6,16〕的影响较大;PAA浓度的不断升高会使目标污染物的降解率先快速升高后缓慢升高,甚至会出现降低的现象〔22,25〕;在无机阴离子方面,Cl−对降解的影响由多方面因素决定〔22〕,CO32−往往对降解有消极影响〔9〕,NO3−对降解的影响不大〔9〕;NOM成分复杂,对目标污染物的降解有很强的抑制作用〔42〕。
相比于传统AOPs,PAA−AOPs具有操作简单、成本低、反应条件要求宽松和毒副产物少等优势,潜力巨大。但是,PAA−AOPs仍然有很多问题有待解决,如PAA稳定性差以及内部机理研究不清等。基于目前的研究情况,笔者提出以下几点研究展望:
(1)开发增强PAA稳定性的方法。PAA稳定性差,自然条件下会缓慢分解〔45〕,这对于PAA−AOPs的实际应用是一个巨大的阻碍,有必要开发增强PAA稳定性的方法。
(2)加强碳质材料/PAA体系的研究。碳质材料/PAA体系相比于光照/PAA体系反应条件更容易实现,相比于过渡金属/PAA体系不会引入金属污染物,有很强的优越性。目前关于碳质材料活化PAA的研究并不多,加强碳质材料活化PAA的研究对于推动PAA−AOPs的发展意义重大。
(3)强化R—C·对目标污染物降解的动力学研究。R—C·在PAA−AOPs中发挥着重要的作用,目前关于R—C·对目标污染物降解的动力学研究十分有限〔30〕。深化此方面的研究有利于对PAA−AOPs作用机理的进一步了解。