小花异裂菊根际与非根际微生物功能多样性比较
2023-01-19史艳财秦惠珍邓丽丽韦记青
王 博,覃 芳,史艳财,秦惠珍,邓丽丽,韦记青
(1.桂林理工大学 旅游与风景园林学院,广西 桂林 541006; 2. 广西师范大学 生命科学学院,广西 桂林 541006;3. 广西壮族自治区中国科学院广西植物研究所,广西 桂林 541006)
小花异裂菊HeteroplexismicrocephalaY. L. Chen.为菊科Asteraceae异裂菊属HeteroplexisChang多年生灌木植物,可用于治疗消化不良、脾虚、浮肿等症[1],对菊科的分类、系统演化等研究具有极为重要的科学价值,已被列为国家二级保护植物[2]。小花异裂菊在石灰岩山地的特有化发展十分显著,仅分布在广西阳朔、融安等县石山区的中上部,该区域具有典型的喀斯特环境特点:干湿频繁交替,土层浅薄,土被不连续,土壤富钙、盐分高、养分含量低等[3]。典型的石山特有种以及分布地具有典型的喀斯特生态特征使小花异裂菊成为研究喀斯特生境特有植物生态适应机制的理想物种。
目前,关于小花异裂菊的研究主要集中在核型[4]、化学成分[1]、遗传多样性[5]等方面。根际是植物—土壤—微生物相互作用最为活跃的场所,根系通过调整根际分泌物(可溶性糖、氨基酸等)的组分和数量选择性地提高或降低某些微生物丰度,形成具有特定结构与功能的根际微生物群落[6]。根际微生物可影响植物营养吸收、植物抗性等过程[7],尤其是在贫瘠、盐分胁迫等逆境条件下[8]。近年来,根际微生物研究多数集中在农田、草原以及沙漠等生境的植物,对喀斯特地区植物根际微生物的研究还较为薄弱[9-11]。相关研究显示根际微生物在提高小花异裂菊适应性方面起着重要作用,但具体机制尚不清楚[12]。
基于上述研究现状,本研究以5个代表性分布点小花异裂菊的根际与非根际土壤微生物为研究对象,采用Biolog-ECO微平板法对其功能多样性进行测定,将微生物功能多样性与主要土壤理化因子结合起来综合分析,以期阐明小花异裂菊根际和非根际微生物功能多样性差异及影响因子,为揭示小花异裂菊及其他喀斯特石山特有植物生态适应机制提供依据。
1 材料与方法
1.1 采样地概况
采样地为广西桂林市阳朔县。阳朔县位于广西壮族自治区东北部,桂林市南面,地处东经110°13′~110°40′,北纬24°38′~25°04′,年平均气温19 ℃,年平均日照时数1 465 h,年平均降雨量1 640 mm,年平均无霜期302 d。
1.2 采样方法
2019年8月分别在5个分布地(具体信息见表1)采样。每个采样点选择3株年龄、株高、长势等基本一致的植株,植株之间距离20 m以上。具体采样方法:挖出完整的植株根系,抖去根部大块土壤,采集附着在根系上的土壤,装入无菌封口袋中,作为根际土(R);采集距离根系10~20 cm土壤,装于无菌袋中,作为非根际土壤(N)。土壤采集完后立即置于冰盒带回实验室。一份用于Biolog-ECO微平板试验,另一份室内自然风干,用于土壤理化性质测定。

表1 采样地信息Tab. 1 Geographic locality of sample
1.3 测定方法
1.3.1 土壤养分含量测定
全氮含量测定采用高氯酸-硫酸消化法[11],全磷、速效磷含量测定采用NaHCO3浸提-钼锑抗比色法[11],全钾含量测定采用氢氟酸-高氯酸消煮法[11],速效钾含量测定用NH4OAc浸提-火焰光度法[11],交换性钠含量测定采用乙酸铵交换-火焰光度法[11],交换性钙和镁含量测定采用乙酸铵-原子吸收分光光度法[11]。土壤pH采用pH计(上海雷磁pHs-3c型)测定;电导率采用电导率仪(上海雷磁DDB-303A)测定。
1.3.2 群落功能多样性测定
称取相当于10 g风干土壤量的鲜土加入到250 mL三角瓶中,加入90 mL灭菌水,混合均匀,封口后放置于200 r/min摇床中,振荡30 min;取出后静置于超净无菌工作台40~60 s;取3 mL上清液转移至装有27 mL灭菌水的试管中,涡旋震荡均匀,重复3次,将土壤溶液最终稀释至1 000倍。用八孔加样器吸取150 μL稀释后的土壤菌液加入生态板中,每个样品重复3次。将Biolog-ECO板放入28 ℃恒温培养箱中培养。利用多功能荧光酶标仪(SP-Max 3500 FL)在波长590 nm处测量吸收光值,每隔24 h测量1次,连续测量10 d。
白酒品评是判断酒质优劣的重要检测技术,具有快速、准确的特点,到目前为止,还不能被分析仪器所替代[6]。由公司的2名国家评委和4名省评委组成原酒质量鉴评小组,对试验组和对照组的118个酒样进行品评分析,品评结果见表4。由表4可知,使用清洁稻壳所产原酒具有醇厚干净,糠味、土腥味、涩味、霉味等异杂味小的共性特点,其质量普遍优于对照酒样,实验组原酒质量评分比对照组高11.64%。
1.4 数据处理
Biolog-ECO法测定的数据采用以下公式计算分析:
(1)平均颜色变化率(AWCD)
式中:Ci是指第i个非对照微孔的吸光度,R是对照微孔的吸光度,N是培养基中碳源种类的数量。
(2)多样性指数
H=-∑(Pi×lnPi),
式中Pi是第i个非对照微孔的吸光度与所有非对照微孔的吸光度之和的比值。
(3)丰富度指数
D=1-∑Pi2。
(4)均匀度指数
(5)碳源的相对利用率——以第7 天对应碳源反应孔的AWCD值之和为相对利用率。
1.5 数据分析
2 结果与分析
2.1 土壤理化性质
由图1可知,5个采样点中,高海拔(XP)采样点小花异裂菊根际与非根际土壤全氮、全钾、碱解氮、速效钾、交换性钠的含量以及电导率较低;低海拔(GJ)采样点小花异裂菊根际与非根际土壤碱解氮、速效钾、交换性钠、交换性镁的含量、电导率以及pH值较高。5个采样点中,根际土壤全磷、全钾、碱解氮、速效钾、交换性钠、交换性镁的含量、电导率以及pH值均大于相应的非根际土壤,而且根际土壤与非根际土壤在全钾、碱解氮、速效磷的含量及pH值之间有显著差异(P<0.05)。
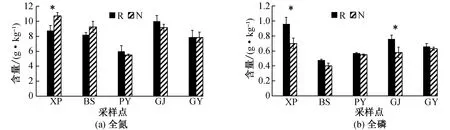




R为根际,N为非根际,*表示同一采样点在根际与非根际土壤理化性质差异显著(P<0.05),数值为平均值±标准误差图1 小花异裂菊根际与非根际土壤理化性质 Fig. 1 Physical and chemical properties of soil between rhizosphere and non-rhizosphere soils of H. microcephala
对11个土壤理化因子进行pearson相关分析,结果见表2。由表可见,土壤理化因子之间存在较高的相关性,全氮与碱解氮、有效磷,速效钾、交换性镁以及电导率这6个变量之间极显著正相关(P<0.01),交换性钙与交换性镁之间极显著负相关(P<0.01);全氮与速效钾、碱解氮与电导率、交换性钠与pH之间均表现出显著正相关(P<0.05);而全磷、全钾与其他的9个土壤理化因子的相关性并不显著(P>0.05)。
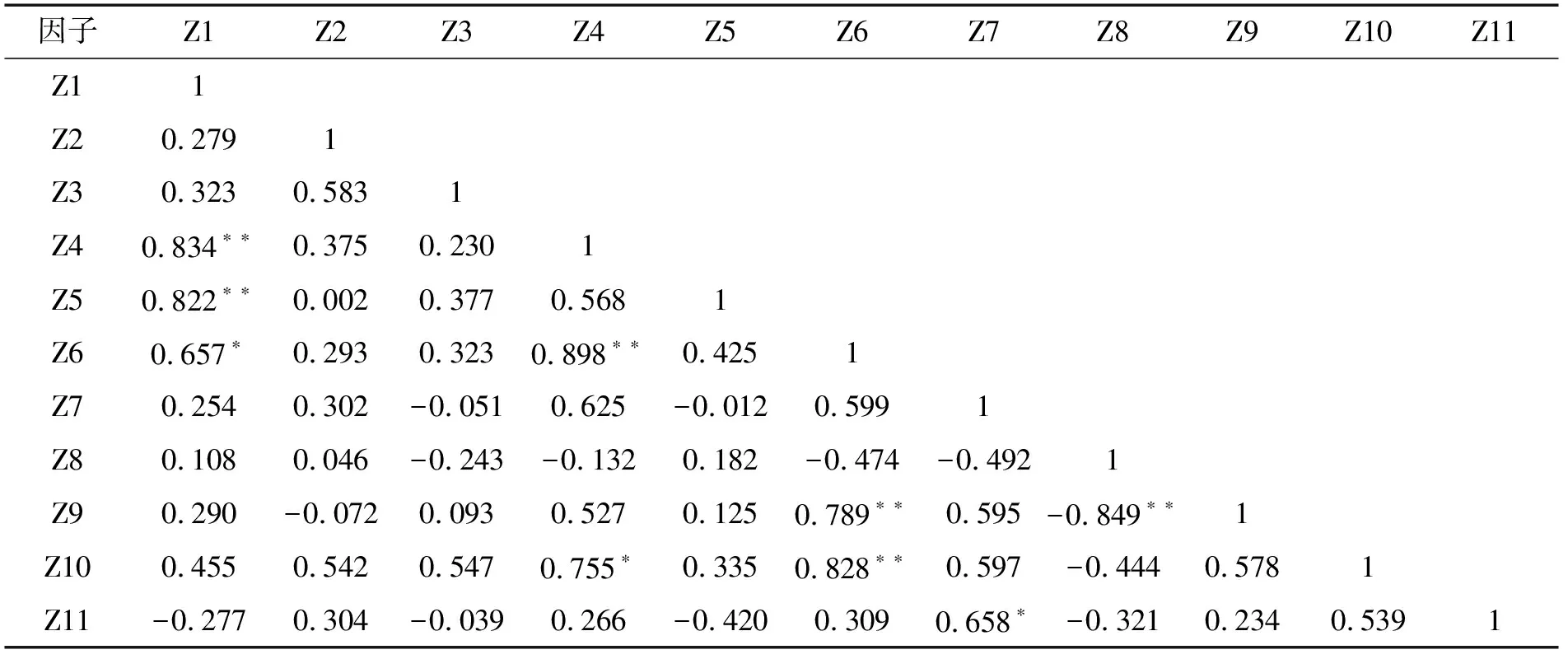
表2 土壤理化因子之间相关性Tab. 2 Correlation between soil physical and chemical factors
2.2 土壤微生物代谢活性
图2为小花异裂菊根际与非根际土壤微生物AWCD变化情况,由图可知:微生物平均颜色变化率(AWCD值)在0~1 d无明显变化,说明这时碳源被利用程度低;2~7 d开始急剧上升,表明微生物开始大量利用碳源;AWCD值在7 d后趋于稳定,微生物代谢活性基本稳定。5个采样点小花异裂菊根际土壤微生物对碳源的利用率均大于相应的非根际土壤微生物。高海拔采样点(XP和PY)的根际土壤微生物代谢活性相对较低。

图2 小花异裂菊根际与非根际土壤微生物AWCD变化情况Fig. 2 Average well color development (AWCD) between rhizosphere and non-rhizosphere soils of H. microcephala
2.3 土壤微生物功能多样性指数
由表3可知,采样点GJ、BS的根际与非根际土壤微生物在多样性指数、丰富度指数以及均匀度指数值基本相同,而采样点PY、XP的根际土壤微生物多样性指数、丰富度度指数以及均匀度指数值均大于非根际。

表3 小花异裂菊根际与非根际土壤微生物功能多样性指数Tab. 3 Diversity indices about soil microbial community of rhizosphere and non-rhizosphere of H. microcephala
2.4 土壤微生物利用碳源的类型
6类碳源的相对利用情况见图3。由图可知,小花异裂菊根际土壤微生物与非根际土壤微生物对糖类、羧酸类及氨基酸类碳源的相对利用率最高,对胺类碳源的相对利用率最低,其碳源相对利用率由大到小依次为:羧酸类、糖类、氨基酸类、聚合物类、代谢产物类、胺类。除BS之外,其他4个采样点小花异裂菊根际土壤微生物的6类碳源相对利用率均大于非根际土壤微生物。此外,5个采样点中,低海拔采样点(GJ和GY)对6类碳源利用能力较高,而高海拔采样地(XP)的利用能力较低。

图3 小花异裂菊根际与非根际土壤微生物对6类碳源的相对利用率Fig. 3 Relative utilization ratio in six groups of carbon sources by rhizosphere and non-rhizosphere microbial of H. mcrocephala
2.5 土壤微生物碳源利用多样性的主成分分析
小花异裂菊根际、非根际土壤碳源利用多样性的主成分分析如图4所示。第一和第二主成分分别解释变量方差的56.64%和13.69%,两者累积贡献率达70.33%,变异主要来源于第一和第二主成分,因此将前2个主成分得分作图来表征微生物群落碳源代谢特征。N-乙酰基-D葡萄胺(糖类碳源)与第一主成分相关性最强,呈正相关。苯乙基胺(胺类碳源)与第二主成分相关性最强,呈正相关。在第一主成分上,可将5个采样点根际、非根际利用碳源的能力分开,也可将高海拔和低海拔采样点区分开,表明糖类化合物是区分小花异裂菊根际和非根际碳源代谢差异的主要碳源。第二主成分上,5个采样点根际、非根际利用碳源的能力区别也较为明显。

A2:β-甲基-D葡萄糖苷;A3:D-半乳糖内酯;A4:L-精氨酸;B1:丙酮酸甲脂;B2:D-木糖;B3:D-半乳糖醛酸;B4:L-d冬酰胺酸e;C1:吐温40;C2:I-赤藻糖醇;C3:2-羟基苯甲酸;C4:L-苯基丙氨酸;D1:吐温80;D2:D-甘露醇;D3:4-羟基苯甲酸;D4:L-丝氨酸;E1:α-环式糊精;E2:N-乙酰基-D葡萄胺;E3:γ-羟基丁酸;E4:L-苏氨酸;F1:肝糖;F2:D-葡萄胺酸;F3:衣康酸;F4:甘氨酰-L-谷氨酸;G1:D-纤维二糖;G2:葡萄糖-1-磷酸盐;G3:α-丁酮酸;G4:苯乙基胺;H1:α-D-乳糖;H2:D,L-α-甘油;H3:D-苹果酸;H4:腐胺图4 小花异裂菊根际与非根际土壤微生物群落碳源利用主成分分析Fig. 4 Principal component analysis of carbon utilization for rhizosphere and non-rhizosphere of H. microcephala
2.6 土壤微生物碳源利用与土壤理化性质的冗余分析
不同采样点小花异裂菊根际与非根际土壤微生物碳源利用与土壤理化性质的冗余分析如图5所示。图5中,箭头的长度表示差异大小,土壤理化因子箭头越长,表示对碳源影响越大;实线箭头表示碳源,虚线箭头表示土壤理化因子,实线箭头和虚线箭头的夹角表示碳源与土壤理化因子的相关性,夹角小于90°表示正相关,大于90°表示负相关,夹角越小表明相关性越高,反之,则越低。在所测土壤理化因子中,全钾、交换性钙和交换性镁对土壤利用碳源模式的影响最大,其次是碱解氮、速效钾和交换性钠。速效钾、交换性钠、交换性镁、电导率以及pH与大多数碳源的夹角小于90°,呈正相关,而全磷、速效磷、交换性钙与碳源利用为负相关。
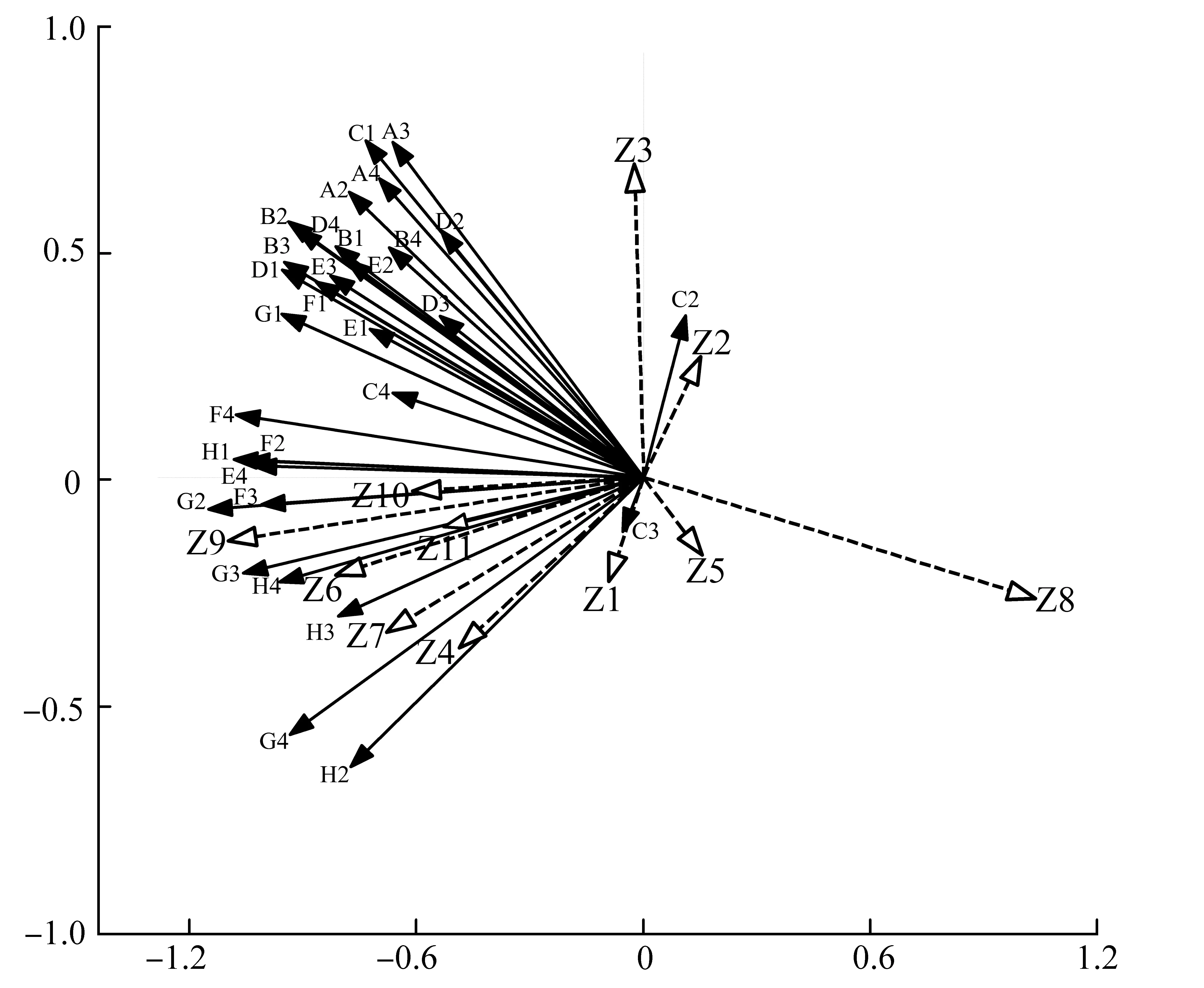
Z1:全氮;Z2:全磷;Z3:全钾;Z4:碱解氮;Z5:速效磷;Z6:速效钾;Z7:交换性钠;Z8:交换性钙;Z9:交换性镁;Z10:电导率;Z11:pH图5 小花异裂菊根际和非根际土壤理化因子与31种碳源的冗余分析Fig. 5 Rudundancy analysis of 31 sole-carbon sources and soil nutrients of rhizosphere and non-rhizosphere of H. microcephala
3 讨论
根际是植物—土壤—微生物与其环境条件相互作用最为活跃的场所,根际微生物可通过促进矿物矿化、催化土壤生物化学过程等方式,提高土壤中植物可利用形态营养元素的含量和植物对逆境的适应性。近年来,已有学者对根际微生物对石山适生或特有植物生态适性的影响进行了探讨,例如,王新洲等[13]研究表明白栎、园果化香等植物具有十分显著的根际效应。本文中,根际土壤的全氮、全磷、全钾、碱解氮、交换性钠以及交换性镁含量均大于相应的非根际土壤,表明根际富集了较多的营养成分,有利于促进小花异裂菊的生长发育以及提高其抵御环境胁迫的能力[14-15]。这与何滕兵等[16]的研究结果一致。
通过检测微生物碳源利用程度可有效反映土壤微生物群落多样性的动态变化。本文中,5个分布地小花异裂菊的根际微生物AWCD值均大于非根际土壤,其根际土壤微生物多样性指数、丰富度指数和均匀度指数总体上均高于非根际土壤,呈现出明显的根际聚集现象,可见根际微生物代谢能力增强有利于小花异裂菊对喀斯特石山逆境的适应能力。这与文献[12-13]的研究结果一致。
Biolog-ECO平板中的碳源分为6类:糖类、氨基酸类、羧酸类、胺类、聚合物类以及代谢产物类[17]。糖类是自然界较丰富且微生物较容易利用的碳源;氨基酸是土壤有机氮的重要组成部分;羧酸类能够酸化土壤环境,降低pH值;胺类大多具有碱性,能与酸结合成盐;聚合物类与代谢产物类是聚糖的重要构件分子或参与糖代谢的中间体[18]。在6类碳源中,小花异裂菊根际微生物对羧酸类与糖类的利用率最大,表明小花异裂菊根际微生物对于羧酸类和糖类最为敏感。这可能是由于小花异裂菊所在的喀斯特石山区土壤偏碱性,过高的pH值会抑制植物生长、降低土壤中微量元素以及土壤微生物活性,而根际分泌的羧酸类化合物(例如α-丁酮酸、2-羟基苯甲酸以及4-羟基苯甲酸等)携带的酸性基团对土壤具有明显的酸化作用[19],能够使根际pH有所降低。糖类具有吸水、亲水和保水的作用,对土壤团聚体的比例和结构具有重要影响[20]。小花异裂菊分布地的土层较薄,岩石裸露、土被发育不连续,水分渗透快,保水保肥能力差,糖类物质的增加有利于提高根际土壤保水保肥能力。与此同时,糖类、羧酸类化合物是植物根系分泌物的主要成分,也是微生物代谢利用最广的碳源,土壤微生物对糖类、羧酸类碳源利用的提高有利于土壤有效养分转化[21-22]。受这2类碳源数量增加的影响,小花异裂菊根际能够利用羧酸类和糖类碳源的微生物丰度也因此得到提高。这一结果与异裂菊属其他4个物种根际微生物碳源利用类型相[12]一致,表明羧酸类和糖类化合物可能是喀斯特石山中上部分布的植物根际广泛存在且能被微生物利用的主要碳源。主成分分析中,糖类碳源清楚地区分了小花异裂菊各个居群的根际与非根际土壤,也揭示了根际土壤中的糖类碳源分解代谢更高。
冗余分析结果显示,全钾、交换性钙是影响小花异裂菊碳源利用模式的重要因子,全钾含量与碳源利用呈正相关,交换性钙与碳源利用呈负相关。这可能是由于全钾是根际微生物生长活动的重要营养物质,而土壤钾元素主要来源于石灰岩的风化,小花异裂菊分布的石山中上部的岩石裸露严重、生物活性低,岩石风化以物理风化为主,致使矿化速率较慢以及土壤中钾含量较低,全钾因此成为根际土壤中微生物生长繁殖的限制因素[23]。喀斯特地区土壤中钙离子含量极为丰富,可达酸性土壤的3倍以上。高浓度的钙离子可干扰依赖钙离子的信号系统,造成以磷酸为基础的能量代谢紊乱,影响微骨架动力学等,导致微生物代谢功能紊乱或死亡[24-25]。
诸多研究表明,海拔高度会影响土壤微生物群落多样性和代谢活性,海拔越高,土壤微生物多样性越低[26]。本文研究结果表明,小花异裂菊高海拔分布地的条件相对更为恶劣,养分含量相对于低海拔地区更低。与此同时,小花异裂菊高海拔分布地的土壤微生物群落结构相似,微生物多样性和代谢活性较低,小花异裂菊根际分泌物对土壤微生物群落结构多样性和代谢活性的影响更为明显。由此可知,相对于低海拔地区,高海拔地区根际微生物在提高小花异裂菊抗逆性过程中起着更为重要的作用。
4 结论
本文采用土壤养分分析常规方法和Biolog-ECO微平板法,对小花异裂菊5个典型分布地的根际和非根际土壤养分和微生物代谢功能多样性进行研究,结果表明:
1)小花异裂菊根际土壤速效钾、全钾、pH显著高于非根际(P<0.05),根际土壤的全氮、全磷、碱解氮、交换性钠以及交换性镁等均高于非根际,但差异不显著(P>0.05);
2)小花异裂菊根际与非根际微生物平均颜色变化率均表现为根际大于非根际;
3)小花异裂菊根际与非根际土壤微生物的多样性指数、丰富度指数均高于相应的非根际,而根际土壤微生物均匀度指数与非根际相差不大;
4)小花异裂菊根际与非根际土壤微生物主要利用的碳源类型为糖类和羧酸类;
5)冗余分析显示,土壤养分因子对小花异裂菊根际微生物的碳源利用模式有明显影响,其中,影响较大的有全钾、交换性钙和交换性镁;全磷、速效磷、交换性钙对碳源利用影响为负相关。
