二甲双胍联合阿卡波糖治疗2型糖尿病的疗效及对免疫功能和NLRP3水平的影响
2023-01-18岳斌张巍徐丽郑华东李明
岳斌,张巍,徐丽,郑华东,李明
1.长庆油田职工医院内分泌科,陕西 西安 710018;
2.西安交通大学第二附属医院老年病科,陕西 西安 710004
2型糖尿病(type 2 diabetes,T2DM)是一种需长期反复治疗的终生性疾病,流行病学调查显示中国成人T2DM患病率高达11.6%,患病人数居全球首位[1]。目前,临床对于T2DM的治疗以饮食运动干预以及降糖药为主。二甲双胍主要用于肥胖或伴高胰岛素血症的T2DM患者或磺脲类治疗效果不佳者,可干扰肝葡萄糖的生成过程[2]。但单用二甲双胍具有局限性,有学者提出联用二甲双胍和阿卡波糖,并通过随机对照试验证实其疗效较好[3-4]。检索国内近5年内文献,对于二甲双胍联用阿卡波糖治疗T2DM的研究多集中于对血糖水平控制效果上,对其作用机制研究报道较为少见。而T2DM以胰岛素抵抗为主,发病后会存在自身免疫性胰岛炎或胰岛功能损伤,而血清C肽(C-peptide,CP)、谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)、胰岛细胞抗体(islet cell antibody,ICA)、胰岛素自身抗体(insulin autoantibody,IAA)水平检测被认为可反映T2DM患者的自身免疫损伤[5]。T2DM被认为是一种慢性炎症性疾病,NOD样受体家族pyrin域3(nod like receptor family pyrin domain containing 3,NLRP3)炎症小体是炎性体的一种,参与多种宿主免疫和炎性反应[6]。本研究旨在观察二甲双胍联合阿卡波糖治疗T2DM的疗效,并探讨其对患者免疫功能和炎性小体水平的影响。
1 资料与方法
1.1 一般资料回顾性分析2018年3月至2020年9月长庆油田职工医院诊治的163例T2DM患者的临床资料,根据患者治疗方案分组,其中81例给予二甲双胍治疗者纳入对照组,82例给予二甲双胍联合阿卡波糖治疗者纳入研究组。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经本院医学伦理委员会审核批准。
表1 两组患者的一般资料比较[±s,例(%)]Table1 Comparison of general data between thetwo groups[±s,n(%)]

表1 两组患者的一般资料比较[±s,例(%)]Table1 Comparison of general data between thetwo groups[±s,n(%)]
组别对照组研究组χ2/t值P值例数81 82男46(56.79)42(51.22)女35(43.21)40(48.78)0.509 0.476年龄(岁)55.16±5.94 55.38±6.42 0.227 0.821病程(年)5.62±1.83 5.75±1.96 0.438 0.662性别
1.2 病例选择
1.2.1 纳入标准(1)符合T2DM诊断标准[7],空腹血糖≥7.0 mmol/L,餐后2 h血糖≥11.1 mmol/L;予葡萄糖耐量试验(OGTT),服糖2 h后血糖≥11.1 mmol/L,或任意时间血糖≥11.1 mmol/L;(2)年龄>18岁;(3)既往未使用降糖药物治疗;(4)所有患者均签署知情同意书。
1.2.2 排除标准(1)合并严重慢性疾病、感染、恶性肿瘤、肠道吸收障碍等疾病者;(2)妊娠或哺乳期女性;(3)药物过敏者;(4)中途退出,无法继续研究者;(5)因出现高血糖综合征、低血糖反应等需调整治疗方案者;(6)合并其他可能影响患者糖脂代谢、氧化应激和炎症相关指标的疾病,如自身免疫疾病等。
1.3 治疗方法对照组患者给予盐酸二甲双胍缓释片[默克制药(江苏)有限公司,国药准字J20171052,规格0.5 g]治疗,0.5 g/次,2次/d,早、晚餐后口服。研究组患者给予二甲双胍+阿卡波糖治疗,二甲双胍用法用量同对照组,阿卡波糖(拜耳医药保健有限公司,国药准字H19990205,规格50 mg)治疗,50 mg/次,3次/d,随三餐口服。所有患者入院后均给予相同的饮食运动干预。两组患者均治疗3个月。
1.4 观察指标与评价方法(1)治疗效果:疗效评估方法见文献[7]。显效:治疗后患者症状显著改善,空腹血糖(FPG)水平降低至≤6.1mmol/L,餐后2 h血糖(2-hour post-meal blood glucose,2 hPG)降低至≤7.8 mmol/L;好转:治疗后患者症状有所改善,FPG水平降低至6.1~7.0 mmol/L,2 hPG降低至7.8~10 mmol/L;无效:治疗后血糖无明显变化或不变。总有效率即显效率+好转率。(2)糖脂代谢指标:治疗前、治疗3个月后检测两组患者的FPG、2 hPG、糖化血红蛋白[HbAlc,酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)],通过全自动生化分析仪测定总胆固醇(total cholesterol,TC)、高/低密度脂蛋白胆固醇(high/low density lipoprotein cholesterol,H/LDL-C)、甘 油 三 酯(triglyceride,TG)水平。(3)氧化应激:检测治疗前后两组患者的丙二醛(malondialdehyde,MDA,ELISA法)水平、超氧化物歧化酶(superoxide dismutase,SOD,黄嘌呤氧化酶法)水平,检测脂质过氧化氢(lipid hydroperoxide,LHP)、总抗氧化能力(total antioxidant capacity,T-AOC)水平。检测方法:测定前先将试剂和样本平衡至室温;在微孔下1/3处垂直、均匀的滴加试剂;然后37℃60 min条件下进行温育,多采用水浴加热;洗板5次;采用过氧化氢或四甲基联苯胺作用显色剂进行显色反应,显色时间37℃15~30 min;终止显色反应,于30 min内采用酶标仪完成比色测定;然后根据试剂盒要求设置计算参数,判定检测值。(4)NLRP3水平:采用Western法检测治疗前后血清NLRP3水平。(5)血清CP、GADA、ICA和IAA水平:于治疗前后检测两组患者的GADA、ICA和IAA阳性率,仪器为全自动化学发光免疫分析仪,放射免疫法检测空腹血清CP水平。(6)安全性:统计两组患者用药期间不良反应发生情况。
1.5 统计学方法应用SPSS20.0统计软件分析数据。计数资料比较采用χ2检验;计量资料符合正态分布,以均数±标准差(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的治疗效果比较研究组患者的治疗总有效率为93.90%,明显高于对照组的83.95%,差异有统计学意义(χ2=4.108,P=0.043<0.05),见表2。

表2 两组患者的治疗效果比较(例)Table2 Comparison of curativeeffect between thetwo groups(n)
2.2 两组患者治疗前后的糖脂代谢指标水平比较治疗前两组患者的糖脂代谢指标水平比较差异均无统计学意义(P>0.05);治疗后,两组患者的HDL-C水平明显高于治疗前,而FPG、2 hPG、HbAlc、TC、TG、LDL-C水平明显低于治疗前,且治疗后研究组患者的HDL-C水平明显高于对照组,其余糖脂代谢指标明显低于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的糖脂代谢指标水平比较(±s)Table 3 Comparison of thelevels of glucose-lipid metabolism indicatorsbetween thetwo groupsbeforeand after treatment(±s)
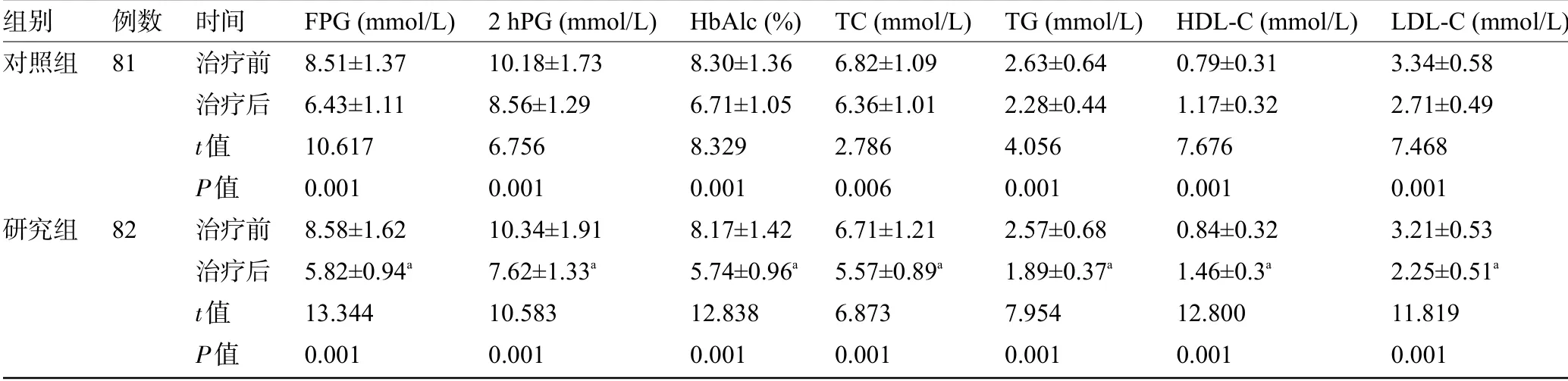
表3 两组患者治疗前后的糖脂代谢指标水平比较(±s)Table 3 Comparison of thelevels of glucose-lipid metabolism indicatorsbetween thetwo groupsbeforeand after treatment(±s)
注:与对照组治疗后比较,a P<0.05。Note:Compared with thecontrol group after treatment,a P<0.05.
组别对照组研究组例数81 82时间治疗前治疗后t值P值治疗前治疗后t值P值FPG(mmol/L)8.51±1.37 6.43±1.11 10.617 0.001 8.58±1.62 5.82±0.94a 13.344 0.001 2 hPG(mmol/L)10.18±1.73 8.56±1.29 6.756 0.001 10.34±1.91 7.62±1.33a 10.583 0.001 HbAlc(%)8.30±1.36 6.71±1.05 8.329 0.001 8.17±1.42 5.74±0.96a 12.838 0.001 TC(mmol/L)6.82±1.09 6.36±1.01 2.786 0.006 6.71±1.21 5.57±0.89a 6.873 0.001 TG(mmol/L)2.63±0.64 2.28±0.44 4.056 0.001 2.57±0.68 1.89±0.37a 7.954 0.001 HDL-C(mmol/L)0.79±0.31 1.17±0.32 7.676 0.001 0.84±0.32 1.46±0.3a 12.800 0.001 LDL-C(mmol/L)3.34±0.58 2.71±0.49 7.468 0.001 3.21±0.53 2.25±0.51a 11.819 0.001
2.3 两组患者治疗前后的氧化应激水平比较治疗前两组患者氧化应激水平比较差异均无统计学意义(P>0.05);治疗后,两组患者的SOD、T-AOC水平明显高于治疗前,而MDA、LHP水平明显低于治疗前,且治疗后研究组患者的SOD、T-AOC水平明显高于对照组,MDA、LHP水平明显低于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后的氧化应激水平比较(±s)Table4 Comparison of oxidativestresslevel between thetwo groupsbeforeand after treatment(±s)

表4 两组患者治疗前后的氧化应激水平比较(±s)Table4 Comparison of oxidativestresslevel between thetwo groupsbeforeand after treatment(±s)
注:与对照组治疗后比较,a P<0.05。Note:Compared with thecontrol group after treatment,a P<0.05.
组别对照组研究组例数81 82时间治疗前治疗后t值P值治疗前治疗后t值P值MDA(mmol/L)7.38±1.42 5.96±1.13 7.042<0.001 7.46±1.51 4.73±1.08a 13.316<0.001 SOD(U/L)74.86±8.25 83.95±8.72 6.815<0.001 74.59±8.13 93.26±9.54a 13.488<0.001 LHP(μmol/L)29.31±3.58 24.73±2.94 8.953 0.001 28.46±4.12 20.46±3.87a 12.738 0.001 T-AOC(U/mL)26.67±3.91 30.83±4.15 6.566 0.001 27.52±4.05 34.64±4.82a 10.241 0.001
2.4 两组患者治疗前后的NLRP3水平比较治疗前两组患者NLRP3水平比较差异无统计学意义(P>0.05);治疗后,两组患者的NLRP3水平明显低于治疗前,且治疗后研究组患者的NLRP3水平明显低于对照组,差异均有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后的NLRP3水平比较(±s,pg/mL)Table 5 Comparison of NLRP3 level between the two groups before and after treatment(±s,pg/mL)
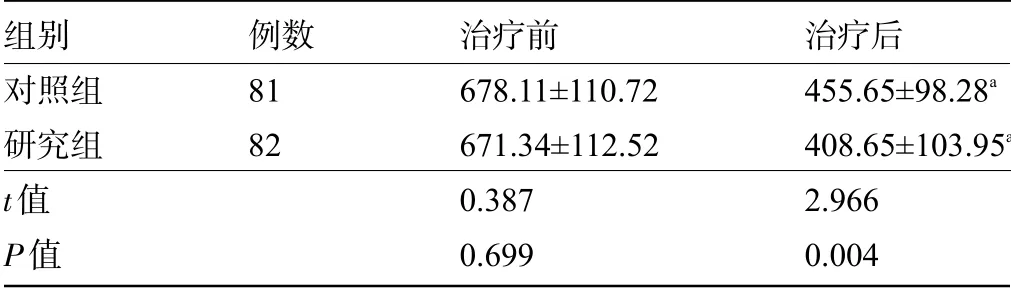
表5 两组患者治疗前后的NLRP3水平比较(±s,pg/mL)Table 5 Comparison of NLRP3 level between the two groups before and after treatment(±s,pg/mL)
注:与本组治疗前比较,a P<0.05。Note:Compared with thesame group beforetreatment,a P<0.05.
组别对照组研究组t值P值例数81 82治疗前678.11±110.72 671.34±112.52 0.387 0.699治疗后455.65±98.28a 408.65±103.95a 2.966 0.004
2.5 两组患者治疗前后的血清CP水平、GADA、ICA和IAA阳性率比较治疗前,两组患者的血清CP水平、GADA、ICA和IAA阳性率比较差异均无统计学意义(P>0.05);治疗后,两组患者的血清CP水平、GADA、ICA、IAA阳性率明显低于治疗前,且研究组患者的血清CP水平和GADA、ICA阳性率明显低于对照组,差异均有统计学意义(P<0.05);研究组患者的IAA阳性率为0,略低于对照组的3.70%,但差异无统计学意义(P>0.05),见表6。
表6 两组患者治疗前后的血清CP水平、GADA、ICA和IAA阳性率比较[±s,例(%)]Table6 Comparison of serum CPlevel,thepositiverates of GADA,ICA and IAA between the two groups before and after treatment[±s,n(%)]

表6 两组患者治疗前后的血清CP水平、GADA、ICA和IAA阳性率比较[±s,例(%)]Table6 Comparison of serum CPlevel,thepositiverates of GADA,ICA and IAA between the two groups before and after treatment[±s,n(%)]
注:与对照组治疗后比较,a P<0.05,b P>0.05。Note:Compared with thecontrol group after treatment,a P<0.05,b P>0.05.
组别对照组研究组82例数81时间治疗前治疗后t/χ2值P值治疗前治疗后t/χ2值P值CP(ng/mL)0.36±0.10 0.25±0.09 7.359 0.001 0.34±0.11 0.18±0.07a 11.112 0.001 GADA阳性率17(20.99)11(13.58)1.554 0.212 18(21.95)3(3.66)a 12.288 0.001 ICA阳性率10(12.35)7(8.64)0.592 0.442 12(14.63)1(1.22)a 10.109 0.001 IAA阳性率7(8.64)3(3.70)1.705 0.192 9(10.98)0(0)b 9.523 0.006
2.6 两组患者的不良反应比较治疗期间,两组患者均无发热、皮疹等过敏反应发生,对照组患者出现恶心呕吐3例,低血糖1例,不良反应发生率为4.94%(4/81);研究组患者出现恶性呕吐1例,低血糖1例,不良反应发生率为2.44%(2/82)。两组患者不良反应发生率比较差异无统计学意义(连续性校正χ2=0.218,P=0.641>0.05)。
3 讨论
T2DM是一种常见的慢性内分泌疾病,患病人群以中老年居多。据统计,近20多年来,经济状况的改善使疾病谱发生了重大变化,T2DM发病率逐年上升,且发病年龄也日渐年轻化[8],现已成为我国重要的社会健康问题。目前,全球T2DM控制策略的主要目标是维持长期稳定的血糖水平、减少T2DM引起的并发症和死亡。现已有多项研究表明二甲双胍、阿卡波糖均可调控T2DM患者血糖水平,且后者具有较好的减重作用[9-10]。
二甲双胍调控血糖的机制主要是通过肝脏降低肝糖输出、增加葡萄糖利用率,减轻胰岛素抵抗,降低机体游离脂肪酸水平[11]。早在二十世纪九十年代英国DM前瞻性研究就发现了二甲双胍可改善胰岛素代谢综合征,同时美国DM预防研究也报道了二甲双胍具有预防DM的潜在作用。阿卡波糖作为一种口服降糖药,可有效抑制从食物中摄取的多糖、寡糖、双糖等营养成分的分解,减少小肠吸收,以达到降低2 hPG的作用[12]。席晓宇等[13]研究发现二甲双胍联合阿卡波糖治疗T2DM的疗效显著优于单用二甲双胍。本研究将单药治疗与两者联合进行比较分析,也有此结论。分析其原因,二甲双胍和阿卡波糖分别通过不同的作用机制实现调节糖脂代谢的目的。二甲双胍通过调节线粒体膜,可有效改善胰岛素抵抗状态,此外,还有研究表明二甲双胍在体外、体内均可激活AMP激酶,从而调节血糖;二甲双胍通过利用基础脂肪分解、增加葡萄糖转运等方式,可加快脂肪前体细胞分解代谢的速度[14]。阿卡波糖不仅可抑制α-糖苷酶活性还可影响肠道激素分泌、改变肠道菌群,达到改变代谢产物、调节血糖血脂的效果。二甲双胍与阿卡波糖联用具有“1+1>2”的效果,可提高对血糖血脂的调控水平。氧化应激也被认为是导致T2DM发生的因素,可损伤胰岛细胞,若患者持续维持高血糖状态,则活性氧簇随之增加,最终加重氧化应激状态。MDA、SOD、和LHP均是氧化代谢产物,敏感性高,可反映机体氧化应激程度。本研究显示,二甲双胍联合阿卡波糖可改善氧化应激状态,控制T2DM患者病情进展。
伴随着T2DM的发生,胰岛β细胞随之受到损伤[15],而血清自身抗体阳性可早于临床症状的出现,血清CP、GADA、ICA和IAA作为反映机体自身免疫损伤的重要标志物,检测其指标水平变化可辅助评估治疗效果。本研究提示二甲双胍联合阿卡波糖在改善机体免疫损伤、促进胰岛β细胞功能恢复方面也具有积极作用,这也是本研究的创新之处。通过检索文献,笔者认为原因可能是阿卡波糖通过延缓糖类在小肠内的吸收,降低餐后血氧,可避免高血糖对胰岛素分泌的刺激,有利于胰岛素敏感性的恢复[16];同时联用二甲双胍对血糖的良好控制也有利于减轻免疫损伤。早在2005年就已经有学者提出T2DM发病的炎症学说,炎症可通过多种途径影响胰岛β细胞结构和功能障碍,目前已有文献报道主要从肿瘤坏死因子、白细胞介素等常规炎症因子探索阿卡波糖对T2DM患者炎症反应的影响[17],对炎症小体水平的研究较少。NLRP3炎症小体是一种重要的宿主介质,可促进多种炎症因子的成熟和分泌。本研究结果提示阿卡波糖联合二甲双胍可降低炎症小体水平,减轻机体炎症反应。分析其原因,阿卡波糖可为肠道益生菌的生长、繁殖,提供高水平的碳水化合物环境,进而促进机体对内毒素、炎症小体等的降解,从而减轻机体炎症反应。在安全性方面,本研究显示阿卡波糖联合二甲双胍的用药安全性较好。
综上所述,阿卡波糖联合二甲双胍治疗T2DM的效果优于单药治疗,其机制考虑与机体氧化应激、免疫功能、炎症小体和糖脂代谢水平的改善有关,可为临床治疗T2DM提供一定的理论依据。但本研究仍存在不足之处,如随访时间短,未研究远期效果,同时因T2DM需长期治疗,本研究尚未考虑到药物的经济成本,故仍待进一步探索。
