醋酸铅诱导心肌细胞凋亡的机制研究
2023-01-18张蓝心李欣杨丹邓杨李登位
张蓝心,李欣,杨丹,邓杨,李登位
1.南充市第四人民医院检验科,四川 南充 637000;
2.南充市中心医院检验科,四川 南充 637000
铅暴露是全世界最重要的公共卫生问题之一。由于具有优异性能的含铅材料应用于如光伏、化工、日化和医疗等多个领域,使得人类持续暴露于含铅的环境中[1-3]。重要的是,铅可通过呼吸道、皮肤和胃肠道进入人体,经血液循环到达全身各组织器官,从而对重要脏器造成损伤[4]。而心脏作为人体最重要的器官之一,其主要组成单位心肌细胞仅具有极其有限的再生能力,一旦遭受损伤有可能导致心肌永久性缺失,从而影响心脏功能[5]。因此探讨铅诱导的心肌损伤具有重要意义。
据报道,当铅蓄积在心肌组织时,主要通过诱导大量心肌细胞凋亡,从而影响心脏功能[6]。众所周知,凋亡是最重要也是最常见的细胞死亡形式之一,主要存在三大基本途径:线粒体途径、内质网途径和死亡受体途径,其中线粒体途径和内质网途径称为内源性途径,而死亡受体途径被称为外源性途径。目前,研究已经表明铅中毒将诱发过度氧化应激,从而导致线粒体损伤,最终引起细胞凋亡的发生[7]。有趣的是,过度氧化应激产生的大量活性氧(reactive oxygen species,ROS)以及能量代谢危机所致的钙失衡可能诱发内质网应激,而内质网应激将进一步加重氧化应激的发生和钙调节紊乱,最终促使细胞走向凋亡[8]。然而,目前罕有研究去探索铅暴露是否可通过诱发心肌细胞内质网应激从而诱导细胞凋亡,这使得研究者们难以从诱导凋亡的内源性途径整体上去理解铅暴露诱导细胞凋亡的机制。因此,本研究将围绕凋亡的内源性途径探讨铅诱导心肌细胞凋亡的具体机制,深入理解铅暴露所致心肌损伤的病理过程。
1 材料与方法
1.1 材料AC16人心肌细胞来源于ATCC。Cell Counting Kit-8(CCK-8)、活性氧荧光探针(DCFH-DA)购自日本同仁化学研究所;胰酶细胞消化液(0.25%胰酶)、RIPA细胞快速裂解液、BCA试剂盒、乳酸脱氢酶(LDH)细胞毒性检测试剂盒、线粒体膜电位检测试剂盒(JC-1)、Calpain 1单克隆抗体、Caspase 3多克隆抗体、β-actin单克隆抗体、HRP酶标抗兔二抗购自上海碧云天生物技术有限公司;DMEM、胎牛血清购自美国Thermofisher;Bip单克隆抗体、Cleaved-PARP单克隆抗体购自美国CST(Cell Signaling Technology);醋酸铅购自于北京伊诺凯科技有限公司。酶标仪、细胞培养箱购自美国Thermofisher;低温高速离心机购自德国Eppendorf;曝光机购自美国Azure Biosystems;电泳仪购自美国BIO-RAD。
1.2 方法
1.2.1 细胞培养AC16细胞复苏后,使用含10%胎牛血清(FBS)的DMEM培养基,置于37℃、5%CO2培养箱中培养,待细胞融合度达到80%~90%时,按照1∶(3~4)的比例传代3次后进行实验,所有细胞均随机分为正常对照组和不同浓度的醋酸铅组。
1.2.2 CCK-8细胞活性检测制备AC16细胞悬液,细胞密度为7×103个/孔,100μL/孔接种到96孔板,放置CO2培养箱中培养24 h后分别设正常对照组和不同浓度醋酸铅组(浓度分别为:3.125μg/mL、6.25μg/mL、12.5μg/mL、25μg/mL、50μg/mL、100μg/mL、200μg/mL),于5%CO2、37℃培养箱中分别培养24 h。然后每孔加入CCK-8液10μL,继续培养1.5 h后取出,用酶标仪(450 nm)检测各组细胞的吸光值(OD值)。
1.2.3 LDH释放检测制备AC16细胞悬液,细胞密度为7×103个/孔,100μL/孔接种到96孔板,放置CO2培养箱中培养24 h后分别设正常对照组和不同浓度醋酸铅组(浓度同上),于5%CO2、37℃培养箱中分别培养24 h。然后将细胞培养板用多孔板离心机400×g离心5 min。分别取各孔的上清液120μL,加入到一新的96孔板相应孔中,随即按照说明书进行样品测定。
1.2.4 细胞内ROS水平检测检测经过不同浓度(50μg/mL、100μg/mL)醋酸铅处理的AC16细胞产生的ROS水平。按2×105个/孔在普通小皿中接种AC16细胞,于5%CO2、37℃培养箱中分别培养24 h后,将醋酸铅与细胞进行共孵育,同时设置正常对照组,待再次培养6 h后,用染核试剂和ROS荧光探针对细胞进行探针装载。然后在荧光显微镜下观察细胞内ROS产生情况。
1.2.5 线粒体膜电位检测检测经过不同浓度(50μg/mL、100μg/mL)醋酸铅处理的AC16细胞线粒体膜电位变化。按2×105个/孔在普通小皿中接种AC16细胞,于5%CO2、37℃培养箱中分别培养24 h后,将醋酸铅与细胞进行共孵育,同时设置正常对照组,待再次培养6 h后,按照说明书用线粒体膜电位荧光探针JC-1处理细胞。然后在荧光显微镜下观察细胞线粒体膜电位变化情况。
1.2.6 Western Blot检测经过不同浓度(50μg/mL、100μg/mL)醋酸铅处理的AC16细胞内质网应激和凋亡相关蛋白表达的改变。按8×105个/孔在普通大皿中接种AC16细胞,于5%CO2、37℃培养箱中分别培养24 h后,将醋酸铅与细胞进行共孵育,同时设置正常对照组,待再次培养12 h后移除培养液,用冰PBS洗一遍,加入适量RIPA裂解液,置于摇床冰上,裂解15 min,用细胞刮充分刮数下,收集蛋白至EP管,采用BCA法进行的蛋白定量。各组样本取相同适量蛋白进行SDS-PAGE电泳(初始电压为80 V,待蛋白条带入分离胶,调整电压至120 V),预先将PDVF膜泡在甲醇液中30~60 s,待电泳结束,将其转印至PVDF膜,赶走膜和胶之间的气泡,放入转膜槽(90 V,90 min),1×TBST稀释的5%脱脂牛奶,摇床上常温封闭1.5 h。将一抗和膜置于孵育盒中共同孵育(一抗稀释液配制所有的一抗,浓度为1∶1 000),4℃摇床过夜。回收一抗,1×TBST洗膜3次,15 min/次。二抗用1×TBST稀释的5%脱脂牛奶溶解,与膜在摇床上常温孵育1.5 h。1×TBST洗膜3次,15 min/次,随即进行显色及曝光。采用ImageJ对Western blot条带进行量化,将归一化后目标蛋白灰度值与内参β-actin灰度值之间比值视为目标蛋白相对表达量。
1.3 统计学方法应用SPSS20.0软件处理数据。计量资料符合正态分布,以均数±标准差(±s)表示,多样本比较采用单因素方差分析(one-way ANOVA test),组间多重比较采用最小显著性差异法(LSD法)检验;组内两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞毒性作用检测醋酸铅对细胞存活率和LDH释放以明确醋酸铅对AC16的细胞毒性。如图1所示,当≥25μg/mL醋酸铅处理24 h后,细胞存活率较正常对照组明显下降且具有浓度依赖性,差异具有统计学意义(P<0.05)。同时随着醋酸铅的浓度增高,培养液中LDH的浓度成梯度增加,差异具有统计学意义(P<0.05)。

图1 不同浓度醋酸铅处理后,AC16心肌细胞存活率和LDH释放情况Figure 1 The viability and LDH release of AC16 cardiomyocytes after treatment with different concentrationsof lead acetate
2.2 ROS蓄积和线粒体损伤基于上述结果,选择适当暴露浓度(50μg/mL、100μg/mL)进一步验证醋酸铅经线粒体途径诱发细胞凋亡。通过荧光探针标记ROS以及反应线粒体膜电位变化,结果发现醋酸铅处理后,心肌细胞胞内ROS水平相较于正常对照明显升高,从而造成线粒体损伤、膜电位下降,引起能量衰竭,进而使得ROS水平进一步上升(图2)。

图2 不同浓度醋酸铅处理后AC16细胞内ROS水平和线粒体膜电位的变化Figure2 Changesof ROSlevels and mitochondrial membranepotential in AC16 cellstreated with different concentrationsof lead acetate
2.3 内质网应激为进一步理解醋酸铅所致AC16心肌细胞的损伤机制,通过Western blotting检测内质网应激和凋亡的关键蛋白。结果显示,相较于正常对照组,内质网应激的感受器蛋白Bip和通路关键蛋白Calpain 1表达均明显上升,差异有统计学意义(P<0.05)。同时发现醋酸铅处理后AC16的凋亡相关蛋白Cleaved-caspase3和Cleaved-PARP较正常对照组表达均明显增加,差异有统计学意义(P<0.05),见图3~图5。
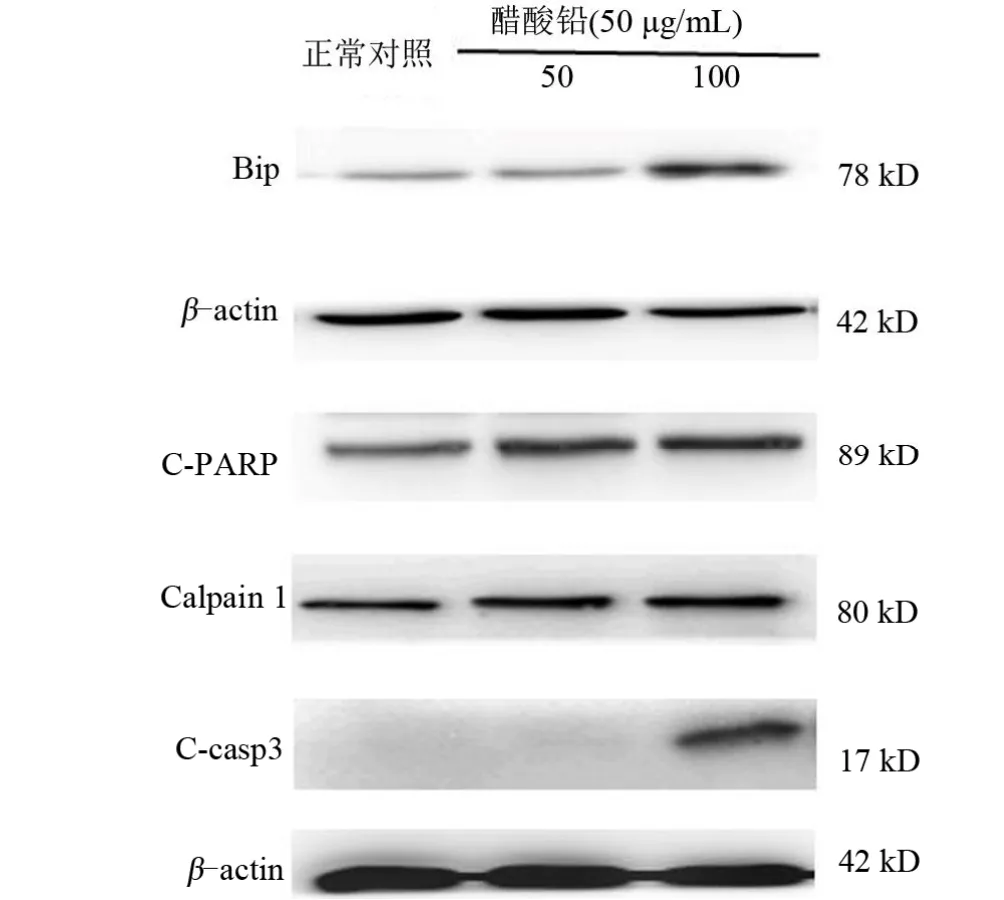
图3 Western blotting检测醋酸铅处理后AC16细胞内质网应激相关蛋白Calpain 1和Bip蛋白和凋亡相关蛋白Cleaved-caspase3、Cleaved-PARP的表达Figure 3 Western blotting was used to detect the expressions of endoplasmic reticulum stress-related proteins Calpain 1 and Bip proteins and apoptosis-related proteins Cleaved-caspase3 and Cleaved-PARP in AC16 cells after lead acetatetreatment

图4 不同浓度醋酸铅处理后AC16细胞内质网应激相关蛋白Bip和Calpain 1蛋白的相对表达量Figure 4 The relative expression of endoplasmic reticulum stress-related proteins Bip and Calpain 1 in AC16 cells treated with different concentrationsof lead acetate

图5 不同浓度醋酸铅处理后AC16细胞凋亡相关蛋白Cleaved-PARP和Cleaved-caspase3的相对表达量Figure 5 The relative expression of apoptosis-related proteins Cleaved-PARP and Cleaved-caspase3 in AC16 cells treated with different concentrationsof lead acetate
3 讨论
铅是广泛存在的工业污染物,进入人体后经血液循环蓄积在全身各组织器官,通过干扰细胞的各种生理、生化过程,造成多组织器官损伤,尤其是铅中毒诱导的心肌损伤受到广泛关注。研究表明,铅暴露对心脏组织产生毒性作用,可导致心脏功能受损[9]。随后的研究也发现铅暴露与心脏组织损伤程度、血清LDH活性水平和肌酸激酶同工酶浓度相关,表明铅暴露会导致心脏毒性[10]。近年临床研究也揭示了血铅水平与左心室每博输出量和射血分数呈负相关[11]。同时,前瞻性研究发现左心室的收缩能力随着铅暴露而下降[12]。这些不利影响最终可能导致心力衰竭,严重威胁人类生命安全。因此铅暴露所引起的心脏疾病的防治是迫切需要解决的问题,那么探索铅暴露所致心肌损伤的机制可能为铅中毒的防治提供新的思路。
为此,本研究选用人源心肌细胞AC16建立体外研究模型,首先通过经典的CCK-8实验和乳酸脱氢酶的释放明确铅化合物的心肌细胞毒性。研究发现铅暴露会显著降低细胞的存活率,同时设置不同暴露浓度,明确了醋酸铅致心肌细胞毒性的量-效关系。这将为铅暴露的防治提供重要的基础数据,也为下一步机制探索提供依据。
基于上述结果,本研究选择合适的铅暴露浓度探索毒性损伤机制。目前普遍认为铅具有诱发氧化应激的能力,近年来的研究也揭示氧化应激在铅中毒的病理过程中的作用[13-15]。因此,通过检测ROS水平的变化,揭示了铅暴露后AC16细胞内ROS水平明显升高,提示铅可诱导氧化应激的发生。同时由于铅对巯基(-SH)具有高的亲和力,与-SH形成硫醇盐,抑制氧化还原体系中酶的活性,进一步破坏氧化还原的调节能力[16]。这一过程也将加剧氧化应激的程度,从而严重影响细胞的生理活动,还使得细胞各种成分受到破坏。本次研究也发现,铅暴露后细胞内线粒体膜电位明显下降,提示ROS水平持续升高使得线粒体受到损伤。当线粒体膜完整性受到损害时,细胞色素C释放到胞质中,从而诱发细胞凋亡[17]。
为了明确细胞凋亡的发生,检测了凋亡相关蛋白的表达改变。研究发现铅暴露诱导AC16心肌细胞凋亡蛋白Cleaved-caspase3和Cleaved-PARP表达明显增加,证明了铅诱导心肌细胞凋亡的发生。但是,凋亡的内源性途径主要有两条,分别为线粒体途径和内质网途径。当细胞受到刺激时,不仅引起氧化应激和线粒体损伤,还使得内质网稳态发生变化,导致内质网腔中积累未折叠或错误折叠的蛋白质,称为内质网应激,这会激活未折叠蛋白质反应(UPR),从而影响细胞的存活[18]。然而目前鲜有研究探索铅暴露是否会影响内质网稳态从而诱发内质网应激。为此,继续深入分析内质网应激感受器蛋白的表达,发现Bip蛋白明显升高,提示内质网应激发生。重要的是,研究还发现钙调蛋白Calpain1表达增加,这不仅证明内质网稳态失衡,还提示Ca2+从内质网中释放到胞质中。而Ca2+被线粒体吸收,通过不同的机制进一步促进线粒体产生ROS和细胞色素C的释放,进而诱导氧化应激并损害线粒体功能,最终导致细胞死亡[19]。因此,本次研究发现线粒体途径和内质网途径在铅暴露诱导心肌细胞凋亡中具有重要协同作用,不仅加深对毒性损伤机制的理解,有助于为疾病的防治提供基础理论。
综上,本研究通过体外模型明确了铅暴露会造成心肌细胞损伤。同时首次初步阐明铅诱发心肌细胞内质网应激,揭示其与氧化应激和线粒体损伤在铅暴露所致心肌细胞凋亡的协同效应。这为全面理解铅所致毒性损伤机制提供新的依据,有助于拓展该疾病的治疗策略。然而,本次研究仍然存在一些不足之处,一方面是对机制的探索有待进一步深入,另一方面是未通过体内模型进行研究。为此,接下来的工作将建立体内模型,深入挖掘铅暴露损伤机制和特点,力争为铅暴露所致心血管疾病的防治提供新思路。
