三种属(Seriola)鱼类表型特征比较分析*
2023-01-17王开杰徐永江崔爱君柳学周
王开杰 徐永江 崔爱君 姜 燕 王 滨 柳学周
王开杰 徐永江①崔爱君 姜 燕 王 滨 柳学周
(中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室深蓝渔业工程联合实验室 山东青岛 266071)


传统分类方法通过形态特征的可数及可量性状比较, 分析方法单一, 有局限性, 且测量的形态位点较少。多变量形态度量学方法则是基于框架位点引入多元统计的一种分析方法, 可对鱼类体形外貌的连续性数量特征差异进行分析(杨天燕等, 2018), 在描述亲缘关系较近的鱼类形态变异及识别物种方面十分有效。侯吉伦等(2016)通过多元统计方法分析了中国沿海6个地理群体的花鲈()形态特征; 陈杰等(2014)用3种多元统计方法分析了我国鳊鲂属(and)鱼类群体的形态差异。
1 材料与方法
1.1 实验材料

1.2 表型性状度量

对其8个可数性状进行度量和计数, 包括胸鳍鳍条数、臀鳍鳍条数、尾鳍鳍条数、背鳍鳍条数、腹鳍鳍条数、第一鳃弓数、鳃耙数和脊椎骨数。
1.3 统计分析

γ=P+ΣγP;d=P2;d= 2r×P×P, (1)
式中,γ为相关系数;P为通径系数;d为单个自变量对体重的决定系数;d为两个自变量共同对体重的决定系数。
1.3.2 主成分分析 使用SPSS 23.0软件进行主成分分析(马爱军等, 2008), 输出其特征根向量、方差贡献率和累计方差贡献率, 然后再用Origin.2021软件输出主成分的散点图。
1.3.3 判别分析 使用SPSS 23.0软件首先对13个表型性状比值的均值进行均等性检验, 采用Wilks’Lambda逐步判别法筛选变量, 随后筛选贡献大的变量进行判别函数构建。并参照李思发等(2005)的方法计算各判别函数的判别正确率。


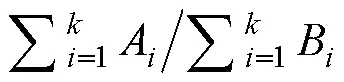


2 结果
2.1 3种鱼的外部特征描述及形态度量框架图的构建

图1 3种鱼表型形态鉴别示意图
注: 图中相同字母(A、B、C、D)表示形态差异辨识位点。A. 上颌骨后部拐角; B. 眼后到鳃盖的距离; C. 胸鳍与黄带位置关系; D. 尾叉开角程度

表1 3种鱼外部形态差异辨识位点
2.2 3种鱼表型性状对体重影响的通径分析

表2 3种属鱼类可数性状统计
注: 表中鳍数的描述是鱼类特定的鳍式表达模式, 如: I, VI, I –31~35表示有两个背鳍, 第一背鳍有5根硬棘刺, 第二背鳍有1根硬棘刺和31~35根软条。表格中上标不同小写字母表示差异显著(<0.05)

表3 3种鱼形态度量性状比
注: 表格每行中不同小写字母表示差异显著(<0.05)
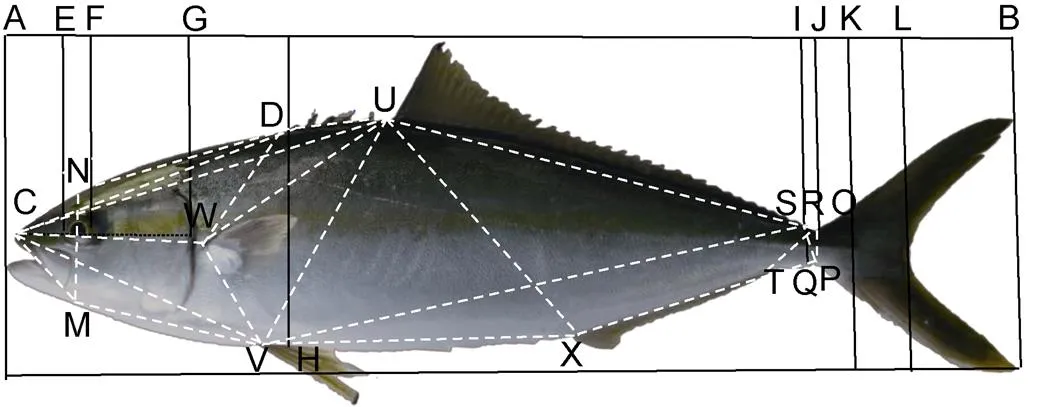
图2 黄条形态度量结构框架图
注: 可量性状: AB: 全长(TL); AL: 叉长(FL); AK: 体长(SL); DH: 体高(BH); AG: 头长(HL); FG: 眼后头长(POL); EF: 眼径(ED); IJ: 尾柄长(PL); RQ: 尾柄高(PD)。12个位点: C: 吻端起点; N: 过眼睛中点垂直线与背部边缘交叉点; M: 过眼睛中点垂直线与腹部边缘交叉点; D: 第1背鳍起点; W: 胸鳍起点; V: 腹鳍起点; U: 第2背鳍起点; X: 臀鳍起点; S: 第2背鳍终点; T: 臀鳍终点; O: 尾鳍背部起点; P: 尾鳍腹部起点。下同
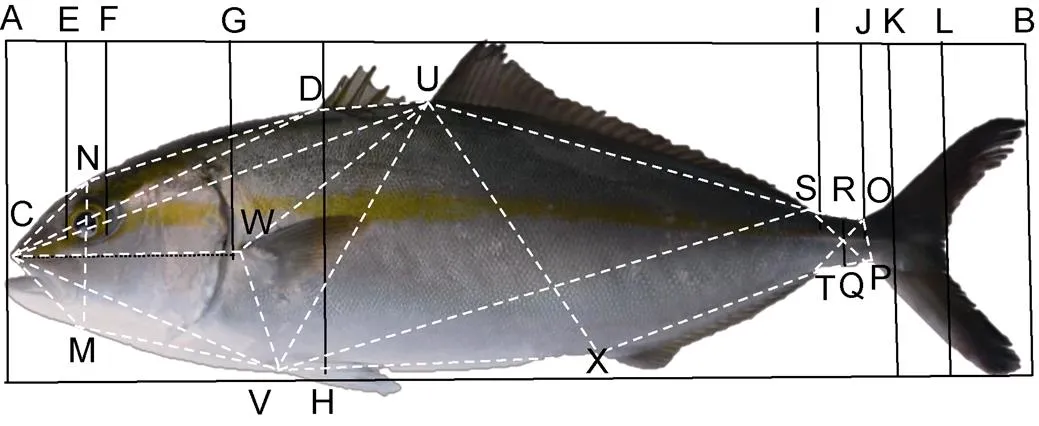
图3 高体形态度量结构框架图
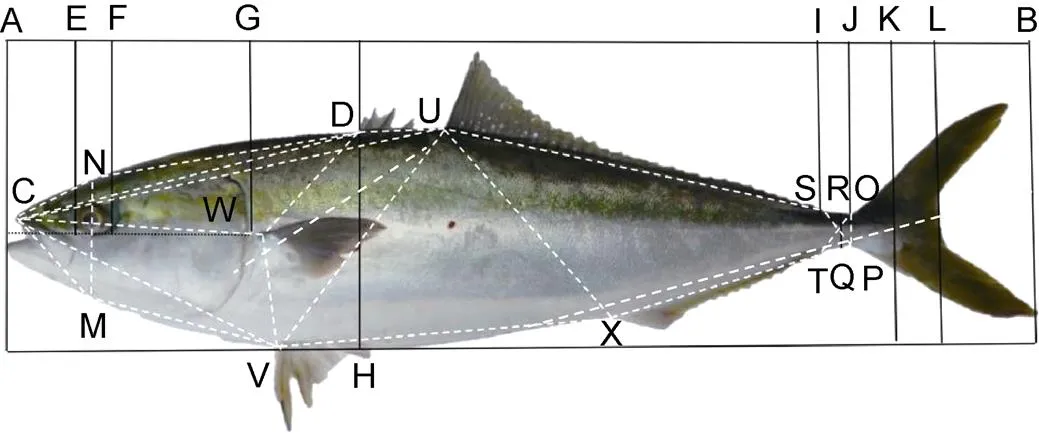
图4 五条形态度量结构框架图

表4 3种鱼表型性状统计

表5 黄条各表型性状间相关性分析
注: *表示差异显著(<0.05), **表示差异极显著(<0.01)。下同

表6 高体各表型性状间相关性分析

续表

表7 五条各表型性状间相关性分析

表8 黄条表型性状对体重影响的通径分析
注: 表格中“—”表示无。下同
=–8 732.725+121.8371+227.8472+208.4607
+379.0318(2=0.966), (5)
=–2 354.733+36.2481+50.7182+151.0783
+94.4264+91.6805(2=0.852), (6)

表9 高体表型性状对体重影响的通径分析

表10 五条表型性状对体重影响的通径分析
=–14 159.820+500.6252+569.8744
+77.2366(2=0.895), (7)
式(5)、(6)、(7)中,为体质量(BW),1~8分别为体长(SL)、体高(BH)、眼间距(ID)、下颌长(LJL)、眼后头长(POL)、全长(TL)、尾柄长(PL)、尾柄高(PD)。
2.3 3种鱼表型性状的多元统计分析
=4 073.0301+126.2782+922.1013+30.3594
+4.3095+457.8686+89.5557–5628.780, (8)

表11 3种鱼表型性状指标的特征值与方差贡献率

表12 主成分载荷矩阵
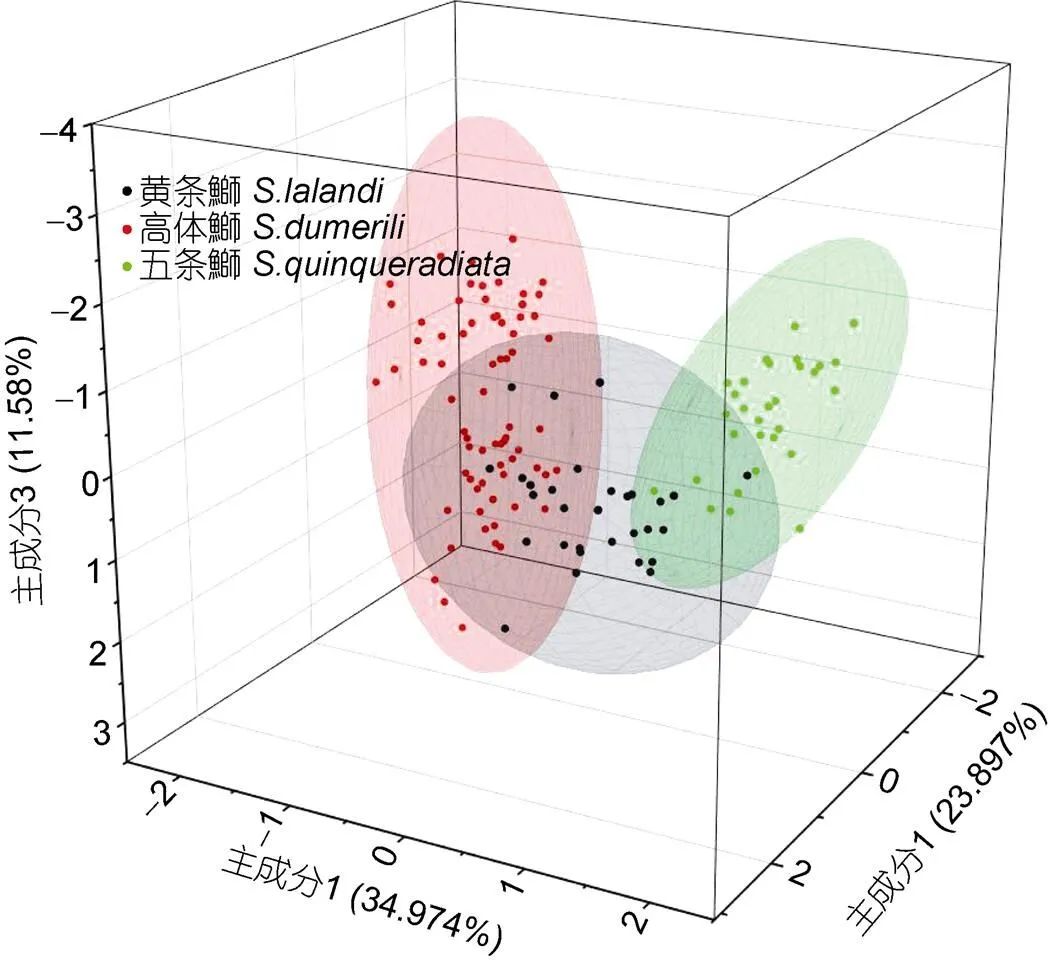
图5 3种鱼主成分1、2和3的得分图
=3894.7411+103.8472+865.6203+17.9104
+3.3365+443.6526+81.3787–4928.930, (9)
=3 865.7191+107.1742+814.7123+40.8774
+7.8255+410.9106+86.2667–4 967.871, (10)
式中,1~7分别对应TL/SL、SL/BH、SL/HL、HL/ED、SL/PD、HL/ID、SL/UJL。
3 讨论
3.1 3种鱼的形态度量特征比较分析


表13 基于7个贡献显著的比率变量判别函数对3个鱼群体判别分析结果
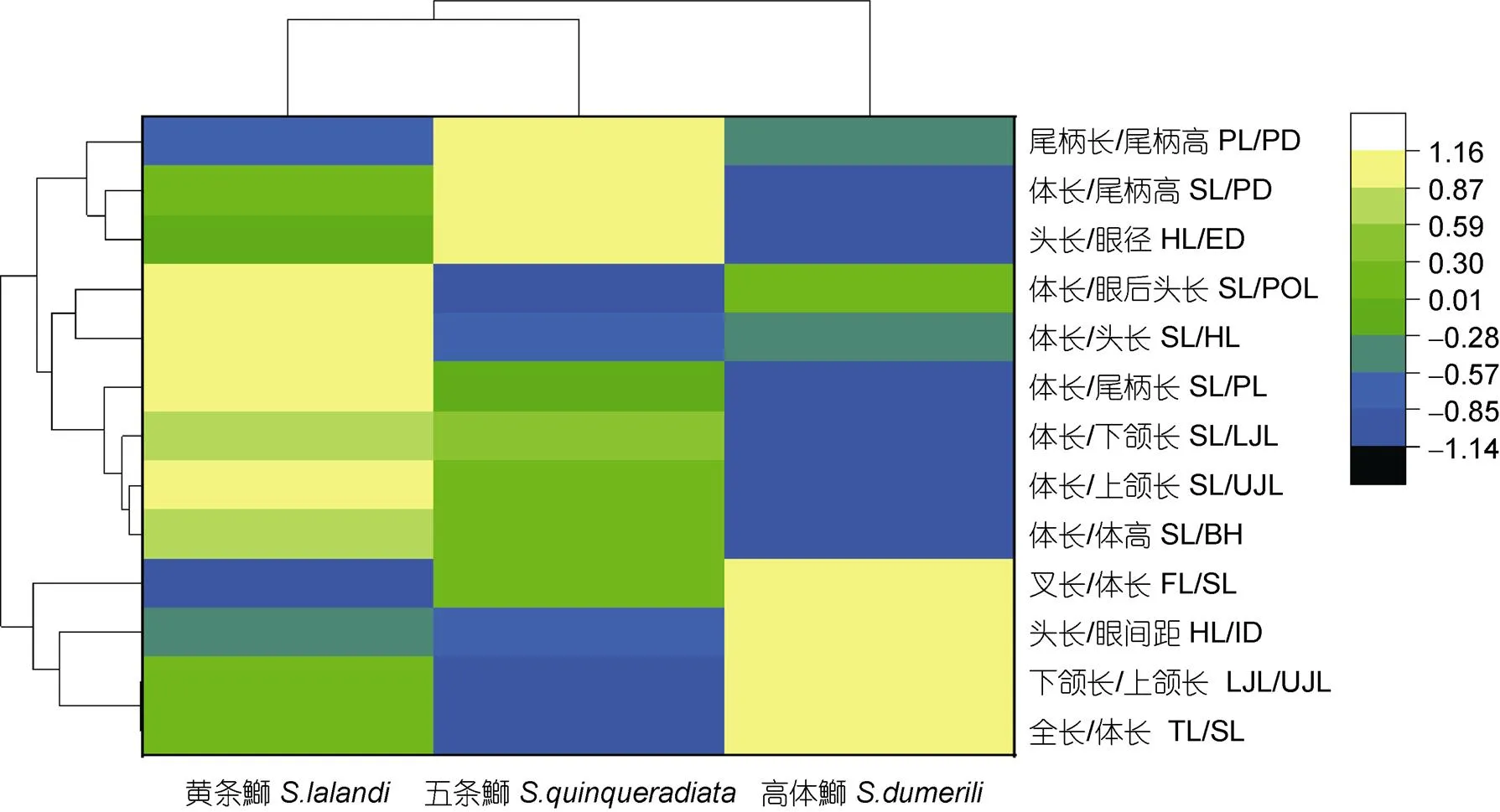
图6 基于13个表型性状比值的3种鱼群体的聚类热图
3.2 通径分析

3.3 多元统计分析比较

4 结论

马爱军, 王新安, 雷霁霖, 2008. 大菱鲆()四个不同地理群体数量形态特征比较[J]. 海洋与湖沼, 39(1): 24-29.


王新安, 马爱军, 许可, 等, 2008a. 大菱鲆幼鱼表型形态性状与体重之间的关系[J]. 动物学报, 54(3): 540-545.
王新安, 马爱军, 陈超, 等, 2008b. 七带石斑鱼()两个野生群体形态差异分析[J].海洋与湖沼, 39(6): 655-660.

乔德亮, 李思发, 2010. 细鳞斜颌鲴三个群体形态差异[J]. 生态学杂志, 29(12): 2425-2430.
刘小林, 常亚青, 相建海, 等, 2002. 栉孔扇贝壳尺寸性状对活体重的影响效果分析[J]. 海洋与湖沼, 33(6): 673-678.
孙希福, 2009. 基于形态学和分子生物学资料探讨中国沿海10种虾虎鱼类的系统发育关系[D]. 青岛: 中国海洋大学: 38-41.

李思发, 王成辉, 程起群, 2005. 红鲤四品系的形态差异和种系关系[J]. 水产学报, 29(5): 606-611.
李思发, 李晨虹, 李家乐, 1998. 尼罗罗非鱼品系间形态差异分析[J].动物学报, 44(4): 450-457.
杨天燕, 孟玮, 郭焱, 等, 2018. 塔里木裂腹鱼和厚唇裂腹鱼多变量形态学分析[J]. 浙江海洋大学学报(自然科学版), 37(3): 221-227.
张明辉, 陈刚, 谢俊刚, 2011. 以色列红罗非形态性状对体重影响的通径分析[J]. 安徽农学通报, 17(16): 47-49, 51.
陈杰, 李福贵, 黄创新, 等, 2014. 不同鳊鲂属鱼类群体的形态差异分析[J].上海海洋大学学报, 23(3): 388-394.
孟乾, 张志勇, 贾超峰, 等, 2020. 4月龄斑石鲷生长性状的相关分析与通径分析[J]. 水产科技情报, 47(3): 135-139.
练青平, 宓国强, 胡廷尖, 等, 2011. 唇鱼骨、花鱼骨及其杂交F1的形态差异分析[J]. 大连海洋大学学报, 26(6): 493-499.
侯吉伦, 赵雅贤, 任建功, 等, 2016. 中国沿海6个花鲈群体的形态差异分析[J].海洋渔业, 38(5): 459-467.
梁宏伟, 李忠, 罗相忠, 等, 2015. 长丰鲢与长江鲢形态差异与判别分析[J].水生生物学报, 39(5): 1059-1064.
谢鹏, 2019. 中国鱥属鱼类形态学比较和温度适应的研究[D]. 武汉: 华中农业大学: 45-49.

CADRIN S X, 2000. Advances in morphometric identification of fishery stocks [J]. Reviews in Fish Biology and Fisheries, 10(1): 91-112.
MATSUMOTO Y, THAO L X, MORIOKA K,, 2017. Effects of graded levels of taurine supplement to the no-fishmeal diet on the growth and physiology in juvenile yellowtail[J]. Aquaculture Science, 65(3): 239-246.
NWANI C D, BECKER S, BRAID H E,, 2011. DNA barcoding discriminates freshwater fishes from southeastern Nigeria and provides river system-level phylogeographic resolution within some species [J]. Mitochondrial DNA: The Journal of DNA Mapping, Sequencing, and Analysis, 22(S1): 43-51.
RIGOS G, KATHARIOS P, KOGIANNOU D,, 2021. Infectious diseases and treatment solutions of farmed greater amberjackwith particular emphasis in Mediterranean region [J]. Reviews in Aquaculture, 13(1): 301-323.
SISTROM M, EDWARDS D L, DONNELLAN S,, 2012. Morphological differentiation correlates with ecological but not with genetic divergence in agecko [J]. Journal of Evolutionary Biology, 25(4): 647-660.
TAKEYAMA H, CHOW S, TSUZUKI H,, 2001. Mitochondrial DNA sequence variation within and between tunaspecies and its application to species identification [J]. Journal of Fish Biology, 58(6): 1646-1657.
VOSS R S, MARCUS L F, PATRICIA ESCALANTE P, 1990. Morphological evolution in muroid rodents I. Conservative patterns of craniometric covariance and their ontogenetic basis in the Neotropical genus[J]. Evolution, 44(6): 1568-1587.
YOKOYAMA S, ASADA Y, ISHIKAWA M,, 2020. Growth and physiological responses of juvenile amberjack () fed pellet diets bound by different binders [J]. Journal of the World Aquaculture Society, 51(6): 1326-1340.
COMPARATIVE ANALYSIS OF MORPHOLOGICAL CHARACTERISTICS OF THREESPECIES
WANG Kai-Jie, XU Yong-Jiang, CUI Ai-Jun, JIANG Yan, WANG Bin, LIU Xue-Zhou
(Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Joint Laboratory for Deep Blue Fishery Engineering of Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China)
To reveal the interspecific differences of phenotypic characteristics among threespecies, the morphology of farmed,, andin China was analyzed. The countable and morphometrical characteristics were measured and compared, and the relationship and difference were determined using multivariate statistical methods including one-way ANOVA, path analysis, principal component analysis, discriminant analysis and cluster analysis. A total of 190 experimental fish were used. Results of one-way ANOVA show that there were significant differences among all the morphometric indexes (<0.05) except for fork length/soma length (FL/SL), soma length/caudal peduncle length (SL/PL) and head length/eye diameter (HL/ID), and mandibular length/maxillary length (LJL/UJL). In addition, four phenotypic traits (SL, body height (BH), caudal peduncle length (PL), and caudal peduncle height (PD)) are the main traits affecting body weight inas path analysis shown. Five phenotypic traits, soma length (SL, BH, eye diameter (ID), mandibular length (LJL) and head length behind the eyes (POL) inwere the main traits affecting their body weight. Three phenotypic traits (BH, LJL, and total length (TL)) were the main traits affecting the body weight of. Four principal components were constructed by principal component analysis, of which the first principal component contributed 34.974%, followed by the other three principal components (23.897%, 11.587%, 9.489%, respectively), and their cumulative variance contribution rate was 79.947%. The discriminant accuracy rate of1and2offishes was 100%, and the comprehensive discriminant rate was 100.00% as revealed by discriminant analysis.andwere clustered into a branch, and then were clustered into a large branch with. The present results provide intuitive morphometric basis for the species identity, germplasm norm establishment, and genetic breeding offishes.Key wordsspecies; phenotypic characteristics; path analysis; multivariate morphometrics; multivariate statistical analysis
Q789; Q954; S965
10.11693/hyhz20220400110
*国家重点研发计划项目, 2022YFD2401100号, 2019YFD0900901号; 中国水产科学研究院基本科研业务费, 2020TD47号; 国家海洋水产种质资源库项目, 2021-2025; 财政部和农业农村部: 国家现代农业产业技术体系资助, CARS-47号。王开杰, 硕士, E-mail: jasions@qq.com
徐永江, 研究员, E-mail: xuyj@ysfri.ac.cn
2022-04-27,
2022-07-09
