海马齿对不同盐度水质的碳汇作用以及不同形态氮利用的研究*
2023-01-17刘旭佳何绪刚赖俊翔黄国强熊向英
刘旭佳 何绪刚 赖俊翔 黄国强 侯 杰 熊向英 刘 京
海马齿对不同盐度水质的碳汇作用以及不同形态氮利用的研究*
刘旭佳1,2,3,4何绪刚2①赖俊翔1,5黄国强6侯 杰2熊向英1, 3刘 京4
(1. 广西科学院 广西海洋科学院 广西近海海洋环境科学重点实验室 广西南宁 530007; 2. 华中农业大学水产学院 湖北武汉 430070; 3. 广西海洋研究所有限责任公司 广西北海 536000; 4. 北部湾大学海洋学院 广西海洋生物多样性养护重点实验室 广西钦州 535011; 5. 北部湾海洋产业研究院 广西防城港 538000; 6. 广西中医药大学海洋药物研究院 广西南宁 530200)
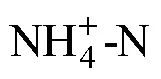
盐度; 海马齿; 碳汇; 氮
海马齿(), 属番杏科海马齿属, 主要生长在海边沙地或盐碱地带的多年生匍匐性肉质耐盐碱高等植物, 具有非常强的生长能力与较广的生态适应特征。由于可在不同盐度环境中进行水培(张艳琳等, 2009; 曾碧健等, 2017; 刘炜等, 2021), 海马齿依靠发达根系吸附水体中悬浮颗粒物, 降低养殖水体氮磷含量(杨芳等, 2019), 通过吸收氮磷同化为自身生物量并形成碳汇, 被应用在立体生态养殖系统中具有较高的生物安全性与景观生态服务功能(李卫林等, 2019; 杨芳等, 2019)。海马齿近年来被广泛应用于生态修复领域, 比如养殖废水、海水养殖池塘以及养殖网箱养殖区水质修复应用(曾碧健等, 2016; 王进进, 2017; Boxman, 2018; 杨芳等, 2019; Zhang, 2022)。
植物生存的土壤环境中, 80%以上氮素为有机氮形式, 其中氨基酸态氮占20%~40%(马林, 2004)。池塘养殖过程中会产生很多溶解态有机质、无机氮等物质, 养殖过程输出的溶解性有机物(DOM)主要由残饵、粪便以及代谢产物释放的蛋白质样荧光产物(酪氨酸和色氨酸)组成, 这种DOM可高度降解(Nimptsch, 2015)。国内有研究报道湖泊中水溶性有机质(WSOM)主要是类色氨酸物质(冯伟莹等, 2016; 张博等, 2018), 因此研究海马齿对色氨酸的利用具有重要的现实意义。近年来, 许多学者关注盐度对海马齿生长的研究, 主要针对耐盐机理、形态结构变化响应、生长以及生理生化指标等(Lokhande, 2010; 李卫林等, 2019; 刘炜等, 2021)。目前关于海马齿在不同盐度水质中的有机元素积累以及对无机氮与色氨酸利用情况未见报道。因此, 本文主要研究不同盐度条件下海马齿有机元素含量、积累速率以及根际与无机氮、色氨酸吸收关系, 探讨海马齿碳汇作用以及根际对不同形态氮的利用, 同时为海马齿在不同盐度水域修复中的应用提供科学数据参考。
1 材料与方法
1.1 实验材料与培养
海马齿于2021年6月11日在广西北海市竹林盐场虾塘边采摘, 带回实验室, 地上部分保留10 cm左右, 每株海马齿2~3个茎节淹没在250 mL锥形瓶中水里进行单株水培。6月11日至30日, 进行盐度0、10、20、30、35水培驯化, 盐度30海水取自广西海洋研究所有限责任公司竹林增养殖基地的砂滤天然海水, 通过添加超纯水(PTB-375G, 成都沛亿)进行低盐水调配, 盐度35通过添加海盐(Instant Ocean®Aquarium Systems, Inc.)进行配制。每天提高或者降低盐度2~3。实验过程水温范围28.5~31.2 °C。水培过程添加霍格兰营养液(Phygene, 福州)。每5日更换相应盐度的新水。
1.2 实验设计
选择生长均匀的海马齿, 鲜重为(3.16±0.26) g/ind., 每个盐度组选择18株海马齿, 并进行单独编号, 海马齿水培时间为6月11日至9月1日, 共82 d, 在实验开始和终末时, 将5个盐度处理组海马齿各取9株, 60 °C烘干至恒重, 记录单株海马齿干重, 然后粉碎过80目筛, 测定海马齿有机碳、有机氮和有机磷含量。
每个盐度处理组分为对照组、对照抑菌组、海马齿根际菌组、海马齿抑菌组, 每组设3个重复试样。抑菌组通过添加氨芐青霉素200 mg/L, 头孢噻肟100 mg/L用于抑制细菌生长。每个盐度组培养水经过0.45 μm滤膜过滤, 添加初始浓度霍格兰营养液, 然后经过高压灭菌锅121 °C, 20 min灭菌, 待冷却后在超净工作台进行分装, 每个锥形瓶分装300 mL水, 立刻使用硅胶塞密封, 将相对应盐度培养的海马齿插在硅胶塞中央孔, 最后用凡士林密封。对照组用无孔硅胶塞密封, 所有锥形瓶用锡箔纸包裹遮光。
对照组代表细菌和非生物因子作用, 对照抑菌组代表非生长因子的作用, 海马齿根际菌组代表海马齿、根际菌、细菌和非生物因子作用, 海马齿抑菌组代表海马齿和非生物因子的作用。对照组减去海马齿根际菌组代表海马齿根际菌联合作用, 对照抑菌组减去海马齿抑菌组代表海马齿单独作用。
1.3 样品测定
1.3.1 海马齿植株有机碳、有机氮和有机磷测定 有机碳、有机氮采用元素分析仪(VarioEL III CHONS analyzer, Germany)测定。有机磷采用灰化法测定(Zhou, 2003)。
1.3.3 色氨酸测定 采用对二甲氨基苯甲醛比色测定法, 在酸性条件下, L-色氨酸与对二甲氨基苯甲醛产生缩合反应, 生成蓝色希夫碱化合物, 然后加入亚硝酸钠进行重氮化反应蓝色继续加深, 在一定范围内与L-色氨酸浓度成线性相关, 593 nm分光光度法定量测定(李阳, 2009)。
1.3.4 海马齿根与根际培养水细菌测定 剪取S0、S10、S20、S30、S35处理组的海马齿新根, 剪刀用75%乙醇进行消毒处理。将5个盐度处理组海马齿根际5日培养水各取1 L(分别标记为SW1、SW2、SW3、SW4、SW5), 分别经过0.45 μm、0.22 μm滤膜过滤。细菌样品放入液氮中保存。
将每个样品剪碎, 用E. Z. N. A Water DNA Extraction Kit试剂盒(Omega Bio-Tek, USA)提取DNA。对16S rDNA基因可变区V3~V4区进行PCR扩增, 所用引物序列为细菌特异性引物: 341F(5′-CCT AYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNG GGTATCTA AT-3′)。PCR产物使用2%浓度的琼脂糖凝胶电泳检测, 送百迈克生物信息公司(北京)进行基于Illumina HiSeq2500测序平台, 利用双末端测序的方法, 构建小片段文库进行测序。
1.4 数据分析
所有结果数据以平均值±标准差表示, 采用EXCEL进行分析作图, 并对不同处理组之间的数据进行LSD方差检验, 以< 0.05作为差异显著标准。
细菌群落数据分析首先使用Trimmomatic v0.33软件, 对测序得到的Raw Reads进行过滤; 然后使用cutadapt 1.9.1软件进行引物序列的识别与去除, 得到不包含引物序列的高质量Reads; 使用FLASH v1.2.7软件, 通过overlap对每个样品高质量的Reads进行拼接, 得到的拼接序列即Clean Reads; 使用UCHIME v4.2软件, 鉴定并去除嵌合体序列, 得到最终有效数据(effective reads)。使用Usearch软件对Reads在97.0%的相似度水平下进行聚类、获得OTU。以SILVA为参考数据库使用朴素贝叶斯分类器对特征序列进行分类学注释, 得到每个特征对应的物种分类信息。
2 结果与分析
2.1 不同盐度条件下海马齿干重变化
不同盐度处理组海马齿初重与终末干重变化见图1。6月11日5个盐度组海马齿植株初始干重间无显著差异(d=4,=1.452,=0.226)。实验终末时, 5个盐度处理组之间海马齿干重差异显著(d=4,=14.896,=0.000), 其中S10盐度处理组显著高于其余处理组(0.05), S35盐度处理组显著低于其余处理组(0.05), 其余组间差异不显著(0.05)。
2.2 不同盐度条件下海马齿植株有机碳、有机氮、有机磷含量
实验开始时, 不同盐度处理组海马齿有机碳、有机氮、有机磷含量见表1。不同盐度处理组海马齿有机碳、有机氮、有机磷含量间差异不显著(d=4,=1.381,=0.249; d=4,=1.160,=0.336; d=4,=0.966,=0.431)。实验结束时, 不同盐度处理组有机碳含量差异显著(d=4,=20.189,=0.000; d=4,=43.571,=0.000; d=4,=41.459,=0.000)。S10处理组有机碳含量显著高于其余处理组(0.05), S0处理组显著高于S30、S35处理组(<0.05), 且S30处理组显著高于S35处理组(<0.05)。S0、S10处理组有机氮含量显著高于其余处理组(<0.05), 且S20、S30处理组有机氮含量显著高于S35处理组(<0.05)。S0、S10处理组有机磷含量显著高于其余处理组(<0.05), 且S20处理组有机磷含量显著高于S30、S35处理组(<0.05)。
不同盐度处理组海马齿干重有机碳、有机氮、有机磷积累速率见表2。不同盐度处理组海马齿干重有机碳、有机氮、有机磷积累速率差异显著(d=4,=14.307,=0.000; d=4,=26.854,=0.000; d=4,=37.016,=0.000)。S10处理组海马齿干重有机碳积累速率显著高于其余处理组(0.05), S35处理组显著低于其余四个处理组(<0.05)。S0、S10处理组海马齿干重有机氮积累速率高于其余处理组(0.05), S35处理组显著低于其余四个处理组(<0.05)。S0、S10处理组海马齿干重有机磷积累速率高于其余处理组(0.05), S30与S35处理组无显著差异(0.05)。
2.3 不同盐度条件下海马齿吸收无机氮情况
不同盐度条件下海马齿利用氮情况见图2~8, 图中纵坐标代表单株培养锥形瓶水体中营养盐质量。所有实验组培养水体中铵态氮含量随时间变化见图2。可以看出, S0处理组除对照抑菌组5 d出现降低外, 对照组、海马齿根际菌组、海马齿抑菌组在1、3、5 d时均呈现增加现象; S10盐度处理组, 海马齿根际菌组在3、5 d时铵态氮含量明显增加, 其他组铵态氮含量基本低于初始含量; S20盐度处理组, 铵态氮含量跟S10处理组变化相似, 同时海马齿根际菌组在3、5 d时铵态氮含量更高; S30、S35盐度处理组, 海马齿根际菌组在3、5 d时的铵态氮含量均显著增加, 对照抑菌组与海马齿抑菌组铵态氮含量则明显降低。海马齿根际菌联合作用与海马齿作用铵态氮利用量见图3。可以看出, S0、S10处理组海马齿根际菌联合作用、海马齿单独作用下均不利用铵态氮, S20、S30与S35处理组的海马齿抑菌情况下会利用少量铵态氮。
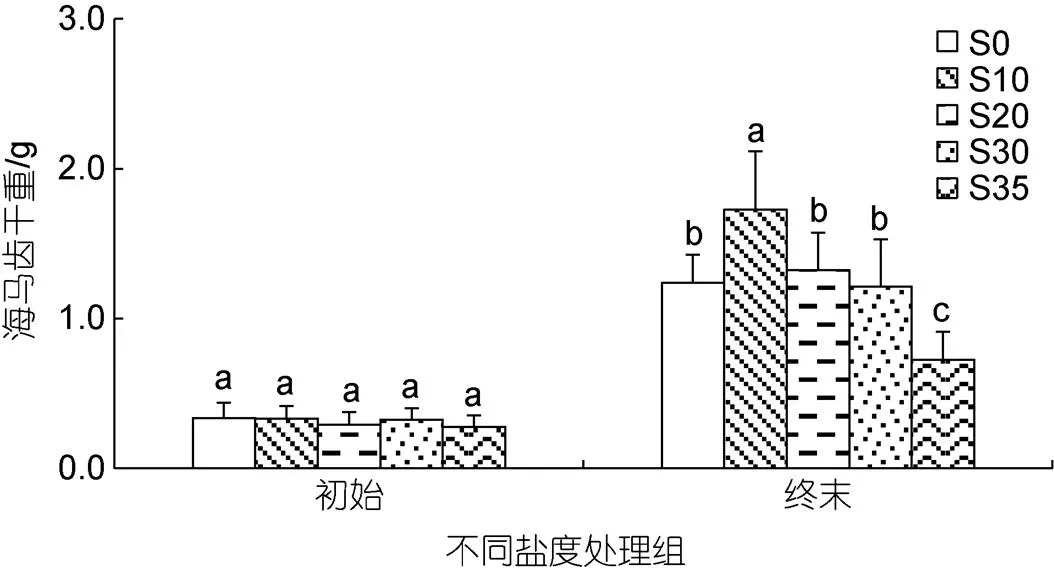
图1 不同盐度条件下初始与终末海马齿干重

表1 不同盐度处理组海马齿有机碳、有机氮、有机磷含量
注: 同一行中不同小写字母代表不同盐度处理组之间差异显著(0.05)
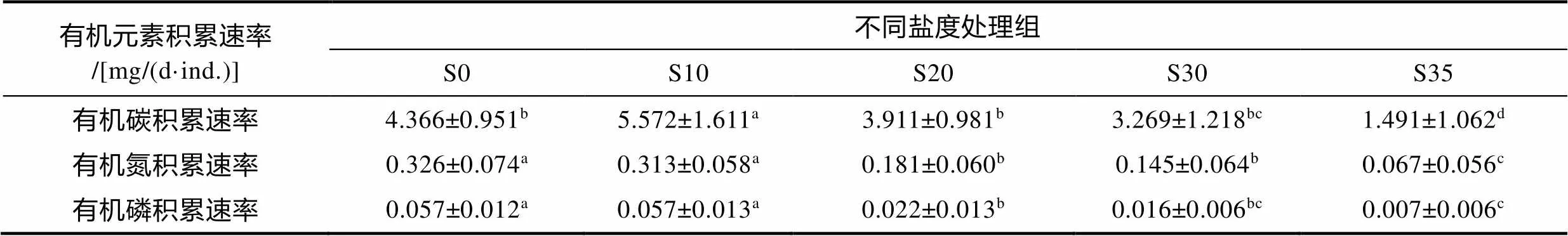
表2 不同盐度处理组海马齿中有机碳、有机氮、有机磷积累速率
注: 同一行中不同小写字母代表不同盐度处理组之间差异显著(0.05)

图2 所有实验组培养水体中铵态氮含量随时间变化
所有实验组培养水体中硝态氮含量随时间变化见图4。5个盐度处理组中, 海马齿根际菌组的硝态氮含量在3、5 d时均显著下降。海马齿抑菌组整体上在3、5 d时也表现下降趋势, 但含量整体要高于海马齿根际菌组。海马齿根际菌联合作用与海马齿作用硝态氮利用量见图5。可以看出, S10盐度处理组抑菌情况下在3、5 d时不利用硝态氮, 其余处理组海马齿根际菌联合作用与海马齿单独作用均会利用大量硝态氮, 海马齿根际菌联合情况下利用量明显高于海马齿单独作用。
所有实验组培养水体中磷酸盐含量随时间变化见图6。5个盐度处理组中, 海马齿根菌组与海马齿抑菌组的磷酸盐含量均呈现出整体下降现象, 其中S20处理组下降最显著。海马齿根际菌联合作用与海马齿作用无机磷利用量见图7。可以看出, S20盐度处理组海马齿根际菌联合、海马齿抑菌组, 1、3、5 d磷酸盐利用量最高; S10处理组海马齿根际菌组、海马齿抑菌组1、3 d利用量最低。
所有实验组培养水体中色氨酸含量随时间变化见图8。5个盐度处理组中, 海马齿根际菌组色氨酸含量均表现急剧下降; S0、S10处理组海马齿抑菌组色氨酸含量也出现急剧下降, 而S20、S30、S35处理组海马齿抑菌组色氨酸含量下降幅度则小很多。海马齿根际菌联合作用与海马齿作用色氨酸利用量见图9。可以看出, 5个盐度处理组海马齿根际菌联合作用下均吸收色氨酸; S0、S10处理组海马齿抑菌组利用量较高, S20、S30、S35盐度处理组利用量比较少。
2.4 不同盐度条件下海马齿根际与根际培养水细菌群落结构
高通量测序及其数据分析结果显示: 5个盐度处理组海马齿根际S0、S10、S20、S30、S35, 与5个盐度海马齿根际培养水SW10、SW10、SW20、SW30、SW35的细菌归属于25门类、60纲、161目、290科、497属、532种。表4是10个样品细菌门水平细菌组成与比率。
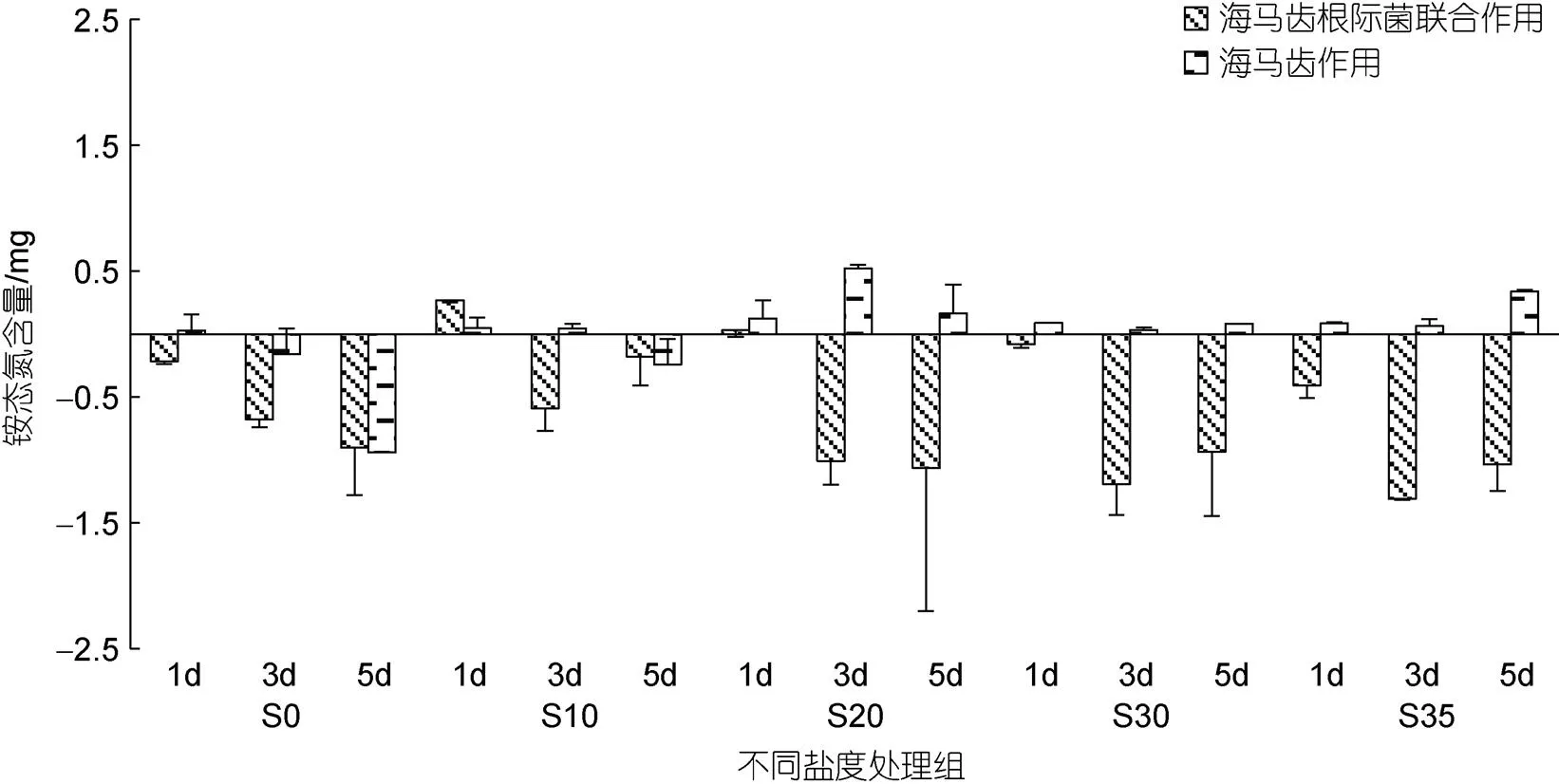
图3 海马齿根际菌联合作用与海马齿作用利用铵态氮含量
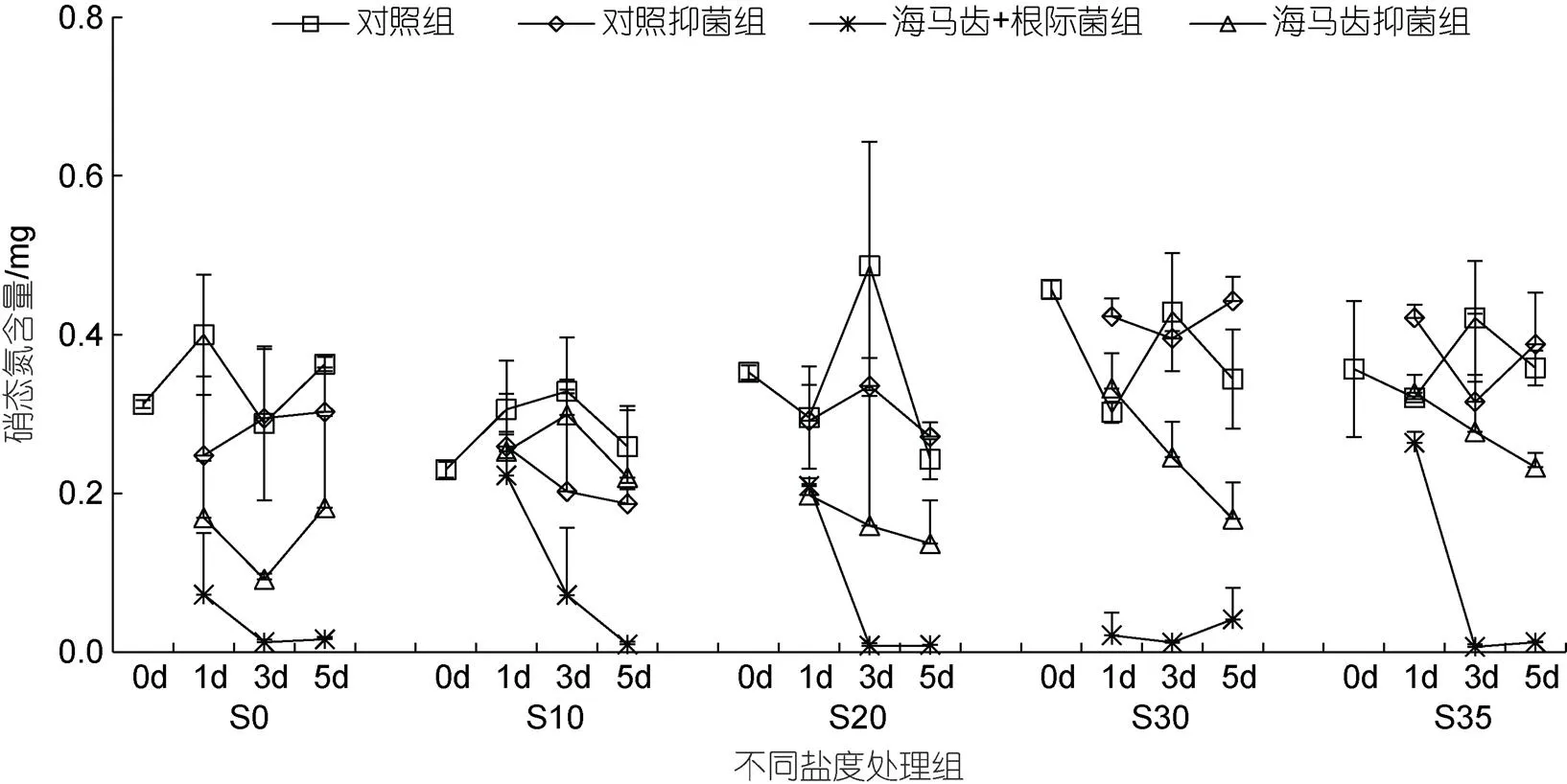
图4 所有实验组培养水体中硝态氮含量随时间变化

图5 海马齿根际菌联合作用与海马齿作用利用硝态氮含量
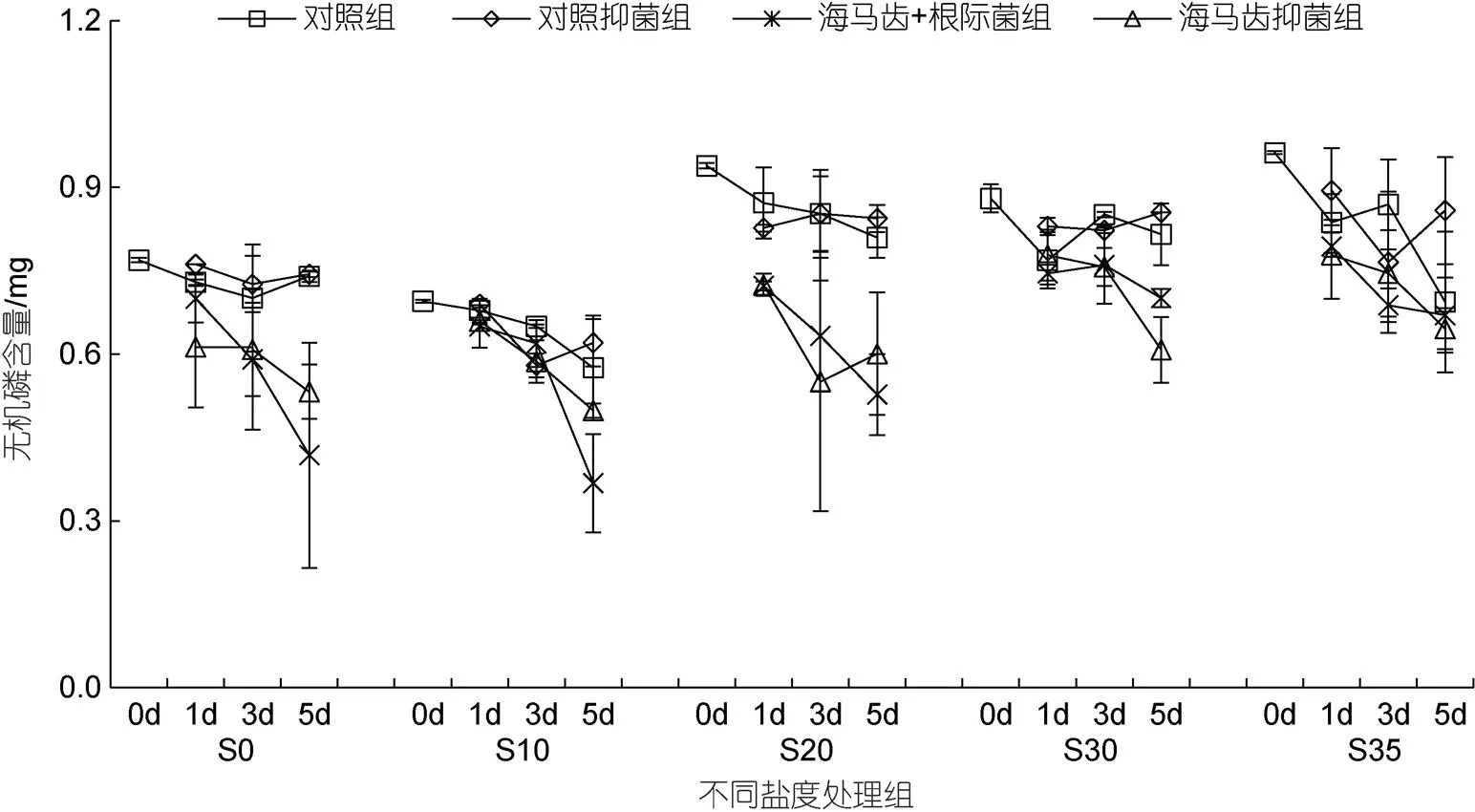
图6 所有实验组培养水体中磷酸盐含量随时间变化

图7 海马齿根际菌联合作用与海马齿作用利用磷酸盐含量

图8 所有实验组培养水体中色氨酸含量随时间变化

图9 海马齿根际菌联合作用与海马齿作用利用色氨酸含量
根际区与根际培养水优势菌数量差异很大(表3)。根际区优势菌有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)。根际培养水的优势菌有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝藻门(Cyanobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)。
硝化细菌类群和比率见表4。根际区硝化菌数量明显低于根际培养水。根际区硝化细菌除S30盐度组外, 其他盐度处理组相差不大。根际培养水硝化细菌SW30最低, SW20含量最高。共发现两个菌属氨氧化细菌(ammonia oxidizing bacteria, AOB): 亚硝化单胞菌属()和亚硝化螺杆菌属()。检测到一个亚硝酸盐氧化菌(nitrite oxidizing bacteria, NOB), 主要是硝化螺菌属()。
反硝化细菌类群和比率见表5。根际区反硝化菌数量明显低于根际培养水, 且根际区、根际培养水反硝化细菌数量均显著高于硝化细菌。共发现放线菌门2个菌属, 厚壁菌门3个菌属, 拟杆菌门1个菌属, 变形菌门7个菌属的反硝化细菌。根际菌中乳杆菌属()、不动杆菌属()、苍白杆菌()含量较高。

表3 海马齿根际与根际培养水门水平细菌类群组成和比率
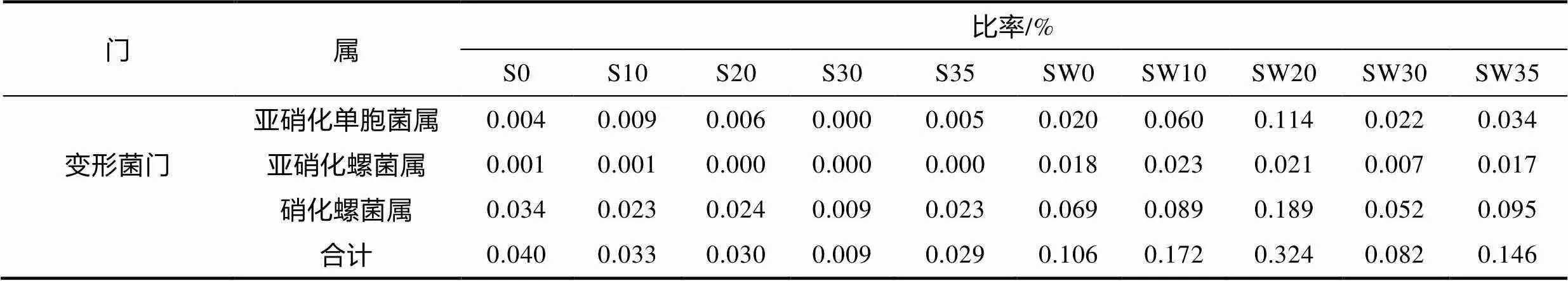
表4 海马齿根际与根际培养水硝化细菌类群组成和比率

表5 海马齿根际与根际培养水反硝化细菌类群组成和比率
3 讨论
3.1 不同盐度条件下海马齿生长
经过近3个月培养, 盐度10条件下海马齿干重、有机碳含量以及积累速率最高, 有机氮、有机磷含量以及积累速率与盐度0之间均无显著差异, 且显著高于其余盐度处理; 盐度35条件下海马齿干重、有机元素含量以及积累速率则最低, 说明一定盐度下海马齿可以快速生长并积累较高的有机元素, 高盐环境对海马齿生长造成胁迫, 从而导致营养元素积累最少。水培过程中通过观察海马齿株高变化以及根系绒毛结构, 可以看出S0、S10低盐度处理组的海马齿生长最为迅速, 主要是由于根系绒毛长、数量多以及吸水量较高的原因。国内许多研究人员开展了盐度对海马齿生长影响的研究(张艳琳等, 2009; 曾碧健等, 2017; 李卫林等, 2019; 刘炜等, 2021), 其一致结论是低盐促进海马齿生长, 高盐对其生长产生抑制, 外在表现为海马齿出现叶片肉质、茎节短、生长缓慢、甚至死亡等现象。李卫林等(2019)研究盐度对水培海马齿生长和生理生化因子的影响, 指出在盐度0~20, 海马齿生长几乎不受影响, 高盐度25~35, 海马齿生长受到明显胁迫, 盐度35条件上部分海马齿茎节腐烂溃败, 苗种成活率下降。刘炜等(2021)研究明确指出, 盐度10条件下, 海马齿干物质积累量较高, 生长最快, 这与本实验结论完全一致; 但该作者的实验中出现盐度30导致海马齿死亡的情况, 这与曾碧健等(2017)文章结果相似。本实验中海马齿在驯化与实验过程中, 盐度0~35范围均未出现死亡, 这与水培过程中添加色氨酸有重要关系, 具体分析见讨论3.3。除此之外, 与海马齿来源地有很大相关性, 本实验中海马齿取自广西北海虾塘旁的滩涂区域, 土壤中盐分本来就很高, 同时海马齿水培时间长达82 d, 均是高盐水质条件下海马齿能够基本维持生长的原因。
本实验计算了不同盐度海马齿积累有机碳、有机氮和有机磷含量, 其中盐度10条件下海马齿有机质积累速率最高, 有机碳、有机氮与有机磷积累速率分别为(5.572±1.611)、(0.313±0.058)、(0.057±0.013) mg/(d·ind.), 可以看出, 海马齿固碳作用显著, 若将海马齿应用于养殖水体修复, 将是一种实现蓝碳增汇的综合养殖模式, 同时可为评估海马齿移除养殖水体营养元素提供可靠数据参考。
3.2 不同盐度条件下海马齿吸收无机氮含量
海马齿发达根部可为根际微生物培养提供附着位点, 同时海马齿光合作用产生的O2输送到根际区, 形成好氧的表层与厌氧的亚层微环境, 可为脱氮微生物主要是硝化菌与反硝化菌提供优势条件。胡绵好(2009)等对凤眼莲-固定化氮循环细菌联合作用对富营养化水体进行原位修复, 研究结果表明植物-微生物处理系统可以显著提高水体中氮循环微生物数量, 且对总氮与铵态氮去除率为77.2%和49.2%。Zhang等(2022)研究养殖废水中不同浓度磺胺对海马齿吸收氮磷的影响中指出, 随着磺胺浓度增加, 28 d后海马齿鲜重、根系活力明显下降, 叶片中抗氧性酶活力降低, 对废水氮磷吸收下降, 水体中微生群落结构改变,而根际菌受的影响较小。本研究中单株海马齿培养瓶为封闭状态, 根际氮利用实验为5 d, 时间较短, 对海马齿植株以及体内抗氧化体系影响较小; 且磺胺与本实验中氨芐青霉素、头孢噻肟的抑菌原理不同, 杨芳等(2014)用氨芐青霉素, 头孢噻肟可以完全抑制海马齿根际与培养水体中的细菌, 因此本实验中抑菌条件可以代表海马齿单独作用, 但是海马齿与根际菌是互相依托关系, 对根际菌抑制也有可能抑制海马齿单独作用下利用氮能力, 具体机制还有待后续进一步研究。
本实验结果显示, 海马齿在不抑菌情况下, 不同盐度处理组培养水中硝态氮均出现大幅降低, 而铵态氮浓度则明显增加, 根据细菌高通量分析测序结果, 不同盐度处理的海马齿根际培养水中均存在较高丰度的反硝化细菌, 高盐条件有利于反硝化细菌生长(仇元, 2016; 王芬等, 2020)。通过分析, 海马齿实验瓶中硝态氮变化至少有3个反应过程, 异化硝酸盐还原为铵(dissimilatory nitrate reduction to ammonium, DNRA)被海马齿利用; 硝态氮经过反硝化作用被逐步还原为一氧化氮、氧化亚氮和氮气从而导致硝态氮减少; 硝化过程也会生成部分硝态氮, 整体上呈现出硝态氮下降的结果。铵态氮变化至少也有3个反应过程, 海马齿自身消耗代谢产生; 色氨酸被吸收利用后的氧化脱氨; 直接被吸收, 由于产生的含量远大于消耗部分, 因此最后呈现出大量增加的结果。海马齿在抑菌情况下, 培养水中硝态氮也出现大幅降低, 只有盐度20、30、35处理组的海马齿会利用少量铵态氮, 最高值出现在S20盐度处理组, 第3 d利用量为0.52 mg。一般情况下, 铵态氮与硝态氮同时存在时, 植物会优先吸收铵态氮, 硝态氮必须依次经过硝酸还原酶与亚硝酸还原酶作用才能还原为铵态氮, 才能被利用合成氨基酸、蛋白质以及其他高分子化合物;另一种观点认为, 硝态氮才是植物的重要氮源, 只有当硝态氮不足时, 才会吸收铵态氮(巫晓杰等, 2011)。仇元(2016)研究海马齿生态浮床植物根际脱氮过程, 结果表明海马齿高盐30培养过程中水体7 d后氨氮从0.328 mg/L降低0.181 mg/L, 亚硝态氮从0上升到0.027 mg/L, 硝态氮从56.88 mg/L降到33.94 mg/L, 说明海马齿主要利用的是硝态氮, 这与其初始营养盐设置高也有很大关系, 充足的氮浓度满足植物氮吸收与同化, 而氮储存能力也会加快其吸收速率。
不同盐度下海马齿根际均会吸收不同浓度磷酸盐, S20盐度处理组吸收量最大, 海马齿根际菌联合作用吸收最大值出现在第5 d为(0.28±0.07) mg、海马齿单独作用吸收最大值出现在第3 d为(0.30±0.23) mg。植物吸收磷通常与根形态、根系分泌物、体内磷转运等因素有关, 同时会受到特异基因表达的调控(李廷轩等, 2017)。本实验结果表明海马齿根际菌联合作用与海马齿单独作用都可以直接吸收磷酸盐, 且海马齿单独作用吸收量也会高于联合作用, 说明海马齿根系与磷相关代谢菌对无机磷吸收都有竞争, 但具体吸收机理以及海马齿根系与细菌联合机制还需要进一步深入研究。
3.3 不同盐度条件下海马齿吸收色氨酸
色氨酸是植物体内生长素生物合成重要的前体物, 同时作为动物饲料添加剂(孙育平等, 2016)在养殖过程会溶失在养殖水体中, 因此研究色氨酸吸收转化对于构建海马齿浮床立体生态养殖系统具有重要实践意义。色氨酸作为植物生长素合成的前体物质,在植物生长过程中发挥重要作用。色氨酸可以明显促进玉米、甘蓝的生长与养分吸收(陈振德等, 1997; 陈明昌等, 2005)。本实验中盐度35条件下海马齿除了形态差异外, 并未出现植株死亡, 与添加色氨酸有很大关系, 实验过程中发现添加色氨酸后第2 d, 海马齿植株根部可以促生很多白色新根, 色氨酸可能改变海马齿根际及植株体内的生长激素水平。
通过分析推测, 海马齿培养水体中色氨酸大量消耗至少存在两个反应过程, 一是海马齿与根际菌均可以直接利用色氨酸, 甚至存在强烈竞争, 吸收后进行运转、分配和代谢; 二是直接代谢释放, 最终导致色氨酸大幅下降。不抑菌的实验瓶中, 色氨酸含量均表现出显著降低, 不同盐度处理组海马齿根际菌联合作用(单株)在5 d时间内可以代谢25 mg左右的色氨酸。抑菌条件下, 色氨酸可以以分子形式直接进入海马齿, 海马齿单独作用吸收色氨酸含量在盐度S0、S10时最高, 高盐环境则会对色氨酸吸收产生一定抑制, 因此说明在盐度0~35条件下, 有细菌存在时海马齿对色氨酸利用具有绝对竞争优势(崔晓阳, 2007), 3 d时色氨酸被消耗殆尽。海马齿单独作用时对色氨酸的利用则处于弱势, 海马齿根系利用色氨酸与无机氮差异显著, 从数值来看, 盐度0~35范围海马齿对色氨酸第5 d利用量(5.36~13.08 mg)远高于硝态氮(-0.033~0.275 mg)、铵态氮(-0.942~0.340 mg)。因此, 在无机氮与色氨酸共存的抑菌情况下, 海马齿对色氨酸利用量远高于无机氮。
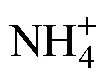
4 结论
海马齿在盐度10培养条件下生长最佳, 干物质含量、有机元素含量与积累速率最高。不同盐度抑菌培养条件下, 色氨酸与无机氮共存时均能被能被海马齿利用, 色氨酸利用量远高于硝态氮、铵态氮; 不抑菌条件下铵态氮则表现出增加的结果。海马齿具有明显碳汇作用, 可以用海马齿浮床形式应用于不同盐度范围的池塘或者水域进行水质修复。
马林, 2004. 植物对氨基酸的吸收和利用[J]. 西南科技大学学报(自然科学版), 19(1): 102-107.
王进进, 2017. 海马齿生态浮床对高位池养殖效果的研究[D]. 广州: 中山大学.
王芬, 段洪利, 刘亚飞, 等, 2020. 人工湿地处理含盐富营养化水的植物根际与非根际菌群分析[J]. 环境工程学报, 14(7): 1844-1851.
仇元, 2016. 海马齿生态浮床植物根际脱氮过程及影响因素的研究[D]. 厦门: 厦门大学.
冯伟莹, 朱元荣, 吴丰昌, 等, 2016. 太湖水体溶解性有机质荧光特征及其来源解析[J]. 环境科学学报, 36(2): 475-482.
刘炜, 常佳楠, 张建琳, 等, 2021. 盐度对滨海修复种海马齿生长及荧光参数的影响[J]. 热带亚热带植物学报, 29(3): 269-275.
孙育平, 裘金木, 王国霞, 等, 2016. 低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料表观消化率、消化酶活和全虾氨基酸组成的影响[J]. 水生生物学报, 40(4): 720-727.
巫晓杰, 申玉春, 叶宁, 等, 2011. 海马齿对氮、磷吸收利用速率的初步研究[J]. 中国农学通报, 27(20): 92-96.
李卫林, 罗冬莲, 杨芳, 等, 2019. 盐度对水培海马齿生长和生理生化因子的影响[J]. 厦门大学学报(自然科学版), 58(1): 63-69.
李廷轩, 叶代桦, 张锡洲, 等, 2017. 植物对不同形态磷响应特征研究进展[J]. 植物营养与肥料学报, 23(6): 1536-1546.
李阳, 2009. 直接发酵法生产L-色氨酸的研究[D]. 福州: 福建师范大学.
杨芳, 李凯, 黄凌风, 等, 2014. 海马齿根际降解可溶性蛋白质的研究[J]. 厦门大学学报(自然科学版), 53(1): 142-148.
杨芳, 杨妙峰, 郑盛华, 等, 2019. 东山湾海马齿生态浮床原位修复效果研究[J]. 渔业研究, 41(3): 225-233.
张艳琳, 范伟, 蔡元保, 等, 2009. 海马齿对不同比例淡海水组培的生长和生理响应[J]. 西北植物学报, 29(6): 1240-1245.
张博, 王书航, 姜霞, 等, 2018. 太湖五里湖水体悬浮物中水溶性有机质(WSOM)的荧光光谱组分鉴别及其与氮形态的关系[J]. 湖泊科学, 30(1): 102-111.
陈明昌, 程滨, 张强, 等, 2005. 土施L-蛋氨酸、L-苯基丙氨酸、L-色氨酸对玉米生长和养分吸收的影响[J]. 应用生态学报, 16(6): 1033-1037.
陈振德, 黄俊杰, 何金明, 等, 1997. 土施L-色氨酸对甘蓝产量和养分吸收的影响[J]. 土壤学报, 34(2): 200-205.
胡绵好, 袁菊红, 常会庆, 等, 2009. 凤眼莲-固定化氮循环细菌联合作用对富营养化水体原位修复的研究[J]. 环境工程学报, 3(12): 2163-2169.
莫良玉, 吴良欢, 陶勤南, 2002. 高等植物对有机氮吸收与利用研究进展[J]. 生态学报, 22(1): 118-124.
崔晓阳, 2007. 植物对有机氮源的利用及其在自然生态系统中的意义[J]. 生态学报, 27(8): 3500-3512.曾碧健, 岳晓彩, 黎祖福, 等, 2016. 生态浮床原位修复对海水养殖池塘浮游动物群落结构的影响[J]. 海洋与湖沼, 47(2): 354-359.
曾碧健, 窦碧霞, 黎祖福, 等, 2017. 海洋盐生植物海马齿()对环境盐度胁迫的耐受性及营养价值综合评价[J]. 海洋与湖沼, 48(3): 568-575.
霍常富, 孙海龙, 范志强, 等, 2007. 根系氮吸收过程及其主要调节因子[J]. 应用生态学报, 18(6): 1356-1364.
BOXMAN S E, NYSTROM M, ERGAS S J,, 2018. Evaluation of water treatment capacity, nutrient cycling, and biomass production in a marine aquaponic system [J]. Ecological Engineering, 120: 299-310.
LOKHANDE V H, NIKAM T D, PENNA S, 2010. Biochemical, physiological and growth changes in response to salinity in callus cultures ofL. [J]. Plant Cell, Tissue and Organ Culture (PCTOC), 102(1): 17-25.
NIMPTSCH J, WOELFL S, OSORIO S,, 2015. Tracing dissolved organic matter (DOM) from land-based aquaculture systems in North Patagonian streams [J]. Science of the Total Environment, 537: 129-138.
ZHANG C Y, WANG D, HE W H,, 2022.-mediated removal of nitrogen and phosphorus affected by sulfadiazine in Aquaculture Wastewater [J]. Antibiotics, 11(1): 68.
ZHOU Y, ZHANG F S, YANG H S,, 2003. Comparison of effectiveness of different ashing auxiliaries for determination of phosphorus in natural waters, aquatic organisms and sediments by ignition method [J]. Water Research, 37(16): 3875-3882.
EFFECT OF SALINITY ON CARBON SEQUESTRATION BYAND UTILIZATION OF NITROGEN IN DIFFERENT FORMS
LIU Xu-Jia1, 2, 3, 4, HE Xu-Gang2, LAI Jun-Xiang1, 5, HUANG Guo-Qiang6, HOU Jie2, XIONG Xiang-Ying1, 3, LIU Jing4
(1. Guangxi Key Laboratory of Marine Environmental Science, Guangxi Academy of Marine Sciences,Guangxi Academy of Sciences, Nanning 530007, China; 2. College of Fisheries, Huazhong Agriculture University, Wuhan 430070, China; 3.Guangxi Institute of Oceanology Co. LTD, Beihai 536000, China; 4. Guangxi Key Laboratory of Marine Biodiversity Conservation, Oceanography institute, Beibu Gulf University, Qinzhou 535011, China; 5. Beibu Gulf Marine Industry Research Institute, Fangchenggang 538000, China; 6. Institute of Marine Drug, Guangxi University of Chinese Medicine, Nanning 530200, China)

salinity;; carbon sequestration; nitrogen
Q945
10.11693/hyhz20220500139
*国家自然科学基金项目, 31960225号, 31972797号; 广西自然科学基金, 2021GXNSFAA196074号; 北海市科技开发项目, 201995045号, 202082035号; 防城港市科技开发项目, 防科AB20014027号。刘旭佳, 博士, 副研究员, E-mail: lxu0312@126.com
何绪刚, 教授, 博士生导师, E-mail: xgh@mail.hzau.edu.cn
2022-05-25,
2022-09-07
