冷暴露对小鼠肝脏内质网应激和内源性凋亡的影响
2023-01-17李东倪薛琳琳郑小雪郭景茹
李东倪,薛琳琳,郑小雪,徐 彬,郭景茹*
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;2.黑龙江职业学院,黑龙江 哈尔滨 150111)
我国北方寒冷的气候能够降低动物的生产与繁殖性能,也会对动物的抗氧化、自身免疫等功能产生影响,这大大制约着我国北方地区畜牧业以及养殖业的发展,产生了不可估量的经济损失[1-4]。肝脏是机体重要的消化腺,同时作为代谢稳态的中枢器官,与各项生命活动都密切相关,比如糖脂代谢、蛋白质的合成与分解等,因此更易受到寒冷刺激的影响[5]。据报道,当机体持续处于低温环境下,能够诱发肝硬化、肝炎等多种肝脏疾病的发生[6]。内质网(endoplasmic reticulum,ER)是机体感受外界环境变化的细胞器,蛋白质合成与分解主要依靠于ER[7-8]。ER同时也具有维持钙离子稳态、参与蛋白质的修饰与加工等功能。当机体受到各种因素作用时,可导致内质网稳态被破坏,从而影响蛋白的正确折叠,引起未折叠或错误折叠蛋白聚集在内质网腔内,引发内质网应激(ER stress,ERS)[9]。
ERS是发生在真核细胞中的一种具有保护作用的反应机制。已有研究表明,ERS在肝脏损伤与肝脏疾病中能够发挥重要作用,例如调控非酒精性脂肪肝、炎症性急性肝功能衰竭等疾病中肝细胞的凋亡[10-11]。当发生ERS时,首先引起未折叠蛋白反应(unfolded protein response,UPR)。UPR主要由3条交联的信号通路组成:蛋白激酶R样内质网激酶(PERK)通路、肌醇需求酶1(IRE1)通路、转录活化因子6(ATF6)通路[12]。一定程度的ERS可启动细胞保护的效应机制,减缓内质网负荷并重新对内质网稳态进行维持[13]。若ER持续处在应激状态,UPR继而通过上述3条信号通路激活下游的促凋亡信号分子,最终可引起内源性凋亡[13]。肝细胞的各项生命活动都是以线粒体功能为基础的,线粒体参与肝细胞内跨膜运输、细胞信号转导和凋亡等过程[14]。在线粒体介导的凋亡中,膜电位的下降是内源性凋亡的早期标志[9]。近年来的研究表明,位于线粒体内外膜之间的细胞色素C(Cyt C)是线粒体凋亡信号传导过程中的关键蛋白[15],Cyt C被释放到细胞质是引起细胞凋亡的重要步骤。Cyt C结合细胞凋亡活化因子Apaf-1和Pro-Caspase-9,启动级联反应,激活下游的Caspase家族蛋白[16],使凋亡进行下去,继而激活由线粒体所介导的内源性凋亡[17]。此外,也有研究证实Bcl-2家族也参与调控细胞的凋亡过程[18]。促凋亡蛋白广泛分布在细胞浆内,当促凋亡蛋白转移至线粒体时能够激活线粒体凋亡通路;抗凋亡蛋白定位在线粒体外膜上,参与调控Cyt C的释放[18-19]。据此,本试验旨在探讨冷暴露对小鼠肝脏ERS与内源性凋亡的影响。
1 材料与方法
1.1 试验动物及主要试剂5周龄C57BL/6型雄性小鼠,体质量23~25 g,购自北京维通利华Charles River公司;GRP78、CHOP、XBP1、Bcl-2、Bax、Cyt-C、Caspase-3、β-actin一抗、HRP标记山羊抗兔二抗、HRP标记山羊抗小鼠二抗均购自武汉三鹰生物技术有限公司;BCA蛋白浓度测定试剂盒(增强型)、组织线粒体分离试剂盒、SDS-PAGE凝胶快速配置试剂盒、显影发光液均购自碧云天生物技术有限公司。
1.2 主要仪器酶标仪(深圳迈瑞生物医疗电子股份有限公司);电泳仪(Bio-Rad,美国);ChemiDoc +化学发光成像系统(Bio-Rad,美国);CEA540Ge型人工智能气候室(济南旭邦电子科技有限公司);MM400型混合型球磨仪(Retsch,德国);Micro17微型离心机(Thermo Scientific)。
1.3 试验动物分组及处理C57BL/6型雄性小鼠在人工智能气候室内预饲7 d,饲养条件如下:温度为(24±2)℃,湿度为40%,光照昼夜12 h交替。将试验小鼠随机分为室温对照组和冷暴露组,室温对照组小鼠刺激刺温度为(24±2)℃,湿度为40%。冷暴露组的刺激条件如下:温度为(4±1)℃,湿度为40%,每天冷暴露 3 h,连续刺激3周。
1.4 样品采集小鼠腹腔注射戊巴比妥进行麻醉,颈椎脱臼处死,分离肝脏组织并采集样品,样品用于制备肝脏组织HE染色切片、Masson染色切片、透射电镜切片和检测肝脏组织中内质网应激和内源性凋亡相关途径蛋白表达变化。
1.5 肝脏组织病理学检测肝脏样品经过4%多聚甲醛固定、梯度乙醇脱水、二甲苯透明化处理、石蜡浸蜡与包埋制作成连续切片;切片经过二甲苯与乙醇处理后,制成HE与Masson染色切片,最后常规脱水、透明、封片。(1)HE染色:经上述方法处理后,置于苏木素染液中染色5 min,用水冲洗后置于乙醇中分化10 min,经氨水返蓝后,置于伊红染液中染色2~3 min,染色后的切片经不同梯度酒精脱水、透明、中性树脂封片,然后通过光学显微镜观察肝脏组织病理学形态变化。(2)Masson染色:切片脱蜡、水洗,苏木精液染色6 min,乙醇分化;切片经丽春红染色5 min后取出,经磷钼酸水溶液分化3 min,苯胺蓝染色2 min,冰醋酸分化1 min,染色后的切片经酒精脱水、封片,然后显微镜下观察肝脏纤维组织变性情况。
1.6 肝脏组织透射电镜观察肝脏样品经戊二醛固定、磷酸漂洗液漂洗、乙醇脱水、包埋固化处理后制作成切片,3%醋酸铀-枸橼酸铅双染色,然后通过透射电镜观察肝脏细胞超微结构。
1.7 Western blot检测肝脏组织相关蛋白的表达取新鲜肝脏组织样品并剪碎后放入1.5 mL离心管中,提取组织线粒体蛋白,根据分离试剂盒说明书加入含PMSF的线粒体分离试剂A(线粒体分离试剂A与PMSF的比例为10∶1);样品经混合球磨仪匀浆至完全裂解后,4℃、600×g离心5 min;提取管中上清液,4℃、1 000×g离心10 min;保留沉淀部分,沉淀即为分离得到的线粒体;管中加入蛋白上样缓冲液,煮沸蛋白使其变性,随后将蛋白样品加入到10%、12%聚丙烯胺凝胶中进行SDS-PAGE电泳,湿法转PVDF膜,5%蛋白免疫印迹封闭液室温封闭1 h,洗膜后加入按比例稀释的一抗,置于4℃下孵育过夜;次日,洗膜后加入按比例稀释的二抗,室温孵育1 h,按说明配制ECL显影液,使用凝胶成像系统(Image Lab)对蛋白条带进行灰度分析。
1.8 统计分析本试验使用Graphpad Prism 7.0软件(Graphpad software,San Diego,CA,USA)计算各组的试验数据,以P<0.05为具有显著性差异,具有统计学意义。
2 结果
2.1 小鼠肝脏组织病理学变化HE染色结果显示,室温对照组小鼠肝脏组织结构正常,肝小叶结构清晰,肝细胞形态正常,排列整齐,未见明显肿胀变性;冷暴露组小鼠肝脏发生轻微水样变性,肝小叶结构紊乱,可见炎性细胞浸润(图1)。Masson染色结果显示,室温对照组小鼠肝脏细胞间质未见明显蓝染;冷暴露组小鼠肝组织可见轻微的胶原纤维沉积(图1)。
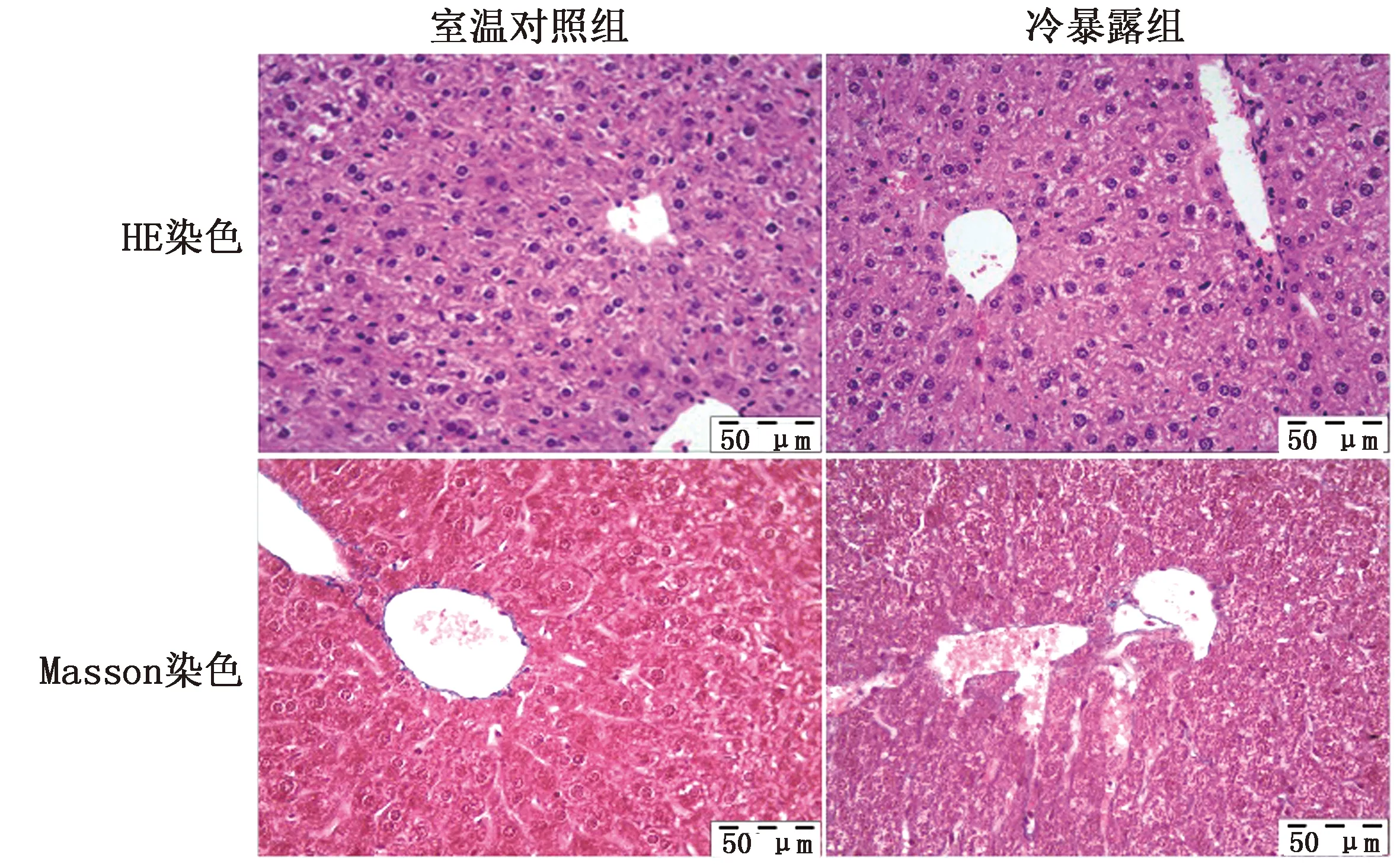
图1 室温对照组和冷暴露组小鼠肝脏组织学形态(10×40)
2.2 小鼠肝脏细胞透射电镜观察结果分析透射电镜结果见图2,红色箭头表示内质网,黑色箭头表示线粒体),冷暴露组小鼠肝脏细胞内质网结构破坏,线粒体发生轻微损伤。
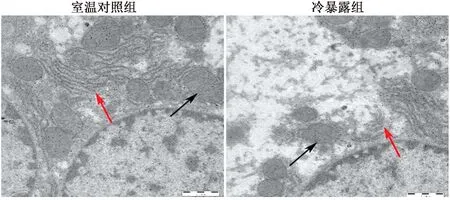
图2 透射电镜观察室温对照组和冷暴露组小鼠肝细胞中内质网和线粒体形态
2.3 内质网应激相关蛋白表达水平Western blot结果显示,与对照组相比,冷暴露组小鼠肝脏组织内GRP78、XBP1、CHOP蛋白表达水平显著增加(P<0.05)(图3)。
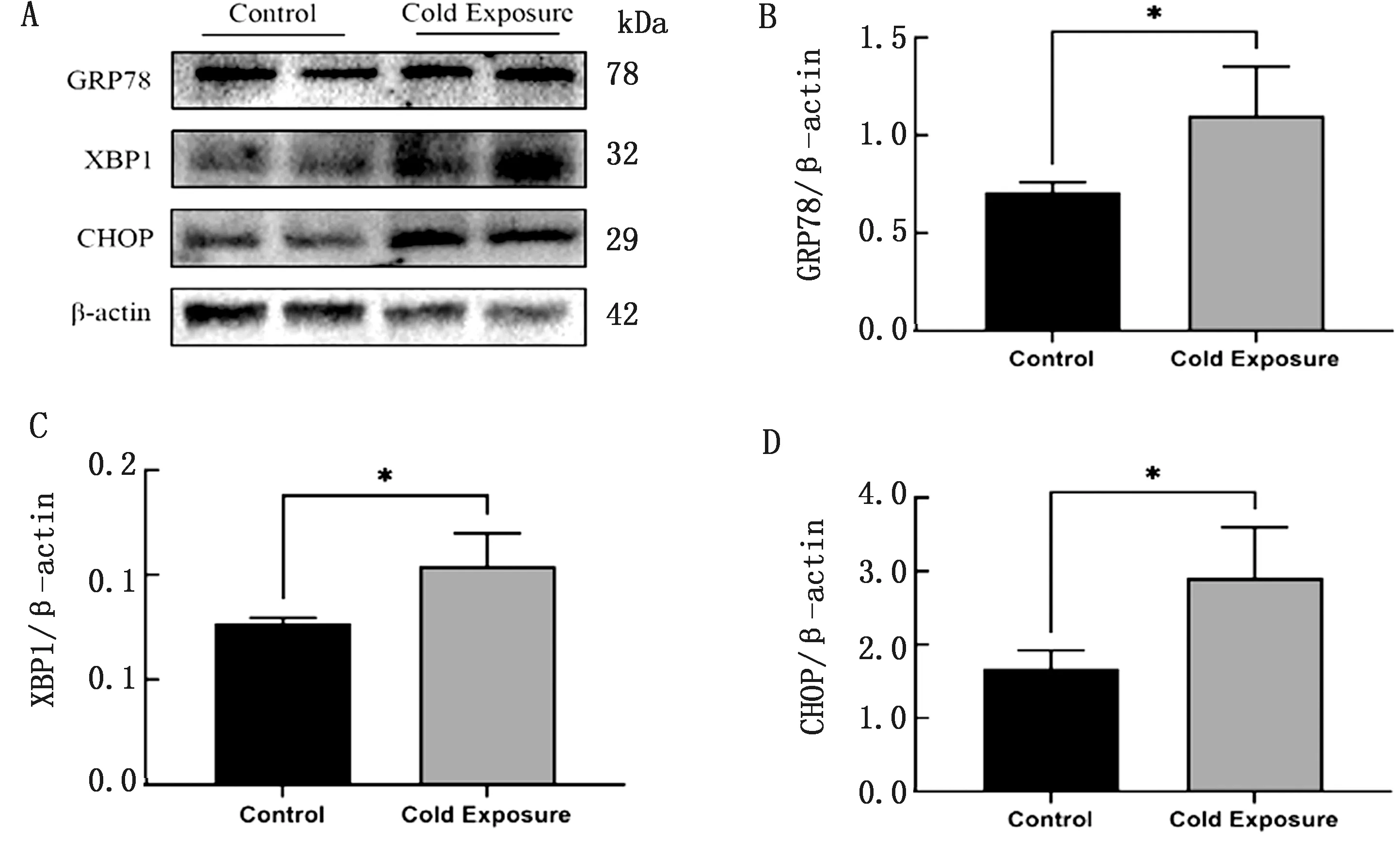
A.对照组和冷暴露组小鼠肝脏内质网应激相关蛋白表达量的Western blot检测结果;B~D.分别为GRP78、XBP1、CHOP与内参β-actin比值分析结果。*P<0.05表示有显著性差异
2.4 线粒体凋亡相关蛋白表达水平通过Western blot检测Caspase-3、Bax、Bcl-2、Cyt C的表达水平,结果显示:与对照组相比,冷暴露组小鼠肝脏组织内Cyt C蛋白表达水平显著增加(P<0.01);Bax/Bcl-2、Cleaved-Caspase-3/Pro-Caspase-3表达水平显著升高(P<0.01)(图4)。
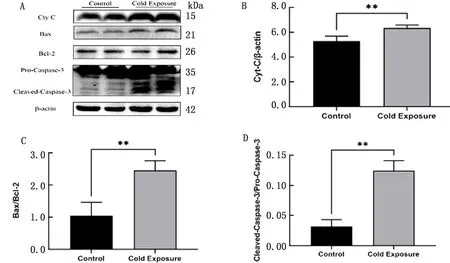
A.对照组和冷暴露组小鼠肝脏线粒体凋亡相关蛋白表达量的Western blot检测结果;B~D.分别为Cyt C、Bax/Bcl-2、活化的Caspase-3/Caspase-3前体的表达变化。**P<0.01表示有极显著性差异
3 讨论
在畜牧业发展过程中,寒冷会引起机体免疫功能下降,影响机体生产、繁殖性能,对养殖业造成巨大损失,是阻碍我国北方地区畜牧经济健康平稳发展的直接因素之一[1]。肝脏作为机体的重要器官,与动物机体各项生命活动都密切相关,比如蛋白质的合成与分解。除此之外,肝脏也具有吞噬和免疫功能,可以抵御外界有害物质侵入机体[6]。冷暴露也容易影响肝脏的正常功能,加速肝糖原分解、导致糖异生[2]。在本试验中,我们通过病理组织学观察发现冷暴露组小鼠细胞发生了形态学变化,肝脏受到损伤,内质网与线粒体也受到破坏。有研究指出,肝脏中存在丰富的内质网,当肝脏长期处于外界不良刺激下,会导致肝脏内质网功能发生紊乱,极易发生ERS;若肝脏长期处于ERS,又可进一步发生ERS介导的细胞凋亡途径[19-20]。
GRP78作为内质网分子伴侣,当ERS发生时,与位于内质网膜上的转录因子ATF6发生解离,ATF6随后通过囊泡的方式移动至高尔基体,并被2个位点蛋白酶分割,从而激活转录因子X盒结合蛋白1(X box-binding protein 1,XBP1)以及下游促凋亡信号分子C/EBP同源蛋白(C/EBP-homologous protein,CHOP),以达到促进蛋白质进行正确折叠的目的[8]。本试验结果表明,与对照组相比,冷暴露组小鼠肝脏组织中ERS关键蛋白GRP78、XBP1、CHOP表达显著上调,说明冷暴露下机体肝脏组织发生了ERS。
当ER持续处于应激状态时,发生ERS的关键蛋白CHOP过量表达能够促进机体细胞发生内源性凋亡[5]。此外,常青等[21]的研究表明,位于线粒体膜间隙的Cyt C在正常情况下不能透过线粒体外膜进入胞质。当细胞处于应激状态时,能够改变线粒体膜完整性,引起膜电位降低,随后Cyt C进入细胞质[22],在细胞质中与细胞凋亡活化因子Apaf-1以及Pro-Caspase-9结合,激活Pro-Caspase-9产生有活性的Caspase-9,再活化下游Caspase-3等蛋白,从而激活线粒体介导的内源性凋亡途径[23-24]。Bcl-2家族也参与线粒体凋亡的调控过程[25],当该家族中的促凋亡蛋白移动到线粒体时,线粒体通透性发生改变、膜电位降低,Cyt C进入胞质,从而激活线粒体凋亡途径[26-27]。凋亡蛋白表达情况与凋亡程度密切相关。为进一步探讨内质网应激是否激活了肝细胞的凋亡途径,我们检测了肝脏组织线粒体蛋白表达情况,结果显示Bax与Bcl-2的比值显著升高,提示冷暴露进一步导致肝细胞发生凋亡;活化的Caspase-3与Caspase-3前体比值显著升高,Cyt C蛋白的表达水平也显著提升,提示机体肝脏组织发生了内源性线粒体介导的凋亡。
综上,冷暴露能够诱导小鼠肝脏发生ERS,导致线粒体凋亡的发生。因此线粒体介导的凋亡途径在ERS中发挥重要作用,这提示我们未来可以尝试以线粒体为着手点,减轻肝脏ERS,预防肝脏损伤。
