健脾祛湿方调控LncRNA H19/miR-130a-3p对高脂血症大鼠血脂代谢及胆固醇逆转运的研究
2023-01-17赵凡张建军蔡祥焜邸松蕊姜砚馨吕美豫田世民王林元郑立新王淳
赵凡 张建军 蔡祥焜 邸松蕊 姜砚馨 吕美豫 田世民 王林元 郑立新 王淳
高脂血症是临床上常见的一种慢性代谢性疾病,其发病隐匿,常诱发多种心脑血管疾病如动脉粥样硬化、脑血管意外、高血压、冠心病等疾病的发生。 长链非编码 RNA (long non-coding RNAs,LncRNAs)是一类长度超过200 个核苷酸、编码潜力有限的RNA,参与高脂血症、动脉粥样硬化、心肌肥厚、心肌纤维化等多种心血管疾病的调控[1]。 Lnc H19 是第一个被发现的LncRNA,具有多种生物学功能,参与调节细胞的增殖、分化和代谢。 研究发现,H19 在肝脏中含量丰富,其表达受脂肪酸的刺激,可作为一种脂质感受器调节肝脏代谢动态平衡[2]。 微小RNA(MicroRNA,Mi RNAs)为一种约22个核苷酸的内源RNA,是脂类代谢的转录后调节因子[3]。 可结合并靶向mRNA,通过调节其衰退、失稳或翻译抑制,以调节靶蛋白的丰度[4-5]。 在斑块的发生发展过程中,miRNA 可从斑块的细胞成分中释放到循环中,因此也常用作预测冠心病的生物标志物[6]。 生物学认为,LncRNAs 似乎是与 miRNA 通路相互作用的网络存在,LncRNAs 既是miRNA 的来源,也是其抑制调节因子[7]。
中医学认为,高脂血症源在脾,标为痰、湿、瘀;发生多由于脾失健运,继而导致痰、湿、瘀等病理产物,同时也是致病因素的产生。 课题组前期研究中发现,健脾祛湿方可通过调节过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)/肝 X 受体 α(liver X receptor α,LXRα)/三磷酸腺苷结合盒转运体A1(adenosine triphosphate binding cassette transporter A1,ABCA1)信号通路显著改善脾虚湿盛型大鼠血脂异常情况。 目前有研究表明 PPARγ 是miR-130a/b 在前脂肪细胞、人肝细胞癌组织和肝细胞系中的靶标[8-9]。 故本实验以高脂血症大鼠为研究对象,探究健脾祛湿方调节血脂代谢的同时,选取Lnc H19、miR-130a-3p 为切入点,初步探讨健脾祛湿方作用靶点上游是否存在非编码RNA 的调控影响以介导肝脏的胆固醇逆转运通路。
1 材料与方法
1.1 实验动物
SPF 级健康雄性 SD 大鼠,6 ~7 周龄,体质量(180±20)g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0011]。 饲养于中国检验检疫科学研究院SPF 级动物实验室[许可证号:SYXK(京)2015-0039],实验过程中大鼠自由饮水,饲养室温度为20 ~26 ℃,相对湿度为40% ~70%,灯照周期为12 小时。 实验符合相关伦理学要求(伦理审批号:2021-FD-019)。
1.2 实验药品
健脾祛湿方(红曲 ∶白术 ∶葛根 ∶茯苓 ∶山楂比例为 3 ∶12 ∶16 ∶16 ∶12),其中红曲购自武汉佳成生物制品有限公司,白术、葛根、茯苓、山楂购自北京晨益药业有限公司;血脂康购自北京北大维信生物科技有限公司, 规格:0.3 g × 120 粒, 批号:20210340。
1.3 实验试剂
总胆固醇(total cholesterol,TC,批号:211771)、甘油三酯(triglycerides,TG,批号:211101)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C,批号:211481)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C,批号:211581)、血肌酐(serum creatinine,Scr,批号:210791)、血尿素(blood urea,BUN,批号:211101)检测试剂盒均由中生北控生物科技有限公司提供。 总蛋白定量测试盒(BCA 法,批号:211771)由南京建成生物有限公司提供。 大鼠胆固醇酯转运蛋白(cholesteryl ester transporter,CETP)Elisa 试剂盒(货号:ml003189)、大鼠卵磷脂胆固醇酰基转移酶(lecithin cholesterol acyltransferase,LCAT)Elisa 试剂盒(货号:ml300981-2)均由上海酶联生物有限公司提供。 RIPA 裂解液(货号:P0013C)、PMSF(货号:ST506)、蛋白酶磷酸酶抑制剂混合物(货号:P1045)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(货号:A0208)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(货号:A0216)购自碧云天生物科技有限公司。 PPARγ(货号:16643-1-AP)、LXRα(货号:14351-1-AP)、GAPDH(货号:6004-1-1g)购自 proteintech 公司;ABCA1 抗体(货号:ab66217)购自abcam 公司。
1.4 实验仪器
ZS-MV 小动物麻醉机(中国北京众实迪创科技发展有限责任公司);TBA-120FR 型全自动生化分析仪(日本东芝);多功能酶标仪(美国伯腾仪器有限公司);4-5R 离心机(中国湖南恒诺仪器设备有限公司);CFX 型荧光定量PCR 仪(美国Bio-Rad);湿转印电泳槽、垂直电泳槽(美国Bio-Rad);凝胶成像系统(上海勤翔科学仪器有限公司)。
1.5 分组与造模
SD 大鼠适应性饲养7 天,造模前按体质量随机分为2 组,空白组8 只,模型组40 只。 每周称量体质量一次。 实验第8 天,除空白组给予普通饲料喂养外,模型组(40 只)均采用高脂饲料喂养建立高脂血症大鼠模型。 造模2 周后,空白组和模型组大鼠不禁食采血(眼内眦),采血后尽快分离血清,测定血清 TC、TG、LDL-C、HDL-C 水平。
根据TC 水平将模型组随机分成5 组:即功能模型组、血脂康组、健脾祛湿方低、中、高剂量组,分组后模型组各组间比较 TC、TG、LDL-C、HDL-C 差异均无显著性。 分组后各组与空白组比较 TC、TG、LDL-C 差异有显著性。 连续造模8 周。
1.6 给药方法
正式分组后开始给药,灌胃剂量为1 mL/100 g,除空白组、功能模型组给予生理盐水外,血脂康组(0.12 g/kg,相当于成人每日0.02 g/kg)、健脾祛湿方低、中、高剂量组(1.2 g/kg、2.4 g/kg、3.6 g/kg 生药量,相当于成人推荐量的5 倍、10 倍、15 倍)给予相应的药物,连续给药6 周。
1.7 观察指标及检测方法
1.7.1 一般观察 观察各组大鼠造模给药后毛发、二便、精神活动状态以及体质量的变化。
1.7.2 血脂四项 末次灌胃给药7 小时后,大鼠不禁食眼眶采血。 采用全自动生物化学分析仪检测血清 TC、TG、LDL-C、HDL-C 含量。 并根据公式(1)(2)计算 AI 及 R-CHR[10-11]。 (1)AI=(TC-HDL-C)/HDL-C;(2)R-CHR=TC/HDL-C。
1.7.3 血清中 AST、ALT、BUN、Scr 含量 取材前禁食不禁水12 小时,于取材前2 小时称体质量后腹腔麻醉,腹主动脉取血,室温静置1 ~2 小时,3500 r/分钟,离心15 分钟,分离血清,取上清液。 采用全自动生物化学分析仪检测 AST、ALT、Scr、BUN含量。
1.7.4 肝脏、主动脉脂质沉积的情况 油红O 染色:肝脏、主动脉用OCT 包埋后,迅速放入液氮中,随后使用冰冻切片机,将其切为厚度8 ~10 μm 的冰冻切片。 油红O 染色10 分钟,75%酒精分化2秒,水洗1 分钟,苏木素复染2 分钟,自来水洗涤。1%盐酸酒精分化并水洗,氨蓝水洗后,甘油明胶封片,光学显微镜下观察肝脏、主动脉脂质沉积情况。
1.7.5 血清中LCAT、CETP 含量 使用腹主动脉取血所得血清,按照ELISA 试剂盒说明书步骤,用酶联免疫吸附法检测LCAT、CETP 含量。
1.7.6 肝脏 PPARγ、LXRα、ABCA1 蛋白表达 采用RIPA 蛋白裂解液(按比例加入PMSF、蛋白酶抑制剂、磷酸酶抑制剂),冰上匀浆,4 ℃,12000×g,离心10 分钟,取上清,BCA 法进行组织浓度测定,计算上样量,加入5×上样缓冲液和定量RIPA 裂解液,制备成等浓度等体积的样品,涡旋混匀,100 ℃变性5 分钟。 配置SDS-PAGE 胶(8%分离胶+ 5%浓缩胶),上样后先恒压80 V 跑30 分钟,随后恒压120 V 跑90 分钟,至 marker 跑到底部停止电泳。 随后进行转膜,恒压120V 90 分钟,5%脱脂奶粉封闭1小时,1×TBST 洗涤 5 次,每次 5 分钟,一抗 4 ℃孵育过夜,回收一抗。 1×TBST 洗涤 5 次,每次 5 分钟,二抗室温孵育1 小时,1×TBST 洗涤5 次,每次5 分钟。制备显影液,利用暗室显影技术采集化学发光图像、Image J 分析灰度值。
1.7.7 Real-time PCR 检测肝脏 LncRNA H19、miR-130a-3p、PPARγ、LXRα、ABCA1 mRNA 表达 称取大鼠肝脏,RNA 提取试剂盒提取大鼠肝脏RNA,去除DNA,使用反转录试剂盒合成cDNA,进行实时荧光PCR 检测。 PCR 的反应条件:95 ℃ 10 分钟,95 ℃ 15秒,60 ℃ 1 分钟,40 个循环,实验重复 3 次。 采用2-ΔΔct相对定量法计算相对表达情况。 引物序列由武汉赛维尔生物科技有限公司合成,引物序列见表1。

表1 引物序列
1.8 统计学处理
采用SPSS 20.0 软件进行统计学处理,数据以均数±标准差()表示,多组间数据比较用单因素方差分析(One-way ANOVA),组间两两比较用LSD检验,以P<0.05 表示差异有统计意义。
2 结果
2.1 大鼠的一般状态
实验期间,空白组大鼠精神状态正常,活动自如,毛发正常。 功能模型组大鼠精神状态一般,懒动嗜睡,毛发发黄易脱落。 各给药组大鼠较模型组情况均有所改善。
2.2 健脾祛湿方对高脂血症大鼠体质量的影响
给药前,与空白组相比,功能模型组大鼠体质量显著升高(P<0.01)。 与功能模型组相比,各给药组大鼠体质量无显著性差异。 给药后,与空白组相比,功能模型组大鼠体质量显著升高(P<0.01)。 与功能模型组相比,各给药组大鼠体质量呈下降趋势。 结果见表2。
表2 健脾祛湿方对高脂血症大鼠体质量的影响(,n=8,g)
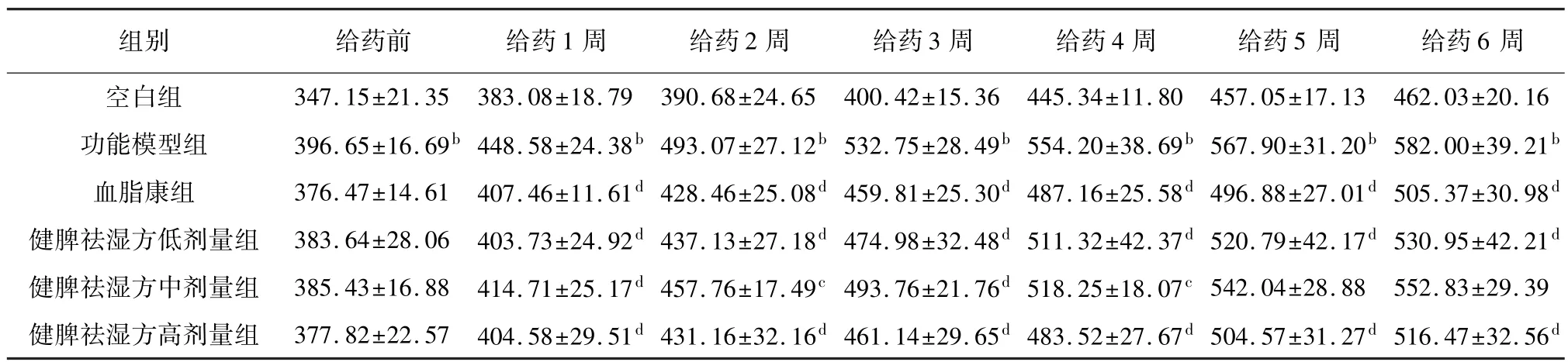
表2 健脾祛湿方对高脂血症大鼠体质量的影响(,n=8,g)
注: 与空白组相比,aP<0.05,bP<0.01;与功能模型组相比,cP<0.05,dP<0.01。
组别 给药前 给药1 周 给药2 周 给药3 周 给药4 周 给药5 周 给药6周±20.16功能模型组 396.65±16.69b 448.58±24.38b 493.07±27.12b 532.75±28.49b 554.20±38.69b 567.90±31.20b 582.00±39.21b血脂康组 376.47±14.61 407.46±11.61d 428.46±25.08d 459.81±25.30d 487.16±25.58d 496.88±27.01d 505.37±30.98d健脾祛湿方低剂量组 383.64±28.06 403.73±24.92d 437.13±27.18d 474.98±32.48d 511.32±42.37d 520.79±42.17d 530.95±42.21d健脾祛湿方中剂量组 385.43±16.88 414.71±25.17d 457.76±17.49c 493.76±21.76d 518.25±18.07c 542.04±28.88 552.83±29.39健脾祛湿方高剂量组 377.82±22.57 404.58±29.51d 431.16±32.16d 461.14±29.65d 483.52±27.67d 504.57±31.27d 516.47±32.56空白组 347.15±21.35 383.08±18.79 390.68±24.65 400.42±15.36 445.34±11.80 457.05±17.13 462.03 d
2.3 健脾祛湿方对高脂血症大鼠血脂四项TC、TG、HDL-C、LDL-C、AI 及 R-CHR 的影响
2.3.1 给药4 周后健脾祛湿方对高脂血症大鼠TC、TG、HDL-C、LDL-C 的影响 与空白组相比,功能模型组大鼠 TC、 TG、 LDL-C 含量显著升高(P<0.01),HDL-C 含量未见显著性差异。 与功能模型组相比,血脂康、健脾祛湿方低、高剂量组大鼠TC 含量显著降低(P<0.05),各给药组大鼠TG 含量均显著降低(P<0.01,P<0.05,P<0.05,P<0.05),LDL-C、HDL-C 含量有所降低,但未见显著性差异。结果见表3。
表3 给药4 周后健脾祛湿方对高脂血症大鼠TC、TG、HDL-C、LDL-C 的影响(,n=8)

表3 给药4 周后健脾祛湿方对高脂血症大鼠TC、TG、HDL-C、LDL-C 的影响(,n=8)
注: 与空白组相比,aP<0.05,bP<0.01;与功能模型组相比,cP<0.05,dP<0.01。
组别 TC(mmol/L) TG(mmol/L) LDL-C(mmol/L) HDL-C(mmol/L)1.14±0.25 0.65±0.09 2.00±0.30 1.56±0.44 0.43±0.12 0.68±0.06功能模型组 2.75±0.40b 2.68±0.67b 1.19±0.24b 0.67±0.17血脂康组 2.37±0.33c 1.74±0.42d 1.11±0.19 0.59±0.08健脾祛湿方低剂量组 2.31±0.46c 1.95±0.89c 1.03±0.20 0.66±0.10健脾祛湿方中剂量组 2.64±0.31 2.01±0.58c 1.13±0.16 0.66±0.10健脾祛湿方高剂量组 2.30±0.22c 2.06±0.53c空白组
2.3.2 给药6 周后健脾祛湿方对高脂血症大鼠TC、TG、HDL-C、LDL-C 的影响 与空白组相比,功能模型组大鼠 TC、 TG、 LDL-C 含量显著升高(P<0.01),HDL-C 含量显著降低(P<0.01)。 与功能模型组相比,血脂康、健脾祛湿方中、高剂量组大鼠TC 含量显著降低(P<0.01),各给药组大鼠TG含量均显著性降低(P<0.01),LDL-C 含量未见显著差异,健脾祛湿方中、高剂量组大鼠HDL-C 含量有所升高,差异具有统计学意义(P<0.05)。 结果见表4。
表4 给药6 周后健脾祛湿方对高脂血症大鼠TC、TG、HDL-C、LDL-C 的影响(,n=8)
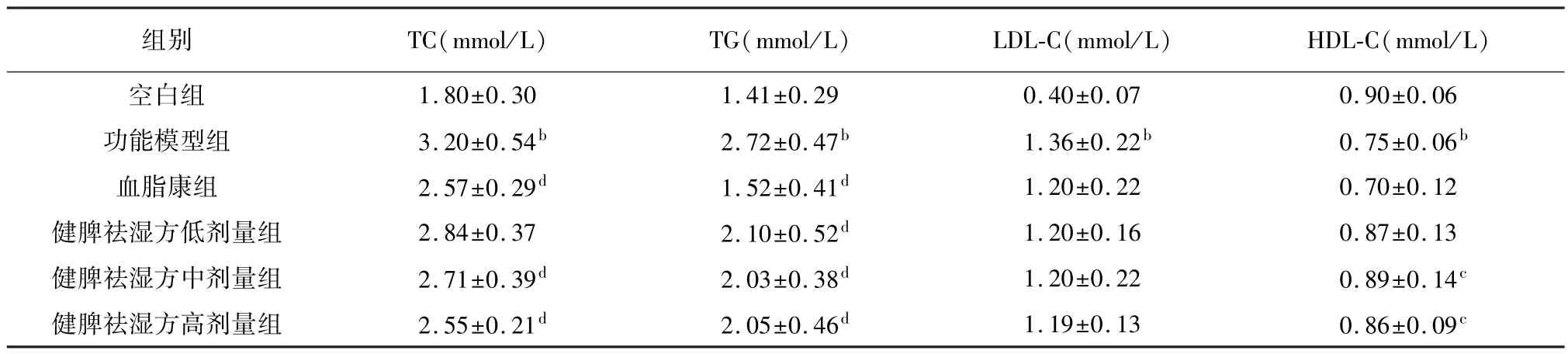
表4 给药6 周后健脾祛湿方对高脂血症大鼠TC、TG、HDL-C、LDL-C 的影响(,n=8)
注: 与空白组相比,aP<0.05,bP<0.01;与功能模型组相比,cP<0.05,dP<0.01。
组别 TC(mmol/L) TG(mmol/L) LDL-C(mmol/L) HDL-C(mmol/L)1.80±0.30 1.41±0.29 0.40±0.07 0.90±0.06功能模型组 3.20±0.54b 2.72±0.47b 1.36±0.22b 0.75±0.06b血脂康组 2.57±0.29d 1.52±0.41d 1.20±0.22 0.70±0.12健脾祛湿方低剂量组 2.84±0.37 2.10±0.52d 1.20±0.16 0.87±0.13健脾祛湿方中剂量组 2.71±0.39d 2.03±0.38d 1.20±0.22 0.89±0.14c健脾祛湿方高剂量组 2.55±0.21d 2.05±0.46d 1.19±0.13 0.86±0.09空白组c
2.3.3 给药4、6 周后健脾祛湿方对高脂血症大鼠AI、R-CHR 的影响 给药4 周时,与空白组相比,功能模型组大鼠AI、R-CHR 水平显著升高(P<0.01);健脾祛湿方低剂量组 AI、R-CHR 水平显著降低(P<0.01);给药6 周后,血脂康、健脾祛湿方低、中、高剂量组AI、R-CHR 水平显著降低,差异具有统计学意义(P<0.05,P<0.05,P<0.01,P<0.01)。 结果见表5。
表5 给药4、6 周,健脾祛湿方对高脂血症大鼠AI、R-CHR 的影响(,n=8)

表5 给药4、6 周,健脾祛湿方对高脂血症大鼠AI、R-CHR 的影响(,n=8)
注:与空白组相比,aP<0.05,bP<0.01;与功能模型组相比,cP<0.05,dP<0.01。
4周6 周组别1.89±0.38 2.85±0.37 1.27±0.26 2.25±0.26功能模型组 3.65±1.03b 4.65±1.03b 3.03±0.71b 4.03±0.71b血脂康组 3.04±0.88 4.04±0.88 2.48±0.43c 3.48±0.43c健脾祛湿方低剂量组 2.68±0.52d 3.68±0.52d 2.42±0.26c 3.42±0.26c健脾祛湿方中剂量组 3.25±0.68 4.25±0.68 2.17±0.55d 3.17±0.55d健脾祛湿方高剂量组 3.08±0.56 4.08±0.56 2.26±0.33d 3.26±0.34 AI R-CHR AI R-CHR空白组d
2.4 健脾祛湿方对高脂血症大鼠肝功能(AST、ALT)、肾功能(Scr、BUN)的影响
与空白组相比,功能模型组大鼠血清AST、ALT活性升高,其中 AST 升高差异显著(P<0.05)。 与功能模型组相比,各给药组AST、ALT 活性呈下降趋势,血脂康、健脾祛湿方低、中、高剂量组AST 差异显著,有统计学意义(P<0.01,P<0.01,P<0.01,P<0.05)。
与空白组相比,功能模型组大鼠Scr 水平显著升高(P<0.01),BUN 水平显著降低(P<0.05)。与功能模型组相比,各给药组Scr 水平呈下降趋势,血脂康、健脾祛湿方低剂量组 Scr 显著降低(P<0.05);血脂康、健脾祛湿方中、高剂量组BUN水平有上升趋势,但无统计学差异。 结果见表6。
表6 健脾祛湿方对高脂血症大鼠AST、ALT、Scr、BUN 的影响(,n=8)
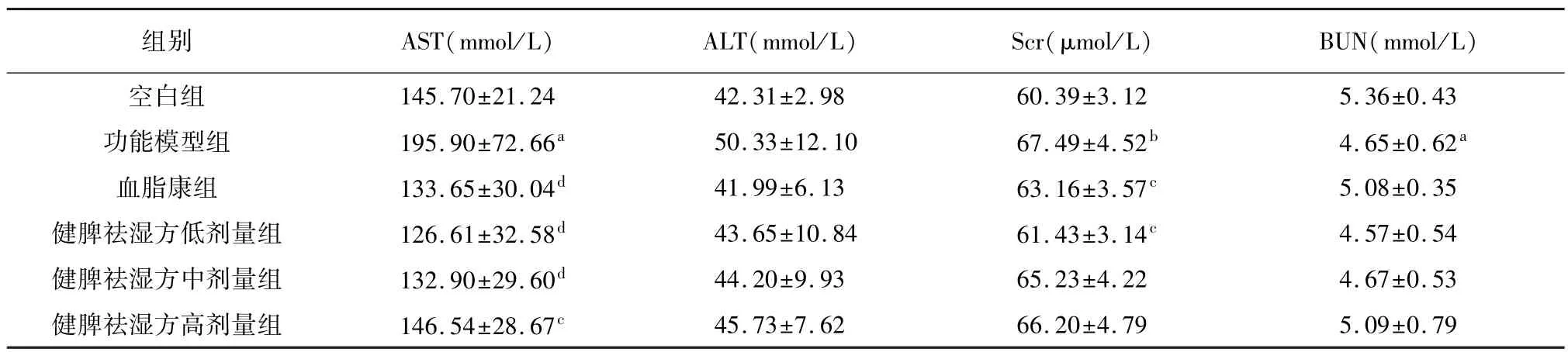
表6 健脾祛湿方对高脂血症大鼠AST、ALT、Scr、BUN 的影响(,n=8)
注: 与空白组相比,aP<0.05,bP<0.01;与功能模型组相比,cP<0.05,dP<0.01。
组别 AST(mmol/L) ALT(mmol/L) Scr(μmol/L) BUN(mmol/L)45.73±7.62 66.20±4.79 5.09±0.79 43功能模型组 195.90±72.66a 50.33±12.10 67.49±4.52b 4.65±0.62a血脂康组 133.65±30.04d 41.99±6.13 63.16±3.57c 5.08±0.35健脾祛湿方低剂量组 126.61±32.58d 43.65±10.84 61.43±3.14c 4.57±0.54健脾祛湿方中剂量组 132.90±29.60d 44.20±9.93 65.23±4.22 4.67±0.53健脾祛湿方高剂量组 146.54±28.67c空白组 145.70±21.24 42.31±2.98 60.39±3.12 5.36±0.
2.5 健脾祛湿方对高脂血症大鼠肝脏、主动脉脂质沉积的影响
肝脏油红O 染色:空白组大鼠肝脏切片中细胞界限清楚,未见细胞肿胀及染红的脂肪沉积。 功能模型组大鼠肝细胞界限模糊,发生明显的脂肪变性,内有大量脂肪空泡及红色脂滴。 各给药组肝细胞界限较模型组有所改善,脂滴含量明显减少。 见图1。
主动脉油红O 染色:空白组大鼠胸主动脉壁上未见红色脂滴。 功能模型组大鼠主动脉壁内呈大量红染,可见明显红色脂滴。 各给药组主动脉壁内红染较功能模型组有所改善,脂滴含量明显减少。见图1。
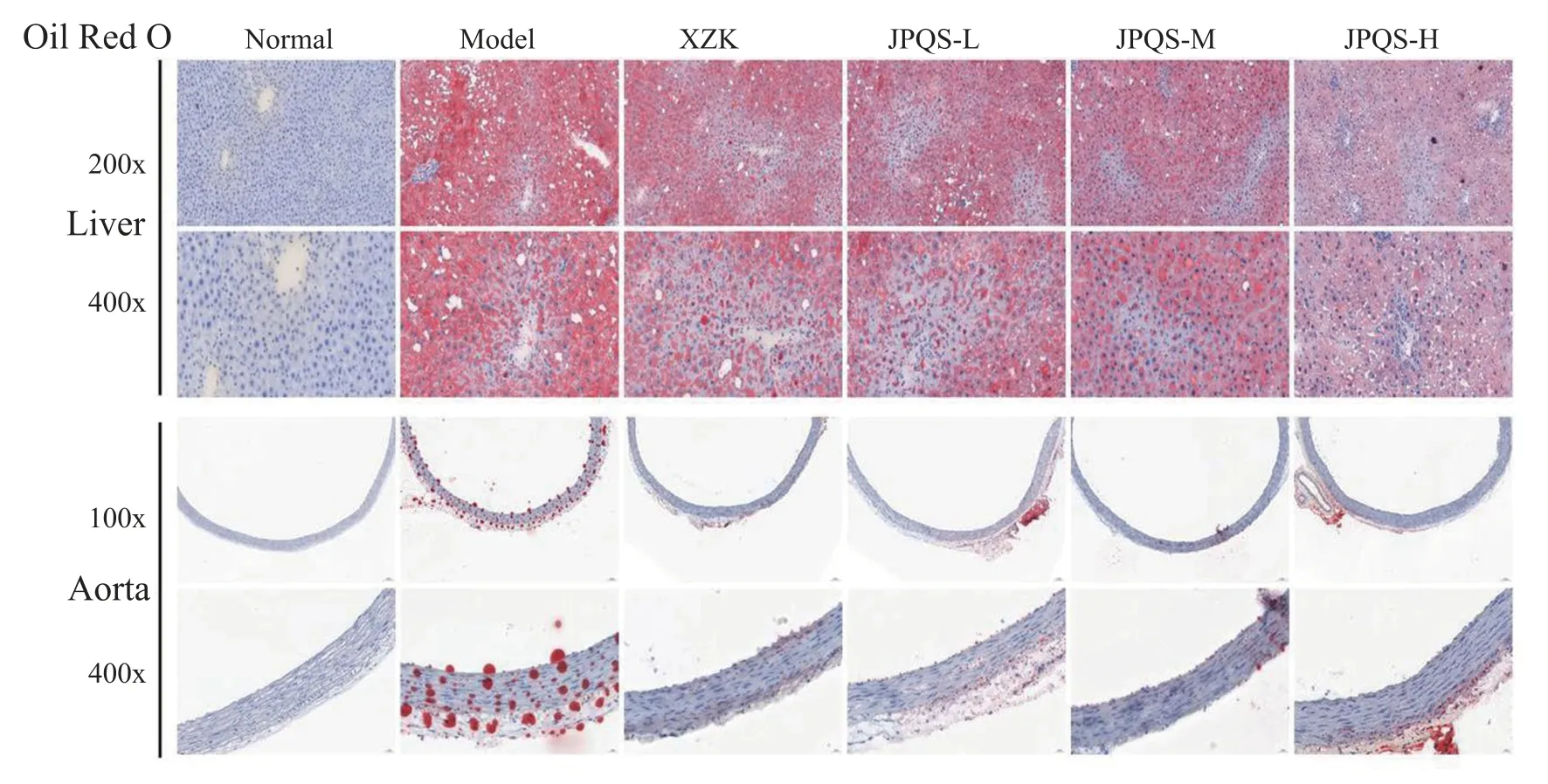
图1 各组大鼠肝脏、主动脉脂质沉积情况
2.6 健脾祛湿方对高脂血症大鼠血清CETP、LCAT含量的影响
与空白组相比,功能模型组大鼠血清CETP 含量显著升高,LCAT 含量显著降低(P<0.01)。 与功能模型组相比,血脂康、健脾祛湿方低、中、高剂量组大鼠血清CETP 含量显著降低(P<0.01),LCAT含量显著升高(P<0.01)。 结果见表7。
表7 健脾祛湿方对高脂血症大鼠血清CETP、LCAT 含量比较(,n=8)
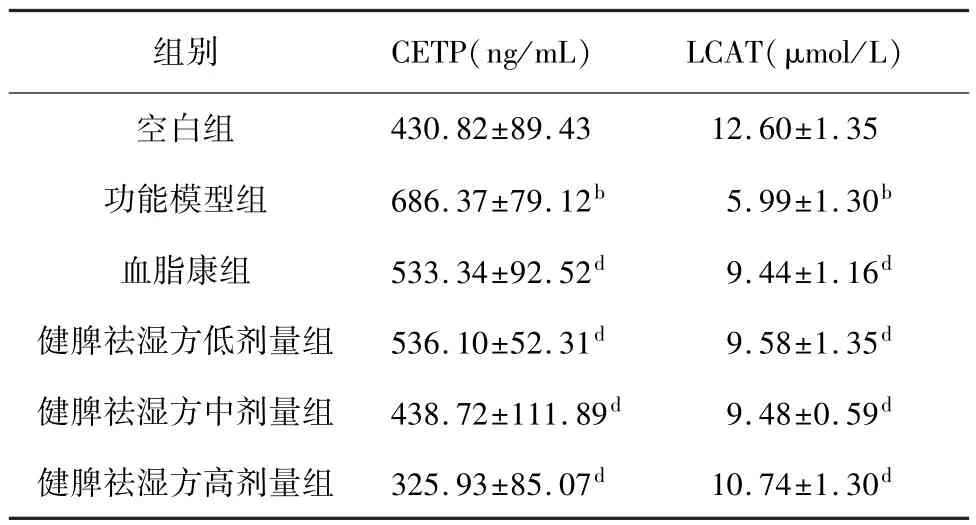
表7 健脾祛湿方对高脂血症大鼠血清CETP、LCAT 含量比较(,n=8)
注: 与空白组相比, aP<0.05, bP<0.01;与功能模型组相比, cP<0.05,dP<0.01。
组别 CETP(ng/mL) LCAT(μmol/L)430.82±89.43 12.60±1.35功能模型组 686.37±79.12b 5.99±1.30b血脂康组 533.34±92.52d 9.44±1.16d健脾祛湿方低剂量组 536.10±52.31d 9.58±1.35d健脾祛湿方中剂量组 438.72±111.89d 9.48±0.59d健脾祛湿方高剂量组 325.93±85.07d 10.74±1.30空白组d
2.7 健脾祛湿方对高脂血症大鼠肝脏PPARγ、LXRα、ABCA1 蛋白表达的影响
与空白组相比,功能模型组 PPARγ、LXRα、ABCA1 表达显著降低(P<0.05)。 与功能模型组相比,各给药组 PPARγ、LXRα、ABCA1 水平均呈上升趋势,其中健脾祛湿方中、高剂量组PPARγ 含量显著升高(P<0.05)。 结果见表8、图2。
表8 健脾祛湿方对高脂血症大鼠肝脏PPARγ、LXRα、ABCA1 蛋白表达的影响(,n=3)
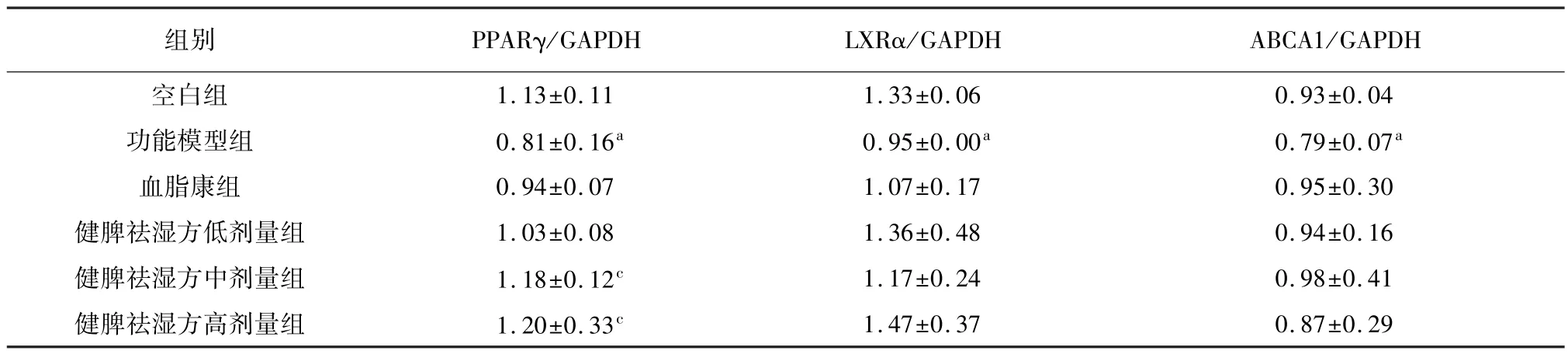
表8 健脾祛湿方对高脂血症大鼠肝脏PPARγ、LXRα、ABCA1 蛋白表达的影响(,n=3)
注: 与空白组相比,aP<0.05,bP<0.01;与功能模型组相比,cP<0.05,dP<0.01。
1.47±0.37 0.87±0.29组别 PPARγ/GAPDH LXRα 1.13±0.11 1.33±0.06 0.93±0.04功能模型组 0.81±0.16a 0.95±0.00a 0.79±0.07a血脂康组 0.94±0.07 1.07±0.17 0.95±0.30健脾祛湿方低剂量组 1.03±0.08 1.36±0.48 0.94±0.16健脾祛湿方中剂量组 1.18±0.12c 1.17±0.24 0.98±0.41健脾祛湿方高剂量组 1.20±0.33c/GAPDH ABCA1/GAPDH空白组
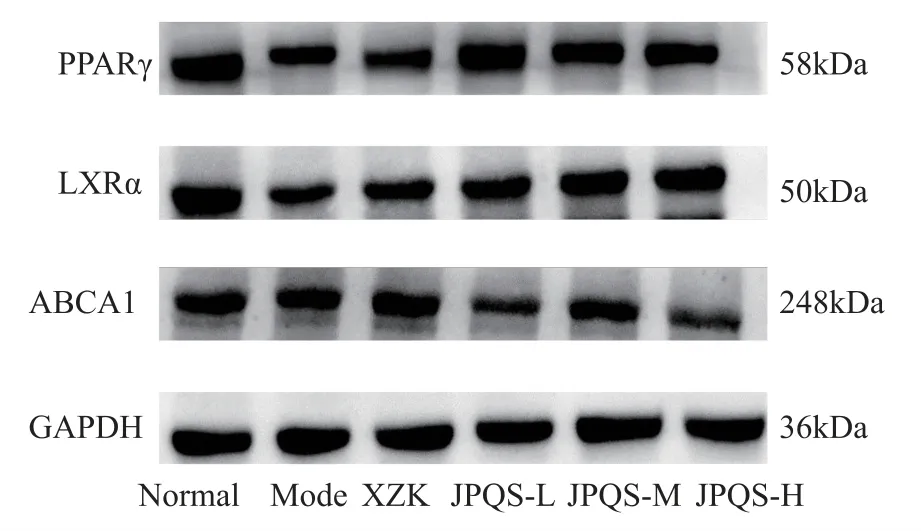
图2 各组大鼠肝脏PPARγ、LXRα、ABCA1 蛋白表达的情况
2.8 健脾祛湿方对高脂血症大鼠肝脏LncRNA H19、miR-130a-3p、PPARγ、LXRα、ABCA1 mRNA 表达的影响
与空白组相比,功能模型组LncRNA H19、miR-130a-3p 水平显著升高(P<0.01,P<0.05)。 与功能模型组相比,各给药组LncRNA H19 表达显著降低(P<0.01);各给药组miR-130a-3p 表达呈下降趋势,血脂康、健脾祛湿方低、中剂量组差异显著(P<0.05,P<0.01,P<0.05)。
与空白组相比,功能模型组 PPARγ、LXRα、ABCA1 表达降低,其中 LXRα、ABCA1 差异显著(P<0.05)。 与功能模型组相比,各给药组PPARγ、LXRα 水平呈上升趋势,其中血脂康、健脾祛湿方中、高剂量组PPARγ 含量显著升高(P<0.05);低剂量组LXRα 含量显著升高(P<0.01)。 血脂康、健脾祛湿方低、中剂量组ABCA1 水平有所升高,但差异不具有统计学意义。 结果见表9。
表9 健脾祛湿方对高脂血症大鼠肝脏LncRNA H19、miR-130a-3p、PPARγ、LXRα、ABCA1 mRNA 表达的影响(,n=3)

表9 健脾祛湿方对高脂血症大鼠肝脏LncRNA H19、miR-130a-3p、PPARγ、LXRα、ABCA1 mRNA 表达的影响(,n=3)
注: 与空白组相比,aP<0.05,bP<0.01;与功能模型组相比,cP<0.05,dP<0.01。
0.83±0.15 0.93±0.25组别 LncRNA H19 miR-130a-3p PPARγ LXRα 3±0.48功能模型组 1.72±0.21b 1.14±0.15a 1.19±0.34 0.80±0.36a 1.02±0.32a血脂康组 0.89±0.18d 0.88±0.16c 2.18±0.08c 1.23±0.32 1.09±0.14健脾祛湿方低剂量组 0.71±0.04d 0.80±0.09d 1.53±0.77 2.07±0.80d 1.45±0.42健脾祛湿方中剂量组 0.87±0.07d 0.88±0.08c 2.26±0.50c 1.40±0.10 1.41±0.20健脾祛湿方高剂量组 1.06±0.09d 0.96±0.07 2.34±0.35c ABCA1空白组 0.79±0.19 0.87±0.11 1.33±0.40 1.67±0.15 1.7
3 讨论
高脂血症在我国具有低知晓率、低治疗率、低控制率、高发病率的特点,其发病逐渐趋向年轻化。中医认为高脂血症为本虚标实之证,病位在脾肝肾,尤以脾失健运为主。 脾失运化,是引起高脂血症的重要病机,因此常以健脾祛湿、化浊降脂作为基本治疗原则。 课题组以“辨证保健”理论为指导,通过实验验证了健脾祛湿法对脾虚湿盛型高脂血症大鼠的降血脂作用[12-14]。 本研究中的健脾祛湿方以红曲、白术、茯苓、葛根、山楂五味中药组成,具有健脾祛湿、化浊降脂的功效。 现代研究表明,红曲中的洛伐他汀可竞争性地与HMG-CoA 还原酶结合,降低其活性,从而发挥抑制胆固醇合成的作用。王岚等[15]发现红曲对高脂血症大鼠血脂具有一定的调节作用,可有效降低血清TC、TG,其中对TC 降低的效果更显著。 宁素云等[16]认为山楂粉可有效改善高脂饮食ApoE-/-小鼠肠道菌群的构成,促进菌群的恢复,有效缓解高脂饮食所致的脂代谢紊乱的症状。 王均等[17]研究发现葛根的主要有效成分葛根素能显著降低高脂症大鼠TC、TG、LDL 的含量,升高HDL 含量,改善其全血全切变率及血浆黏度,达到显著的降脂作用。 “脾脏补气健脾第一药”的白术,长于补气复脾胃,利水除湿邪,研究发现白术精提取物在降低高脂血症大鼠血清TC、TG、LDL-C、ACAT 水平,提高 LCAT 和 HDL-C 水平的同时,可降低肝脏中 HMG-CoA 还原酶、TC、TG 水平,对脂质代谢具有一定的调节作用[18]。
TC、TG、LDL-C 是冠心病和动脉粥样硬化的危险因素[19],在脂质代谢的过程中,HDL-C 可以将TC、TG 从周围组织输送到肝脏,最后通过肝脏受体将其清除。 实验结果显示,健脾祛湿方可降低高脂血症大鼠血清中TC、TG 水平,提高HDL-C 水平,表明健脾祛湿方可在一定程度上改善脂代谢紊乱。同时AI 和R-CHR 分别反映机体患动脉粥样硬化和冠心病的风险。 实验表明健脾祛湿方可降低高脂血症大鼠血清中AI、R-CHR 水平,与其降血脂水平相对应,起到了预防动脉粥样硬化、冠心病发生的作用。 当机体肝细胞受损时,AST、ALT 会被释放到循环系统中,因此测定血清中AST、ALT 酶的活性可了解肝细胞的损伤程度[20-21]。 研究表明,功能模型组AST、ALT 活性升高,表明肝脏组织存在炎症反应。 给药6 周后,健脾祛湿方能使大鼠 AST、ALT 水平不同程度地降低,提示具有一定程度的肝脏保护作用。 血清中Scr、BUN 常用于评价肾功能,给药后大鼠Scr、BUN 均有不同程度的改善,提示健脾祛湿方对肾功能无明显影响。
CETP、LCAT 参与 HDL 重塑和代谢过程[22]。其中CETP 是一种参与脂蛋白之间胆固醇酯交换的酶,可促进 TC 从 HDL 向 LDL 或 VLDL 的转移,最终导致 HDL 降低,LDL 和 VLDL 水平升高。 LCAT是一种富含糖类的糖蛋白,可催化血浆中最相关部分胆固醇酯的生物合成,TC 从外周组织到肝脏的运输受到LCAT 的调控,LCAT 表达抑制,常引起 TC氧化增加、HDL 降低[23]。 实验结果显示,功能模型组大鼠CETP 表达增强,LCAT 受到抑制,健脾祛湿方干预后,低、中、高剂量组CETP 水平显著性降低,LCAT 含量显著升高,表明胆固醇酯从HDL 转移到富含TG 的脂蛋白和LDL 的过程受到抑制。
Sun H、Huang Y 等[24-25]实验研究发现,LncRNA H19 的过表达可促进动脉粥样硬化的进程、诱发缺血性中风,其基因敲除后可以缓解动脉粥样硬化。PPARγ 信号通路作为胆固醇代谢的关键途径,可通过诱导LXRα 的表达来增加ABCA1 的表达,以达到介导胆固醇代谢,减轻肝脏脂质沉积及炎症反应的作用[26]。 Chu X 等[27]经实验证实了 PPARγ 是miR-130 的靶基因的同时,发现miR-130 下调可促进PPARγ 的表达,从而以抑制炎症和心肌纤维化,起到保护心脏的作用。 研究结果显示,各给药组LncRNA H19、 miR-130a-3p mRNA 表 达 降 低,PPARγ、LXRα、ABCA1 蛋白及 mRNA 表达水平升高。
本实验研究结果显示,健脾祛湿方可降低高脂血症大鼠 TC、TG、LDL-C、AI、R-CHR 水平,提高HDL-C 水平,减少肝脏、主动脉脂质沉积,一定程度上改善脂代谢紊乱,降低动脉粥样硬化、冠心病的发病机率。 同时可提高 CETP 酶活性,降低 LCAT酶活性,抑制胆固醇酯从HDL 转移到富含TG 的脂蛋白和LDL 的过程。 健脾祛湿方干预后高脂血症大鼠肝脏LncRNA H19、miR-130a-3p mRNA 水平显著降低,PPARγ、LXRα、ABCA1 蛋白及 mRNA 表达显著增强。 提示健脾祛湿方可能通过调控LncRNA H19 正向靶向 miR-130a-3p 表达以介导 PPARγ/LXRα/ABCA1 信号通路的表达,以实现调节血脂代谢水平紊乱的作用。
